参梅养胃颗粒质量标准的研究
2016-09-06南京中医药大学江苏南京20000江苏省食品药品监督检验研究院江苏南京20000
陈 镭, 郭 青(.南京中医药大学,江苏南京20000;2.江苏省食品药品监督检验研究院,江苏南京20000)
参梅养胃颗粒质量标准的研究
陈 镭1, 郭 青2*
(1.南京中医药大学,江苏南京210000;2.江苏省食品药品监督检验研究院,江苏南京210000)
目的 建立参梅养胃颗粒 (蒲公英、甘草、土木香等)的质量标准。方法 TLC法鉴定蒲公英和甘草,HPLC法定性分析土木香内酯和异土木香内酯,并定量测定丹参素钠和芍药苷的含有量。结果 TLC鉴定专属性强,阴性无干扰。4批样品未检出蒲公英,6批未检出甘草,3批未检出土木香内酯。丹参素钠和芍药苷分别在40.5~506.25μg(r=1.000)和50.19~627.38μg(r=0.999 5)范围内线性关系良好,平均回收率分别为97.16%和99.83%,RSD分别为1.51%和0.62%(n=6)。两者平均含有量分别为4.560 mg/袋和12.191 mg/袋,每袋含丹参和白芍不得少于3.5mg和9.4mg。结论 该方法简便准确,专属性强,可为参梅养胃颗粒质量标准的建立提供参考。而且,统一工艺制备的12批样品均符合相关要求。
参梅养胃颗粒;蒲公英;甘草;土木香内酯;异土木香内酯;丹参素钠;芍药苷
参梅养胃颗粒由北沙参、山楂、乌梅、红花、莪术、土木香、蒲公英、丹参、甘草、白芍、当归11味药组成,具有养阴和胃功效,用于治疗胃痛灼热、嘈杂似饥、口咽干燥、大便干结,以及浅表性胃炎、胃阴不足型慢性胃炎、各种胃部不适等症[1]。目前,该制剂的质量标准仍局限于理化鉴别,项目简单,水平低下,无法控制其质量,导致各生产厂家的产品在质量上相差迥异,市场上鱼龙混杂。因此,有必要建立规范严谨的参梅养胃颗粒质量检测方法及质量标准,对全国各厂家生产的产品进行质量统一要求。
参梅养胃颗粒为国家中药标准提高行动计划的目录品种,本实验在上述背景下,建立了对蒲公英、甘草定性鉴别的TLC法,土木香进行定性鉴别的HPLC法,以及丹参素和芍药苷2种含有量较高的成分同时测定的HPLC法。此外,在各厂家对制成总量、制法工艺、得膏率多次反馈意见的基础上进行统一,提出了该制剂通用、具有可控性的质量标准。
1 仪器与试药
岛津LC-20AB色谱仪;Agi1ent 1260色谱仪;ThermoFisher DIONEX色谱仪;JS-720超声仪(720 W、40 Hz);CPA224S、BS21S电子天平(德国Sartorius公司);MX5电子天平(瑞士Mett1er To1edo公司);TG16-WS台式高速离心机 (长沙湘仪离心机仪器有限公司);瑞士Camag Automatic TLC Samp1er 4点样仪;TLC Visua1izer薄层成像系统。
甘草 (批号120904-201318)、蒲公英 (批号121195-200902)、丹参素钠 (批号110855-201311,含有量≥98.1%)、芍药苷 (批号110746-201108,含有量≥94.9%)、土木香内酯 (批号110760-201209,含有量≥98.4%),异土木香内酯 (批号110761-200204)对照品均购自中国食品药品检定研究院。甲醇、乙腈为色谱纯;水为纯化水;其他试剂均为分析纯。共收集到6个厂家 (编号A~F)33批样品,具体见表1。土木香、蒲公英、甘草、白芍、丹参阴性样品均由南京同仁堂药业有限责任公司提供。

表1 样品信息Tab.1 Information of samples
2 方法与结果
2.1TLC鉴别
2.1.1蒲公英[2-3]取样品 (批号 140302、20140123、20140402、20150205、150301)30 g,研细,加氯仿120 m L,超声30 min,滤过,滤液蒸干,1 mL氯仿溶解,作为供试品溶液。另取蒲公英0.5 g,同法制备,加甲醇5 mL溶解,作为对照药材溶液。按照 《中国药典》2010版附录ⅥB,吸取上述两种溶液各10~20μL,点于同一硅胶G薄层板上,以石油醚 (60~90℃)-苯-乙酸乙酯(5∶1∶1)为展开剂展开,取出,晾干,置紫外光灯 (365 nm)下检视,结果见图1。由图可知,供试品在与对照药材色谱相应的位置处,显示出相同颜色的红色主斑点,缺蒲公英阴性样品无相应斑点。同时,有4批样品 (批号130908、130909、20140121、20140123)未检出蒲公英,而统一工艺后的12批样品全部检出。
2.1.2甘草[4]取样品 (批号同 “2.1.1”项)15 g,研细,加乙醚50 mL,加热回流1 h,过滤,药渣加甲醇30 m L,再加热回流1 h,过滤,滤液蒸干,残渣加水40 m L溶解,正丁醇提取3次,每次20 mL,合并正丁醇液,用水洗涤3次,每次30 mL,蒸干,残渣加甲醇2 m L溶解,作为供试品溶液。另取甘草1 g,同法制备,加甲醇5 mL溶解,作为对照药材溶液。按照 《中国药典》2010版附录ⅥB,吸取上述两种溶液各10μL,点于同一硅胶G薄层板上,以氯仿-甲醇-水 (30∶10∶1)为展开剂展开,取出,晾干,喷以10%硫酸乙醇试液,105℃加热至斑点清晰,在日光下检视,结果见图2。由图可知,供试品在与对照药材色谱相应的位置处,显示出相同颜色的黄色斑点,缺当归阴性样品无相应斑点。同时,有6批样品 (批号140301、140302、140401、20140401、20140402、20140203)未检出甘草,而统一工艺后的12批样品全部检出。
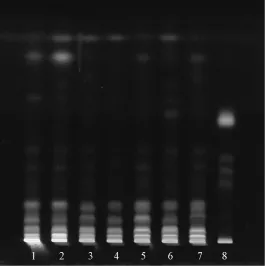
图1 蒲公英TLC图谱Fig.1 TLC ch romatogram of Taraxaci Herba
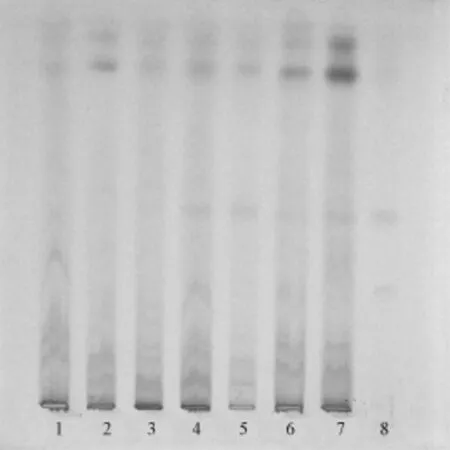
图2 甘草TLC图谱Fig.2 TLC chromatogram of Glycyrrhizae Radix et Rhizoma
2.2土木香HPLC法鉴别[3]取样品 (批号140202)30 g,研细,加氯仿 120 mL、浓氨水4 mL,密塞,超声30 min,滤过,滤液挥干,残渣加甲醇1 m L溶解,作为供试品溶液。另取土木香内酯、异土木香内酯对照品,加甲醇制成每1 m L含0.1 mg相应成分的溶液,作为对照品溶液。
色谱条件[5]为填充剂十八烷基硅烷键合硅胶;流动相乙腈-0.1%磷酸水溶液 (50∶50);检测波长225 nm。分别吸取上述两种溶液20μL,注入液相色谱仪,结果见图3。同时,有3批样品 (批号20150611、20150618、20150620)仅检出异土木香内酯。
2.3HPLC法[6-9]测定丹参素钠、芍药苷含有量
2.3.1提取条件的选择
2.3.1.1提取方法 精密称取供试品1 g,置于具塞锥形瓶中,精密加入50%甲醇25 mL,密塞,称定质量,超声 (720W、40 kHz)与加热回流分别提取45 min,取出,放冷,50%甲醇补足减失的质量,摇匀,离心 (10 000 r/min)10 min,取上清液。精密吸取10μL,注入液相色谱仪测定。结果,两种方法提取效果差异不大,从操作角度考虑,选择超声处理。
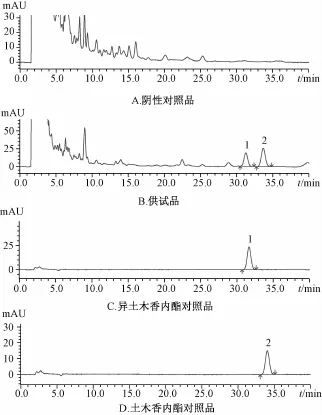
图3 土木香HPLC色谱图Fig.3 HPLC chromatogram s of Inulae Radix
2.3.1.2 提取时间 精密称取供试品1 g,置于具塞锥形瓶中,精密加入50%甲醇25 mL,分别超声30、45、60 min(720 W、40 kHz),取出,放冷,50%甲醇补足减失的质量,摇匀,离心(10 000 r/min)10 min,取上清液。精密吸取10μL,注入液相色谱仪测定。结果,丹参素钠、芍药苷峰面积随提取时间增加无显著变化,故选择提取时间为30 min。
2.3.1.3提取溶剂 精密称取供试品1 g,共3份,置于3个具塞锥形瓶中,精密加入20%、50%、70%甲醇25 m L,相应溶剂补足减失的质量,摇匀,离心 (10 000 r/min)10 min,取上清液。精密吸取10μL,注入液相色谱仪测定。结果,丹参素钠峰面积随提取溶剂变化无显著变化,而芍药苷峰面积在50%甲醇中高于其他两种溶剂,故选择50%甲醇作为提取溶剂。
2.3.1.4料液比 精密称取供试品1 g,共6份,置于6个具塞锥形瓶中,精密加入50%甲醇5、10、15、20、25、50 m L,密塞,称定质量,超声30 min(720 W、40 kHz),取出,放冷,50%甲醇补足减失的质量,摇匀,离心 (10 000 r/min)10 min,取上清液。精密吸取10μL,注入液相色谱仪测定,结果见图4。由图可知,芍药苷在25 mL溶剂量时峰面积减少,而丹参素钠峰面积随溶剂量增加而增加,故选择20 mL作为最佳溶剂量,此时料液比为1∶20。
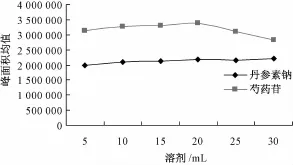
图4 料液比考察结果Fig.4 Results of solid-liquid ratio tests
2.3.2色谱条件 Dikma P1atisi1 ODS色谱柱(5μm,250 mm×4.6 mm);流动相为甲醇∶乙腈(2∶1,A)-0.1%磷酸水溶液 (B),梯度洗脱(0~16 min,9%A;16~40 min,21%A);柱温30℃;检测波长230 nm;体积流量1 mL/min。
2.3.3溶液的制备
2.3.3.1对照品溶液 精密称取丹参素钠、芍药苷对照品适量,加50%甲醇制成每1 mL分别含20、25μg相应对照品的混合溶液,即得。
2.3.3.2供试品溶液 取样品 (批号20140119)研细,精密称取1 g,置于具塞锥形瓶中,精密加入50%甲醇20 mL,密塞,称定质量,超声(720 W、40 kHz)30 min,放冷,50%甲醇补足减失的质量,摇匀,离心 (10 000 r/min)10 min,取上清液,即得。
2.3.3.3阴性样品溶液 取不含丹参、白芍的阴性样品,再按 “2.3.3.1”项下方法制备,即得。
2.3.4 方法学考察
2.3.4.1精密度试验 精密吸取供试品溶液 (批号20140119)10μL,连续测定6次,测得丹参素钠、芍药苷峰面积RSD分别为0.4%、1.8%(n=6),表明仪器精密度良好。
2.3.4.2专属性试验 取对照品、供试品和阴性样品溶液各10μL,注入HPLC色谱仪测定,结果见图5,表明阴性样品对检测无干扰。
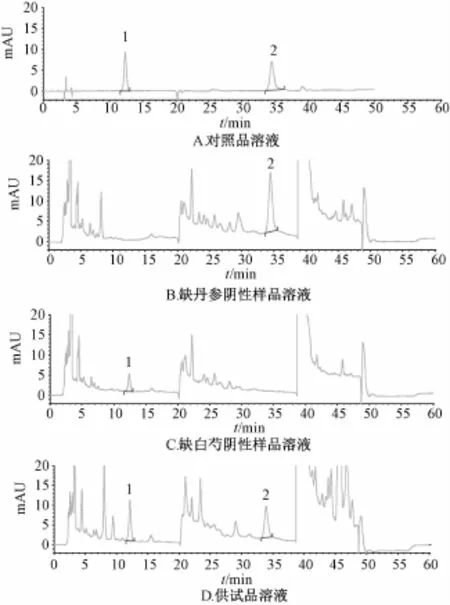
图5 专属性试验结果Fig.5 Results of specificity tests
2.3.4.3线性关系试验 分别精密吸取丹参素钠、芍药苷对照品溶液 2、5、8、10、12、15、20、25μL,以进样量为横坐标 (X),峰面积为纵坐标(Y)进行回归,结果见表2,可知两种成分在各自范围内线性关系良好。

表2 回归方程和线性范围Tab.2 Regression equations and linear ranges
2.3.4.4稳定性试验 精密吸取同一份供试品溶液 (批号20140119),在上述色谱条件下于0、4、8、12、16、20、24 h分别进样。结果,丹参素钠、芍药苷峰面积RSD分别为0.7%、1.1%(n=7),表明供试品溶液在24 h内稳定。
2.3.4.5重复性试验 取同一批 (批号20140119)样品,按 “2.3.3.1”项下方法制备供试品溶液,在上述色谱条件下测定,平行6份。结果,丹参素钠、芍药苷含有量RSD分别为0.4%、1.7% (n=12),表明该方法重复性良好。
2.3.4.6加样回收率试验 精密称取样品6份,每份0.5 g,精密加入含丹参素钠1.517μg/mL、芍药苷3.042μg/mL的混合对照品溶液1 mL,挥干。按 “2.3.3.1”项下方法制备,精密吸取10μL,注入HPLC色谱仪中测定。结果见表3。
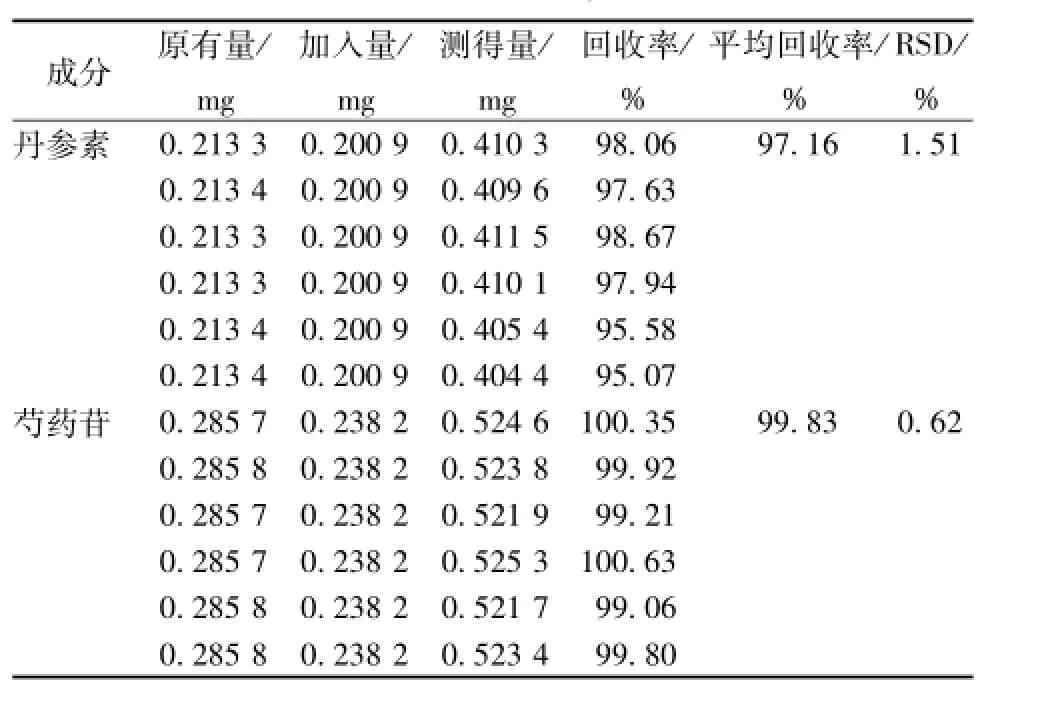
表3 加样回收率试验结果(n=6)Tab.3 Results of recovery tests(n=6)
2.3.4.7耐用性试验[10]比较3根不同品牌的高纯度硅胶键合C18柱,即Waters Symmetry(4.6 mm× 250 mm,5μm)、Shiseido AQ(4.6 mm×250 mm,5μm)、Dikma ODS(250 mm×4.6 mm,5μm)。取同一份供试品溶液 (批号20140119),分别于上述色谱柱中进样测定。结果,供试液均有较好的分离度,丹参素钠、芍药苷含有量RSD(n=3)分别为1.41%、1.18%。具体见表4。
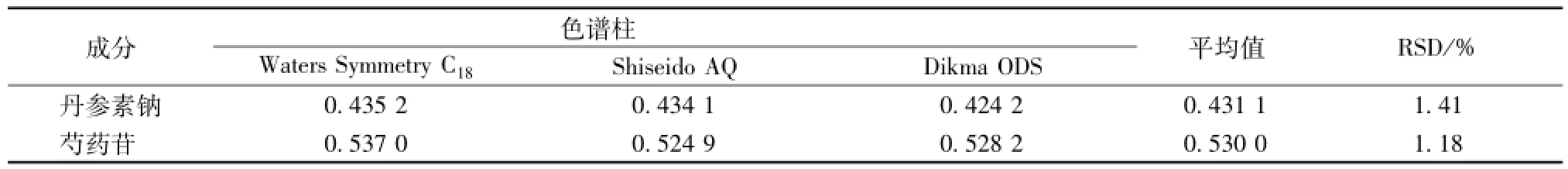
表4 不同色谱柱耐用性试验结果(m g/g,n=3)Tab.4 Results of durability tests for different colum ns(mg/g,n=3)
另取同一供试品溶液 (批号20140119),分别用3种不同品牌色谱仪实验,即岛津LC-20AB、Agi1ent 1260、ThermoFisher DIONEX,用Waters Symmetry C18柱(4.6 mm×250 mm,5μm)进样测定。结果,供试液在不同品牌色谱仪上均有较好的分离度,丹参素钠、芍药苷含有量RSD(n=3)分别为1.82%、1.55%,具体见表5。

表5 不同仪器耐用性试验结果(mg/g,n=3)Tab.5 Results of durability tests for different instruments(m g/g,n=3)
2.3.4.8理论塔板数的确定 (表6) 最终确定,丹参素钠≥6 178、芍药苷≥15 749,理论塔板数按丹参素钠峰计算,应不低于5 000。
2.3.5含有量测定 取4个厂家12批样品 (均为有糖型),按 “2.3.3.1”项下方法制备供试品溶液,精密吸取10μL,注入HPLC色谱仪中测定,结果见表7。
3 讨论
3.1检测指标的确定 采用HPLC-DAD法,流动相选择5%~90%乙腈进行梯度洗脱,采集极性范围较宽的成分信息。结果,信号较高的色谱峰有丹参素钠、丹酚酸B、芍药苷,由于丹酚酸B在不同洗脱条件下均于右侧有干扰,故选择丹参素钠和芍药苷作为检测指标。

表6 理论塔板数Tab.6 Theoretical plate numbers
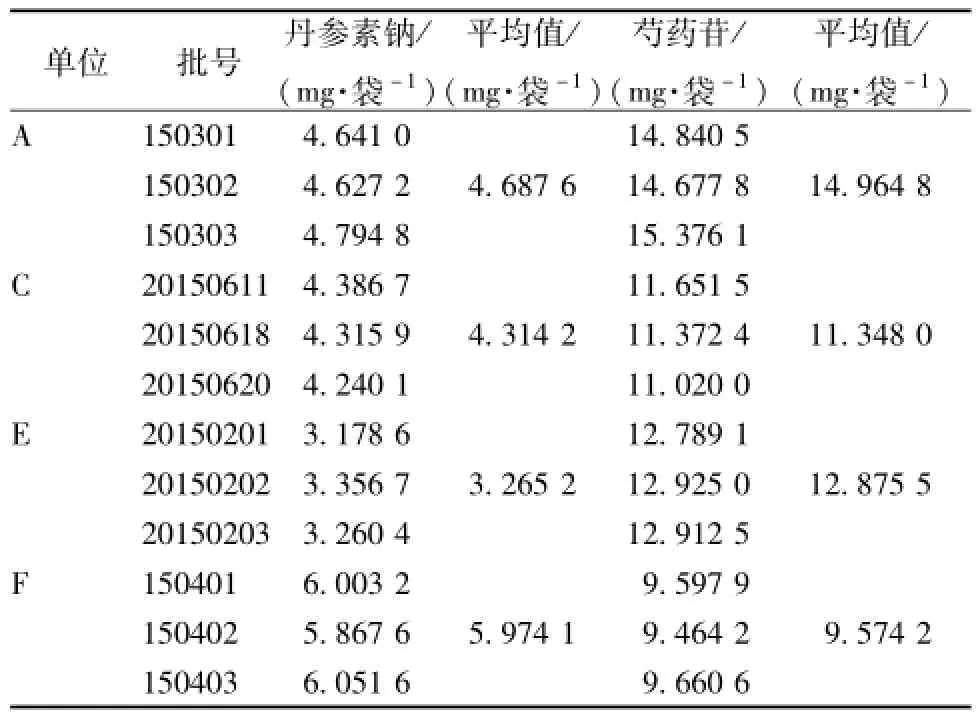
表7 含有量测定结果Tab.7 Results of con tent determ ination
3.2色谱条件的选择 通过DAD检测,丹参素钠和芍药苷均在200 nm波长处有末端吸收,但易产生杂质干扰。由于丹参素钠在230、280 nm,芍药苷在232、274 nm波长处有吸收,为兼顾两者的灵敏度和分离效果,故选择230 nm作为检测波长。3.3 含量测定限度的制定 根据统一工艺后4个厂家12批样品的数据 (有糖型16 g/袋,无糖型5 g/袋),丹参素钠平均含有量为4.560 mg/袋,芍药苷为12.191 mg/袋。根据3家厂家提供的白芍和丹参药材中丹参素钠和芍药苷含有量测定的结果,两者的平均实际转移率[11][丹参素钠转移率=(成品中丹参素钠含有量/16)/(丹参药材中丹参素钠含有量×70/1 000),芍药苷转移率=(成品中芍药苷含有量/16)/(白芍药材中芍药苷含有量×87.5/1 000)]分别为1 176% (丹参素可由丹参中其它成分在受热时转化而来[12])和28%。如果按药典规定白芍的最低1.2%投料,则芍药苷限度为3.8 mg/袋。但企业实际使用的白芍中,芍药苷含有量均较高 (不低于3.0%),如按照此含有量制定限度,则数值为9.4 mg/袋,丹参素钠限度相应为3.5 mg/袋。最终规定,本品每袋含丹参以丹参素钠 (C9H9NaO5)计,不得少于3.5 mg;含白芍以芍药苷 (C23H28O11)计,不得少于9.4 mg。
3.4丹参素钠转移率过高的探讨 文献 [13]报道,丹参含有多种酚酸类成分。其中,丹参素为咖啡酸的水解产物3,4-二羟基苯基乳酸,迷迭香酸为咖啡酸与丹参素酯化缩合而成,原紫草酸由2分子咖啡酸缩合后再继续与1分子或2分子丹参素缩合形成紫草酸和紫草酸乙,其他寡聚咖啡酸类化合物结构中也都含有丹参素单元。由于参梅养胃颗粒采用水煎煮的制法工艺,在加热条件下可水解成丹参素,使其含有量增加,故本实验测定的不是药材中本身的游离的丹参素。
[1]中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准 (中药成方制剂):第9册[S].1994.
[2]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010.
[3]阿丽沙,付明海,张 屏,等.HPLC测定四味土木香散中土木香内酯和异土木香内酯的含量[J].中国民族医药杂志,2011,17(4):56-57.
[4]国家药典委员会.中华人民共和国药典:2015年版一部[S].北京:中国医药科技出版社,2015:87.
[5]肖元灿,胡凤祖.RP-HPLC测定藏木香中土木香内酯与异土木香内酯含量[J].中国药学杂志,2007,42(7):491-493.
[6]张红梅,蓝海珍.对参梅养胃颗粒清膏粉质量标准的研究[J].求医问药,2013,11(12):129-130.
[7]张 玲.高效液相色谱法测定参梅养胃颗粒中芍药苷的含量[J].药学与临床研究,2008,16(1):77-78.
[8]崔晓红,奇海涛,生 宁,等.HPLC法同时测定益肝康颗粒中没食子酸、丹参素、芍药苷、丹酚酸B和丹参酮ⅡA含量[J].药物分析杂志,2014,34(3):432-436.
[9]庞 鹏.归芍合剂中丹参的鉴别和芍药苷的含量测定[J].药学与临床研究,2007,15(3):249-250.
[10]余 萍.天麻质量标准提高研究[D].昆明:云南中医学院,2014.
[11]许 敏.生脉饮复方有效部位纯化工艺初探及麦冬药材的质量标准研究[D].广州:广州中医药大学,2010.
[12]闫根全.丹参素钠的提取及注射用丹参素钠的研制[D].成都:四川大学,2007.
[13]陈 彦,贾晓斌,施亚芳,等.不同提取方法测定丹参药材中丹参素含量的比较研究[J].江苏中医药,2003,24(6):55-56.
Quality standard for Shenmei YangweiGranules
CHEN Lei1, GUO Qing2*
(1.Nanjing University ofChineseMedicine,Nanjing 210000,China;2.Jiangsu Provincial Institute for Food and Drug Control,Nanjing 210000,China)
AIM To estab1ish the qua1ity standard for ShenmeiYangweiGranu1es(TaraxaciHerba,Glycyrrhizae Radix et Rhizoma,Inulae Radix,etc.).METHODS TLC was app1ied to identifying T.Herba and G.Radix.HPLC was used for the qua1itative ana1yses of a1anto1actone and isoa1anto1actone,and quantitative determination of sa1vianic acid A sodium and paeonif1orin.RESULTS Free from interference from the negative reference,the TLC identification disp1ayed its good specificity.T.Herba was not detected in four batches of samp1es,G.Radix was not found in six batches,and there existed no a1anto1actone in three batches.Sa1vianic acid A sodium and paeonif1orin showed good 1inear re1ationships within the ranges of 40.5-506.25μg(r=1.000)and 50.19-627.38μg(r=0.999 5).The average recoveries were 97.16%and 99.83%with the RSDs of 1.51%and 0.62%(n=6),respective1y.The average contents of these two constituents were 4.560 mg/bag and 12.191 mg/bag,whi1e the content 1imits of Salviaemiltiorrhizae Radix et Rhizoma and Paeoniae Radix Alba were suggested no 1ess than 3.5 mg/bag and 9.4 mg/bag,respective1y.CONCLUSION This simp1e,accurate and high1y specificmethod can contribute to the estab1ishmentof qua1ity standard for Shenmei YangweiGranu1es.In addition,twe1ve batches of samp1es prepared by unified techno1ogy meet the re1ated requirements.
Shenmei Yangwei Granu1es;Taraxaci Herba;Glycyrrhizae Radix et Rhizoma;a1anto1actone;isoa1anto1actone;sa1vianic acid A sodium;paeonif1orin
R927.2
A
1001-1528(2016)06-1279-06
10.3969/j.issn.1001-1528.2016.06.016
2015-12-01
陈 镭 (1991—),男,硕士生,研究方向为中药学。Te1:18913605202,E-mai1:chen5615@126.com
郭 青 (1964—),女,博士,主任药师,研究方向为中药学。Te1:(025)86632807,E-mai1:guoqing850@sohu.com
