合煎对利口清含漱液稳定性的影响
2016-09-06薛非非王明芳赵利利王志敏张朔生山西中医学院制药与食品工程学院山西晋中03069山西华元医药集团有限公司山西太原03003
薛非非, 李 坤, 王明芳, 赵利利, 王志敏, 张朔生*(.山西中医学院制药与食品工程学院,山西晋中03069;.山西华元医药集团有限公司,山西太原03003)
合煎对利口清含漱液稳定性的影响
薛非非1, 李 坤1, 王明芳1, 赵利利1, 王志敏2, 张朔生1*
(1.山西中医学院制药与食品工程学院,山西晋中030619;2.山西华元医药集团有限公司,山西太原030032)
目的 研究合煎对利口清含漱液稳定性的影响。方法 将处方中原工艺改为合煎,并在合煎剂中加入pH稳定剂、澄清剂。单因素试验对5种制剂工艺进行研究,以绿原酸含有量为质量控制指标,验证合煎对制剂稳定性的改善效果。结果 合煎与单煎相比,绿原酸含有量基本保持稳定。样品pH值在观察期内变化不大,絮状物减少。结论
通过合煎工艺及加入澄清剂、pH稳定剂等措施,可以提高利口清含漱液的稳定性。
利口清含漱液;稳定性;合煎;单因素试验
利口清含漱液主要成分为金银花和北豆根,具有清热解毒的功效,用于肺胃火热引起的复发性口疮和牙周病(牙龈炎和牙周炎)的辅助治疗,可减轻该类疾病引起的口腔局部溃疡、渗出、充血、出血、水肿和疼痛等症状[1]。原处方是通过两种药材分煎后再合并煎煮液制成,在贮藏过程中存在pH值变化较大、絮状物较多、有效成分含有量下降等问题。本实验通过采取合煎工艺[2-5]及加入壳聚糖、磷酸氢二钠等措施对现有工艺进行改进,采用单因素试验法对制剂pH值及绿原酸含有量变化情况进行分析,得出最优工艺。
1 仪器与试剂
Thermo Fisher Scientific U3000高效液相色谱仪;pHS-3C+/3C智能酸度计 (成都世纪方舟科技有限公司)。
金银花 (产地河南)和北豆根 (产地河北)经山西中医学院张朔生教授鉴定,分别为忍冬科忍冬属植物金银花Flos Lonicerae japonicae及防己科植物北豆根Rhizoma Menisperm i。
乙腈为色谱纯;壳聚糖、磷酸氢二钠等均为分析纯;水为纯化水。
绿原酸对照品 (中国食品药品检定研究院,批号140601)。样品 (编号I~V),具体制备工艺见 “2.2”项。
2 方法与结果
2.1色谱条件与系统适应性试验 C18色谱柱 (C18烷基硅烷键合硅胶为填充剂,4.6 mm×250 mm,5μm);检测波长327 nm[6];柱温25℃;体积流量1.0 mL/min;流动相乙腈-0.4%磷酸溶液 (13∶87);理论塔板数按绿原酸计算,应不低于1 000。HPLC色谱图见图1。
2.2供试品溶液的制备
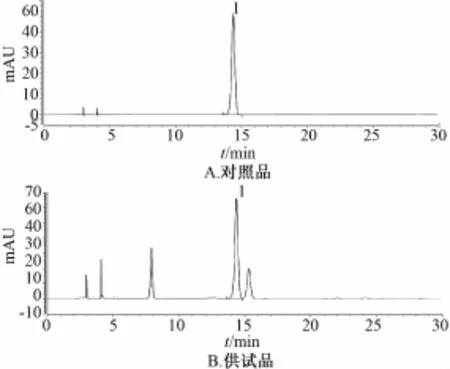
图1 HPLC色谱图
2.2.1制备工艺Ⅰ 称取金银花26.25 g,加水210 mL,浸泡1 h,煎煮3次,第1次40 min,第2次30 min,第3次20min,合并煎液,滤过,滤液备用。取北豆根26.25 g,加水210 mL,浸泡4 h,煎煮3次,第1次40 min,第2次30min,第3次20min,合并煎液,滤过,将两者水煎液分别减压浓缩至相对密度为1.15~1.20(50℃)的清膏,加入乙醇至含醇量达70%,搅匀,静置过夜,回收乙醇,合并两种溶液,加水至375mL,0~4℃放置48 h,滤过,滤液备用。取苯甲酸钠1.25 g、柠檬酸1.25 g、碳酸氢钠3.75 g,加水30 mL溶解,滤过,滤液备用。取薄荷脑0.175 g,加乙醇适量使溶解,与上述两种滤液合并,加水至500 m L,搅匀,即得样品Ⅰ。
2.2.2制备工艺Ⅱ 称取金银花26.25 g,加水210 mL,浸泡1 h。取北豆根26.25 g,加水210mL,浸泡4 h,合并两种药材浸泡液,煎煮3次,第1次40 min,第2次30 min,第3次20 min,合并煎液,滤过,水煎液分别减压浓缩至相对密度为1.15~1.20(50℃)的清膏,其余制法同 “2.2.1”项,即得样品Ⅱ。
2.2.3制备工艺Ⅲ 按 “2.2.2”项下制法,在加水定容至500 m L前加入壳聚糖 (0.6 g/100 mL)[7],搅匀,即得样品Ⅲ。
2.2.4制备工艺Ⅳ 按 “2.2.2”项下制法,将原工艺碳酸氢钠3.75 g换成磷酸氢二钠7.88 g[8],即得样品Ⅳ。
2.2.5制备工艺V 按 “2.2.2”项下制法,将原工艺碳酸氢钠3.75 g换成磷酸氢二钠7.88 g,并且在加水定容至500 mL前加入壳聚糖 (0.6 g/100 mL),搅匀,即得样品V。
2.2.6供试品溶液 取样品10 mL,过滤,精密量取续滤液1mL,置于10mL棕色量瓶中,加50%甲醇至刻度,摇匀,即得。
2.3对照品溶液的制备 精密称取绿原酸对照品4.20 mg,置50 mL棕色量瓶中,加50%甲醇制成含绿原酸0.084 mg/mL的溶液,即得 (10℃以下保存)。
2.4线性范围的考察 精密吸取 “2.3”项下对照品溶液1、2、3、4、5、6 mL,置于10m L量瓶中,加50%甲醇定容至刻度,摇匀。在 “2.1”项色谱条件下,依次进样10μL,以峰面积为纵坐标 (Y),绿原酸质量浓度为横坐标 (X)进行线性回归,得回归方程Y=342.67X+0.003 5(r=0.999 9),表明绿原酸在0.008 4~0.050 4 mg/mL范围内线性关系良好。
2.5精密度试验 精密吸取同一对照品溶液,连续进样6次,每次10μL,测得绿原酸峰面积RSD为0.37%,表明仪器精密度良好。
2.6稳定性试验 取同一份供试品溶液 (样品Ⅱ),分别于0、1、2、4、8、24 h进样,测得绿原酸峰面积RSD为1.14%,表明供试品溶液在24 h内稳定。
2.7重复性试验 取同批样品 (样品II),重复进样6次,每次10μL,测得绿原酸平均含有量为0.566 2 mg/mL,RSD为0.16%,表明该方法重复性良好。
2.8加样回收率试验 精密吸取9份绿原酸含有量已知的样品Ⅱ1.0mL,置于10mL棕色量瓶中,分别精密加入绿原酸对照品溶液(0.084 mg/mL)5.0、7.0、8.0 mL,加50%甲醇至刻度,摇匀,进样10μL测定。结果,绿原酸平均回收率为96.40%,RSD为0.56%。
2.95种工艺的利口清含漱液结果比较
2.9.1绿原酸含有量测定 取 “2.2”项下供试品溶液,每隔20 d测定一次绿原酸含有量 (外标法)。结果,改进工艺后的样品Ⅱ~V较样品Ⅰ中绿原酸含有量增加,而且在一个多月内基本保持稳定。具体见表1。
2.9.2统计学处理 通过SPSS 13.0统计软件,对表1数据进行分析,数据以±s表示,组间均值比较采用LSD法(α<0.05)。结果,0、20、40 d含有量相互差异均有统计学意义 (P<0.05)。
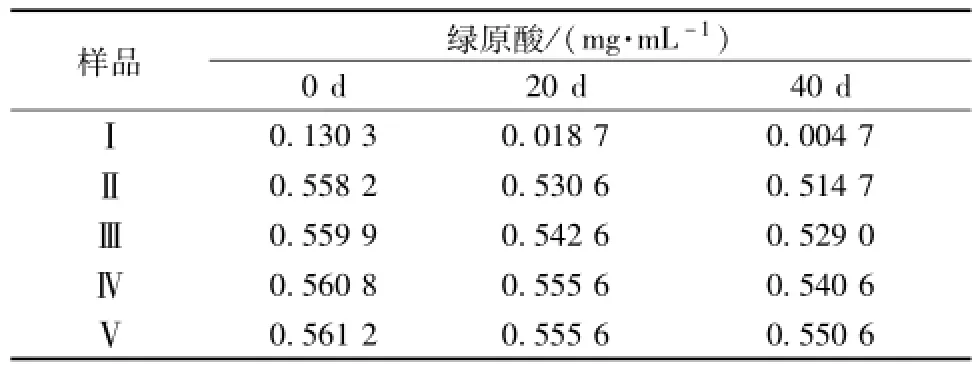
表1 含有量测定结果
2.9.3pH值测定 样品Ⅰ的pH值随时间的延长而略有降低。经过工艺改进后,样品Ⅱ、Ⅲ能保持稳定,但有较小的浮动;样品Ⅳ、V在观察期内基本保持恒定。结果见图2。

图2 pH值变化图
2.9.4絮状物的观察 样品Ⅰ在观察期内出现明显的絮状物,样品Ⅱ~V有所减少,其中样品Ⅲ、V减少显著,而且溶液也较澄清。
3 讨论
3.1意义 本实验建立了利口清含漱液中绿原酸的含有量测定方法[9],为研究金银花提取工艺奠定了基础,也为优化利口清含漱液制剂工艺和制定相关质量标准提供了依据。
3.2合煎的选择 复方中药溶液制剂中的各类型有效组分若按其酸碱性分类,大致可分为弱有机酸和弱有机碱[10]。研究表明,这两类成分以游离状态存在时,大多在水中溶解度较小而出现沉淀,若采用适当方式使两者反应成盐后,不仅其溶解度会显著增加,更保证了制剂的稳定性。
利口清含漱液中金银花主要成分为绿原酸[11],而北豆根为北豆根碱等生物碱类成分[12-13],合煎过程中会产生酸碱反应,生成较稳定的酸碱复合物,可防止利口清含漱液在长期贮藏过程中含有量的下降。实验显示,合煎样品中绿原酸含有量高而稳定,pH值也相对稳定,而采用原工艺制成的样品中其波动较大。因此,合煎可以作为解决利口清含漱液含有量下降的方法之一。
3.3pH稳定剂的选择 在复方制剂中[14],一种成分很可能受处方中溶剂和其它成分或辅料的影响,从而发生改变。因此,一般需加入适当的酸、碱或缓冲溶液,使其处于最适pH值状态,以满足药物制剂安全、稳定、有效的要求。
由于利口清含漱液原工艺中pH值变化较大,因此改变了缓冲溶液,将原工艺中的碳酸氢钠改为磷酸氢二钠溶液,柠檬酸-磷酸氢二钠缓冲溶液[15]使利口清含漱液的pH值相对稳定,能够达到预期效果。
3.4澄清剂的选择 原工艺中利口清含漱液长期贮藏时,会出现絮状物明显增多的问题,因此本实验加入澄清剂壳聚糖以提高其澄清度。壳聚糖是一种优良的澄清剂,具有良好的澄清性能,在中药提取方面具有广泛的应用[16-17]。结果表明,加入壳聚糖后样品絮状物明显减少,澄清度明显高于其他样品。此外,加入缓冲液磷酸氢二钠后,pH值相对稳定,而且絮状物也有所下降。因此,通过加入澄清剂壳聚糖和缓冲液磷酸氢二钠,同样可以有效解决这一问题。
综上所述,采用合煎工艺、加入澄清剂壳聚糖、改变pH缓冲剂等综合措施,可有效提高利口请含漱液的稳定性,而且能保证制剂中有效成分绿原酸的含有量,疗效得到保障。另外,通过HPLC法测定绿原酸的含有量时,操作简便,重复性好,可准确评价该制剂的质量。
[1]姜 秋,冯廷民,赵玉春,等.利口清含漱液治疗牙周病的临床研究[J].白求恩医科大学学报,2000,26(3):275-276.
[2]林丽美,王智民,王维皓,等.RP-HPLC对金银花和连翘单煎、单煎后合并及混煎的分析[J].中国中药杂志,2007,32(21):2240-2243.
[3]任旻琼,周日宝,王朝晖,等.RP-HPLC对金银花和黄芩单煎液与混煎液的分析[J].现代中药研究与实践,2014,28(4):54-56.
[4]闵春艳,游本刚,许琼明,等.正交试验比较金银花药材中绿原酸与木犀草苷的乙醇提取工艺[J].中成药,2011,33(10):1815-1818.
[5]徐殿红,范庆龙,高晓艳,等.正交设计优化金银花绿原酸煎提工艺[J].亚太传统医药,2015,11(4):28-29.
[6]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:205.
[7]黄秉南,杨义雄.壳聚糖澄清剂用于中药提取液澄清工艺的实验[J].海峡药学,2002,14(4):11-12.
[8]陈晓娟,周春山.酶法及半仿生法提取杜仲叶中绿原酸和黄酮[J].精细化工,2006,23(3):257-260.
[9]王 倩,王建新,于治国,等.金银花药材高效液相色谱指纹图谱研究[J].中成药,2005,27(7):751-754.
[10]徐莲英.中药制药工艺技术解析[M].北京:人民卫生出版社,2003:532.
[11]夏 远,李弟灶,裴振昭,等.金银花化学成分的研究进展[J].中国现代中药,2012,14(4):26-32.
[12]郑艳春,秦 婷,崔雅慧,等.北豆根化学成分及药理作用的研究进展[J].中国医药导报,2011,8(13):9-10.
[13]罗 栋,李晓宇,孙 蓉.与功效和毒性相关的北豆根化学成分研究进展[J].中国药物警戒,2012,9(4):230-233.
[14]郝 福,蒋 晔,李艳荣,等.复方中药化学成分的研究进展[J].中成药,2007,29(2):258-261.
[15]杨国才,陈香颖,王季春,等.柠檬酸-磷酸氢二钠缓冲液法提取紫薯干花青素的工艺研究[J].南方农业学报,2013,44(4):635-656.
[16]王琼珺,柳港生,吴锦忠.影响中药注射剂澄明度的因素及解决方法[J].中医药学刊,2006,24(2):360-361.
[17]陆 萍,倪东杰,郭良君.壳聚糖澄清剂与醇沉法制备健骨口服液的比较[J].中国药师,2012,15(11):1580-1582.
R927.11
B
1001-1528(2016)06-1402-03
10.3969/j.issn.1001-1528.2016.06.043
2015-09-10
薛非非 (1992—),女,硕士生,从事中药炮制现代研究。E-mai1:18234046128@163.com
张朔生 (1965—),男,硕士,教授,硕士生导师,从事中药炮制现代研究及新产品开发。Te1:(0351)3179909,E-mai1:zhangshuosheng@a1iyun.com
