参七合剂对高脂血症大鼠sLOX-1、SOD、NO和胆汁酸代谢的影响
2016-09-06姜海斌刘柏炎杨丽洁常德职业技术学院内科教研室湖南常德45000湖南中医药大学第一中医临床学院湖南长沙4008
蒋 锐, 姜海斌*, 刘柏炎, 杨丽洁, 金 娟(.常德职业技术学院内科教研室,湖南常德45000;.湖南中医药大学第一中医临床学院,湖南长沙4008)
参七合剂对高脂血症大鼠sLOX-1、SOD、NO和胆汁酸代谢的影响
蒋 锐1, 姜海斌1*, 刘柏炎2, 杨丽洁1, 金 娟1
(1.常德职业技术学院内科教研室,湖南常德415000;2.湖南中医药大学第一中医临床学院,湖南长沙410208)
目的 观察参七合剂 (西洋参、三七、熟何首乌)对高脂血症模型大鼠血浆凝集素样氧化低密度脂蛋白受体-1(serum 1ectin-1ike oxidized 1ow density 1ipoprotein receptor-1,sLOX-1)、超氧化物歧化酶(SOD)、丙二醛(MDA)、一氧化氮 (NO)、内皮素 (ET)和胆汁酸代谢的影响,探讨其血管保护的作用机制。方法 将120只SD大鼠雌雄分开,随机分成对照组 (20只)和造模组 (100只),使用高脂饲料喂养10 d造模。将造模组大鼠按血脂水平先分层,再随机分为模型组,辛伐他汀组 (给予辛伐他汀0.002 g/kg灌胃),参七合剂小、中、高剂量组 (分别给予参七合剂1、2、4 g/kg灌胃),每组20只。继续喂养20 d后,按照试剂盒要求检测sLOX-1、SOD、MDA、NO、ET、总胆汁酸(tota1bi1e acid,TBA)及血脂水平。结果 与对照组比较,模型组SOD、NO显著降低(P<0.01),sLOX-1、MDA、ET、TBA显著升高 (P<0.01)。与模型组比较,参七合剂各组SOD、NO及粪TBA显著升高 (P<0.05,P<0.01),sLOX-1、MDA、ET显著降低(P<0.05,P<0.01),血清TBA无差异(P>0.05)。sLOX-1水平与总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)水平呈现正相关(r=0.651、P<0.05,r=0.744、P<0.05)。结论 参七合剂通过降低LOX-1的表达、调节脂质氧化与过氧化水平的平衡、保护血管内皮细胞,对高脂血症模型大鼠的血管起到保护作用;通过增加粪便中胆汁酸的排泄量间接降低血液中胆固醇的水平。
参七合剂;高脂血症;凝集素样氧化低密度脂蛋白受体-1;血管保护;胆汁酸
高脂血症(hyper1ipidemia,HLP)是由于脂肪代谢或运转异常使总胆固醇 (TC)、三酰甘油 (TG)和 (或)低密度脂蛋白胆固醇 (LDL-C)过高,和 (或)高密度脂蛋白胆固醇 (HDL-C)过低而引发的一种病症[1]。近年来,随着人们生活水平的提高和饮食结构的改变,高脂血症的发生率在逐年上升。以动脉粥样硬化-血栓为基础的冠心病是诸多危险因素所致的慢性疾病,大量的研究表明吸烟、胆固醇升高、高血压和糖尿病是冠心病致病性的危险因素。血浆胆固醇尤其是LDL-C升高是冠心病发生、发展的必备条件[2]。当血脂升高时,过多的脂质沉积于血管壁和血管内皮细胞上,导致内皮细胞SOD活性降低,最终氧化应激反应损伤血管内皮细胞[3]。降低异常升高的血脂水平是预防心脑血管疾病发生,改善冠心病进程的有效途径[4]。胆汁酸主要在肝内合成,有清除胆固醇、转运脂质物质以及负反馈调节胆汁酸和胆固醇的生物合成等作用,肝脏合成胆汁酸的能力下降直接影响血液中胆固醇的水平[5]。中药降脂研究已成为当前的热点,具有现实的临床意义。前期实验研究显示参七合剂对高脂血症大鼠有较好的降脂作用[6]。本研究旨在通过实验观察参七合剂对高脂血症大鼠sLOX-1、SOD、MDA、NO、ET、TBA等指标的影响,进一步探讨参七合剂对血管的保护作用及降脂机制。
1 材料
1.1动物 SPF级SD大鼠,120只,雌雄各半,体质量(197±16)g,由湖南斯莱克景达实验动物有限公司提供,实验动物生产许可证号SCXK(湘)2013-0004。SD大鼠饲养于湖南中医药大学动物实验中心SPF级实验室,恒温(20~22℃)、恒湿 (50%~60%)。
1.2药物 参七合剂由西洋参、三七、熟何首乌组成,药物饮片购自长沙九芝堂药材公司,粉碎,过200目筛,钴60消毒。辛伐他汀 (10 mg/片,哈药集团三精明水药业有限公司生产,批准文号:国药准字H20010454);蛋黄粉购自安徽亳州市众意蛋业有限责任公司 (批号20130926);胆固醇和甲硫氧嘧啶购自天津博迪化工股份有限公司 (批号分别为20131214、20131109);胆盐购自上海蓝季科技发展有限公司 (批号20120906)。
1.3试剂 TC(批号20140408)、TG(批号20140217)、LDL-C(批号20140403)、HDL-C(批号20140120)、SOD(批 号20140424)、MDA (20140307)、NO (批 号20131227)、ET(批号 20131125)以及 TBA (批 号20140320)试剂盒均为南京建成生物工程研究所产品;LOX-1试剂盒 (批号20140211)为美国R&D公司产品。
1.4仪器 O1ympus AU600型全自动生化分析仪(日本奥林巴斯)。
2 方法
2.1造模及分组 120只SD大鼠普通饲料适应性喂养1周后先将雌雄分开,然后分别将雌、雄SD大鼠随机分成对照组20只、造模组100只,两组中雌雄各半。对照组给予普通饲料,造模组给予高脂饲料[6],自然摄食,连续喂养10 d。第11天,120只SD大鼠尾静脉采血,检测TC、TG、LDL-C、HDL-C。将造模组大鼠雌雄分开,按照血脂4项水平先分别分层,然后随机分成模型组,辛伐他汀组,参七合剂小、中、高剂量组,每组20只,雌雄各半。对照组继续给予普通饲料,模型组、药物干预各组均给予高脂饲料,继续喂养20 d。
2.2给药 给药剂量换算方法[7]:,其中D、R、W分别为给药剂量、体型系数、体质量。人、鼠的体型系数分别为R人=0.1、R鼠= 0.09。以临床等效剂量的1、2、4倍量作为SD大鼠的小、中、高剂量,则参七合剂小、中、高剂量组每只SD大鼠的给药量分别为0.2、0.4、0.8 g。参七合剂用2%羧甲基纤维素钠蒸馏水溶液配制成0.1、0.2、0.4 g/mL的混悬液,使用时摇匀;辛伐他汀 (10 mg/片)溶于蒸馏水,配制成0.2mg/mL的溶液,药物4℃保存。药物干预各组分别给予辛伐他汀或不同质量浓度参七合剂混悬液2 mL/只灌胃,对照组和模型组均给予蒸馏水2 mL/只灌胃,给药在晚8时进行。
2.3指标检测 收集实验最后3 d大鼠粪便,-20℃保存。末次灌胃后,禁食不禁水12 h,腹腔注射乌拉坦1.5 g/kg麻醉,腹主动脉采血。使用自动生化分析仪按照试剂盒操作说明,用酶水解法检测TC、TG、LDL-C、HDL-C,用酶循环法检测TBA,用黄嘌呤氧化酶法检测SOD,用硝酸还原酶法检测NO,用硫代巴比妥酸法检测MDA,用ELISA检测ET。用ELISA法,严格按照试剂盒操作步骤执行,以标准品0、16、32、62.5、125、250、500、1 000 pg/mL的光密度 (D)值制作标准曲线,根据样品 (D)值计算sLOX-1的质量浓度[8]。
2.4统计学方法 采用SPSS 17.0统计软件进行统计分析,数据以±s表示,组间比较采用t检验。相关分析用单因素Pearson分析。以P<0.05为有统计学意义。
3 结果
3.1参七合剂对大鼠sLOX-1及血脂水平的影响 与对照组比较,其他各组sLOX-1及TC、TG、LDL-C水平均显著升高,HDL-C显著降低(P<0.01),表明本实验高脂血症大鼠模型构建成功。与模型组比较,参七合剂各组、辛伐他汀组sLOX-1、TC、TG、LDL-C降低,HDL-C升高(P<0.01)。与辛伐他汀组比较,参七合剂小、中剂量组TC、LDL-C显著降低,HDL-C显著升高(P<0.01),sLOX-1、TG没有差异(P>0.05),参七合剂高剂量组sLOX-1、TC、TG、LDL-C、HDL-C均没有差异(P>0.05)。单因素Pearson分析结果显示sLOX-1水平与TC、LDL-C水平呈现正相关,相关系数分别为r=0.651、P<0.05,r=0.744、P<0.05。结果表明高脂血症能使大鼠血浆中sLOX-1升高;参七合剂、辛伐他汀均能明显降低高脂血症大鼠sLOX-1;参七合剂小、中剂量对高脂血症大鼠TC、LDL-C、HDL-C的影响优于辛伐他汀。见表1。
表1 参七合剂对大鼠sLOX-1及血脂水平的影响(±s,n=20)
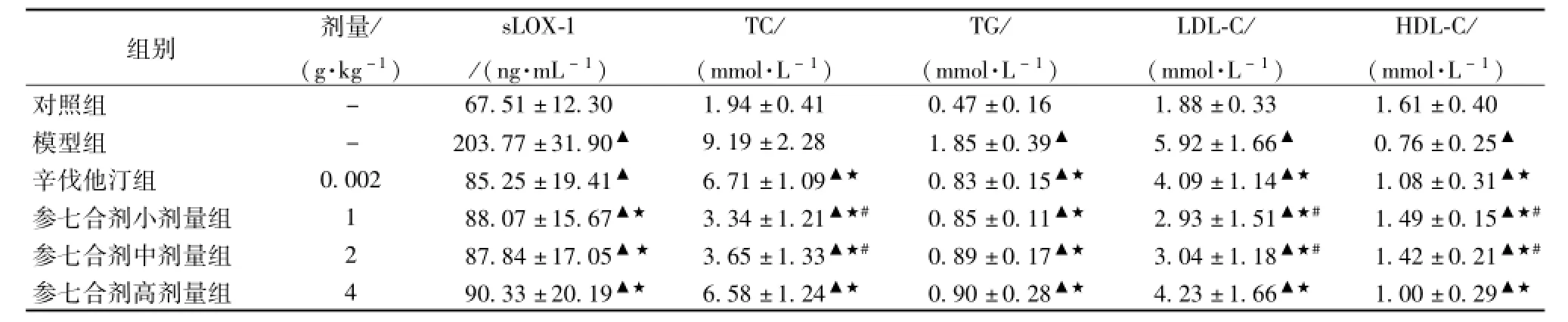
表1 参七合剂对大鼠sLOX-1及血脂水平的影响(±s,n=20)
注:与对照组比较,▲P<0.01;与模型组比较,★P<0.01;与辛伐他汀组比较,#P<0.01
?
3.2参七合剂对大鼠SOD、MDA、NO、ET水平的影响与对照组比较,其他各组SOD、NO显著降低 (P<0.01)而MDA、ET显著升高(P<0.01)。与模型组比较,参七合剂各组、辛伐他汀组SOD、NO升高 (P<0.05,P<0.01),MDA、ET降低 (P<0.05,P<0.01)。与辛伐他汀组比较,参七合剂各组ET、NO没有差异 (P>0.05);参七合剂小、中剂量组MDA降低、SOD升高显著 (P<0.01),高剂量组没有差异 (P>0.05)。结果表明高脂血症能使大鼠血清中SOD、NO降低,MDA、ET升高;参七合剂、辛伐他汀均能明显降低高脂血症大鼠MDA、ET,升高SOD、NO,可明显抑制大鼠的脂质过氧化过程,改善大鼠血管NO的释放及血管的舒张能力和自我修复能力;参七合剂小、中剂量对MDA、SOD的影响优于辛伐他汀。见表2。
3.3参七合剂对大鼠TBA水平的影响 与对照组比较,其他各组血清和粪TBA显著升高 (P<0.01)。与模型组比较,参七合剂各组、辛伐他汀组血清TBA水平没有差异(P>0.05),粪TBA显著增加 (P<0.01)。与辛伐他汀组比较,参七合剂各组血清TBA没有差异 (P>0.05),小、中剂量组粪TBA显著增加 (P<0.01)。结果表明高脂血症能使大鼠血清和粪TBA升高;参七合剂、辛伐他汀均能明显增加高脂血症大鼠粪TBA、而对血清TBA没有影响。参七合剂小、中剂量对粪TBA的影响优于辛伐他汀。见表3。
表2 参七合剂对大鼠SOD、MDA、NO、ET的影响(±s,n=20)

表2 参七合剂对大鼠SOD、MDA、NO、ET的影响(±s,n=20)
注:与对照组比较,▲P<0.01;与模型组比较,★P<0.01,●P<0.05;与辛伐他汀组比较,#P<0.01
?
表3 参七合剂对大鼠TBA水平的影响(±s,n=20)
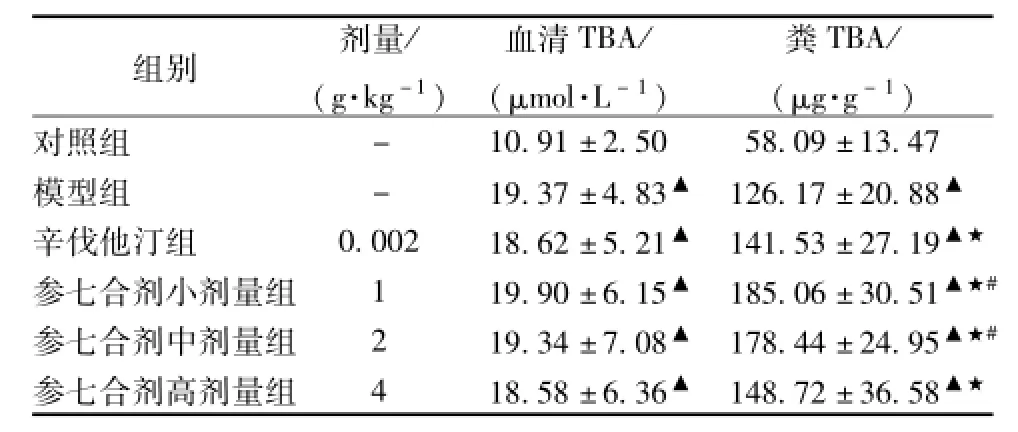
表3 参七合剂对大鼠TBA水平的影响(±s,n=20)
注:与对照组比较,▲P<0.01;与模型组比较,★P<0.01;与辛伐他汀组比较,#P<0.01
?
4 讨论
血脂异常对健康的损害主要在心血管系统,富含TG的脂蛋白具有致动脉粥样硬化的作用[9],TG、LDL-C升高是主要致病危险因素。LDL是血液中胆固醇的主要携带者,通过血管内皮进入血管壁内,在内皮下滞留的LDL被修饰成氧化型LDL(oxidized 1ow-density 1ipoprotein,ox-LDL),巨噬细胞吞噬ox-LDL后形成泡沫细胞,后者不断增多、融合,构成动脉粥样硬化斑块的脂质核心。目前已公认,ox-LDL是诱导血管内皮结构损伤和功能障碍的一个主要因素,在动脉粥样硬化的发生、发展中发挥重要作用[10]。ox-LDL受体包括清道夫受体-A、CD68、LOX-1等,而LOX-1则是表达在大动脉内皮细胞上负责摄取和代谢ox-LDL的主要受体[11],具有对 ox-LDL特异性结合、内吞以及降解作用[12]。ox-LDL无论是通过结合并激活其受体LOX-1,还是通过直接细胞毒作用,皆可抑制NO的生成,从而促进ET的合成和释放,NO和ET的作用平衡是调节体循环和局部血液灌注的主要决定因素[13]。ox-LDL作用于LOX-1受体,可使其表达上调,可溶性LOX-1(sLOX-1)是LOX-1的可溶形式,其外周血水平与LOX-1的表达水平呈正相关[8]。SOD是体内清除氧自由基的重要酶,其水平的高低反映机体清除氧自由基的能力。MDA是过氧化脂质十分重要的降解产物,对细胞及细胞成分具有一定的损伤作用,能干扰脂肪酸的氧化降解[14]。MDA的测定常与SOD的测定相互配合,MDA水平越高,间接反映了机体细胞受自由基攻击越严重[15]。NO能直接反映血管受损程度[16],血浆ET质量浓度一定程度上也反映了血管内皮细胞损伤的程度[17]。
实验结果显示,高脂血症能使大鼠血浆中sLOX-1升高,提示由LOX-1介导的ox-LDL对血管内皮的损伤加重;而参七合剂能降低血液中TC、LDL-C及LOX-1的水平,从而抑制ox-LDL损伤血管内皮,起到保护血管内皮功能的作用。高脂血症能使大鼠血清中SOD、NO降低,使MDA、ET升高;而参七合剂通过升高 SOD、NO水平,降低MDA、ET水平,抑制大鼠的脂质过氧化过程,改善大鼠血管NO的释放及血管的舒张能力和自我修复能力。
实验结果还显示,高脂血症能使大鼠血清和粪TBA升高,参七合剂能明显增加高脂血症大鼠粪TBA、而对血清TBA没有影响。参七合剂可能通过增加粪便中胆汁酸的排泄量进而促进肝脏合成胆汁酸的途径,降低血液中胆固醇的水平。
参七合剂由西洋参、三七、熟何首乌组成,具有益气养血、活血化瘀的功效。三七皂苷能显著降低肝组织MDA水平,且能显著升高还原型谷胱甘肽 (GSH)含有量,亦能减轻大鼠肝组织脂肪变性样作用[18]。西洋参茎叶皂苷能纠正高脂血症大鼠脂蛋白-胆固醇代谢的紊乱,抑制高脂饮食和失血引起的脂质过氧化反应,从而保护细胞膜和亚细胞膜结构和功能[19]。何首乌所含成分均二苯烯能使血清游离脂肪酸及肝脏过氧化脂质含有量下降[20]。
综上所述,参七合剂通过降低sLOX-1的表达、调节脂质氧化与过氧化水平的平衡、保护血管内皮细胞,从而对高血脂症模型大鼠的血管起到保护作用。另外,参七合剂能通过增加粪便中胆汁酸的排泄量间接降低血液中胆固醇的水平。
[1]Bravo L,Mateos R,Sarria B,et al.Hypocho1estero1aemic and antioxidant effects of yerbamate(Ilex paraguariensis)in high-cho1estero1 fed rats[J].Fitoterapia,2014,92:219-229.
[2]赵水平.血脂异常[M].上海:上海交通大学出版社,2009:247-248.
[3]Visavadiya N P,Narasimhacharya A V.Ame1iorative effects of herba1 combinations in hyper1ipidemia[J].Oxid Med Cell Longev,2011,2011:160408.
[4]张 茁.缺血性脑卒中的预防[J].中华老年心脑血管病杂志,2006,8(3):146-147.
[5]潘文干.生物化学[M].6版.北京:上人民卫生出版社,2009:274-278.
[6]蒋 锐,姜海斌,刘柏炎,等.参七合剂对高脂血症大鼠的降脂效应及其机制[J].中国实验方剂学杂志,2013,19(12):254-257.
[7]徐叔云,卞如濂,陈 修.药理实验方法学[M].3版.北京:人民卫生出版社,2003:202.
[8]陈群娟.高血压和高血脂患者血浆sLOX-1水平的临床分析[J].中国处方药,2014,12(11):102-103.
[9]Lyson T,Mariak Z,Jadeszko M,et al.Resu1ts of Destandau microendoscopic 1umbardiscectomy[J].Neurol Neurochir Pol,2008,42(2):105-111.
[10]宋军那,刘 康,刘保林.氧化低密度脂蛋白损伤血管内皮功能的机制及相关药物研究现状[J].药学进展,2009,33(10):433-438.
[11]Mehta J K,Chen J,Hermonat P L,et al.Lectin-1ike oxidized 1ow-density 1ipoprotein receptor-1(LOX-1):a critica1 piayer in the deve1opmentofatherosc1erosis and re1ated disorders[J].Cardiovasc Res,2006,69(1):36-38.
[12]Goba1 F,Deshmukh A,Shah S,et al.Triad of metabo1ic syndrome,chronic kidney disease,and coronary heart disease with a focus on microa1buminuria death by overeating[J].Am Coll Cardiol,2011,57(23):2304-2307.
[13]何翠瑶,李晓辉,李淑惠,等.三七皂总苷对氧化低密度脂蛋白损伤血管内皮细胞保护作用的研究[J].中国药房,2008,19(6):401-403.
[14]何自立,陈伟平,单 巍.蚕蛹油对大鼠非酒精性脂肪肝形成的影响[J].中国微生态学杂志,2007,19(6):483-485.
[15]张中兴,吴开国,杨 莉,等.矽尘染毒大鼠体内脂质过氧化与抗氧化的水平[J].工业卫生与职业病,2006,32(2):74-75.
[16]Cacanyiova S,Dovinova I.The ro1e of oxidative stress in acety1cho1ine-induced re1axation of endothe1ium-denuded arteries[J].JPhysiol Pharmacol,2013,64(2):241-247.
[17]Choi D H,Lee Y J,Oh H C,et al.Improved endothe1ia1 dysfunction by Cynanchum wilfordii in apo1ipoprotein Emice fed a high fat/cho1estero1 diet[J].Med Food,2011,15(2):169-173.
[18]沈映君.中药药理学[M].2版.北京:人民卫生出版社,2011:534-536.
[19]郑毅男,李慧萍,张 晶,等.西洋参皂苷对高脂肪食小鼠脂肪和胰脂肪酶活性的影响[J].吉林农业大学学报,2005,27(5):519-521.
[20]沈映君.中药药理学[M].2版.北京:人民卫生出版社,2011:860-861.
R285.5
B
1001-1528(2016)06-1376-04
10.3969/j.issn.1001-1528.2016.06.036
2015-08-12
湖南省教育厅科技计划项目 (12C0969);常德市科技局科技计划项目 (2010BS02)
蒋 锐 (1969—),女,硕士,副教授,从事高脂血症及妇科杂病防治研究。Te1:13786699264,E-mai1:jiangrui69@ 163.com
姜海斌 (1971—),男,博士,副教授,从事高脂血症及肾病防治研究。Te1:13786650036,E-mai1:jhsp810@163.com
