低盐驯化对半滑舌鳎幼鱼生长、渗透生理及糖代谢酶活力影响的研究*
2016-09-06房子恒田相利董双林
房子恒, 田相利, 董双林
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
低盐驯化对半滑舌鳎幼鱼生长、渗透生理及糖代谢酶活力影响的研究*
房子恒, 田相利**, 董双林
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
为研究半滑舌鳎(Cynoglossussemilaevis)幼鱼在不同盐度条件下的适应性,将半滑舌鳎幼鱼在淡水(S0)和盐度5(S5)、盐度10(S10)、盐度20(S20)、盐度30(S30)条件下驯养60d,测量半滑舌鳎幼鱼的生长、渗透生理和糖代谢酶活力等指标。实验表明:盐度降低至10~20时,对半滑舌鳎幼鱼的生长具有一定的促进作用,在S10时鳃和肾脏中的Na+/K+-ATPase活力最低(P<0.05)。通过检测鱼体的糖代谢酶活力发现:鳃中丙酮酸激酶(PK)活力在S10附近有最小值,琥珀酸脱氢酶(SDH)和苹果酸脱氢酶(MDH)活力在S10、S5及S0时均显著降低(P<0.05),表明鳃中柠檬酸循作用在驯化至低盐度后有所减弱,在淡水条件下糖酵解作用有所增强;在淡水条件下肾脏中己糖激酶(HK)、PK的活力最高(P<0.05),SDH和MDH活力较高,表明淡水中幼鱼肾脏中糖酵解和三羧酸循环作用有所增强;在淡水条件下肝脏中HK和SDH活力有所增强,表明淡水中幼鱼肝脏中的糖代谢作用有一定程度的增强。研究结果表明,淡水条件下,半滑舌鳎幼鱼的代谢水平始终维持在较高状态,表现为渗透压调节器官中糖代谢作用有所加强,生长受到抑制,在S10附近鱼体代谢率低,代谢酶活力处在较低水平,有利于幼鱼生长。
半滑舌鳎; 盐度; 生长; 渗透生理; 糖代谢
引用格式:房子恒, 田相利, 董双林. 低盐驯化对半滑舌鳎幼鱼生长、渗透生理及糖代谢酶活力影响的研究[J]. 中国海洋大学学报(自然科学版), 2016, 46(8): 19-27.
FANG Zi-Heng, TIAN Xiang-Li, DONG Shuang-Lin. The growth performance, osmotic physiology and carbohydrate metabolism activityies of juvenile Cynoglossus semilaevis acclimated to low salinity water[J]. Periodical of Ocean University of China, 2016, 46(8): 19-27.
盐度是影响鱼类生长的重要环境因子,研究鱼类的最适生长盐度对于养殖生产具有重要的意义。大多数广盐性鱼类对盐度变化具有较强的适应能力,这类鱼能够通过自身具有的渗透压调节机能来实现鱼体与周围水环境的离子交换,使鱼体形成稳定的、适应不同盐度环境的渗透压条件,实现在较大盐度范围内正常的生存、生长。盐度变化会对鱼类的代谢产生影响,尤其是渗透调节压力的增大对鱼类代谢率的影响更显著。Febry等[1]对莫桑比克罗非鱼(Oreochromismossambicus)的研究发现,其用于渗透压调节所消耗的能量大小依次为淡水>海水>等渗海水。通常认为在等渗条件下鱼体用于调节机体离子含量变化所需的能量最少,此时鱼体可将更多的能量分配至生长中去[2-4]。有研究表明,鱼体参与渗透调节的能量水平在占总能量收支的20%~50%,而另外的一些研究表明可能只占到10%[5]。
通常,鱼类在低盐度情况下的生长水平显著高于海水条件[6-9],原因可能是由于低盐度更接近鱼类的等渗点,在这个盐度范围内鱼类用于渗透调节所需的能量最少,更多的能量用于鱼体的生长。在整个渗透调节过程中,鳃和肾等重要的渗透压调节组织器官中的糖代谢作用会有所增强,以满足组织器官对于能量的需求[1-2]。此外,在鱼体适应不同的盐度环境时,鳃和肾中的Na+/K+-ATPase的活力也会发生相应的变化[10],而Na+/K+-ATPase活力的提高会导致机体耗能的增加,从而进一步影响为机体供能的糖代谢作用[11-12]。
鱼类细胞内外的离子交换所需的能量通常由糖和脂分解所产生的ATP提供[11-12],而糖类的氧化磷酸化作用是鱼类产生ATP的重要途径。整个糖代谢作用是一个非常复杂的酶促反应,糖酵解过程中的己糖激酶、丙酮酸激酶以及柠檬酸循环中的琥珀酸脱氢酶及苹果酸脱氢酶是对糖代谢效率具有关键性调节作用的酶,可以在一定程度上可以反映出糖代谢水平的高低。除以上2种糖代谢途径外,磷酸戊糖途径也是细胞中参与葡萄糖分解和ATP生成的重要代谢途径,参与此途径的起始阶段反应的六磷酸葡萄糖脱氢酶是该途径中的一种关键酶。
本研究以半滑舌鳎(Cynoglossussemilaevis)幼鱼为实验对象,将其在S0、S5、S10、S20和S30等5个盐度梯度条件下驯养60d,在之前的研究中,本文分析了各个盐度下半滑舌鳎幼鱼的免疫状况,从免疫的角度探讨了半滑舌鳎幼鱼低盐养殖的可行性[13],而在本研究中,重点从酶学的角度阐释了呼吸代谢与半滑舌鳎幼鱼生长的紧密联系,为揭示盐度影响半滑舌鳎幼鱼生长的具体能量学机制提供一定的理论依据。
1 材料与方法
1.1 实验材料
实验所用半滑舌鳎购自莱州明波水产有限责任公司。实验用鱼运至中国海洋大学岙山卫实验基地后,暂养于多个玻璃钢水族箱(55cm×30cm×35cm)中。暂养期间温度控制在(21.0±0.5)℃,盐度为30,24h充气泵充氧,日换水量100%,光照周期14L∶10D,pH=8.1,氨态氮<0.19mg/L。稳定7天后,待其适应实验室环境条件,选取相近规格的半滑舌鳎幼鱼开始缓慢驯化至实验所需盐度。先以每天降低5个盐度的速度由S30驯化至S20,之后以每天降低2个盐度的速度驯化至S10、S5和S0,然后在各盐度下对半滑舌鳎驯养7d,以使其适应新的水环境条件。低盐度海水由天然海水(盐度30左右)与曝气自来水调配而成。
1.2 实验设计和管理
本实验设置S0、S5、S10、S20、S30共5个盐度处理,每个处理设置5个重复,每个重复放置7尾规格相似、无病健康的半滑舌鳎幼鱼,平均体重为(7.58±0.04)g。每天7:00和19:00投喂配合饲料(广东越群海洋生物研究开发有限公司,广东揭东),30min后收集剩余残饵,每天在投喂前40min和摄食后1h收集粪便,其它控制条件同暂养条件,养殖周期为60d。
1.3 样品的采集及酶活的测定
实验结束后所有幼鱼经24h饥饿处理后全部称重取样,取样前对幼鱼进行MS-222麻醉处理,所有幼鱼用1mL注射器从半部尾静脉插入抽取血液,血液抽出后置于冷的1.5mL离心管中,于4℃下静置12h后于4℃ 3500r/min条件下离心10min,取上层血清20μL,用Model 210型冰点渗透压计(Micro-Osmometer)测定渗透压。剩余血清与所取肝脏、鳃和肾脏组织均放入离心管中,迅速投入液氮冷冻,再转移到-80℃冰箱保存,以上操作在冰盘上进行。
所有样品带回实验室后分别测定鳃、肾脏和肝脏内的己糖激酶(HK)活力、丙酮酸激酶(PK)活力、琥珀酸脱氢酶(SDH)活力、苹果酸脱氢酶(MDH)活力、六磷酸葡萄糖脱氢酶(G6PDH)活力以及血清、肾脏和肝脏中的葡萄糖含量。组织样品进行酶活力测定前,先用剪刀剪碎,准确称取0.2g样品于玻璃匀浆管中,加入9倍体积的生理盐水后用匀浆机匀浆,后于4℃ 3000r/min条件下离心10min,然后分别稀释至所需浓度后进行酶活的测定。葡萄糖(GLU)、己糖激酶(HK)活力、丙酮酸激酶(PK)活力、琥珀酸脱氢酶(SDH)活力、苹果酸脱氢酶(MDH)活力及蛋白含量(蛋白的测定采用考马斯亮蓝法)的测定均采用南京建成生物研究所提供的试剂盒。G6PDH的测定方法参照Sangiao等[14],所需试剂均购自Sigma公司。
取半滑舌鳎幼鱼鳃丝和肾脏约0.02g,用生理盐水润洗,置于9倍体积8mg/mL的生理盐水中,用玻璃匀浆管进行冰浴匀浆,4℃下以1500r/min离心10min,取上清液置于0~4℃冷藏保存,在8h内测定Na+/K+-ATP酶活力。Na+/K+-ATPase活力及蛋白含量(蛋白的测定采用考马斯亮蓝法)的测定均采用南京建成生物研究所提供的试剂盒。
1.4 数据处理
实验期间半滑舌鳎幼鱼特定生长率、摄食率、饵料转化率、消化率计算如下:
SGRw=100×(lnWt-lnW0)/t;
FRw=100×Cw/((Wt+W0)/2×t);
FCEw=100×(Wt-W0)/Cw;
ADRw=100×(Cw-Fw)/Cw。
式中:SGRw为以湿重表示的半滑舌鳎幼鱼的特定生长率;FRw为以湿重表示的摄食率;FCEw为以湿重表示的饵料转化率;ADRw是以重量表示的消化率;Cw表示的半滑舌鳎幼鱼的摄食量;Wt和W0为半滑舌鳎幼鱼的末体重和初体重;Fw为以重量表示的粪便量;t为实验时间。
所得数据采用SPSS13.0软件的方差分析(ANOVA)及Duncan多重比较进行分析处理,以P<0.05作为差异显著水平。
2 结果与分析
2.1 不同盐度下半滑舌鳎幼鱼的生长情况
各实验组半滑舌鳎幼鱼的初始体重、末体重、特定生长率、摄食率、饲料转化率及消化率如表1所示。S10和S20组的特定生长率最高,而S0组显著降低(P<0.05);S5组的摄食率显著低于S0组(P<0.05);饲料转化率方面,S0和S30组的饲料转化率显著低于其他各处理(P<0.05),S0时显著低于S30(P<0.05);消化率方面,在S30时有最小值,显著低于S5、S10和S20组(P<0.05)。
注:表中不同盐度处理之间带有不同字母的数据表示相互之间差异显著(P<0.05)。
Note: Data with different letter in the same row means significant difference(P<0.05).
①Initial body weight; ②Final body weight; ③Specific growth rate; ④Ration level; ⑤Food conversion efficiency; ⑥Apparent digestibility rate
2.2 不同盐度下半滑舌鳎幼鱼血清渗透压、鳃及肾脏Na+/K+-ATPase活力
各实验组半滑舌鳎幼鱼血清渗透压、鳃及肾脏Na+/K+-ATPase活力见表2,S0时半滑舌鳎幼鱼的血清渗透压显著低于其他各组(P<0.05),鳃中的Na+/K+-ATPase活力在S10时有最小值(P<0.05),其余各组之间无显著性差异(P>0.05);肾脏中的Na+/K+-ATPase活力也在S10时有最小值,而在S0时有最大值(P<0.05)。

表2 不同盐度下半滑舌鳎幼鱼血清渗透压、鳃丝及肾脏Na+/K+-ATPase活力
注:表中不同盐度处理之间带有不同字母的数据表示相互之间差异显著(P<0.05)。
Note: Data with different letter in the same row means significant difference(P<0.05).
①Plasma osmolarity; ②Gill Na+/K+-ATPase activity; ③Kidney Na+/K+-ATPase activity
2.3 不同盐度下半滑舌鳎幼鱼鳃组织的糖代谢酶活力
各实验组半滑舌鳎幼鱼鳃内糖代谢酶活力见表3,不同盐度处理下鳃中HK的活力未检测到显著性差异(P>0.05);PK的活力在S10时有最小值,S0时有最大值(P<0.05),S30时有次大值;驯化至S10及以下盐度后,幼鱼鳃中的SDH及MDH活力较S30时显著降低(P<0.05);鳃中的G6PDH的活力在S0时有显著性的降低(P<0.05)。
2.4 不同盐度下半滑舌鳎幼鱼肾脏组织的糖代谢酶活力
不同盐度下半滑舌鳎幼鱼肾脏内糖代谢酶活力见表4,肾脏中HK、PK的活力均在S0时最高(P<0.05);SDH活力在S0及S5时有较高的水平,显著高于其它处理(P<0.05),其余各处理之间均无显著性差异(P>0.05),MDH活力在S0时活力最高(P<0.05);不同盐度条件下驯养的幼鱼肾脏的G6PDH的活力无显著性差异(P>0.05)。

表3 不同盐度下半滑舌鳎幼鱼鳃糖代谢酶活力
注:表中不同盐度处理之间带有不同字母的数据表示相互之间差异显著(P<0.05)。
Note: Data with different letter in the same row means significant difference(P<0.05).
①HK activity; ②PK activity; ③G6PDH activity; ④SDH activity; ⑤MDH activity

表4 不同盐度下半滑舌鳎幼鱼肾脏糖代谢酶活力
注:表中不同盐度处理之间带有不同字母的数据表示相互之间差异显著(P<0.05)。
Note: Data with different letter in the same row means significant difference (P<0.05).
①HK activity; ②PK activity; ③G6PDH activity; ④SDH activity; ⑤MDH activity
2.5 不同盐度下半滑舌鳎幼鱼肝脏组织的糖代谢酶活力
不同盐度下半滑舌鳎幼鱼肝脏内糖代谢酶活力见表5,肝脏HK活力在S20时有最小值(P<0.05),驯化至S0、S5和S10后HK活力显升高。肝脏中PK活力在不同盐度下未检测到显著性差异(P>0.05)。肝脏内SDH活力在S0和S10时活力显著低于其他处理(P<0.05)。各处理中肝脏内的MDH活力未检测到有显著性的差异(P<0.05)。G6PDH的活力在淡水条件下的活力最高,在S5时也检测到较高的活力水平,显著高于S10和S20处理(P<0.05)。
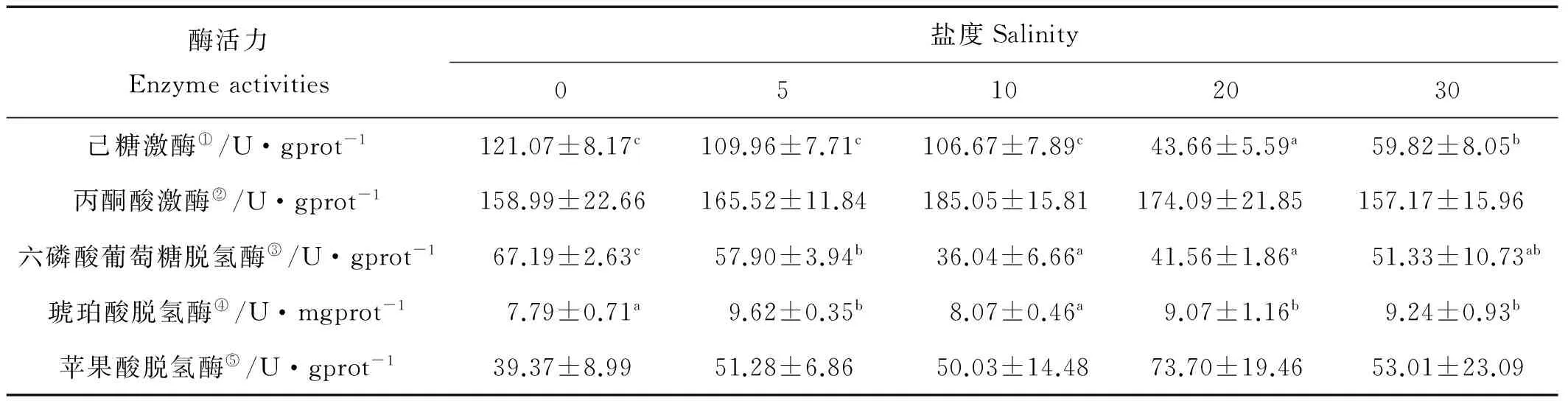
表5 不同盐度下半滑舌鳎幼鱼肝脏糖代谢酶活力
注:表中不同盐度处理之间带有不同字母的数据表示相互之间差异显著(P<0.05)。
Note: Data with different letter in the same row means significant difference (P<0.05).
①HK activity; ②PK activity; ③G6PDH activity; ④SDH activity; ⑤MDH activity
2.6 不同盐度下半滑舌鳎幼鱼血清、肝脏及肾脏中的葡萄糖含量
不同盐度条件下半滑舌鳎幼鱼血清、肝脏及肾脏中的葡萄糖含量见表6,血清葡萄糖含量在S0时有最小值,S5时有次小值,显著低于其他各处理(P<0.05);肝脏内的葡萄糖含量在S10最低,显著低于S0、S20及S30组(P<0.05);肾脏中的葡萄糖含量在S10时有最大值,显著高于S0和S30组(P<0.05)。

表6 不同盐度下半滑舌鳎幼鱼血清、肝脏及肾脏中的葡萄糖含量
注:表中不同盐度处理之间带有不同字母的数据表示相互之间差异显著(P<0.05)。
Note: Data with different letter in the same row means significant difference (P<0.05).
①Plasma glucose level; ②Liver glucose level; ③Kidney glucose level
3 讨论
3.1 不同盐度下半滑舌鳎幼鱼的生长及渗透生理情况
根据渗透压的调节机理,当鱼体处于等渗环境时由代谢所消耗的能量较少[15-18]。鱼体可以将摄入的更多的能量用于生长。本研究中,半滑舌鳎幼鱼的血清渗透压在S5~S30范围内均无显著性差异,说明其对不同盐度环境的适应能力极强,然而鳃、肾中的Na+/K+-ATPase活力则表现出了差异性,在S10时均为最小值,且活力的变化成U型分布,这与范春燕等[19]的研究结果类似。半滑舌鳎幼鱼的特定生长率在S10~S20时高于S30,类似的现象在Lambert等[6]、Gaumet等[20]、曾霖等[21]的研究中也均有发现,然而,这种较低盐度对鱼类生长的促进作用在其他研究中未被发现[22-23]。淡水条件下半滑舌鳎幼鱼的生长受到抑制,但未发现死亡现象,说明半滑舌鳎幼鱼对淡水环境具有一定的适应能力,在对欧洲川鲽幼鱼(PlatichthysflesusL.)和巴西南部一种广盐性牙鲆(ParalichthysorbignyanusL.)的研究中也发现以上2种广盐性鱼类也可以在淡水中存活,但生长受到抑制[24-25]。
半滑舌鳎幼鱼的饲料转化率随盐度的变化趋势与特定生长率相近。对牙鲆(PlatichthysflesusL.)幼鱼[24]、真鲷(SparusaurataL.)[26]和大菱鲆(Cophthalmusmaximus)[9]的研究均表明,广盐性鱼类在盐度14~28范围内的饲料转化率水平较高,这些与本研究得出的结果基本一致。本实验中,S10~S30范围内幼鱼的摄食率未见显著性差异,而王成桂等[27]、尤宏争等[28]在对龙虎斑(Epinepheluslanceolatus♂×E.fuscoguttatus♀)和豹纹鳃棘鲈幼鱼(Plectropomusleopardus)的研究中却发现生长较好的盐度条件下摄食率在也有所提高。
本实验中,在盐度5~30范围内半滑舌鳎幼鱼的消化率随盐度的升高呈现逐渐降低的趋势,田相利等[29]在对半滑舌鳎幼鱼研究中也发现,在相同温度下,半滑舌鳎幼鱼的消化率也随着盐度的升高而逐渐降低,Lambert等[6]对大西洋鲑幼鱼(GadusmorhuaL.)、Conides等[24]对真鲷的研究中也得出过类似的结论,这充分说明较高盐度对鱼类的消化机能能够产生一定的抑制作用。李国希[30]、田田[31]等研究发现,盐度对鱼类消化酶的活力影响显著,并推测盐度是通过影响鱼类的渗透压来调节消化酶活性的。此外,海水中大量的无机离子因盐度的改变浓度发生变化,也有可能进一步促进或抑制消化酶的活性[32-33]。
3.2 不同盐度下半滑舌鳎幼鱼不同组织中的糖酵解关键酶的活力
Vijayan等[34-35]研究表明当鱼体受到盐度胁迫时,可以释放激素如皮质醇等来促进鱼体内葡萄糖的产生,Kazumi等[36]在对罗非鱼的研究中也指出葡萄糖可能是莫桑比克罗非鱼在适应高盐海水过程中重要的能量来源,因此研究不同盐度条件下鱼体的葡萄糖代谢情况,有助于揭示鱼体在渗透压调节过程中的机体能量的产生、分配与调节机制。糖酵解作用是鱼体葡萄糖分解的重要途径之一。通过对半滑舌鳎幼鱼不同组织中糖酵解作用的研究发现,在适应不同盐度环境后,半滑舌鳎幼鱼机体的糖酵解代谢也表现出了一定的适应性,而且不同的组织器官还表现出了一定的特异性。
肝脏是鱼体重要的能量代谢器官,研究表明,鱼体在渗透压调节过程中肝脏所需的能量消耗基本都来自糖类等碳水化合物[37]。当鱼体处于非等渗的环境中,会促进肝脏中糖原分解为葡萄糖,除维持鱼体正常的血糖浓度[38],还可以向鳃、肾等渗透压调节组织器官输送葡萄糖[39-40],为鱼体的渗透压调节提供能量。本实验条件下,通过我们对肝脏中葡萄糖含量的检测结果来看,仅在S10时肝脏中葡萄糖含量水平较低,而其他盐度下肝脏中的葡萄糖含量都处于较高水平,这可能是由于等渗条件下机体对葡萄糖的需求量较低,肝脏产生的葡萄糖较少所致。HK参与糖酵解的第一步反应,能将葡萄糖磷酸化生成为6-磷酸葡萄糖,它的活力通常可以用来反映鱼体细胞利用外源性葡萄糖的能力[41]。肝脏中HK活力在盐度低于S10时显著升高,表明低盐状态下肝脏加速了葡萄糖的磷酸化作用。在低渗环境中,鱼类肾脏通常起到重要的调节作用,半滑舌鳎幼鱼肾脏中HK活力在淡水条件下显著性的升高,这有利于促进肾脏中葡萄糖的转化,加速糖酵解反应,为组织提供能量。
PK是糖酵解过程的限速酶,催化糖酵解最后一步生成丙酮酸的反应[42],其活力的增大表明机体糖酵解旺盛,机体对能量的需求增加,因此其活力的高低通常反应了糖酵解过程实际的反应速率的大小[43]。本研究结果显示:不同处理中肝脏中的PK活力无显著性变化,这与HK活力的变化趋势并不一致,但PK作为关键限速酶,其活力的高低可能更能反映肝脏内的糖酵解作用的进行情况,这说明肝脏作为一个能量代谢的中转站,而其本身的代谢可能还受到其他一些因素的影响,具体的机制还有待于进一步研究。与肝脏中的PK不同,直接参与机体渗透压调节的组织,包括鳃及肾脏中PK的活力在淡水及较高盐度下均有显著提高,表明这些组织中的糖代谢确实由于渗透调节压力的增大而有所增强。例如,当鱼体被转移到高盐度海水中时,鳃的形态及生理学特征均会发生改变,鳃上皮的泌氯细胞大量的发生和分化,并伴随着Na+/K+-ATPase活力的提高[44],而鳃中ATP合成所利用的底物主要为葡萄糖[11]。
3.3 不同盐度下半滑舌鳎幼鱼不同组织中的三羧酸循环关键酶的活力
半滑舌鳎幼鱼鳃中的SDH和MDH的活力在S30时最高,这首先反映出幼鱼鳃组织的能量代谢在环境盐度高出等渗点盐度时较为旺盛,鱼体需要通过鱼鳃向外排出多余的离子,这个过程是耗能的,其次,盐度的升高也可导致幼鱼鳃小瓣上的泌氯细胞作出相应的功能和组织改变,如出现泌氯细胞增大和具高度活性琥珀酸脱氢酶的线粒体数量增多等结构变化[45]。而在淡水和S5条件下,鳃中SDH和MDH的活力并未见显著性提高,表明低盐条件下鳃所发挥的渗透调节作用有限。低盐条件下鱼类的肾脏为避免体内离子的过度流失,肾脏对水分的滤过作用增强,而对离子的重吸收作用会提高,因此当周围水环境的盐度远低于鱼体渗透压时,肾脏必须表现出较强的离子重吸收能力并加强水分的滤过作用,消耗的能量增加。本实验条件下,肾脏中SDH和MDH的活力在淡水和盐度5时显著升高,说明幼鱼为适应低渗环境,肾脏中柠檬酸循环的作用有所加强。
3.4 通过酶学检测的方法解释低盐度条件下半滑舌鳎幼鱼的生长差异
本实验研究显示,半滑舌鳎在驯化至不同盐度下养殖后,其糖代谢酶的活力产生了对不同盐度条件下的适应性,盐度的变化对半滑舌鳎幼鱼不同组织中的糖代谢酶活力影响显著,且在不同组织中表现出一定的差异性。主要体现在直接参与渗透压调节的组织中糖代谢酶的活力相对于环境盐度表现出显著的适应性,低盐条件下在肾脏中检测到的糖酵解酶和三羧酸循环关键酶的活力均有升高,为鱼体在低渗环境下的渗透压调节过程提供能量,而鳃组织在低盐条件下以上2种代谢活动均减弱,但在S30时保持较高的活力,说明以上2种代谢途径也是鳃组织在高渗环境中渗透调节过程消耗能量的重要来源。半滑舌鳎相应组织中的能量代谢酶活力在生长较差的盐度处理组中均有提高,标志着在该盐度环境下能量的消耗增大,在幼鱼的摄食量未见明显升高的情况下,必然导致幼鱼的生长下降。因此,我们认为,盐度影响半滑舌鳎幼鱼生长的一部分原因是由于渗透调节所消耗的能量增加,影响到了摄入能量的分配,从而影响到了生长。
目前在半滑舌鳎人工养殖的生产实践中,仍然采用的是盐度30的养殖条件。本研究就低盐驯化对半滑舌鳎幼鱼生长的影响及其具体代谢机制进行了系统性的研究,从生长情况和组织内的生理代谢状况两个层面上进行了分析论证,进一步明确了低盐度驯化策略(S10~S20范围内)在半滑舌鳎人工养殖中的可行性,具有重大的现实意义。
[1]Febry R, Lutz P. Energy partitioning in fish: the activity-related cost of osmoregulation in a euryhaline cichlid[J]. Exp Biol, 1987, 128: 63-85.
[2]Kirschner L B. The energetics of osmotic regulation in ureotelic and hypo-osmotic fishes[J]. Exp Biol, 1993, 267(1): 19-26.
[3]Kirschner L B. Energetics aspects of osmoregulation in fresh water vertebrates[J]. Exp Biol, 1995, 271(4): 243-252.
[4]Likongwe J S, Stecko T D, Stauffer J R, et al. Combined effects of water temperature and salinity on growth and feed utilization of juvenile Nile tilapia (Oreochromisniloticus)[J]. Aquaculture, 1996, 146(1-2): 37-46.
[5]Boeuf G, Payan P. How should salinity influence fish growth?[J]. Comp Biochem Physiol C, 2001, 130(4): 411-423.
[6]Lambert Y, Dutil J D, Munro J. Effects of intermediate and low salinity conditions on growth rate and food conversion of Atlantic cod (Gadusmorhua)[J]. Can J Fish Aquat Sci, 1994, 51(7): 1569-1576.
[7]Gaumet F, Boeuf G, Severe A, et al. Effects of salinity on the ionic balance and growth of juvenile turbot[J]. J Fish Biol, 1995, 47(5): 865-876.
[8]Woo N Y S, Kelly S P. Effects of salinity and nutritional status on growth and metabolism ofSparussarbain a closed seawater system[J]. Aquaculture, 1995, 135(1-3): 229-238.
[9]Imsland A K, Foss A, Gunnarsson S, et al. The interaction of temperature and salinity on growth and food conversion in juvenile turbot (Cophthalmusmaximus)[J]. Aquaculture, 2001, 198(3-4): 53-67.
[10]Morgan J D, Iwama G K. Salinity effects on oxygen consumption, gill Na+, K+-ATPase and ion regulation in juvenileCohosalmon[J]. Journal of Fish Biology, 1998, 53(5): 1110-1119.
[11]Mommsen T P. Metabolism of the fish gill[A]. Fish Physiology[C]. New York: Academic, 1984: 203-238.
[12]Mommsen T P, Walsh P J, Moon T W. Gluconeogenesis in hepatocytes and kidney of Atlantic salmon[J]. Mol Physio, 1985, 8(1): 89-99.
[13]房子恒, 田相利, 董双林, 等. 不同盐度下半滑舌鳎幼鱼非特异性免疫酶活力分析[J]. 中国海洋大学学报(自然科学版), 2015, 44(5): 46-53.
FANG Zi-Heng, TIAN Xiang-Li, DONG Shuang-Lin, et al. Analysis of the activity of non-specific Immune enzymes of juvenile tongue soles cultured in various salinities[J]. Periodical of Ocean University of China, 2015, 44(5): 46-53.
[14]Sangiao-Alvarellos S, Laiz-Carrion R, Guzman J M, et al. Acclimation ofS.auratato various salinities alters energy metabolism of osmoregulatory and nonosmoregulatory organs[J]. Am J Physiol, 2003, 285(4): 897-907.
[15]Kinne O. Growth, food intake, and food conversion in a euryplastic fish exposed to different temperatures and salinities[J]. Physiol Zool, 1960, 33(4): 288-311.
[16]Brocksen R W, Cole R E. Physiological response of three species of fish to various salinities[J]. Fish Res Bd Canada, 1972, 29(4): 399-405.
[17]Farmer G J, Beamish F W H. Oxygen consumption of Tilapia nilotica in relation to swimming speed and salinity[J]. J Fish Res Bd Can, 1969, 26(11): 2807-2821.
[18]Martinez Palacios C A. The effects of salinity on the survival and growth of juvenileCichlasomaurophthalmus[J]. Aquaculture, 1990, 91(1-2): 68-75.
[19]范春燕, 区又君, 李加儿, 等. 急性盐度胁迫对卵形鲳鲹幼鱼 Na+-K+-ATP酶活性和渗透压的影响[J]. 台湾海峡, 2012, 31(2): 218-224.
FAN Chun-yan, OU You-jun, LI Jia-er, et al. Effects of acute salinity stress on Na+-K+-ATP and osmotic pressure of juvenileTrachinotusovatus[J]. Journal of Oceanography in Taiwan Strait, 2012, 31(2): 218-224.
[20]Gaumet F, Boeuf G, Severe A, et al. Effects of salinity on the ionic balance and growth of juvenile turbot[J]. Journal of Fish Biology, 1995, 47(5): 865-876.
[21]曾霖, 雷霁霖, 刘滨, 等. 盐度对大菱鲆幼鱼生长和肌肉营养成分的影响[J]. 水产学报, 2013, 37(10): 1535-1540.
ZENG Lin, LEI Jilin, LIU Bin, et al. Effects of salinities on growth and flesh quality of juvenile turbot (Scophthalmusmaximus)[J]. Journal of Fisheries of China, 2013, 37(10): 1535-1540.
[22]Shaw H M, Saunders R L, Hall H C. Environmental salinity: its failure to influence growth of Atlantic salmon (Salmosalar) parr[J]. Journal of the Fisheries Research Board of Canada, 1975, 32(10): 1821-1824.
[23]McCormick S D, Saunders R L, Maclntyre A D. The effect of salinity and ration level on growth rate and conversion efficiency of Atlantic salmon (Salmosalar) smolts[J]. Aquaculture, 1989, 82(1-4): 173-180.
[24]Gutt J. The growth of juvenile flounders (PlatichthysflesusL.) at salinities of 0, 5, 15 and 35‰[J]. Appl Ichthyol, 1985, 1(1): 17-26.
[25]Sampaio L A, Bianchini A. Salinity effects on osmoregulation and growth of the euryhaline flounderParalichthysorbignyanus[J]. Journal of Experimental Marine Biology and Ecology, 2002, 269(2): 187-196.
[26]Conides A J, Parpoura A R, Fotis G. Study on the effects of salinity on the fry of the euryhaline species gilthead sea bream (SparusaurataL.)[J]. Aquac Trop, 1997, 12: 297-303.
[27]王成桂, 梁华芳, 黄东科, 等. 不同盐度对龙虎斑生长和摄食的影响[J]. 广东海洋大学学报, 2014, 34(4): 40-44.
WANG Cheng-gui, LIANG Hua-fang, HUANG Dong-ke, et al. Effect of different salinity on growth and feeding of hybrid grouper (Epinepheluslanceolatus♂×E.fuscoguttatus♀)[J]. Journal of Guangdong Ocean University, 2014, 34(4): 40-44.
[28]尤宏争, 孙志景, 张勤, 等. 盐度对豹纹鳃棘鲈幼鱼摄食生长及体成分的影响[J]. 大连海洋大学学报, 2013, 28(1): 89-93.
YOU Hong-zheng, SUN Zhi-jing, ZHANG Qin, et al. Effects of salinity on feeding, growth and body composition in juvenile leopard coraltroutPlectropomusleopardus[J]. Journal of Dalian Ocean University, 2013, 28(1): 89-93.
[29]田相利, 任晓伟, 董双林, 等. 温度和盐度对半滑舌鳎幼鱼消化酶活性的影响[J]. 中国海洋大学学报(自然科学版), 2008, 38(6): 895-901.
TIAN Xiang-Li, REN Xiao-Wei, DONG Shuang-Lin, et al. Studies on the specific activities of digestive enzymes ofCynoglossussemilaevisat different salinities and temperatures[J]. Periodical of Ocean University of China, 2008, 38(6): 895-901.
[30]李希国, 李加儿, 区又君. 盐度对黄鳍绸幼鱼消化酶活性的影响及消化酶活性的昼夜变化[J]. 海洋水产研究, 2006, 27(1): 41-45.
LI Xi-Guo, Li Jia-er, OU You-jun. Effects of salinity on digestive enzyme activity and diurnal variation of digestive enzyme activity of young Yellowfin black porgySparuslatus[J]. Marine Fisheries Research, 2006, 27(1): 41-45.
[31]田田, 袁重桂, 阮成旭. 欧鳗黑仔苗在不同盐度条件下生长效果的比较[J]. 福建水产, 2006, 4: 63-66.
TIAN Tian, YUAN Chong-Gui, RUAN Cheng-xu. The study on variation of growth ofAnguillaanguillaelver at different salinities[J]. Journal of Fujian Fisheries, 2006, 4: 63-66.
[32]汤鸿.锯缘青蟹胚胎和幼体消化酶与碱性磷酸酶活力的实验研究[D].厦门: 厦门大学, 1995: 102-117.
TANG Hong. Experiment Studies on the Digestive enzyme and Alkaline phosphatase Activities in the Embryo and Larvae of Mud Crab,Scyllaserrata(Forskal)[D]. Xianmen: Xiamen University, 1995: 102-117.
[33]庄平, 章龙珍, 田宏杰, 等. 盐度对施氏鲟幼鱼消化酶活力的影响[J]. 中国水产科学, 2008, 15(2): 189-203.
ZHUANG Ping, ZHANG Long-zhen, TIAN Hong-jie. Effects of salinity on digestive enzyme activities of juvenileAcipenserschrenckii[J]. Journal of Fishery Sciences of China, 2008, 15(2): 189-203.
[34]Vijayan M M, Reddy P K, Leatherland J F, et al. The effects of cortisol on hepatocyte metabolism in rainbow trout: A study using the steroid analogue RU486[J]. Gen Comp Endocrinol, 1994, 96(1): 75-84.
[35]Vijayan M M, Mommsen T P, Glemet H C, et al. Metabolic effects of cortisol treatment in a marine teleost, the sea raven[J]. J Exp Biol, 1996, 199: 1509-1514.
[36]Kazumi Nakano, Masatomo Tagawa, Akihiro Takemura, et al. Temporal changes in liver carbohydrate metabolism associated with seawater transfer inOreochromismossambicus[J]. Comparative Biochemistry and Physiology Part B, 1998, 119(4): 721-728.
[37]Sergio Polakof, Francisco J Arjona, Susana Sangiao Alvarellos Maria P, et al. Food deprivation alters osmoregulatory and metabolic responses to salinity acclimation in gilthead sea breamSparusauratus[J]. Comp Physiol B, 2006(5), 176: 441-452.
[38]范国燕. 饥饿对鳊鱼(Parabramispekinensis)和南方鲇(Silurusmeridonalis)幼鱼糖代谢影响的研究[D]. 重庆: 重庆师范大学, 2011: 14-15.
FAN Guo-yan. Effects of Starvation on Metabolism of Glucose in JuvenileParabramispekinensisandSilurusmeridonalis[D]. Chongqin: Chongqing Normal University, 2011: 14-15.
[39]Sangiao-Alvarellos S, Laiz-Carrion R, Guzman J M, et al. Acclimation of S. aurata to various salinities alters energy metabolism of osmoregulatory and nonosmoregulatory organs[J]. Am J Physiol Regul Integr Comp Physiol, 2003, 285(4): 897-907.
[40]Sangiao-Alvarellos S, Arjona F J, Martindel rio M P, et al. Time course of osmoregulatory and metabolic changes during osmotic acclimation inSparusauratus[J]. J Exp Biol 2005, 208: 4291-4304.
[41]Raul Laiz-Carrion, Susana Sangiao-Alvarellos, Jose M Guzman. Energy metabolism in fish tissues related to osmoregulation and cortisol action[J]. Fish Physiology and Biochemistry, 2002, 27(3-4): 179-188.
[42]Gomez-Milan E, Cardenete G, Sanchez-Muros M J. Annual variations in the specific activity of fructose 1, 6-bisphosphatase, alanine aminotransferase and pyruvate kinase in theSparusaurataliver[J]. Comparative Biochemistry and Physiology, 2007, 147(1): 49-55.
[43]聂琴, 苗惠君, 苗淑彦, 等. 不同糖源及糖水平对大菱鲆糖代谢酶活性的影响[J]. 水生生物学报, 2013, 37(3): 425-432.
NIE Qin, MIAO Hui-Jun, MIAO Shu-Yan, et al. Effects of dietary carbohydrate sources and levels on the activities of carbohydrate metabolic enzymes in turbot[J]. Acta Hydrobiologica Sinica, 2013, 37(3): 425-432.
[44]McCormick S D. Hormonal control of gill Na+/K+-ATPase and chloride cell function[C]// Fish Physiology. London: Academic Press, 1995, 14: 285-315.
[45]袁春营, 崔青曼. 盐度影响水产养殖动物生长发育的研究进展[J]. 水产科学, 2004, 23(5): 41-42.
YUAN Chun-ying , CUI Qing-man. Influence of salinity on development and growth of aquatic animals in aquaculture[J]. Fisheries Science, 2004, 23(5): 41-42.
责任编辑朱宝象
The Growth Performance, Osmotic Physiology and Carbohydrate Metabolism Activity of JuvenileCynoglossussemilaevisAcclimated to Low Salinity Water
FANG Zi-Heng, TIAN Xiang-Li, DONG Shuang-Lin
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
To evaluate the capability of juvenile tongue sole adapted to different salinity conditions, the growth, osmotic physiology and carbohydrate metabolic enzyme activity of juvenile tongue sole acclimated to fresh water (S0), S5, S10, S20 and S30 for 60 days were determined. The results showed that the growth increased at S10~S20, and the lowest Na+/K+-ATPase activity in gills and kidney was found at S10 (P<0.05). Under the freshwater condition, the plasma osmolality of juvenile tongue sole was significantly lower compared with the normal level, while the Na+/K+-ATPase activity in the kidney was greatly improved, and the growth performance of juvenile tongue sole decreased significantly. Food conversion efficiency of tongue sole were found decreased at S0 and S30, which were significantly lower than that of other treatments (P<0.05). The minimum apparent digestive rate was obtained at S30, which was significantly lower than that at S5, S10 and S20 (P<0.05). The carbohydrate metabolic enzymes were also detected in different tissues of tongue sole. The minimum value of pyruvate kinase (PK) activity in gills was found at S10, while a maximum value was found at S0 and a higher level of the activity was found at S30. The activity of succinate dehydrogenase (SDH) and malate dehydrogenase (MDH) at S10, S5 and S0 were significantly decreased (P<0.05) in gills of tongue sole. All these showed that glycolysis and the citric acid cycle in gills reduced when acclimated to lower salinity, whereas glycolysis increased at S0. In kidney; hexokinase (HK), PK activity reached the highest level at S0, which was significant higher than the other treatments (P<0.05); higher activity of SDH and MDH were also found at S0, which demonstrated that glycolytic and tricarboxylic acid cycle all enhanced in kindey of tongue sole in fresh water condition. In brief, when acclimated to the freshwater, plasma osmotic of tongue sole could not be recorvered to normal levels, the fish were under stress, the metabolic was always maintained at a high level, carbohydrate metabolism strengthen in osmotic organs, the growth was inhibited, while at S10 metabolic rate and metabolic enzymes activity was at lower levels, more energy could contribute to the growth. A comprehensive and systematic research on the effect of low salinity acclimation on the tongue sole was carried out. The final results of the growth and metabolic enzyme activity demonstrated that the low salinity acclimation method was feasible in tongue sole culture.
tongue sole; salinity; growth; osmoregulation; carbohydrate metabolism
国家“十二五”科技支撑计划项目(2011BAD13B03);山东省农业重大应用技术新项目(鲁财农指[2013]136号)资助
2015-05-07;
2015-11-01
房子恒(1988-),男,博士生,专业方向为养殖生态学。E-mail:fangziheng1988@163.com
**通讯作者:E-mail:xianglitian@ouc.edu.cn
S917.4
A
1672-5174(2016)08-019-09
10.16441/j.cnki.hdxb.20150179
Supported by the National Great Project of Scientific and Technical Supporting Programs (2011BAD13B03) and the Major Project for Agricultural Application Technology Innovation of Shandong Province (2013-136).
