右美托咪定对肺缺血/再灌注损伤小鼠内质网应激相关分子Caspase-12表达的影响*
2016-09-01罗梓垠郭长满项冰倩邱晓晓王万铁
罗梓垠,郭长满,项冰倩,宋 冬,陈 丹,应 磊,邱晓晓,王万铁
(温州医科大学缺血-再灌注损伤研究所,浙江 温州 325035 )
右美托咪定对肺缺血/再灌注损伤小鼠内质网应激相关分子Caspase-12表达的影响*
罗梓垠+,郭长满+,项冰倩,宋冬,陈丹,应磊,邱晓晓△,王万铁△
(温州医科大学缺血-再灌注损伤研究所,浙江 温州 325035 )
目的:探讨右美托咪定(DEX)对肺缺血/再灌注(I/R)损伤小鼠内质网应激(ERS)相关分子天冬氨酸特异性半胱氨酸蛋白酶-12(Caspase-12)表达的影响。方法:选用C57BL/6J小鼠复制在体左肺原位I/R损伤模型。随机将40只小鼠分为4组(n=10):假手术组(sham组),I/R损伤组(I/R组),生理盐水对照组(NS组),右美托咪定干预缺血/再灌注组(DEX组)。DEX组在夹闭小鼠左肺门30 min前经腹腔注射DEX 25 μg/kg,NS组为用同DEX组等体积的生理盐水替代DEX,其余操作同DEX组。3 h肺再灌注结束后,留取左肺。测定肺组织湿/干重比(W/D)及总肺含水量(TLW),光镜观察肺组织形态学改变,对肺组织进行损伤评估(IQA)。原位末端标记(TUNEL)法检测组织细胞凋亡指数(AI),蛋白免疫印迹法(Western blot)和逆转录-聚合酶链反应(RT-PCR)分别检测Caspase-12、葡萄糖调节蛋白78(grp78)蛋白和mRNA表达水平。结果:与sham组比,I/R组和NS组肺W/D、TLW、IQA、AI均明显升高(P<0.01),肺组织形态结构破坏明显,Caspase-12、grp78蛋白和mRNA 表达量增加(P<0.01);I/R组与NS组相比,两组Caspase-12、grp78蛋白和mRNA 表达量无明显差异(P>0.05)。DEX组与I/R组比,W/D、TLW、IQA和AI均有下降(P<0.01或P<0.05),肺组织形态学改变明显减轻,Caspase-12和grp78蛋白和mRNA 表达量下降(P<0.01)。结论:DEX可有效缓解小鼠肺缺血/再灌注性损伤,其机制可能与其对抗ERS中Caspase-12引起的细胞凋亡有关。
Caspase-12;右美托咪定;缺血/再灌注;肺;内质网应激;小鼠
近年来,随着医学科学的迅猛发展,肺动脉袖状切除、肺移植、心肺联合移植、肺溶栓治疗等新的医疗方法不断地建立和发展,但肺缺血/再灌注损伤(ischemia/reperfusion,I/R)始终是溶栓及移植后影响预后的一个重要因素。研究表明,缺血缺氧、葡萄糖/营养物质匮乏、ATP耗竭、氧化应激及Ca2+稳态破坏等均可引起内质网应激(endoplasmic reticulum stress,ERS)。过度的ERS则会引起细胞凋亡,肺组织细胞凋亡在PIRI发生中起关键作用[1-3]。因此,寻求肺I/R的防治方法显得十分迫切和重要。其中天冬氨酸特异性半胱氨酸蛋白酶-12(cysteinylaspartate specific proteinase-12,Caspase-12)是ERS的主要凋亡信号分子之一,内质网内钙离子平衡的失调或者内质网蛋白积累过多都会导致Caspase12的表达[4]。ERS时,葡萄糖调节蛋白78(glucose regulating protein 78,grp78)与3种内质网跨膜蛋白PERK、IRE1和ATF6解离,致使这3种跨膜蛋白活化,起到重要的调控作用,是内质网应激标志蛋白[5]。右美托咪定(dexmedetomidine,DEX)为α2肾上腺素能受体激动剂[6],能够通过减轻肺部炎症反应和细胞因子的产生,对肺起到显著的保护作用[7],并且有研究表明它对心肌、肾脏等缺血/再灌注损伤均都具有一定的药理疗效[8~9]。本实验旨在研究右美托咪定能否通过抑制ERS中Caspase-12的表达以减轻小鼠肺I/R损伤,为临床预防和治疗肺I/R损伤提供新的治疗思路与方法。
1 材料与方法
1.1实验动物
SPF级C57BL/6J小鼠40只,8~10周龄,雄性,体重(20±2)g,由温州医科大学实验动物中心提供,动物使用许可证号:SYXK(浙)2012-075。
1.2药品及试剂
右美托咪定(江苏恒瑞医药股份有限公司),DNase I、Proteinase K(Sigma),TUNEL检测试剂盒(Roche),DAB 显色试剂盒( 北京中杉金桥生物科技有限公司);Trizol(Invitrogen),逆转录试剂盒、PCR 试剂盒(Fermentas Life Science);BCA蛋白浓度测定试剂盒(碧云天生物技术研究所),一抗:兔抗GAPDH多克隆IgG 抗体(杭州至贤生物科技有限公司),Caspase-12、grp78(Cell Signaling Technology),二抗:HRP偶联山羊抗兔IgG二抗(Abcam)。其余所需试剂均为市售分析纯。
1.3实验分组
将40只SPF级C57BL/6J小鼠随机分为4组(n=10):假手术组(sham组)、I/R损伤组(I/R组)、生理盐水对照组(NS组)、右美托咪定干预缺血/再灌注组(DEX+I/R组)。DEX组在夹闭小鼠左肺门30 min前经腹腔注射25 μg/kg DEX,NS组给予与同DEX组等体积的生理盐水,其余操作均同I/R组。实验结束后,处死小鼠,留取左肺组织。
1.4模型制作
依据参考文献建立小鼠原位左肺I/R模型[10],小鼠腹腔麻醉后,取仰卧位固定,备皮消毒,行倒T型气管切开术,插入20G注射针套管后,连接小动物呼吸机,调节呼吸参数。于小鼠左侧2、3 肋间体表处,备皮消毒,用组织剪逐层钝性分离至胸腔,暴露左肺门,用微型动脉夹夹闭肺门30 min,即为缺血期;继之松开动脉夹恢复血流灌注3 h,为再灌注期。3 h肺再灌注结束后,处死小鼠,留取左肺组织。术中维持小鼠体温在(37+0.5)℃。假手术组(sham组)仅开胸不夹闭左肺门,其余操作步骤均同I/R组,实验毕,处死小鼠,留取左肺组织。
1.5肺W/D及TLW值
实验结束,获取小鼠左肺上叶组织,生理盐水漂洗,用滤纸吸除表面血液和水分,称重,记为湿重(wet weight,W),置于80℃恒温烤箱48 h,称重,记为干重(dry weight,D)。W、D两者的比值表示肺干湿比(wet weight to dry weight of lung tissue,W/D),以W-D/D计算总肺水含量(total lung water content,TLW)。
1.6肺泡损伤定量指标(IQA)检测及光镜观察
取小鼠左肺下叶组织,大小0.5 cm×0.5 cm×0.5 cm,生理盐水漂洗,4%甲醛固定。常规石蜡包埋,组织切片,HE染色,在光学显微镜200倍视野下观察各组肺组织形态学变化,并计数。随机选取50个视野连续观察,肺泡内红细胞和(或)白细胞数大于2个或肺泡内有水肿渗出者的均视为损伤细胞,每视野内损伤肺泡数占总肺泡数的百分比即为肺泡损伤定量评估指标(index of quantitative evaluation for alveolar damage,IQA)。
1.7原位缺口末端标记法(TUNEL法)检测
按照试剂盒说明书操作,光镜下(×400)观察凋亡细胞并计数,胞核呈棕褐色者为凋亡细胞,胞核呈蓝紫色者为未凋亡细胞。每片至少观察500个细胞,计数每100个细胞内的凋亡细胞数,则为凋亡指数(apoptotic index,AI)。
1.8Caspase-12、GRP 78蛋白表达量测定
取100 mg小鼠肺组织用液氮在研钵里加以研磨,用1 000 μl RIPA(含10 μl PMSF)裂解组织,待研磨充分后,吸取匀浆液物理低温离心,取上清液,BCA法测定蛋白浓度,绘制标准曲线,样品蛋白均调配成2 μg/μl,继之将蛋白煮沸变性。配胶进行电泳,上样量30 μg,转膜至PVDF膜。再将用TBS浸湿的膜放至5%脱脂奶粉,室温下封闭1 h,TBST漂洗,加入一抗(Caspase-12/grp78/GAPDH,均以1∶1 000稀释),4℃孵育过夜,TBST洗涤每次5 min×3次,再加入二抗(HRP标记):Caspase-12(1∶3 500),grp78(1∶4 500),GAPDH(1∶4 000),室温孵育1~2 h。TBST洗涤每次5 min×3次,滴加ECL工作液,反应5 min,暗室内曝光,显影、定影。GAPDH为内参,扫描后,用凝胶分析软件分析内参蛋白与目的蛋白吸光度值。
1.9Caspase-12、GRP 78 mRNA表达量
取小鼠肺组织100 mg,加液氮在研钵里加以研磨,以Trizol法提取总RNA,测定RNA浓度,按照RT-PCR试剂盒说明书进行cDNA合成及扩增,PCR反应参数:预变性:94℃,1 min;变性:94℃,30 s;退火:Caspase-12(57℃),GAPDH(55℃),grp78(49℃),30 s;延伸:72℃,30 s;终止延伸:72℃,10 min;循环31次。引物序列如表1。

Tab.1 Gene sequence primers
1.10统计学分析
2 结果
2.1各组肺组织损伤情况比较
Sham组,I/R组,NS组,DEX组的W/D分别是3.08±0.75、5.51±1.56、5.37±0.58、4.08±0.49。各组TLW值分别是2.08±0.75、4.51±1.56、4.37±0.58、3.08±0.49。各组的IQA分别是6.23%±1.76%、42.77%±4.34%、42.80%±3.39%、20.20%±3.33%。与sham组相比较,I/R组和NS组的明显上升(P<0.01),与NS组相比,I/R组和NS组无统计学差异(P>0.05);DEX组与I/R组比,W/D、TLW、IQA值下降明显(P<0.01,图1)。


W/D:The lung tissue wet/dry weight;TLW:The total lung water content;IQA:The damage assessment for the lung tissue
*P<0.05,**P<0.01 vs sham group;#P<0.05,##P<0.01 vs I//R group
2.2光镜下各组肺组织形态学观察
Sham组肺泡结构完整,间质完好,未见炎症细胞浸润(图2A,图2见彩图页Ⅲ);I/R组和NS组肺泡结构紊乱,肺间质明显增厚,大量炎症细胞浸润,肺泡腔内见明显渗出和水肿(图2B、C);DEX组肺泡损伤小,结构相对完整,间质无增厚,炎症浸润及水肿渗出程度减轻(图2D)。箭头所指为损伤部位。
2.3各组肺组织细胞凋亡情况比较
sham 组凋亡细胞数量最少(图3A,图3见彩图页Ⅲ);I/R组、NS组细胞凋亡程度最为严重,以血管内皮细胞凋亡较为明显,肺泡上皮细胞内亦有大量凋亡细胞出现(图3B、C);DEX组凋亡程度相对较低,并且相比于I/R和NS组有改善明显。图中棕褐色颗粒皆为凋亡阳性细胞(图3D)。
2.4各组肺组织Caspase-12和grp78蛋白的表达水平
与sham组比,其余各组Caspase-12、grp78 蛋白水平均升高(P<0.01);I/R组与NS组的蛋白表达水平相比较无明显差异(P>0.05);,DEX组Caspase-12蛋白水平与I/R组相比,呈显著下降趋势(P<0.01,图4)。

Fig.4Levels of Caspase-12 and grp78 protein in each group
A:Sham group;B:I/R group;C:NS group;D:DEX group
*P<0.05,**P<0.01 vs sham group;#P<0.05,##P<0.01 vs I/R group
2.5各组肺组织Caspase-12和grp78 mRNA的表达水平
其余各组与sham组比,Caspase-12和grp78 mRNA水平均上升明显(P<0.01);I/R组与NS组的mRNA表达水平相比较无明显差异(P>0.05)。与IR组相比,DEX组Caspase-12 mRNA表达量明显减少(P<0.01,图5)。
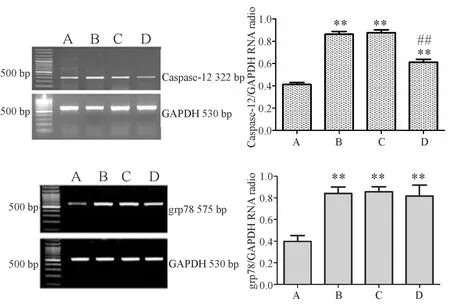
Fig.5Levels of Caspase-12 and grp78 mRNA in each group
A:Sham group;B:I/R group;C:NS group;D:DEX group
*P<0.05,**P<0.01 vs sham group;#P<0.05,##P<0.01 vs I/R group
3 讨论
近来,随着人们对细胞凋亡认识的深入,对其机制的研究也越加透彻,其中内质网途径是研究细胞凋亡的热点之一。研究表明:在肺组织I/R发生发展过程中,可诱发过度的ERS,介导细胞凋亡的发生[11,12]。Caspase-12的表达激活是内质网应激引起的细胞凋亡的途径之一,它广泛存在于小鼠的各组织中,在肺、肾脏、肝脏中均为高表达[13]。Caspase-12位于内质网膜,过度的ERS可引起其他Caspase家族的级联反应,Caspase-9、Caspase-3的活化,最终导致Caspase-12活化介导细胞凋亡的发生[14]。内质网内过多的蛋白沉积,以及钙离子平衡的破坏均能引起ERS,而非ERS介导的细胞凋亡,则无Caspase-12的活化,表明Caspase-12与ERS介导细胞凋亡的机制有关,而与非ERS介导的细胞凋亡无关[15]。本研究中,对小鼠左肺进行I/R处理后,肺组织中的Caspase-12蛋白和mRNA表达明显上升。表明I/R过程中发生了过度的ERS,使Caspase-12表达上升。且Caspase-12介导了细胞凋亡途径,引起小鼠肺组织损伤。
Grp78(78-kD glucose-regulated protein),属于热休克蛋白Hsp70亚家族。Grp78是一种主要位于内质网内的钙离子结合分子伴侣,它是一种高度保守的蛋白,对维持细胞正常活性起着非常重要的作用[16]。当各种诱导条件导致内质网中的蛋白折叠受到干扰并不能完全正常进行时,grp78的表达量就会急速增加。因此,grp78的急速上调被认为是ERS最敏感的标志[17]。本研究中,sham组grp78蛋白和mRNA表达量处于较低水平,I/R组的表达水平则明显高于sham组,提示肺I/R诱发ERS,grp78在发挥其保护作用。但如果内质网发生持久和(或)过强的应激,会超出grp78的防御能力,导致机体丧失自我修复能力,最终诱发细胞凋亡的产生。
DEX是一种在临床上广泛使用的镇痛麻醉药物,具有镇静、抗炎和交感神经阻滞作用[6]。DEX能促进IL-10的生成,参与单肺通气期间 ALI 时局限、抑制炎性细胞因子的表达,且能够使肺泡间隔厚度降低,抑制肺水肿和增强巨噬细胞活力,起到肺保护作用[8]。有学者研究发现,DEX预处理可以维持血流动力学稳定,保证重要器官的血流灌注,能减少氧化应激和炎症反应,减轻大鼠肝脏缺血/再灌注损伤,改善器官损伤情况[18]。本研究中,经DEX干预后,肺组织损伤情况有明显改善,凋亡细胞减少。Caspase-12蛋白和mRNA水平相较于I/R组有明显下降,表明DEX通过使Caspase-12表达下调,以减轻肺I/R损伤。DEX组grp78相较于sham组仍处于高水平表达,表明药物作用后,grp78仍旧发挥着积极的保护作用。
综上所述,右美托咪定对肺I/R损伤能起到较好的保护作用,其机制可能与其抑制ERS中Caspase-12的表达,减轻细胞凋亡有关。
[1]周俊辉,赵珊,陈海娥,等.姜黄素对肺缺血/再灌注损伤小鼠Caspase-12及细胞凋亡的影响[J].中国中西医结合杂志,2014,34(9):1118-1124.
[2]郝卯林,赵珊,陈海娥,等.siRNA沉默过度内质网应激下JNK基因在缺血/再灌注肺损伤中的作用[J].中国应用生理学杂志,2014,30(1):48-53.
[3]Yousefi H,Ahmadiasl N,Alihemmati A.et al.Effect of renal ischemia-reperfusion on lung injury and inflammatory responses in male rat[J].Iran J Basic Med Sci,2014,17(10):802-807.
[4]杨绍杰,孟金萍,屈礻韦,等.细胞凋亡信号传导通路的研究进展[J].中国比较医学杂志,2007,17(5):298-301.
[5]Wolfson JJ,May KL,Thorpe CM,et al.Subtilase cytotoxin activates PERK,IRE1,and ATF6 endoplasmic reticulum stress-signalling pathways[J].Cell Microbiol,2008,10(9):1775-1786.
[6]曹延萍,郝咏梅,刘青娟,等.内质网应激及其特有凋亡途径Caspase-12与糖尿病大鼠肾组织固有细胞凋亡之间的关系[J].中国应用生理学杂志,2011,27(2):236-240.
[7]Ihmsen H,Saari TI.Dexmedetomidine.Pharmacokinetics and pharmacodynamics[J].Anaesthesist,2012,61(12):1059-1066.
[8]吴先荣.右美托咪定肺保护作用的研究进展[J].中国实用医药,2014,9(6):246-248.
[9]Ibacache M,Sanchez G,Pedrozo Z,et al.Dexmedetomidine preconditioning activates pro-survival kinases and attenuates regional ischemia/reperfusion injury in rat heart[J].Biochim Biophys Acta,2012,1822(4):537-545.
[10]Si YN,Bao HG,Xu L,et al.Dexmedetomidine protects against ischemia/reperfusion injury in rat kidney[J].Eur Rev Med PharmacolSci,2014,18(13):1843-1851.
[11]Gielis JF,Jungraithmayr W,Boulet GA.et al.A murine model of lung ischemia and reperfusion injury:tricks of the trade [J].J Surg Res,2015,194(2):659-666.
[12]Khan S,Salloum F,Das A.et al.Rapamycin confers preconditioning-like protection against ischemia-reperfusion injury in isolated mouse heart and cardiomyocytes[J].J Mol Cell Cardiol,2006,41(2):256-264.
[13]Poone GK,Hasseldam H,Munkholm N,et al.The hypothermic influence on CHOP and Ero1-α in an endoplasmic reticulum stress model of cerebral ischemia[J].Brain Sci,2015,5(2):178-187.
[14]Lakshmanan AP,Thandavarayan RA,Palaniyandi SS,et al.Modulation of AT-1R/CHOP-JNK-Caspase12 pathway by olmesartan treatment attenuates ER stress-induced renal apoptosis in streptozotocin-induced diabetic mice[J].Eur J Pharm Sci,2011,44(5):627-634.
[15]Nakagawa T,Zhu H ,Morishima N,et al.Caspase-12 mediates ER-specific apoptosis and cytotoxicity by amyloid-β[J].Nature,2000,403(6765):98-103.
[16]Wu H,Tang Q,Yang J,et al.Atorvastatin ameliorates myocardial ischemia/reperfusion injury through attenuation of endoplasmic reticulum stress-induced apoptosis[J].Int J ClinExp Med,2014,7(12):4915-4923.
[17]Ye Z,Wang N,Xia P,et al.Parecoxib suppresses CHOP and Foxo1 nuclear translocation,but increases GRP78 levels in a rat model of focal ischemia[J].Neurochem Res,2013,38(4):686-693.
[18]Kucuk A,Yaylak F,Cavunt-Bayraktar A,et al.The protective effects of dexmedetomidine on hepatic ischemia reperfusion injury[J].Bratisl Lek Listy,2014,115(11):680-684.
Effect of dexmedetomidine on expression of endoplasmic reticulum stress- related Caspase-12 in lung ischemia/reperfusion injury mice
LUO Zi-yin+,GUO Chang-man+,XIANG Bing-qian,SONG Dong,CHEN Dan,YING Lei,QIU Xiao-xiao△,WANG Wan-tie△
(Ischemia/Reperfusion Injury Research Institute of Wenzhou Medical University,Wenzhou 325035,China)
Objective:To investigate the effect of dexmedetomidine(DEX)on expression of endoplasmic reticulum stress(ERS)-related cysteinyl aspirate specific proteinase-12(Caspase-12)in lung ischemia/reperfusion(I/R)injury mice.Methods:Forty C57BL/6J mice were randomly divided into 4 groups:sham operation group(sham group),ischemia/reperfusion injury group(I/R group),normal salinecontrol group(NS group),ischemia/reperfusion + dexmedetomidine group(DEX group).Dexmedetomidine was infused intraperitoneally into the mice to stablish situ left pulmonary I/R injury mouse model.In NS group,the isometric dexmedetomidine was replaced by normal saline,other operations were as the same as the DEX group.After reperfusion 3 hours,the lung tissue wet/dry weight(W/D),the total lung water content(TLW)of the left lung tissues were determined.The lung tissue morphology changes were observed by light microscopy and the damage assessment(IQA)was taken.The structure changes and the apoptosis index(AI)of the lung tissues were evaluated by TUNEL method.The protein and mRNA expression of Caspase-12 and grp78 in lung tissues were detected by Western blot and reverse translate-PCR.Results:Compared with the sham group,the W/D,TLW,IQA,AI,lung tissue structure damages,and the expression of Caspase-12 and grp78 protein and mRNA obviously raised both in I/R group and NS group(P<0.01 or P<0.05).Compared with I/R group,the W/D,TLW,IQA,AI of DEX group were all decreased,the demaged lung tissue morphology changes were significantly reduced,the protein and mRNA expression level of Caspase-12 and grp78 in DEX group were decreased(P<0.01).Conclusion:DEX can effectively relieve the lung I/R injuries in mice,which maybe associated with inhibition of pneumocyte apoptosis induced by ERS-related Caspase-12 pathway.
Caspase-12;dexmedetomidine;ischemia/reperfusion;lung;endoplasmic reticulum stress;mice
浙江省公益技术应用研究项目(2013C33168);浙江省新苗人才计划项目(2014R413043);温州市公益性科技计划项目(Y20140652)
2015-06-23
2016-01-25
△Tel:0577-86689817;E-mail:wwt@wmu.edu.cn.
+:为共同第一作者
R363
A
1000-6834(2016)02-164-05
10.13459/j.cnki.cjap.2016.02.018
