荧光导航肝切除术中应用吲哚菁绿的可行性
2016-08-31王金伟张雅敏刘子荣沈中阳
王金伟,张雅敏,刘子荣,沈中阳
(1天津市西青医院,天津300380;2天津市第一中心医院)
荧光导航肝切除术中应用吲哚菁绿的可行性
王金伟1,张雅敏2,刘子荣2,沈中阳2
(1天津市西青医院,天津300380;2天津市第一中心医院)
目的观察并分析荧光显像导航肝切除术中应用吲哚菁绿(ICG)的可行性,并与术前用药进行比较。方法拟行部分肝切除术的肝脏肿瘤患者56例,分为术前给药组24例和术中给药组32例。术前给药组手术前5~14 d在肘正中静脉行留置针穿刺或术前行肝功能储备检查时静注ICG 0.25 mg/kg,5~14 d后行肝切除手术;术中给药组于手术开始时自中心静脉导管推注ICG 0.25 mg/kg,5~10 min后观察。比较两组肝脏肿瘤PDE下表现特点及对术前未发现的微小肿瘤病灶的检出情况。结果术前给药组肿瘤区呈现明亮荧光显影,正常肝组织为不显影区域;术前显示肝脏占位病灶24个,术中检出33个;除术前已发现的肿瘤外,另见高亮荧光结节5例,共9个病灶,最小病灶直径约2 mm;术后病理证实肝细胞癌15例,海绵状血管瘤4例,胆管细胞癌2例,恶性纤维组织细胞瘤1例,混合结节性肝硬化2例。术中给药组肿瘤表现为暗影,与周围荧光显影的正常肝组织边界区别明显,良、恶性肿瘤无明显差别;术前显示肝脏占位病灶32个,术中检出44个;除术前已发现的肿瘤外,另见微小肿瘤7例,共12个病灶,最小病灶直径约4 mm;术后病理证实肝细胞癌24例,结直肠癌肝转移4例,海绵状血管瘤2例,胆管细胞癌2例。结论术前或术中注射ICG在荧光显像导航肝切除术中均有较好的应用价值;在确定肿瘤边界方面,术中注射ICG更有优势;在确定肿瘤性质方面,术前注射ICG更具有优势;两种方法均可发现微小肿瘤,其中术前给药可检出直径2 mm的微小病灶。
肝肿瘤;肝切除术;吲哚菁绿;荧光显像导航技术
吲哚菁绿(ICG)是一种近红外荧光染料,可被波长750~810 nm的外来光激发,发射波长850 nm左右的近红外光,这种红外光可被吲哚菁绿荧光显像系统(PDE)所接收,并在显像设备中显示[1~4]。Ishizawa研究小组2009年首次公开报道了应用ICG进行肝癌切除术中导航[5]。在临床试验中,肝切除术前5~14 d通过外周静脉给予ICG 0.25 mg/kg,应用荧光显像仪观察肝脏肿瘤可呈现清晰的、边界清楚的荧光影像,有助于肿瘤性质的鉴定[6,7],但术前给药会相对延长患者的住院时间及术前准备时间。本研究首次尝试在术中给予ICG,观察并分析可行性,与术前用药进行比较。
1 资料与方法
1.1临床资料选取2014年9月~2015年6月拟行部分肝切除的肝脏肿瘤患者56例,男45例、女11例,年龄40~75岁。患者术前通过腹部超声、腹部平扫+四期强化CT或MRI检查明确肝脏占位,并排除远处转移;术前肝功能Child A级;术前均未行介入栓塞治疗、新辅助放疗、化疗等治疗;患者术前ICG皮试阴性。将56例分为术前给药组24例和术中给药组32例。术前给药组男19例、女5例,术中给药组男26例、女6例;术前给药组年龄40~50岁6例、>50~60岁11例、>60~75岁7例,术中给药组分别为9、12、11例;术前给药组肿瘤累及1个肝段3例、累及2个肝段11例、累及2个肝段以上10例,术中给药组分别为5、9、18例;术前给药组术后病理诊断为肝细胞癌15例、海绵状血管瘤4例、胆管细胞癌2例、恶性纤维组织细胞癌1例、结直肠癌肝转移0例、结节性肝硬化2例,术中给药组分别为24、2、2、0、4、0例。两组性别、年龄、肿瘤位置、术后病理诊断情况差异无统计学意义。
1.2吲哚菁绿注射方法及手术方法术前给药组手术前5~14 d在肘正中静脉行留置针穿刺或术前行肝功能储备检查时静注ICG 0.25 mg/kg,5~14 d后行肝切除手术。术中给药组于手术开始时自中心静脉导管推注ICG 0.25 mg/kg,5~10 min后观察。术中暴露肝脏后,应用PDE的近红外探头检查肝脏,探头距离肝脏15 cm左右。于显像设备中观察肝脏及肿瘤情况。术后将肿瘤标本送病理检查,将术中所见肝肿瘤情况与术后病理结果进行对照。
2 结果
术前给药组肿瘤区呈现明亮荧光显影,正常肝组织为不显影区域。术前显示肝脏占位病灶24个,术中检出33个。除术前已发现的肿瘤外,另见高亮荧光结节5例,共9个病灶,最小病灶直径约2 mm,术后病理结果示肝硬化再生结节6例、肝细胞癌3例。术前给药组术后病理证实肝细胞癌15例,其中14例肝脏肿瘤呈明亮荧光显影、与正常组织边界清楚,1例肿瘤未显影;海绵状血管瘤4例,呈不均匀的荧光显影;胆管细胞癌2例,恶性纤维组织细胞瘤1例,肿瘤区无明显荧光表现,周围可见环形荧光;混合结节性肝硬化2例,术前影像学诊断提示肝癌,术中呈明显高亮的荧光结节。见图1。
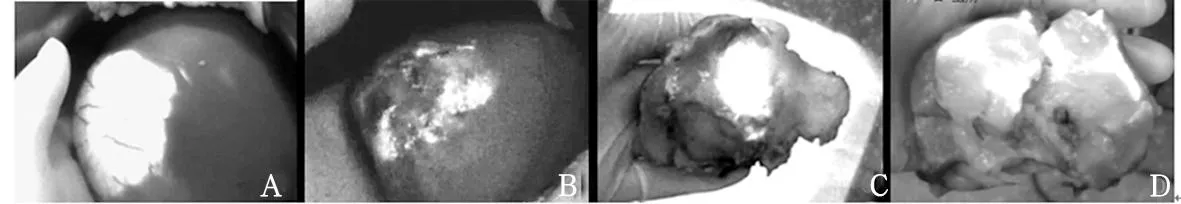
注:A为具有肝细胞功能的肝脏肿瘤PDE下表现;B为肝血管瘤PDE下表现;C为胆管细胞癌PDE下表现;D为胆管细胞癌切开后PDE下表现。
图1术前给药组肝脏肿瘤术中PDE下表现
术中给药组肝脏正常组织可在1~2 min内迅速出现均匀荧光显影,而肝硬化组织显影速度较慢,为不均匀的荧光影像,肿瘤组织为不显影区域,与术前给药组表现相反。术前显示肝脏占位病灶32个,术中检出44个。除术前已发现的肿瘤外,另见微小肿瘤7例,共12个病灶,最小病灶直径约4 mm,术后病理结果示肝细胞癌5例、肝硬化再生结节4例、肝大泡性脂肪变性1例、血管瘤1例、肝局灶样增生1例。术中给药组术后病理证实肝细胞癌24例,结直肠癌肝转移4例,海绵状血管瘤2例,胆管细胞癌2例;除1例肝细胞癌位于肝实质内2 cm、1例因肿瘤位置靠近背侧无明显异常表现,其余肿瘤均表现为暗影,与周围荧光显影的正常肝组织边界区别明显,良、恶性肿瘤无明显差别。见图2。

注:A为正常肝脏在PDE下表现;B为肝硬化组织PDE下表现;C为肝脏转移肿瘤PDE下表现;D为肝细胞癌PDE下表现。
图2术中给药组肝脏肿瘤术中PDE下表现
3 讨论
ICG荧光显像导航技术可对正常肝脏组织、恶性肿瘤组织、良性肿瘤组织有不同表现,可对肿瘤组织边界进行标记[8,9]。正常肝脏组织能迅速摄取ICG,如患者肝硬化严重或局部肝组织由于肿瘤压迫引起血运差,会延缓ICG的摄取和代谢速度。肿瘤组织若具备一定肝功能则可缓慢摄取ICG,并可因代谢能力差而造成ICG在组织内长时间蓄积,肝脏肿瘤组织和正常肝组织间有明显的明暗界限,从而对肿瘤的边界进行辨认。
术前注射ICG时,具有部分肝组织功能的中、高分化肝细胞癌和肝硬化结节等肿瘤可表现为高亮的荧光结节,与周围组织有明显区别;不具备肝组织功能的低分化肝细胞癌、胆管细胞癌等本身不摄取ICG,故不会显示荧光,肿瘤周围组织代谢ICG速度变慢,在ICG代谢完毕前可能出现肿瘤周围的环形荧光;肝血管瘤等肿瘤本身即为肿瘤组织和肝组织的混合体,在术前注射ICG情况下,会表现为不均匀的荧光。换而言之,术前注射ICG可对具有摄取ICG功能的肿瘤进行识别,对不能摄取ICG的肿瘤组织识别能力差。而术中注射ICG时,因肿瘤组织均不具备正常的肝脏功能,摄取ICG速度慢,不论肿瘤病理分型如何,均表现为边界清晰的暗影结节。故在确定肿瘤边界方面,术中注射ICG更具优势。
在肿瘤性质鉴别方面,文献中指出,在术前注射ICG的前提下,高分化肝癌组织显示荧光可能是由于MRP2载体功能异常,肿瘤组织能摄入ICG却无法正常排泄,因而较长时间显示荧光[10~13];中分化肝癌组织中部分细胞丧失摄取功能,同时另一部分肿瘤细胞有摄取功能但排泄功能异常,因而显示为不均匀荧光;低分化肝癌、胆管细胞癌和外源性转移癌由于ICG摄取载体功能异常或不具有该载体,自身不显示荧光,仅表现为癌灶周围的一圈荧光环[14,15]。但上述这些特点只适用于肿瘤横断面标本,并非术中肿瘤切除前可获得的结果。如需进行肿瘤性质鉴别,在肿瘤切除后,须对肿瘤进行切开,根据PDE下表现进行鉴别。而术中注射ICG情况下,不论肿瘤病理分型如何,均表现为同样的暗影结节,不能进行肿瘤性质的鉴别。
肝脏肿瘤的术前检查方式如强化CT、MRI、术前超声检查等,对于直径<10 mm的微小病灶检出率极低,往往造成术中对微小病灶的遗漏,术后短期内即可出现肝内转移。本研究发现,ICG荧光显像导航技术可发现术前影像学检查中未识别的微小病灶,且精度高,被发现的最小病灶直径约2 mm。术前或术中给予ICG两种方式在识别微小病灶的精确度上无明显差别。术前注射ICG情况下,肝硬化结节同样表现为高亮荧光结节,与恶性肿瘤无法区别,结果假阳性率较高;术中注射ICG避免了肝硬化结节的干扰,但增加了电刀烧灼、血管瘤、脂肪变性等干扰项,假阳性率仍偏高。
综上所述,我们认为,术中注射ICG与术前注射ICG相比,保留了后者实时、准确、立体的优点,还可对低分化肝细胞癌、胆管细胞癌等本身无法摄取ICG的肿瘤进行标记,扩大了PDE的应用范围,减少了肝硬化结节的干扰,缩短了住院时间和术前准备时间,但术中给药无法进行肿瘤性质确定,对于肝实质内的肿瘤无法进行识别。故术前、术中注射ICG两种方式各有优缺点,临床工作中可以根据需要选择更恰当的给药方式,以达到更好的效果。
[1] Miyashiro L,Miyoshi N,Hiratsuka M,et al.De-tection of sentinel node in gastric cancer surgery by indocyanine green fluores-cence imaging: comparison with infrared imaging[J].Ann Surg Oncol,2008,15(6):1640-1643.
[2] Kitai T,Inomoto T,Miwa M,et al.Fluorescence navigation with indoc-yanine green for detecting sentinel lymph nodes in breast cancer[J].Breast Cancer,2005,12(3):211-215.
[3] Tsujino Y,Mizumoto K,Matsuzaka Y,et al.Fluorescence navigation with indocyanine green for detecting sentinel nodes in extramammary Paget'S disease and squamous cell carcinoma[J].J Dermatoi,2009,36(2):90-94.
[4] 杨斌,鲁建国,杜锡林,等.吲哚氰绿测定和肝纤维化定量评估肝储备功能的研究[J].中华普通外科杂志,2009,18(17):727-730.
[5] Ishizawa T,Fuknshima N,Shibahara J,et al.Real-time identification of liver cancers by using indoeyanine green fluorescent imaging[J].Cancer,2009,115(11):2491-2504.
[6] Gotoh K,Yamada T,Ishikawa O,et al.A novel image-guided surgery of hepatocellular carcinoma by indocyanine green fluorescence imaging navigation[J].J Surg Oncol,2009,100(1):75-79.
[7] Takayuki T,Mitsuhisa T,Masaaki H,et al.Is a fluorescence navigation system with indocyanine green effective enough to detect liver malignancies?[J].J Hepatobiliary Pancreat Sci,2014,21(3):199-204.
[8] vander Vorst JR,Schaafsma BE,Hutteman M,et al.Near infrared fluorescence guided resection of colorectal Liver metastases[J].Cancer,2013,119(18):3411-3418.
[9] Ishizawa T,Zuker NB,Kokudo N,et al.Positive and negativestaining of hepatic segments by use of fluorescent imagingtechniques during laparoseopichepateetomy[J].Arch Surg,2012,147(4):393-394.
[10] Ishizawa T,Kokudo N.Identification of Hepatocellular Carcinoma[J].Front Gastrointest Res,2013,31(1):10-17.
[11] 邱月,熊杰,彭英,等.吲哚氰绿清除试验对丙肝肝硬化脾切除术后门静脉血栓形成风险的预测价值[J].中华普通外科杂志,2014,23(1):87-90.
[12] Lim C,Vibert E.Identification of Metastatic Liver Cancer[J].Front Gastrointest Res,2013,31(2):18-24.
[13] Rong Y,Chen H,Zhou XF,et al.Identification of an aptamer through whole cell-SELEX for targeting high metastatic liver cancers[J].Oncotarget,2016,16 (7):82-94.
[14] Feng HL,Qian L,Lin W,et al.Indocyanine green clearance test combined with MELD score in predicting the short-term prognosis of patients with acute liver failure[J].Hepatobiliary Pancreat Dis Int,2014,13(3):271-275.
[15] Kawaguchi Y,Akamatsu N,Ishizawa T,et al.Evaluation of hepatic perfusion in the liver graft using fluorescence imaging with indocyanine green[J].Int J Surg Case Rep,2015,14(1):149-151.
国家自然科学基金面上项目(81370576);天津市应用基础与前沿技术研究计划项目(14JCYBJC24800)。
张雅敏(E-mail: 18522629236@163.com)
10.3969/j.issn.1002-266X.2016.19.032
R735.7
B
1002-266X(2016)19-0086-03
2015-11-22)
