半乳甘露聚糖对大鼠降血糖的作用研究
2016-08-30武晗燕毛正银李雪梅北京市药品检验所北京006北京市海淀食品药品监督管理局稽查大队北京0093
武晗燕,毛正银,李雪梅(、北京市药品检验所 北京 006,、北京市海淀食品药品监督管理局稽查大队 北京 0093)
半乳甘露聚糖对大鼠降血糖的作用研究
武晗燕1,毛正银2,李雪梅1
(1、北京市药品检验所北京102206,2、北京市海淀食品药品监督管理局稽查大队北京100193)
摘要:目的 对半乳甘露聚糖给予大鼠辅助降血糖功能进行评价,为该多糖用于人体辅助降血糖的功能提供动物试验资料。方法 选择80 只雄性SD 大鼠,先按体重随机取20 只作为正常对照组给予维持饲料,剩余60只动物进行造模。在本试验条件下,分别以1.4g/kg BW、0.7g/kgBW、0.35g/kg BW(分别相当于人体推荐用量的20、10、5倍)剂量的半乳甘露聚糖辅助降糖咀嚼片给大鼠连续灌胃34天,受试样品空腹血糖、糖耐量及血脂指标均呈阳性,由此判定该受试样品辅助降血糖功能动物实验结果阳性。结论 半乳甘露糖对大鼠具有辅助降血糖作用。
关键词:SD 大鼠;半乳甘露聚糖;降血糖
糖尿病是糖、脂肪和蛋白质代谢紊乱引起的慢性病。目前全球患者已逾亿人, 其中我国患者约3000万, 仅次于美国, 位居世界第二。目前,已知降血糖药物中有萜类、肽、黄酮、糖类、胍类、硫醚、生物碱、香豆精和不饱和脂肪酸等化合物类型。多糖又称多聚糖,广泛存在于许多动植物体内,是一种具有多种生物活性的大分子,广泛参与分子识别、细胞生成、分化、代谢、胚胎发育、细胞癌变等各种生命活动[1,2]。某些特定结构的多糖有显著的降血糖作用。多糖的电荷性质、立体结构等性质发生改变可使多糖生物活性也发生变化。如Dextran, Heparin对多糖进行硫酸化得到的硫酸化衍生物具有降血糖活性。天然壳多糖(chitin)经过脱乙酰化得ch itosan, 其中低分子量(25 000 -50 000 u)的chitosan具有降血糖活性[3]。以上是多糖引入或脱去基团来改变多糖电荷性质以实现多糖生物活性的转变。多糖进行部分降解得到新的多糖,有的也具有活性, 如银耳多糖TAP是具有1, 3-α-D-甘露糖主链结构的多糖, 其部分水解产TAP-H也具有降血糖活性[4, 5]。
半乳甘露聚糖,是一种包含了甘露糖骨干与半乳糖旁基的多糖,具有多种生理功能。随着对其研究的深入,有关半乳甘露聚糖的生理功能研究成为热点。为了了解半乳甘露聚糖的降血糖效果,根据国食药监保化[2012]107号“关于印发抗氧化功能评价方法等9个保健功能评价方法的通知”中辅助降血糖功能检验方法,本实验使用大鼠高血糖模型动物,通过灌胃半乳甘露聚糖溶液,研究了半乳甘露聚糖对大鼠血糖的影响及其辅助降血糖效果。对半乳甘露聚糖的降血糖机理做了初步研究,为深入研究半乳甘露聚糖的生理功效和综合开发利用半乳甘露聚糖提供一定参考。
1 材料和方法
1.1实验动物
80只健康成年SPF级SD雄性大鼠,体重176.7g~200.6g,由北京维通利华实验动物技术有限公司提供,实验动物质量合格证:11400700070850。生产许可证号:SCXK(京)2012-0001,。屏障环境下饲养,使用许可证号:SYXK(京) 2010-0023,动物室温度:22℃~23℃,相对湿度:46%~63%。
1.2供试品
半乳甘露聚糖,由Boston Therapeutics,Inc提供。
1. 3试剂及仪器
仪器:OLYMPUS AU400全自动生化分析仪, S pectraMax190型酶标仪
试剂:多项生化类质控品(正常值),批号:141991,生产单位:中生北控生物科技股份有限公司
葡萄糖(Glu)测定试剂盒,批号:140651,生产单位:中生北控生物科技股份有限公司
甘油三酯(TG)测定试剂盒,批号:140751,生产单位:中生北控生物科技股份有限公司
总胆固醇(CHO)测定试剂盒,批号:131121,生产单位:中生北控生物科技股份有限公司
四氧嘧啶,批号:LG80M07,生产单位:J&K CHEMICAL
葡萄糖,批号:040016,生产单位:北京化学试剂公司
大鼠胰岛素(INS)酶联免疫检测试剂盒,批号:20140509 生产单位:南京建成试剂公司
1.4降血糖实验
1.4.1正常动物降血糖实验
取SD雄性大鼠20只,禁食3小时后自眼眶取血测定血糖值,按血糖水平进行分组,随机分为空白对照组和受试样品高剂量组。空白对照组给予纯化水,受试样品高剂量组给半乳甘露聚糖水溶液(0.4mg/ml)。大鼠每天按1.0ml/100体重进行灌胃,连续灌胃33天,第34天禁食3-4小时后取血测空腹血糖值,比较两组动物血糖值。
1.4.2高血糖模型降糖实验
四氧嘧啶诱导胰岛素抵抗糖脂代谢紊乱模型
购入健康雄性大鼠,体重176.7g~200.6g,普通维持料适应饲养5天,禁食3~4小时,自眼眶取血,测定给葡萄糖前(即0小时)血糖值,按2.5g/kgBW剂量给予葡萄糖后,测定给糖后0.5、2小时血糖值,作为该批次动物基础值。以0、0.5小时血糖水平分9个组,即空白对照组、模型对照组和半乳甘露聚糖高、中、低剂量组,每组12只。空白对照组不做处理,半乳甘露聚糖3个剂量组灌胃给予不同浓度半乳甘露聚糖辅助降糖咀嚼片受试样品,模型对照组给予同体积纯化水,连续34天。各组给予维持料饲养,1周后模型对照组和3个剂量组更换高热能饲料;喂饲高热能饲料3周后,空白对照组、模型对照组和半乳甘露聚糖高、中、低剂量组禁食24小时(不禁水),给予四氧嘧啶105mg/kgBW腹腔注射,注射剂量1ml/100g体重。注射后继续给予高热能饲料喂饲4天。试验结束,各组动物禁食3小时,自眼眶取血检测空腹血糖、糖耐量、血清胰岛素及胆固醇、甘油三脂水平。观察模型对照组与空白对照组、受试样品组胆固醇、甘油三脂的变化及0小时、0.5小时、2小时血糖、曲线下面积变化、胰岛素抵抗指数及给药0.5h、2h血糖下降率。
1. 5统计学方法
采用SPSS 11. 5 统计软件进行方差分析。结果
以x- ± s 表示,P < 0. 05 为差异具有显著性,P < 0. 01为差异具有非常显著性。
1.6观察指标
1.6.1空腹血糖、糖耐量
各组动物禁食3-4小时,测定空腹血糖即给葡萄糖前(0小时)血糖值,剂量组给予不同浓度受试样品,模型对照组给予同体积溶剂,空白对照组不做处理,15-20分钟后各组经口给予葡萄糖2.5g/kg BW,测定给葡萄糖后各组0.5、2小时的血糖值,若模型对照组0.5小时血糖值≥10mmol/L,或模型对照组0.5小时、2小时任一时间点血糖升高或血糖曲线下面积升高,与空白对照组比较,差异有显著性,判定模型糖代谢紊乱成立,在此基础上,观察模型对照组与受试样品组空腹血糖、给葡萄糖后(0.5、2小时)血糖及0、0.5、2小时血糖曲线下面积的变化。

1.6.2胆固醇、甘油三脂
各组动物禁食3-4小时,检测血清胆固醇、甘油三脂,若模型对照组血清胆固醇或甘油三酯明显升高,与空白对照组比较,差异有显著性,判定模型脂代谢紊乱成立,在此基础上,观察模型对照组与受试样品组血脂变化。
1.6.3胰岛素
各组动物禁食3-4小时,检测血清胰岛素,模型对照组与空白对照组比较胰岛素抵抗指数无明显下降,且动物糖/脂代谢紊乱成立,判定胰岛素抵抗糖脂代谢紊乱模型成功。观察模型对照组与受试样品组胰岛素抵抗情况。

1.7指标判定
1.7.1正常动物降糖试验
血糖指标:空腹血糖受试样品剂量组与对照组比较无统计学意义,判定对正常动物血糖无影响。
1.7.2高血糖模型降糖试验
空腹血糖指标:模型成立的前提下,受试样品剂量组与模型对照组比较,空腹血糖下降或血糖下降百分率升高有统计学意义,判定该受试样品空腹血糖指标结果阳性。
糖耐量指标:模型成立的前提下,受试样品剂量组与模型对照组比较,在给葡萄糖或医用淀粉后0.5、2小时任一时间点血糖下降(或血糖下降百分率升高)有统计学意义,或0、0.5、2小时血糖曲线下面积降低有统计学意义,判定该受试样品糖耐量指标结果阳性。
血脂指标:模型成立的前提下,受试样品剂量组与模型对照组比较,血清胆固醇或甘油三酯下降有统计学意义,可判定该受试样品降血脂指标阳性。
2 结果判定
空腹血糖和糖耐量二项指标中一项指标阳性,且血脂(总胆固醇、甘油三酯)无明显升高,对正常动物空腹血糖无影响,即可判定该受试样品辅助降血糖功能动物实验结果阳性。
3 试验结果
3.1正常动物降糖试验
由表1可见,正常大鼠连续灌胃给予受试样品(大剂量)34天后,受试样品(大剂量)组大鼠空腹血糖值与空白对照组比较无显著性差异,表明该受试样品不会降低正常大鼠空腹血糖的作用。
表1 半乳甘露聚糖辅助降糖咀嚼片对正常大鼠空腹血糖的影响(±SD)

表1 半乳甘露聚糖辅助降糖咀嚼片对正常大鼠空腹血糖的影响(±SD)
剂量(g/kgBW)给受试样品前血糖值(mmol/L)动物数(只)组别给受试样品后血糖值(mmol/L)空白对照组 - 8 7.09±0.34 6.85±0.63速可挡大剂量组 1.4 8 7.03±0.38 7.83±0.30
3.2高血糖模型降糖实验
四氧嘧啶诱导胰岛素抵抗糖脂代谢紊乱模型
由表2可见,给予葡萄糖后0.5小时模型组大鼠血糖值大于10 mmol/L,且0.5小时、2小时血糖值和血糖曲线下面积与空白对照组比较,血糖值及曲线下面积都升高,差异有显著性意义(P<0.001),差异都有显著性意义,判定模型糖代谢紊乱成立。由表3可见,模型对照组血清总胆固醇与空白对照组比较,差异有显著性意义(P<0.001),判定模型脂代谢紊乱成立。此外模型对照组与空白对照组比较胰岛素抵抗指数无明显下降,因此判定四氧嘧啶诱导胰岛素抵抗糖脂代谢紊乱模型成立。四氧嘧啶诱导胰岛素抵抗糖脂代谢紊乱模型大鼠连续灌胃给予受试样品34天后,受试样品高、低剂量组大鼠空腹血糖值降低,与模型对照组比较差异有显著性意义(P<0.01,P<0.05);受试样品高、低剂量组空腹血糖下降百分率升高,与模型对照组比较有显著性差异(P<0.01,P<0.05)。由此判定该受试样品空腹血糖指标结果阳性。受试样品小剂量组在给葡萄糖0.5小时、2小时血糖值下降,与模型对照组比较,差异有显著性意义(P<0.01,P<0.05);与模型对照组比较,受试样品小剂量组给予葡萄糖0.5小时血糖下降百分率升高、受试样品高、小剂量组2小时血糖下降百分率升高及曲线下面积降低,差异均有显著性意义(P<0.01,P<0.05)。由此判定该受试样品糖耐量指标结果阳性。受试样品高剂量组与模型对照组比较,血清胆固醇下降,差异有显著性意义(P<0.05),由此判定该受试样品半乳甘露聚糖降血脂指标阳性。
在本试验条件下,由试验结果可见,在模型成立的前提下,受试样品空腹血糖、糖耐量及血脂指标均呈阳性,由此判定该受试样品辅助降血糖功能动物实验结果阳性。
表2 半乳甘露聚糖辅助降糖咀嚼片对四氧嘧啶诱导胰岛素抵抗糖脂代谢紊乱模型大鼠的影响(±SD)
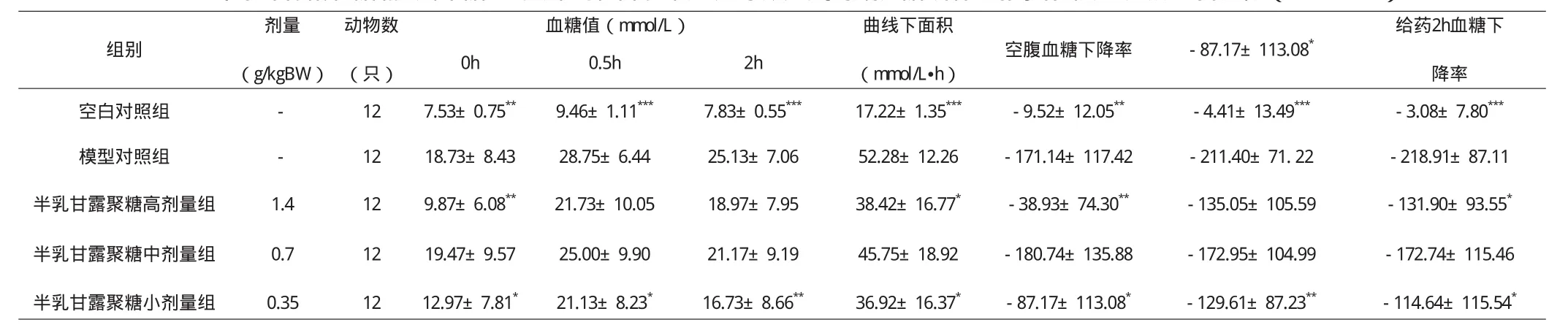
表2 半乳甘露聚糖辅助降糖咀嚼片对四氧嘧啶诱导胰岛素抵抗糖脂代谢紊乱模型大鼠的影响(±SD)
注:与模型对照组比较 ***p<0.001,**p<0.01,*p<0.05
剂量(g/kgBW)血糖值(mmol/L) 曲线下面积(mmol/L•h)动物数(只)组别空腹血糖下降率 -87.17±113.08*给药2h血糖下降率0h 0.5h 2h空白对照组 - 12 7.53±0.75** 9.46±1.11*** 7.83±0.55*** 17.22±1.35*** -9.52±12.05** -4.41±13.49*** -3.08±7.80***模型对照组 - 12 18.73±8.43 28.75±6.44 25.13±7.06 52.28±12.26 -171.14±117.42 -211.40±71. 22 -218.91±87.11半乳甘露聚糖高剂量组 1.4 12 9.87±6.08** 21.73±10.05 18.97±7.95 38.42±16.77* -38.93±74.30** -135.05±105.59 -131.90±93.55*半乳甘露聚糖中剂量组 0.7 12 19.47±9.57 25.00±9.90 21.17±9.19 45.75±18.92 -180.74±135.88 -172.95±104.99 -172.74±115.46半乳甘露聚糖小剂量组 0.35 12 12.97±7.81* 21.13±8.23* 16.73±8.66** 36.92±16.37* -87.17±113.08* -129.61±87.23** -114.64±115.54*
表3 半乳甘露聚糖辅助降糖咀嚼片对高糖模型大鼠胆固醇、甘油三脂、胰岛素抵抗指数的影响(±SD)
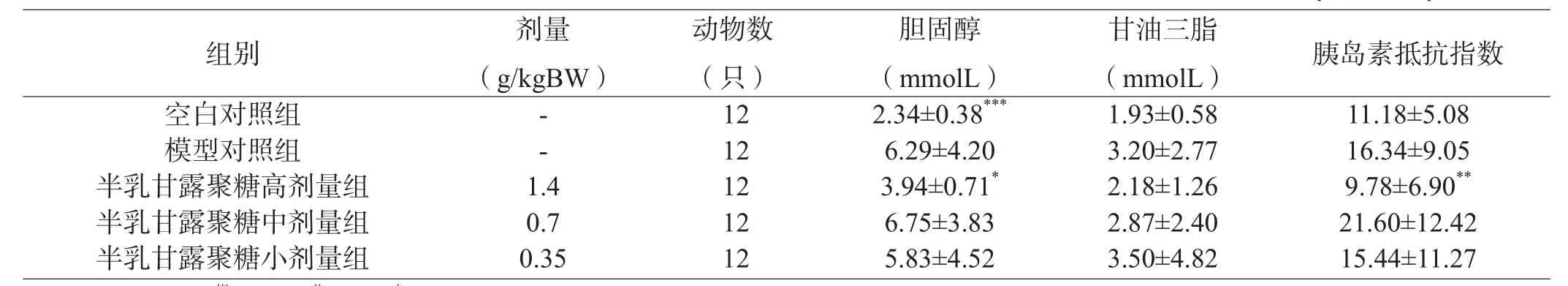
表3 半乳甘露聚糖辅助降糖咀嚼片对高糖模型大鼠胆固醇、甘油三脂、胰岛素抵抗指数的影响(±SD)
注:与模型对照组比较 ***p<0.001,**p<0.01,*p<0.05
组别 剂量(g/kgBW)胆固醇(mmolL)动物数(只)甘油三脂(mmolL) 胰岛素抵抗指数空白对照组 - 12 2.34±0.38*** 1.93±0.58 11.18±5.08模型对照组 - 12 6.29±4.20 3.20±2.77 16.34±9.05半乳甘露聚糖高剂量组 1.4 12 3.94±0.71* 2.18±1.26 9.78±6.90**半乳甘露聚糖中剂量组 0.7 12 6.75±3.83 2.87±2.40 21.60±12.42半乳甘露聚糖小剂量组 0.35 12 5.83±4.52 3.50±4.82 15.44±11.27
3.3结果判定
在本试验条件下,分别以1.4g/kg BW、0.7g/kgBW、0.35g/kg BW(分别相当于人体推荐用量的20、10、5倍)剂量的半乳甘露聚糖辅助降糖咀嚼片给大鼠连续灌胃34天,受试样品空腹血糖、糖耐量及血脂指标均呈阳性,由此判定半乳甘露聚糖辅助降血糖功能动物实验结果阳性。
4 讨论
目前,我国约有3000万糖尿病患者,药物治疗虽然取得了较大的成果,但长期服用西药的副作用仍是治疗高血糖的一大难题。本实验结果以高热能饲料饲喂3周大鼠,高血糖模型成立后,大鼠灌胃给予不同剂量的半乳甘露聚糖,33 d 时与模型组比较时,表明半乳甘露聚糖灌胃给予大鼠具有辅助降血糖作用。
四氧嘧啶是一种胰岛β细胞毒剂,能够产生自由基,并选择性地攻击胰岛β细胞,造成胰岛素分泌降低,从而导致血糖升高,而且还能影响到其他脏器,比如肝脏,使肝脏糖原合成及葡萄糖利用等功能受到抑制,从而引起实验性糖尿病,因此,本实验利用四氧嘧啶制造高血糖大鼠模型[6,7]。
多糖的活性,一般认为与其单糖组成、摩尔比、分子量、溶解度、粘度和溶液中构象等因素有关。首先多糖的水溶性对其活性有重要的影响,例如,水溶性β-葡聚糖具有较高的抗炎与抗癌活性。而不溶于水的β-(1→ 3)-D-葡聚糖则活性很低,但若使其部分羧甲基化后,水溶性提高,抗癌活性明显上升。几丁质(ch itin)本无降血糖活性,当脱去乙酰基后(chitosan)便显示降血糖活性[3]。多糖在溶液中所带电荷的性质对其活性也有很重要的影响作用。研究发现,硫酸酯化匀多糖如卡拉胶、岩藻糖(fuco idan)等具有很强的免疫活性,具有抗病毒作用,但消除硫酸根后其活性也消失[8]。金属离子在降血糖中也扮演重要角色。对南瓜多糖的结构研究发现,Cu在其中处于稳定的螯合状态。Cu是机体内氧化还原过程中极为有效的催化剂。铜盐可促进酶的利用,有利降低血糖[9]当多糖与受体作用时只有分子中几个低聚糖片段与受体结合,可能多糖象蛋白质和酶一样,在多糖分子中存在一个或几个寡糖片段活性中心。因而根据活性多糖的结构比较可以得出多糖与降血糖活性的一些构效关系。
糖类化合物作为药物一般无副作用,并且生物活性多样,因而深受化学家和药学家的重视。不过,由于糖本身的结构复杂,其生物活性的机制仍需深入研究。
参考文献
[1] 谢明勇,聂少平. 天然产物活性多糖结构与功能研究进展[J]. 中国食品学报, 2010, 10(2): 1-11.
[2] 赵国华, 陈宗道, 李志孝, 等. 活性多糖的研究进展[J].食品与发酵工业, 2001(7): 45-48.
[3] Hayashi K, Ito M. Antidiabetic action of low molecular weight chitosan in genetically obese diabetic KK-Ay mice[J] . Biol Pharm Bull, 2002, 25(2):188-192.
[4] Kiho T, Kobayash i T, Morimoto H, et al. Structural features o f an anti-diabetic poly saccharide (TAP) from Trem ella aurantia [J] . Chem Pharm Bull, 2000, 48(11): 1793-1795.
[5] Kiho T, Kochi M, Usui S, et al. Antidiabetic effect of an acidic poly saccharide (TAP) from Trem ella aurantia and its deg radation product (TAP-H) [J] . BiolPharm Bull, 2001, 24(12): 1400-1403.
[6] 张继曼, 文汉. 黑豆皮花色苷的降血糖作用及其机理的研究[J]. 食品工业科技, 2010, 32(3): 374-377.
[7] 冯磊, 张春飞, 李印彩, 等. 茶多糖降血糖机制研究[J].浙江预防医学, 2003, 15(9): 10-11,13.
[8] Ponce N M A, Pujol C A, Damonte E B, et al. Fucoidans from the brown seaweed Adenocystis utricularis: extraction methods, antiviral activity and structural studies [J] . Carbohydr Res, 2003, 338(2):153-165.
[9] Zuo Y M, Ye S L, FangL, et al. Etraction and isolation of pumpk in poly saccharide and research of blood sugar reduction [J] . Food Sci (食品科学), 2001, 22(12): 56 - 58.
中图分类号:R285.5
文献标识码:A
DOI:[CLC Number] R285.5[Document Code] A10.11967/2016140311 10.11967/2016140311
作者简介:⋆武晗燕,北京市药品检验所主管药师,执业药师,主要从事药品检验工作,E-mail:adire@163.com
Galactomannan Effect of Hypoglycemic in the Rat
Hanyan Wu1, Zhengyin Mao2, Xuemei Li1
( 1、Beijing Institute for Drug Control, Beijing 102206, 2、Haidian Food and Drug Administration of Beijing Inspection Team, Beijing 100193 )
Abstract:Objective The rats were given to evaluate the hypoglycemic effect of galactomannan, provide experimental data for the animal polysaccharide hypoglycemic function for human body. Methods Eighty healthy male SD rats were used in this study. One group of 20 rats was chosen as normal control group, and other 60rats were f models of hypoglycemic. Under the condition of this experiment, respectively 1.4g/kg BW, 0.7g/kgBW, 0.35g/kg BW ( respectively in the human body recommended dosage of 20, 10, 5 times ) doses of galactomannan auxiliary hypoglycemic chewable tablets to rats by intragastric administration of 34 days, samples of fasting blood glucose, glucose tolerance and blood lipid indexes were positive, which determine the participants assisted sample drop positive blood sugar function of animal experimental results. Conclusion galactose mannose has auxiliary hypoglycemic effect on rats.
Key Words:SD rat; Galactomannan;Hypoglycemic effect
