枯草芽胞杆菌芽胞表面展示系统的构建
2016-08-30宋天宇赵鹏余涛蒋辉防化研究院国民核生化灾害防护国家重点实验室北京02205
宋天宇,赵鹏,余涛,2,蒋辉,2(、防化研究院;2、国民核生化灾害防护国家重点实验室,北京 02205)
枯草芽胞杆菌芽胞表面展示系统的构建
宋天宇1,赵鹏,余涛1,2,蒋辉1,2
(1、防化研究院;2、国民核生化灾害防护国家重点实验室,北京 102205)
摘要:枯草芽胞杆菌芽胞展示系统具有稳定性高、安全性好、易收集纯化等特点,已广泛应用于疫苗和药物的制备、酶类及其他功能蛋白的生产等领域,同时其在生化战剂的检测、洗消、生物修复等方面也具有重要的应用价值。本实验以绿色荧光蛋白为模型蛋白,以CotG和CotZ为锚定蛋白,构建枯草芽胞杆菌芽胞表面展示系统,并成功将绿色荧光蛋白展示在枯草芽胞杆菌的芽胞表面,为今后获得可在复杂条件下发挥生物活性、贮存稳定性高、生产成本低的功能芽胞提供技术基础。
关键词:枯草芽胞杆菌;芽胞;表面展示;绿色荧光蛋白
1 前言
枯草芽胞杆菌芽胞表面展示技术是通过基因重组将外源蛋白与芽胞的锚定蛋白基因进行基因融合,在芽胞形成过程中衣壳蛋白携带融合表达的外源蛋白组装在芽胞表面,使其发挥特定的生物活性。枯草芽胞杆菌由于安全性好、遗传操作体系完善的特点被广泛应用于食品、医药等行业,而枯草芽胞杆菌芽胞优良的抗逆性使其成为一种理想的表面展示载体,保证了外源蛋白在复杂环境下的保存、运输和生物活性[1, 2]。
枯草芽胞杆菌芽胞含有70多种衣壳蛋白,其中以CotG作为锚定蛋白已成功展示了β-半乳糖苷酶、植酸酶、N-乙基神经氨酸醛缩酶、α淀粉酶等多种酶类[3,5],在酶制剂生产方面已显示出良好的应用前景,对生化战剂的检测、洗消、生物修复等领域的研究和应用具有重要意义。近几年,在枯草芽胞杆菌芽胞外壳层(crust)中还发现了新的衣壳蛋白CotZ,CotZ在芽胞的定位相比于传统锚定蛋白更接近于芽胞表面,其特征有利于提高外源蛋白在芽胞表面展示的效率[6,7]。因此,以CotG和CotZ为锚定蛋白的枯草芽胞杆菌芽胞表面展示系统具有良好的开发潜力。
目前人们对于芽胞结构和其组装机制的了解尚不全面深入,芽胞表面展示系统能否成功构建出具有较高生物活性的重组芽胞仍需要实验条件的摸索与探讨。检验芽胞表面展示系统能否有效展示外源蛋白是开展后续工作的基础,现如今通过绿色荧光蛋白(green fl uorescent protein, GFP)及其突变体已被广泛应用于验证枯草芽胞杆菌芽胞表面展示系统[4, 5, 8,10]。本研究利用GFP为模型蛋白,以CotG和CotZ为锚定蛋白构建枯草芽胞杆菌芽胞表面展示系统,用以验证芽胞表面展示系统的有效性,为今后获得可在复杂条件下发挥生物活性、贮存稳定性高、生产成本低的功能芽胞提供技术基础。
2 材料和方法
2.1材料
2.1.1实验材料
表达载体pET32a+购自 Novagen公司,表达载体pHY300PLK购自TaKaRa公司,克隆菌株Escherichia coli DH5α和表达菌株E. coli BL21购自TIANGEN公司,表达菌株Bacillus subtilis DB104由军事医学科学院第十研究所惠赠。本实验所使用的引物均由北京奥科鼎盛生物科技有限公司合成。
2.1.2试剂
高保真DNA聚合酶、dNTP Mix、PCR Master Mix、核酸分子量标准、质粒抽提试剂盒、胶回收试剂盒、DNA纯化试剂盒、限制性内切酶BamHI、EcoRI、HindIII、T4 DNA 连接酶均购自Thermo Fisher Scientific公司,核酸分子量标准购自Fermentas公司,其他常规化学试剂为国产或进口分析纯试剂。
2.1.3仪器
PCR仪(ABI 2720),恒温摇床(Infors Novotron),电转仪(Bio-Red Micropulser),凝胶成像系统(Bio-Rad Gel Doc 2000),紫外分光光度计(日立U-2001),荧光光度计(日立F-2500)。
2.1.4培养基
LB培养基:蛋白胨10g/L,酵母提取物5g/L,氯化钠10g/ L(固体培养基含1.5%琼脂);枯草芽胞杆菌感受态生长培养基:蛋白胨10g/L,酵母提取物5g/L,氯化钠10g/L,山梨醇0.5mol/L;枯草芽胞杆菌电击恢复培养基:蛋白胨10g/L,酵母提取物5g/L,氯化钠10g/L,山梨醇0.5mol/L,甘露醇0.3mol/L;DSM生胞培养基:营养肉汤8 g/L,氯化钾1 g/L,硫酸镁1M,氯化锰10mM,氢氧化钠调pH至7.0,蒸馏水定容至1L,灭菌后加入硝酸钙至1M,硫酸铁至1mM。
2.2实验方法
2.2.1重组质粒的构建
根据gfp的基因序列,同时考虑载体pET32a+上多克隆位点、阅读框及启动子的作用方向,设计了一对特异性引物。引物设计见表1。

表1 GFP基因PCR扩增所需的引物序列
以携带gfp基因的质粒为模板进行PCR扩增。使用限制性内切酶EcoRI、XhoI对扩增的基因和表达载体pET32a+进行双酶切,通过DNA连接反应将gfp基因重组于载体pET32a+,命名为pET32a+-gfp。通过化学转化法将重组质粒pET32a+-gfp导入克隆菌株E. coli DH5α,以含有氨苄青霉素的LB平板筛选阳性克隆,并进行酶切和基因测序。鉴定基因准确无误后,提取重组质粒pET32a+-gfp,经化学转化法导入表达菌株E. coli BL21(DE3),以含有氨苄青霉素的LB平板筛选阳性克隆并进行PCR验证。
以枯草芽胞杆菌DB104基因组为模板,利用引物cotG-1 和cotG-2通过PCR扩增衣壳蛋白cotG及其自身启动子基因,并在CotG蛋白C端引入一段灵活肽链Gly-Gly-Gly-Gly-Ser(表2加粗标示)。使用限制性内切酶EcoRI、BamHI对扩增的基因和穿梭载体pHY300PLK进行双酶切,并通过DNA连接反应将扩增的基因与载体pHY300PLK重组,命名为pHY300PLK-cotG。以质粒pET21a+-gfp为模板,利用引物gfp-G1和gfp-G2扩增gfp基因。使用限制性内切酶BamHI、HindIII对gfp基因和重组载体pHY300PLK-cotG进行双酶切,并通过连接反应获得重组质粒pHY300PLK-cotG-gfp。通过化学转化法将重组质粒pHY300PLK-cotG-gfp导入克隆菌株E. coli DH5α,以含有氨苄青霉素的LB平板筛选阳性克隆,并进行酶切和测序鉴定。
以相同的方法构建重组载体pHY300PLK-cotZ-gfp。由于cotZ基因自身的序列特性,在PCR扩增时常发生非特异扩增,实验中通过两对引物对cotZ基因进行巢式PCR以获取目标基因。首先以枯草芽胞杆菌DB104基因组为模板,利用引物cotG-1和cotG-2扩增包含衣壳蛋白cotZ及其自身启动子的较长基因片段,扩增产物通过切胶回收后作为第二次PCR的模板,再使用引物cotZ-3、cotZ-4扩增衣壳蛋白cotZ及其自身启动子基因,并在CotZ蛋白C端引入肽链。两次PCR反应的条件均为:95℃预变性5min;95℃变性30s,55℃退火30s,72℃延伸2min,共30个循环;72℃延伸10min。构建重组载体的后续操作与CotG一致。

表2 锚定蛋白和GFP基因PCR扩增所需的引物序列
2.2.2枯草芽胞杆菌的转化
使用Gang-Ping, Xue电转化法将重组载体pHY300PLK-cotG、pHY300PLK-cotG-gfp、pHY300PLK-cotZ、pHY300PLK-cotZ-gfp导入B. subtilis DB104感受态细胞(电转条件:2.5kv,5ms,电击1次)[11],在含有四环素的LB培养板上筛选重组菌株并进行PCR验证。
2.2.3绿色荧光蛋白样品的制备
以上述构建的GFP表达菌株pET32a+-gfp/BL21制备GFP样品。将菌株以1:100接种于5ml含有氨苄青霉素的LB培养基,37℃、250r/min震荡培养过夜,次日以1:100转接种于200ml含有氨苄青霉素的LB培养基,37℃、250r/min震荡培养3h,加入1mmol/L的IPTG诱导剂,15℃、250r/min震荡培养16h。15000r/min离心集菌,重悬于10ml PBS缓冲液,超声破碎细胞,15000r/min离心取上清,以0.45μl PVDF膜过滤,并以组氨酸柱纯化。取10μl GFP纯化液稀释于4ml PBS缓冲液,即为GFP标准样品。
2.2.4重组芽胞的制备
将重组菌株pHY300PLK-cotG-gfp/DB104、pHY300PLK-cotZ-gfp/DB104按1:100转接于DSM培养基,通过营养匮乏法诱导芽胞形成,37℃、250r/min震荡培养48h。取10μl生胞培养后的菌液,以灭菌水稀释106倍,混匀后以200μl涂布于含有四环素的LB筛选平板,重复3组,37℃过夜培养,次日统计克隆数;另取10μl生胞培养后的菌液80℃孵育15min,以灭菌水稀释106倍,混匀后以200μl涂布于含有四环素的LB筛选平板,重复3组,37℃过夜培养,次日统计克隆数。未经高温处理的培养稀释液克隆数乘5×106即为培养液全菌浓度(cfu/ ml),经高温处理的培养稀释液克隆数乘5×106为芽胞浓度(cfu/ml),其比值为培养液的芽胞生成率[12]。以15000r/min离心收集培养液中的菌体,以2mg/ml溶菌酶溶液重悬后37℃孵育30min,15000r/min离心集菌,分别使用1M NaCl和1M KCl洗涤一次,再次以15000r/min离心集菌,使用纯水洗涤2次[13]。以10ml无菌水重悬,65℃孵育1h[14]。15000r/min离心收集芽胞,重悬于10ml PBS缓冲液。
2.2.5重组芽胞的荧光鉴定
通过紫外分光光度计检测上述芽胞悬液的OD600值,并以PBS缓冲液稀释至OD600=0.1。使用荧光光度计检测GFP样品荧光强度并绘制其标准荧光光谱(参数设置:激发波长为470nm,发射波长选取480至680nm)。在相同条件下测定稀释后芽胞悬液的荧光强度,以相同基因型未生胞菌液和B. subtilis DB104芽胞悬液作为对照,每组检测三次取平均值。
随后以流式细胞分析分别检测各芽胞悬液及其对照组,重复3组,计算平均荧光强度。
3 结果与讨论
3.1实验结果
3.1.1绿色荧光蛋白的诱导表达
首先,构建gfp基因重组载体,获得重组质粒pET32a+-gfp(图1)。
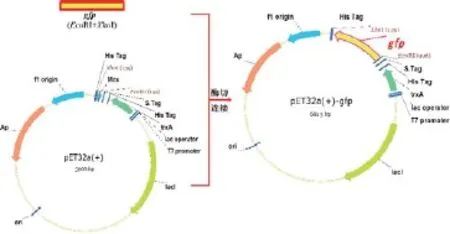
图1 GFP诱导表达重组质粒的构建
使用EcoRI、XhoI对重组质粒pET32a+-gfp进行双酶切,并以1%的琼脂糖凝胶电泳验证。核酸电泳结果(图2)显示,重组质粒经EcoRI、XhoI双酶切后在717bp处有明显条带,与gfp基因大小一致,表明我们获得了正确的pET32a+-gfp基因重组质粒。同时对重组质粒进行基因测序,结果表明重组载体的gfp基因序列完全正确,未产生任何突变,可用于后续实验。
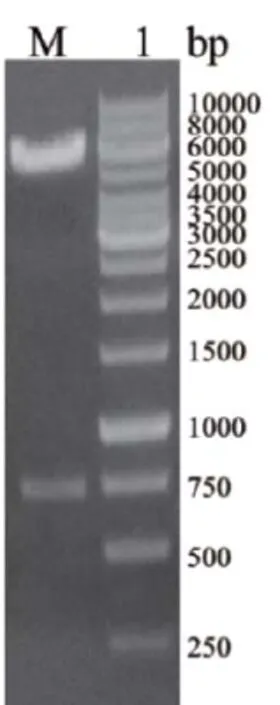
图2 重组质粒pET32a+-gfp的酶切鉴定M:1kb DNA Ladder;1:重组质粒pET32a+-gfp的EcoRI和XhoI双酶切鉴定。
其次,构建GFP重组表达菌株pET32a+-gfp/BL21 (DE3)。经IPTG诱导表达后,超声破碎和纯化,获得GFP标准品(图3)。取GFP标准品进行SDS-PAGE电泳(图4),结果显示重组菌株pET32a+-gfp/BL21(DE3)全蛋白经纯化后,其在约45kDa处有一条明显的条带,大小与GFP一致,表明我们成功获得了GFP重组表达菌株。

图3 GFP标准品

图4 GFP标准品的SDS-PAGE电泳图M:PageRuler Broad Range Unstained Protein Ladder;1:GFP标准品
最后,对GFP标准品进行荧光检测,以便得到GFP标准荧光光谱。由光谱图可知GFP在508nm处具有一个荧光发射峰(图5),与文献相符(由于实验环境及仪器的不同会产生小幅度的偏移)[15],表明我们成功的得到了GFP标准荧光光谱。
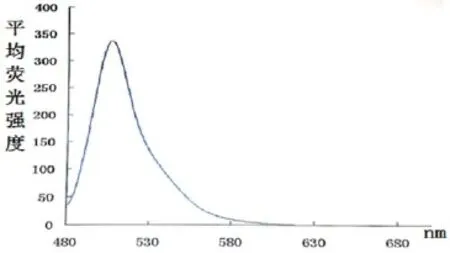
图5 GFP的标准荧光光谱
3.1.2绿色荧光蛋白的芽胞表面展示
为保证衣壳蛋白CotG与外源蛋白GFP能够在正确的时机表达并装配于芽胞表面,本研究使用了CotG自身的启动子对重组蛋白进行表达调控。通过PCR的方法直接将衣壳蛋白及其启动子完整的扩增出来,以枯草芽胞杆菌DB104基因组为模板,利用引物cotG-1和cotG-2扩增出一段1039bp的基因序列,其3'端的585bp为cotG编码序列,5'端的454bp是cotG启动子序列[8]。
通过文献报道,在锚定蛋白与展示的外源蛋白之间加入一段合适的连接肽链能够减少表达装配过程中的相互影响[16,17]。本研究通过在CotG基因3'端添加能够编码氨基酸Gly-Gly-Gly-Gly-Ser的基因序列(表2加粗标示),从而在CotG蛋白C端引入一段被广泛应用的灵活肽链[8],以提高外源蛋白GFP展示的成功率。
构建gfp基因重组载体,获得重组质粒pHY300PLK-cotG-gfp(图6a)和重组质粒pHY300PLK-cotZ-gfp(图6b)。由于cotZ基因自身的序列特性,在PCR扩增时常发生非特异扩增,实验中使用cotZ-1、cotZ-2和cotZ-3、cotZ-4两对引物对cotZ基因进行巢式PCR以获取目标基因。
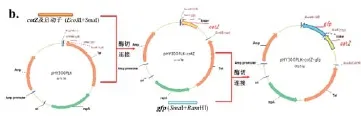
图6 GFP芽胞展示重组质粒的构建
使用EcoRI、BamHI对重组质粒pHY300PLK-cotG进行单、双酶切,并以1%的琼脂糖凝胶电泳验证。结果(图7)显示,经EcoRI单酶切后重组质粒在6637bp处有明显条带,与重组质粒大小一致;经EcoRI、BamHI双酶切后在1039bp处有明显条带,与cotG及其启动子基因大小一致,表明我们得到了正确的重组pHY300PLK-cotG质粒。使用EcoRI、SmaI对重组质粒pHY300PLK-cotZ进行单、双酶切,并以1%的琼脂糖凝胶电泳验证。核酸电泳结果(见图7)显示,经EcoRI单酶切后重组质粒在6510bp处有明显条带,与重组质粒大小一致;经EcoRI、SmaI双酶切后在886bp处有明显条带,与cotZ及其启动子基因大小一致,表明们得到了正确的重组pHY300PLK-cotZ质粒。对pHY300PLK-cotG、pHY300PLK-cotZ两种重组质粒进行基因测序,结果表明重组质粒的基因序列完全正确,并且未产生任何基因突变,可用于后续研究。
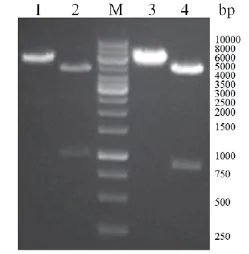
图7 携带锚定蛋白基因重组质粒的酶切鉴定M:1kb DNA Ladder;1:重组质粒pHY300PLK-cotG的EcoRI酶切鉴定;2:重组质粒pHY300PLK-cotG的EcoRI和BamHI酶切鉴定;3:重组质粒pHY300PLK-cotZ的EcoRI酶切鉴定;4:重组质粒pHY300PLK-cotZ的EcoRI和SmaI酶切鉴定
使用BamHI、HindIII对重组质粒pHY300PLK-cotG-gfp进行双酶切,并以1%的琼脂糖凝胶电泳验证。核酸电泳结果(图8)显示,经EcoRI、SmaI双酶切后在717bp处有明显条带,与gfp基因大小一致,表明我们得到了正确的重组pHY300PLK-cotG-gfp质粒;使用SmaI、BamHI对重组质粒pHY300PLK-cotZ-gfp进行双酶切,以1%的琼脂糖凝胶电泳验证。核酸电泳结果(图8)显示,经SmaI、BamHI双酶切后在717bp处有明显条带,与gfp基因大小相符,表明我们得到了正确的重组pHY300PLK-cotZ-gfp质粒。对pHY300PLK-cotG-gfp、pHY300PLK-cotZ-gfp两种重组质粒进行基因测序,结果表明重组质粒的基因序列完全正确,并且未产生任何基因突变,可用于后续的实验。
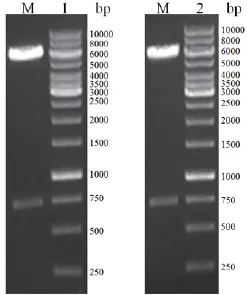
图8 携带GFP基因重组质粒的酶切鉴定M:1kb DNA Ladder;1:重组质粒pHY300PLK-cotG-gfp的BamHI和HindIII酶切鉴;2:重组质粒pHY300PLK-cotZ-gfp的BamHI和SmaI酶切鉴定
重组载体pHY300PLK-cotG-gfp、pHY300PLK-cotZ-gfp分别以电转化的方式导入枯草芽胞杆菌DB104感受态细胞。由于重组质粒携带四环素抗性基因,实验中利用含有四环素的LB培养板筛选重组菌株。将获得的阳性菌株在DSM培养基中培养并使用营养匮乏法诱导形成芽胞,以间接计数法统计菌液中的总菌数,并通过80℃孵育15min对菌液中的营养细胞进行灭活,以间接计数法统计芽胞数量(图9,克隆数见表3)。经计算,菌株pHY300PLK-cotG/DB104、pHY300PLK-cotG-gfp/DB104、pHY300PLK-cotZ/DB104、pHY300PLK-cotZ-gfp/DB104总菌数分别为(2.00 ± 0.12)×107cfu/ml、(2.38 ± 0.46)×107cfu/ml、(1.6 ± 0.27)×107cfu/ml、(3.71 ± 0.39)×107cfu/ml,芽胞数分别为(1.28 ± 0.17)×107cfu/ml、(1.6 ± 0.37)×107cfu/ml、(1.46 ± 0.24)×107cfu/ml、(2.13 ± 0.14)×107cfu/ml,芽胞生成率分别为(64.09 ±10.88)%、(67.24 ±10.24)%、(91.71 ±8.45)%、(58.05 ±10.30)%。由此表明,此培养方法能够使重组菌株有效地形成芽胞。

图9 表面展示的重组菌株计数平板
第一列:菌株pHY300PLK-cotG/DB104培养液总菌;第二列:菌株pHY300PLK-cotG/DB104培养液芽胞;第三列:菌株pHY300PLK-cotG-gfp/DB104培养液总菌;第四列:菌株pHY300PLK-cotG-gfp/DB104培养液芽胞;第五列:菌株pHY300PLK-cotZ/DB104培养液总菌;第六列:菌株pHY300PLK-cotZ/DB104培养液芽胞;第七列:菌株pHY300PLK-cotZ-gfp/DB104培养液总菌;第八列:菌株pHY300PLK-cotZ-gfp/DB104培养液芽胞
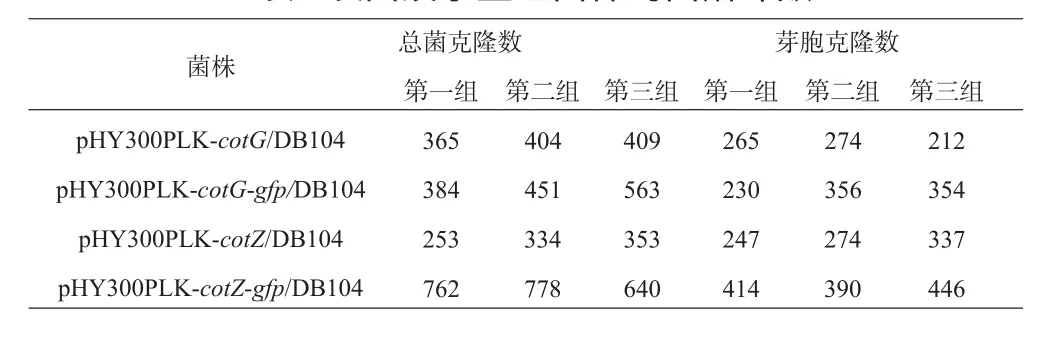
表3 表面展示重组菌株的菌落计数
对纯化后的重组芽胞及相关对照样品进行荧光检测,通过对比各光谱的荧光强度发现:重组菌株pHY300PLK-cotG-gfp/DB104的芽胞荧光强度相对于对照组pHY300PLK-cotG /DB104芽胞在490至580nm之间均有显著的增强,并在508nm处达到最大值,其趋势与GFP的标准荧光光谱一致(图10)。表明重组菌株pHY300PLK-cotG-gfp/DB104能够成功将具有生物活性的GFP展示在芽胞表面。但重组菌株pHY300PLK-cotZ-gfp/DB104的芽胞与对照组pHY300PLK-cotZ/DB104的芽胞相比,荧光强度无明显变化,表明此系统并未成功展示具有生物活性的GFP。

图10 展示绿色荧光蛋白芽胞的荧光光谱
通过流式细胞分析对纯化后的重组芽胞及相关对照样品进行检测(图11),统计每组样品的荧光强度,计算其平均值和标准偏差(表4)。对比各组的荧光强度发现:重组菌株pHY300PLK-cotG-gfp/DB104的芽胞荧光强度相对于对照组pHY300PLK-cotG/DB104芽胞、pHY300PLK-cotG-gfp/DB104营养细胞有显著增强(P<0.001,图12);重组菌株pHY300PLK -cotZ-gfp/DB104与其对照组之间无明显差异(P>0.05,图12)。再一次证明重组菌株pHY300PLK-cotG-gfp/DB104将GFP成功展示在芽胞表面,而菌株pHY300PLK-cotZ -gfp/DB104未成功展示具有生物活性的GFP。
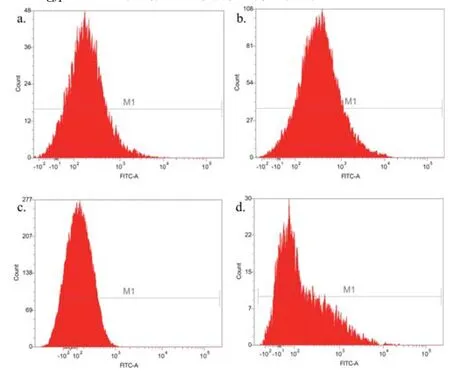

图11 展示绿色荧光蛋白芽胞的流式细胞分析a. 菌株pHY300PLK-cotG/DB104的芽胞;b. 菌株pHY300PLK-cotG-gfp/DB104的芽胞;c. 菌株pHY300PLK-cotG-gfp/DB104的营养细胞;d. 菌株pHY300PLK-cotZ/DB104的芽胞;e. 菌株pHY300PLK-cotZ-gfp/DB104的芽胞;f. 菌株pHY300PLK-cotZ-gfp/DB104的营养细胞
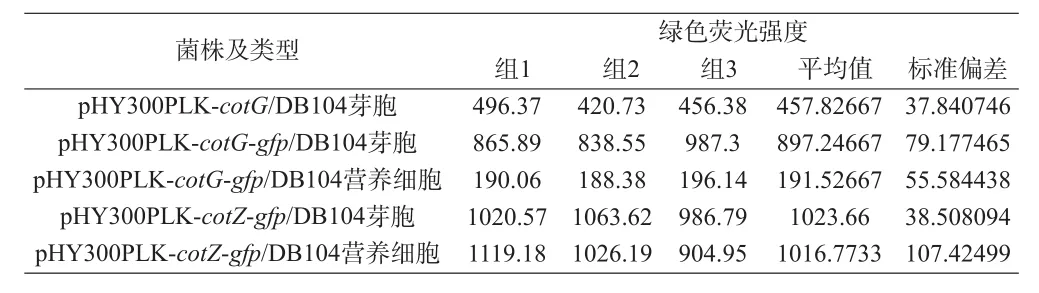
表4 流式细胞检测的平均荧光强度

图12 流式细胞检测的平均荧光强度组1:菌株pHY300PLK-cotG/DB104芽胞;组2:菌株pHY300PLK-cotG-gfp/DB104芽胞;组3:菌株pHY300PLK-cotG-gfp/DB104营养细胞;组4:菌株pHY300PLK-cotZ/DB104芽胞;组5:菌株pHY300PLK-cotZ-gfp/DB104芽胞;组6:菌株pHY300PLK-cotZ-gfp/DB104营养细胞
3.2讨论
枯草芽胞杆菌芽胞表面展示技术能够提高外源蛋白在低温、干燥、有机试剂等复杂环境下的稳定性,可应用于大分子量、多聚体蛋白,具有广阔的应用前景[18-20]。但对于锚定蛋白在芽胞的准确定位和组装机制尚不清楚,利用不同宿主、载体、锚定蛋白构建的芽胞表面展示系统能否高效地展示外源蛋白仍需通过一系列的实验进行验证。Hinc等人的研究表明,与CotB和CotC相比,CotG是唯一能够展示完整尿素蛋白A亚基的锚定蛋白,这对于发挥外源蛋白的生物活性具有重要意义[21]。Obuchowski等认为CotZ在芽胞的定位相比于传统锚定蛋白更接近于芽胞表面,其特征有利于提高外源蛋白在芽胞表面展示的效率[7]。因此,本研究以蛋白酶缺陷型枯草芽胞杆菌DB104为宿主,分别构建了以CotG和CotZ为锚定蛋白,以GFP为模型蛋白的枯草芽胞杆菌芽胞表面展示系统,其中以CotG为锚定蛋白的展示系统能够成功将GFP展示在重组芽胞的表面并保持其自身的生物活性,为深入研究和应用枯草芽胞杆菌芽胞表面展示系统展示不同的功能蛋白奠定了技术基础。
重组芽胞的荧光强度与GFP在芽胞表面的展示效率相关。实验发现,以CotG为锚定蛋白的展示系统能够在枯草芽胞杆菌的芽胞表面展示GFP蛋白,同时可以很好的保持GFP蛋白的生物活性。与已报道的相关研究进行比较[8],尽管所使用模型蛋白和表达载体有所不同,所获得的重组芽胞的流式细胞分析结果基本一致,表明本实验中构建的以CotG为锚定蛋白的芽胞表面展示系统具有良好的开发潜力。另外,本芽胞表面系统中使用了游离型载体复制和表达cotG基因,并未对宿主染色体上的cotG基因进行敲除等处理。据文献报道,在芽胞形成过程中cotG等位基因之间可能会产生竞争性表达,从而对外源蛋白的表达及展示效率产生影响[21, 22],我们将对其进行深入研究,以其进一步提高外源蛋白的展示效率。
实验结果还表明,以CotZ为锚定蛋白的芽胞表面展示系统表达的重组芽胞荧光强度与对照组芽胞相比没有明显变化,说明CotZ的芽胞表面展示系统未能将GFP展示在芽胞表面或GFP在芽胞表面展示过程中丧失了自身的生物活性。与通过CotZ成功展示外源蛋白的研究比较后发现,其系统中均未使用连接肽链[7,16]。由此推测,以CotZ为锚定蛋白的展示系统失败的原因可能是连接肽链对锚定蛋白CotZ与外源蛋白GFP在表达或组装过程中产生了一定的干扰,其具体的原因有待进一步的研究。探究是否由于连接肽链的引入导致GFP未能以具有生物活性的形式展示在芽胞表面将是后续工作的研究内容。此外,本实验中芽胞表面展示系统使用的连接肽链Gl-Gly-Gly-Gly-Ser不含二级结构,主要编码空间位阻较小、不易带点电的甘氨酸。这种结构能增加融合蛋白之间的距离,在一定程度上减小相互干扰,同时其对于融合蛋白构象的影响较小。而Hinc等研究发现在连接肽链中引入一段能够形成稳定α螺旋的EAAAK序列可有效提高外源蛋白在重组芽胞中的表达量和展示效率[7]。因此,使用含有稳定α螺旋结构的肽链连接CotZ与GFP也是后续研究的方向之一。
参考文献
[1] Driks A. Overview: Development in bacteria: spore formation in Bacillus subtilis[J]. Cell Mol Life Sci, 2002, 59(3): 389-391.
[2] Charbit A, Molla A, Saurin W, et al. Versatility of a vector for expressing foreign polypeptides at the surface of Gramnegative bacteria[J]. Gene, 1988,70(1): 181-189.
[3] Xu X, Gao C, Zhang X, et al. Production of N-Acetyl-D-Neuraminic Acid by Use of an Effi cient Spore Surface Display System[J]. Appl Environ Microbiol, 2011,77(10): 3197-3201.
[4] Potot S, Serra C R, Henriques A O, et al. Display of Recombinant Proteins on Bacillus subtilis Spores, Using a Coat-Associated Enzyme as the Carrier[J]. Appl Environ Microbiol,2010,76(17): 5926-5933.
[5] Quynh A N, Schumann W. Use of IPTG-inducible promoters for anchoring recombinant proteins on the Bacillus subtilis spore surface[J]. Protein Expression Purif, 2014,95: 67-76.
[6] Richter A, Kim W, Kim J H, et al. Disulfide Bonds of Proteins Displayed on Spores of Bacillus subtilis Can Occur Spontaneously[J]. Curr Microbiol, 2015, 71(1): 156-161.
[7] Hinc K, Iwanicki A, Obuchowski M. New stable anchor protein and peptide linker suitable for successful spore surface display in B. subtilis[J]. Microb Cell Fact, 2013, 12.
[8] Kim J, Roh C, Lee C, et al. Bacterial surface display of GFP(UV) on Bacillus subtilis spores[J]. J Microbiol Biotechn,2007,17(4): 677-680.
[9] 李倩, 宁德刚, 吴春笃. 以CotX为分子载体在枯草芽胞杆菌芽胞表面展示绿色荧光蛋白[J]. 生物工程学报,2010(02): 264-269.
[10] Wu I L, Narayan K, Castaing J P, et al. A versatile nano display platform from bacterial spore coat proteins[J]. Nat Commun, 2015, 6: 6777.
[11] Xue G P, Johnson J S, Dalrymple B P. High osmolarity improves the electro-transformation efficiency of the grampositive bacteria Bacillus subtilis and Bacillus licheniformis[J]. J Microbiol Methods, 1999, 34(3): 183-191.
[12] 郭夏丽, 狄源宁, 王岩. 枯草芽孢杆菌产芽孢条件的优化[J]. 中国土壤与肥料,2012(3): 99-103.
[13] Nicholson W, Setlow P. Sporulation germination and outgrowth[M]. In: Harwood C, Cutting S(eds), 1990: 391-450.
[14] Tavassoli S, Hinc K, Iwanicki A, et al. Investigation of spore coat display of Bacillus subtilis beta-galactosidase for developing of whole cell biocatalyst[J]. Arch Microbiol,2013,195(3): 197-202.
[15] Chalfi e M, Tu Y, Euskirchen G, et al. Green fl uorescent protein as a marker for gene expression[J]. Science (New York,NY), 1994, 263(5148): 802-805.
[16] Negri A, Potocki W, Iwanicki A, et al. Expression and display of Clostridium difficile protein FliD on the surface of Bacillus subtilis spores[J]. J Med Microbiol, 2013, 63:1379-1385.
[17] Iwanicki A, Piatek I, Stasilojc M, et al. A system of vectors for Bacillus subtilis spore surface display[J]. Microb Cell Fact, 2014, 13(1): 30.
[18] Ban J, Choi S, Jung H, et al. Method for expression of proteins on spore surface[P]. South-Korea. KR20030065534. 2003.
[19] Chen H, Zhang T, Jia J, et al. Expression and display of a novel thermostable esterase from Clostridium thermocellum on the surface of Bacillus subtilis using the CotB anchor protein[J]. J Ind Microbiol Biotechnol, 2015, 42(11): 1439-1448.
[20] Chen H, Tian R, Ni Z, et al. Surface display of the thermophilic lipase Tm1350 on the spore of Bacillus subtilis by the CotB anchor protein[J]. Extremophiles, 2015,19(4): 799-808.
[21] Hinc K, Isticato R, Dembek M, et al. Expression and display of UreA of Helicobacter acinonychis on the surface of Bacillus subtilis spores[J]. Microb Cell Fact, 2010, 9.
[22] Sacco M, Ricca E, Losick R, et al. An additional GerE-controlled gene encoding an abundant spore coat protein from Bacillus subtilis[J]. J Bacteriol, 1995, 177(2): 372-377.
中图分类号:Q81
文献标识码:A
DOI:[CLC Number] Q819[Document Code] A10.11967/2016140305 10.11967/2016140305
基金项目:⋆国民核生化灾害防护国家重点实验室项目(SKLNBC2013-05)
作者简介:宋天宇(1990-),男,硕士研究生,研究方向为生化药理学
通讯作者:蒋辉,(E-mail)jiangtide@sina.cn
Construction of Surface Display Systems Using Bacillus Subtilis Spores
Tianyu Song1, Peng Zhao, Tao Yu1, Hui Jiang1,2
( 1、Research Institute of Chemical Defense; 2、State Key Laboratory of NBC Protection for Civilian )
Abstract:Bacillus subtilis spore display system has been widely used in the preparation of vaccines and drugs, in the production of enzymes and other functional proteins because of its high stability, good safety, easy collection and purification feature. Meanwhile, it also plays an important role in the detection, decontamination and bioremediation of warfare agents. In this paper, we used two different carrier proteins CotG and CotZ to construct Bacillus subtilis spore surface display systems for green fluorescent protein, which provide a technical basis to obtain function spores with biological activity and low production cost using in comple�conditions.
Key Words:Bacillus subtilis; Spore; Display; Green fluorescent protein
