利用植物生长调节剂诱导烟草器官分化的基础教学实验
2016-08-29李玉明王洪钟谢莉萍张贵友
李玉明, 王洪钟, 谢莉萍, 张贵友
(清华大学 生命科学学院, 北京 100084)
实验技术与方法
利用植物生长调节剂诱导烟草器官分化的基础教学实验
李玉明, 王洪钟, 谢莉萍, 张贵友
(清华大学 生命科学学院, 北京100084)
在MS培养基中加入植物生长调节剂,诱导无菌烟草叶片的生长与分化,其中:2,4-D 可以诱导叶片生成愈伤组织;NAA与6-BA浓度比为5∶1时,可以诱导叶片生成不定根;NAA与6-BA浓度比为1∶5时,可以诱导叶片生成不定芽。
基础实验; 组织培养; 诱导分化; 2,4-D ;NAA; 6-BA
有关植物生长调节剂诱导植物生长分化的研究十分普遍, 其中NAA和6-BA两种生长调节剂对不同种植物诱导分化出根和芽的相关研究较多[1-9],但尚未见NAA和6-BA对模式植物烟草叶片的诱导结果。因此,经过设计不同浓度、不同比例的NAA和6-BA,找到最为符合诱导根、芽分化的浓度比。该实验使学生在掌握植物组织培养技术的同时还学习到有关植物细胞全能性和生长调节剂的相关知识。
植物细胞的全能性,即植物体的每个细胞携带着一套完整的基因组,并具有发育成完整植株的潜在能力。因为每个细胞都来自受精卵,所以带有与受精卵相同的遗传信息。细胞分化完成后,就受到所在环境的束缚,相对稳定,但一旦脱离原来所在的环境、成为离体状态时,在适宜的营养和外界条件下,就会表现出全能性,生长发育成完整的植株[10]。
植物组织培养是指在无菌条件下,分离并在培养基中培养离体植物组织(器官或细胞)[11]。当烟草叶片被剪成1 cm2大小的外植体后,叶片边缘创伤部位失去原有的叶的表皮、叶肉等组织结构。在2,4-D诱导的作用下,退回到没有分化的无组织的细胞团或愈伤组织,这个过程也叫脱分化;在不同比例的NAA和6-BA的诱导作用下,叶片边缘创伤部位还能分化出不定根或不定芽。
1 实验
1.1实验材料与仪器
实验材料:烟草Nicotiana tabacum。
实验仪器:超净工作台、高压灭菌锅、人工气候箱、电子天平、pH计、移液器、剪刀、枪形镊、烧杯、量筒、药勺、玻璃棒、平皿、组织培养瓶等。
实验试剂:10×MS、0.1 g/L NAA(α-萘乙酸)、0.1 g/L 2,4-D(2,4-二氯苯氧乙酸)、0.1 g/L 6-BA( 6-苄
氨基腺嘌呤)、蔗糖、琼脂、1mol/ L NaOH、1mol/L HCl。
1.2配制诱导培养基
(1) 10×MS(100 mL/L)采用Phytotechnology Laboratories公司的MS粉,配成10倍于工作浓度的基本培养液。方法:称取4.43 g的MS粉,溶于100 mL蒸馏水中,搅拌、混合均匀,4 ℃保存。
(2) 蔗糖(30 g/L)。蔗糖是碳源,同时起到维持渗透压的作用。
(3) 琼脂(0.8 g/L)琼脂粉是固化剂、支持物。
(4) 植物生长调节剂(以下简称调节剂)。将2,4-D、NAA、6-BA用少量的无水乙醇助溶后,加蒸馏水分别配制成浓度为0.1 g/L储液,以便学生量取。实验设计中包括1个对照组和3个处理组。
对照组(T0)为30 mL MS。
诱导生根组(T1)为30 mLMS+0.03 mL6-BA+0.15 mL NAA。
诱导生芽组(T2)为30 mLMS+0.15mL 6-BA+0.03 mL NAA。
诱导愈伤组(T3)为30MS+0.03 mL 2,4-D。
(5) pH调节。pH调节时用精密pH试纸测定,根据测定结果,向培养基中加入适量的1 mol/ L NaOH、1mol/L HCl ,以达到pH=5.8。
诱引培养基配制见表1。

表1 诱导培养基配制表(30 mL)
1.3消毒
诱导培养基、剪子、镊子、平皿需在高压灭菌锅120 ℃下灭菌15 min;无菌间和超净台紫外灯照射30 min。
1.4接种
坐在超净工作台前,用70%酒精棉球擦拭双手、培养瓶和超净台面。待手上的酒精干了,点燃酒精灯;旋松培养瓶的盖子,放到无菌风道侧面备用;将镊子、剪刀在酒精灯外焰上灼烧,冷却后剪取叶片约1 cm2,剪取时注意尽量避开主叶脉;剪好的叶片平铺在培养基上,注意叶片下表面与培养基接触,盖好瓶盖。
1.5培养
培养4周,25 ℃,光照16 h,暗8 h,湿度70%~80%。
2 实验结果
每周观察1次不同处理的培养瓶,记录外植体的生长变化,结果见表2和图1,剔出染菌培养瓶。
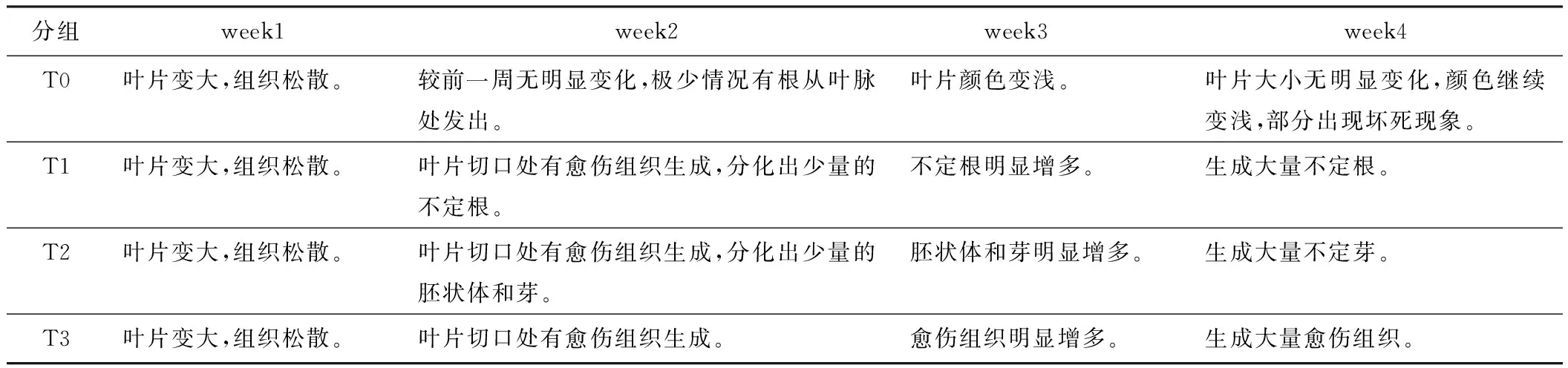
表2 烟草叶片诱导培养4周实验结果
(1) T0组为MS中未加调节剂的对照组。烟草叶片的变化表现为:叶片变大,这主要是离体叶片在光照和培养基的营养下进一步生长的原因;叶片颜色逐渐变浅,可能是叶绿素逐渐降解的过程;也有少数叶片在叶脉处生根,可能是由于叶片本身的内源生长素作用的结果;第4周出现部分组织坏死现象。
(2) T1组为MS中加入NAA(5 mg/L)和6-BA(1 mg/L),两者的浓度比为5∶1。NAA即α-萘乙酸,属于人工合成的生长素类调节剂,6-BA即6-苄基腺嘌呤,属于人工合成的细胞分裂素类调节剂。许多教科书和研究结果认为NAA与6-BA两者之间存在一种剂量效应。Skoog和Miller等人发现烟草愈伤组织根和芽的分化受培养基中生长素和细胞分裂素比例的控制。较高的生长素/激动素可以刺激生根,相反,较高的激动素/生长素可以刺激芽的发生[12]。本实验中,在诱导培养基上生长到1~2周时,烟草叶片创伤边缘的细胞开始发生退分化、生成少量的愈伤组织,随后逐渐分出不定根,并逐渐增多,培养到第4周已经非常明显看到大量的不定根。
(3) T2组为MS中加入NAA(1 mg/L)和6-BA(5 mg/L),两者的浓度比为1∶5。经过4周的诱导培养,烟草叶片边缘的细胞先退分化、生成少量愈伤组织,随后愈伤组织在调节剂的作用下诱导生成不定芽。

图1 植物生长调节剂诱导烟草叶片器官分化结果
(4) T3组是MS中加入2,4-D(1 mg/L)。2,4-D即2,4-二氯苯氧乙酸,也属于人工合成的生长素类调节剂。适合的浓度可以诱导烟草叶片退分化、生成愈伤组织,并控制愈伤组织增殖,但不发生再分化。
上述实验结果均符合相关理论,并且现象明显。
3 总结
(1) 本实验验证了如下理论:①植物细胞的全能性;②植物组织存在退分化与再分化过程;③激素或生长调节剂对植物的生长、分化起到非常重要的调节作用;④生长素与细胞分裂素两者之间存在剂量效应。
(2) 课堂上学生从诱导培养基的配制开始学习组织培养的基本流程,从中掌握培养基的必要组分。配制方法;设计实验对照组和实验组;培养基和其他用具的消毒灭菌;超净台的使用,规范无菌操作的基本步骤;实验材料的培养、观察、记录,进行结果分析。
(3) 实验中选用的烟草叶片为外植体,为无菌材料。以往使用带菌外植体,在操作中由于消毒不当会造成污染率且坏死率较高,成为实验成功的瓶颈,而使用无菌叶片可使实验成功率达到90%以上。
(4) 各种植物生长调节剂的实际用量非常小,对于体积为30 mL的诱导培养基来说不易称取,影响实验结果并浪费课堂时间,因此将试剂配成储液,提高了准确性,便于操作,节省时间。
(5) 在配制培养基的过程中,pH的调节非常重要,酸碱度的不适会影响植物的正常生长,甚至导致植物死亡,pH过低还会导致培养基不易凝固,接种操作困难。
References)
[1] 邹永梅, 黄雪方.“烟草组织培养”的技术探讨[J].江苏教育学院学报,2007,24(3):28-29.
[2] 纪丽丽,韩 雪,王海霞.6-BA、 NAA对大花、 重瓣型非洲紫罗兰组织培养的影响[J].中国园艺文摘,2012(9):17,40.
[3] 黄丽云,张奕琴. 6-BA 和 NAA 对槟榔幼胚离体培养的影响[J].热带生物学报,2011,2(3):256-259.
[4] 章鹏程,陈瑜,邓衍福. 6-BA与NAA不同浓度配比对大花蕙兰原球茎诱导的影响[J].杭州师范大学学报:自然科学版,2012,11(4):331-336.
[5] 康薇,郑进. NAA 和6-BA对野生参薯愈伤组织诱导和不定芽分化、 生根的影响[J].湖北农业科学,2013,52(19):4809-4811.
[6] 孙瑶,黄康康. 不同激素对树兰组织培养的影响[J].浙江农业科学,2012(3):342-343.
[7] 韩柱,徐灵,罗素梅. 细胞分裂素及生长素对微型月季侧芽在组培快繁的影响[J].景德镇高专学报,2012,27(6):38-39.
[8] 詹虹,康永利 ,李洁. 烟草叶片再生芽器官组织培养研究[J].宁夏农林科技,2012,53(12):81-83.
[9] 康实. 烟草组织培养的研究进展及应用前景[J].楚雄师专学报,1999,14(3):90-93.
[10] 潘瑞炽,董愚得.植物生理学[M].3版.北京:高等教育出版社,1995:247-251.
[11] 张志良,瞿伟菁,李小方.植物生理学实验指导[M].4版.北京:高等教育出版社,2003:200-202.
[12] 武维华.植物生理学[M].2版.北京:科学出版社,2003:304-305.
Basic teaching experiment by using plant growth regulators in nicotiana tabacum
Li Yuming, Wang Hongzhong, Xie Liping, Zhang Guiyou
(School of Life Sciences, Tsinghua University, Beijing 10084, China)
The growth and differentiation of sterile leaves could be induced by plant growth regulators. Callus was induced by 2, 4-D added in MS media. Adventitious roots were induced in MS media containing a mixture of NAA: 6-BA (5:1 concentration ratio). While the adventitious buds were induced when the concentration ratio of NAA: 6-BA was 1:5 in MS.
basic experiment; tissue culture; induction of differentiation; 2, 4-D; NAA; 6-BA
DOI:10.16791/j.cnki.sjg.2016.01.009
2015- 06- 18修改日期:2015- 08- 26
李玉明(1976—),女,黑龙江大庆,理学硕士,工程师,研究方向为植物生理学.
E-mail:ym-li@tsinghua.edu.cn
Q943.1;G642.423
B
1002-4956(2016)1- 0032- 03
