3-甲基腺嘌呤对喜树碱诱导的宫颈癌Hela细胞凋亡的影响①
2016-08-29王晓娜任来峰赵安江杨万霞任云青
王晓娜 任来峰 赵安江 杨万霞 任云青
(山西医科大学汾阳学院,汾阳032200)
3-甲基腺嘌呤对喜树碱诱导的宫颈癌Hela细胞凋亡的影响①
王晓娜任来峰赵安江杨万霞任云青
(山西医科大学汾阳学院,汾阳032200)
①本文为山西省自然科学基金(No.2014021037-9)、山西医科大学汾阳学院博士启动基金(No.1301)和山西医科大学汾阳学院科研项目基金(No.1422)资助的课题。
目的:本研究探讨自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)对喜树碱(Camptothecin,CPT)诱导的Hela细胞凋亡的影响。方法:用四甲基偶氮唑盐比色法(MTT方法)检测CPT对Hela细胞作用的最佳药物浓度和时间,以及不同药物对Hela细胞增殖活性的影响;用免疫印迹及免疫荧光检测不同药物作用于Hela细胞后,Hela细胞自噬标志蛋白微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)、p62及凋亡相关蛋白的变化;DAPI核染色观察细胞凋亡。结果:CPT作用于Hela细胞后,Hela细胞增殖活性明显下降,并且可诱导自噬现象的发生。CPT和3-MA联合作用较单独CPT作用Hela细胞的增殖活性降低,细胞自噬水平下降,凋亡率明显升高。结论:CPT在诱导Hela细胞凋亡的同时可诱导自噬,通过3-MA抑制自噬可增强Hela细胞对CPT作用的敏感性。
3-甲基腺嘌呤;喜树碱;自噬;凋亡;Hela细胞
宫颈癌是全世界发病率较高的恶性肿瘤之一,严重威胁女性的生命健康[1]。化疗在中晚期宫颈癌及复发转移宫颈癌患者治疗中发挥重要作用,然而肿瘤耐药已经成为化疗失败、肿瘤复发的主要原因[2]。因此,探讨如何抑制肿瘤细胞耐药性的发生或增强化疗药物的抗癌活性成为临床治疗肿瘤的重要课题。
近年来研究发现,多种化疗药物可引起肿瘤细胞的自噬反应,自噬在肿瘤化疗中可能发挥促凋亡或促生长作用,可能与肿瘤细胞耐药有关[3]。喜树碱(Camptothecin,CPT)是以拓扑异构酶Ⅰ为作用靶点的抗肿瘤药物,临床上已被用于卵巢癌、宫颈癌、结直肠癌、前列腺癌、胰腺癌、乳腺癌及脑瘤的治疗[4]。本实验以宫颈癌Hela细胞为细胞模型,通过将自噬抑制剂3-MA与CPT联合使用,观察抑制自噬对CPT诱导Hela细胞凋亡的影响,探讨自噬与CPT化疗作用间的关系,为宫颈癌治疗提供新的策略。
1 材料与方法
1.1实验材料人宫颈癌Hela细胞株和喜树碱(Sigma)由四川大学华西第二医院发育与干细胞研究所刘聪教授惠赠;高糖DMEM培养基购自Hyclone公司;胎牛血清购自Gibco公司;3-MA及氯喹(CQ)购自Selleck公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)及二甲基亚砜(DMSO)均购自北京索莱宝公司;抗α-tubulin 抗体、HRP标记的抗鼠和抗兔二抗、Cyc3标记的抗兔二抗均购于Sigma公司;抗LC3B、caspase-2抗体购自Cell Signaling Technology公司;抗p62及PARP抗体购自Abcam公司;细胞核染料DAPI购自Vector公司;ECL化学发光剂购自Millipore公司;细胞培养瓶及培养板购自Corning公司;酶标仪(Eon)购自BioTek公司;荧光显微镜(DM4000)购自Leica公司。
1.2方法
1.2.1细胞培养与传代宫颈癌Hela细胞接种于含10%胎牛血清、1%青链霉素混合液的高糖DMEM培养基,37℃、5%CO2进行培养,每隔2日更换新鲜细胞培养液,待细胞长至70%~80%汇合度时,用0.25%胰酶进行消化处理。
1.2.2MTT细胞增殖活性的检测收集对数期细胞,调整细胞浓度为6×104~7×104个/ml,接种于96孔板,每孔100 μl;待细胞完全贴壁后,加入作用药物,对照组加DMSO,每组设立5个复孔;放入培养箱继续培养8、32、56 h,终止培养前4 h加入10 μl MTT溶液(浓度为5.0 mg/ml);终止培养后,轻轻吸弃孔内培养基,每孔加入150 μl DMSO,低速振荡10 min,待结晶充分溶解,在570 nm测量各孔的吸光度值,计算各孔平均OD值,以对照组细胞活性为100%,计算各孔的细胞抑制率,细胞抑制率=(对照组OD值-实验组OD值)/对照组OD值×100%。检测不同浓度CPT对Hela细胞增殖活性的影响,CTP浓度分别设为0.5、1.0、2.0 μmol/L;为检测3-MA与CPT联合对Hela细胞增殖活性的影响,将细胞分为4组,分别为对照组(DMSO)、CPT组(1.0 μmol/L)、3-MA(1.0 mmol/L)、CPT(1.0 μmol/L)+3-MA(1.0 mmol/L)联合组。
1.2.3免疫荧光检测将对数期Hela细胞用胰酶消化离心,调整细胞浓度,将Hela细胞接种于小载玻片上,待细胞完全贴壁后,分别加入对应药物,培养16 h,弃去培养基,PBS洗涤一次,加入4%PFA固定10 min或冰甲醇-20℃固定15 min(用于LC3染色),PBS洗涤一次;加入0.3%TritonX-100通透10 min,PBS洗涤一次;免疫荧光封闭液(0.1%TritonX-100+1%BSA)室温封闭30 min;吸弃封闭液,加入抗LC3B、p62一抗,37℃、30 min,PBS洗涤3次;加入Cyc3标记的抗兔二抗(1∶200)37℃,湿暗盒30 min,PBS洗涤3次;DAPI进行封片,固定,荧光显微镜下观察拍照。
1.2.4免疫印迹分析取对数生长期的Hela细胞,消化离心,铺6孔板,细胞贴壁后,加入相应的药物,药物分组同荧光染色分组,作用36 h,收集细胞,加入(强)RIPA裂解液,在冰上裂解15~30 min后,4℃,12 000 r/min,离心10 min,取上清用BCA法进行蛋白浓度的测定,调整蛋白浓度,加入4×loading Buffer煮沸变性10 min得到蛋白样品。上样,用12%SDS-PAGE胶进行蛋白电泳,转移至NC膜上,用5%脱脂奶粉封闭2 h,加入抗LC3B、p62、PARP、caspase-2、α-tubulin,4℃过夜,TBST洗涤3次;加入HRP标记的抗兔二抗、抗鼠二抗,室温1 h,TBST洗涤3次,每次10 min,加入ECL底物发光,在暗室进行曝光,显影、定影,观察结果。
1.2.5细胞凋亡分析按1.2.3方法收集细胞,用DAPI染细胞核,在荧光显微镜下观察,参考文献[5]的方法计数正常细胞与凋亡细胞,计算细胞凋亡率。
2 结果
2.1CPT对宫颈癌Hela细胞的毒性作用CPT具有抑制Hela细胞的增殖活性。选用不同浓度CPT(0.5、1.0、2.0 μmol/L)分别作用Hela细胞12、36、60 h,倒置显微镜观察细胞形态见图1A,用MTT检测CPT对Hela细胞增殖活性影响。CPT对Hela细胞抑制率随药物浓度增加及时间延长,呈剂量和时间依赖性(图1B)。
2.2CPT诱导Hela细胞自噬的产生CPT作用于Hela细胞后,Hela细胞内LC3的荧光强度及LC3-Ⅱ蛋白表达水平升高(图2A、C);同时p62的荧光强度及p62蛋白表达水平降低(图2B、图4);氯喹(CQ)与CPT联合作用于Hela细胞较单独CPT或CQ作用,LC3的荧光强度及LC3-Ⅱ蛋白水平明显升高(图2A、C),以上结果表明CPT可诱导Hela细胞产生自噬。
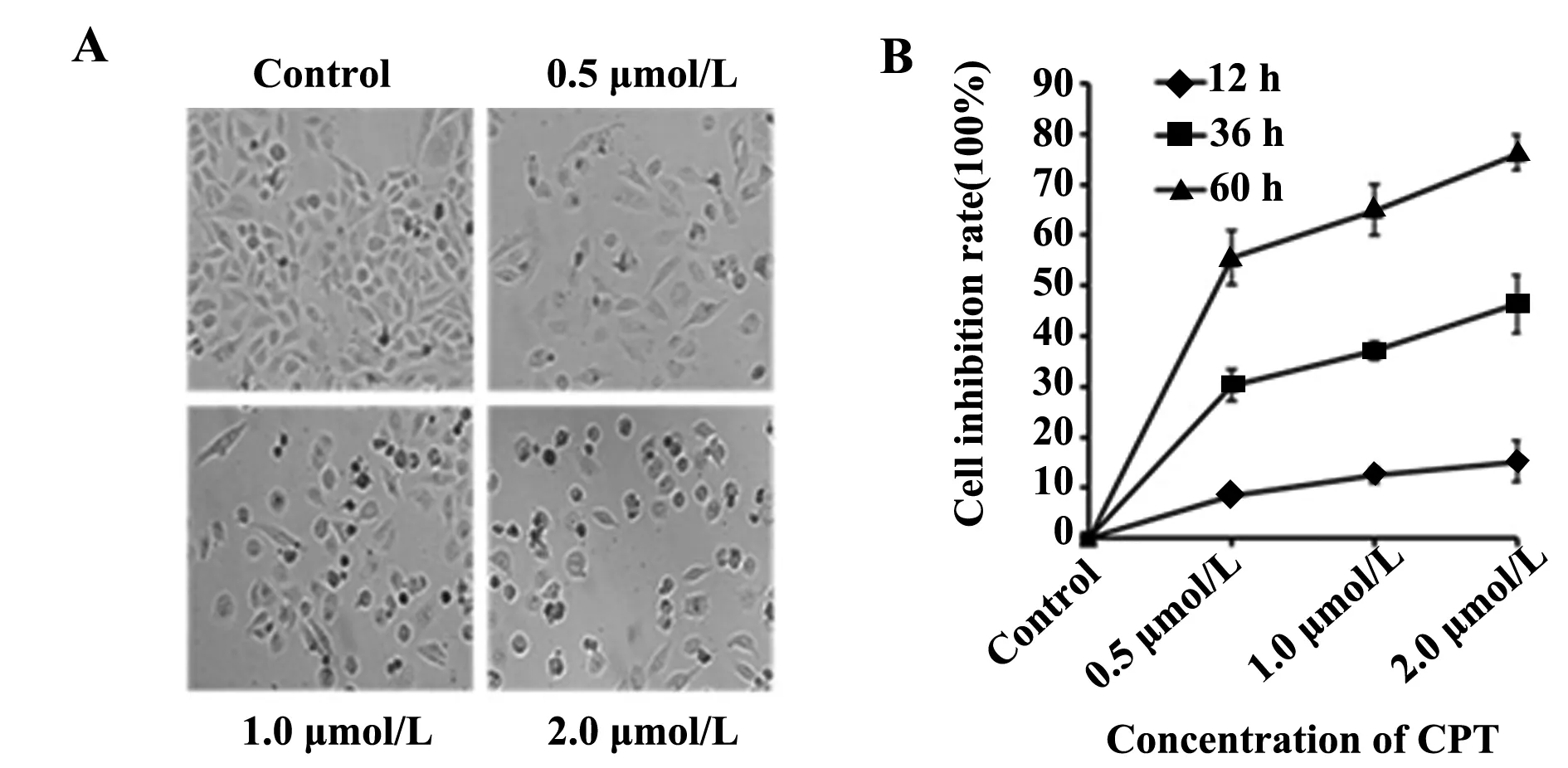
图1 CPT 对Hela 细胞增殖活性的影响Fig.1 Effect of CPT on Hela cell proliferation activityNote: A.Morphological changes of Hela cells after treated with different concentrations of CPT for 36 hours(×20);B.Cell inhibition rate of Hela cells after treated with CPT.
2.33-MA联合CPT明显抑制Hela细胞的增殖单独使用1 mmol/L 3-MA作用于Hela细胞,Hela细胞的增殖活性无显著变化(P>0.05);3-MA与CPT联合作用于Hela细胞较单独3-MA或CPT作用于Hela细胞(36 h,60 h),Hela细胞的增殖活性明显降低(P<0.05,图3A、B),以上提示3-MA抑制自噬可显著增强CPT对Hela细胞的毒性作用。
2.43-MA增强CPT诱导的Hela细胞凋亡不同药物作用于Hela细胞后,Hela细胞的凋亡率不同。单独使用3-MA或CPT作用于Hela细胞,细胞凋亡率为4.03%±0.70%、8.23%±2.00%,与对照组相比,无统计学差异(P>0.05)。3-MA与CPT联合作用Hela细胞(凋亡率为29.0%±5.10%)与单独使用CPT或3-MA比较,细胞凋亡率明显增高(图3C、D),提示3-MA增强CPT诱导的Hela细胞凋亡。
2.53-MA抑制自噬增强CPT诱导的Hela细胞凋亡蛋白表达CPT作用于Hela 细胞后,Hela 细胞内LC3Ⅱ蛋白水平增加,p62蛋白水平降低,提示CPT可诱导Hela细胞发生自噬,同前面结果一致。单独3-MA或3-MA与CPT联合作用于Hela 细胞与单独CPT作用相比,LC3Ⅱ蛋白水平降低,p62表达增加(图4),说明加入3-MA可抑制细胞自噬。
CPT作用于Hela细胞后,总caspase-2蛋白水平降低,cleavage-PARP水平升高,提示CPT作用Hela细胞后可诱导凋亡信号的活化。3-MA与CPT联合作用于Hela细胞较单独CPT作用,cleavage-PARP水平明显升高,总caspase-2水平降低(图4),结果提示3-MA抑制Hela细胞自噬可显著增强CPT诱导的Hela细胞凋亡蛋白的表达。

图2 CPT 诱导的Hela 细胞内LC3及p62的变化Fig.2 Changes of LC3 and p62 CPT-induced Hela cellsNote: A.Fluorescence images of LC3B expression in Hela cells(×40);B.Fluorescence images of p62 expression in Hela cells(×20);C.The expressions of LC3Ⅰand LC3Ⅱprotein in Hela cells.

图3 3-MA联合CPT对CPT诱导的细胞死亡的影响Fig.3 Effect of 3-MA in combination with CPT on CPT-induced cell deathNote: A.Morphological changes of Hela cells after treated with different drugs for 36 hours(×20);B.The proliferation activity of Hela cells treated with different drugs at different time points;C.Morphological changes of Hela cells with nuclear staining after treated with different drugs for 16 hours(×20);D.Hela cell apoptosis rates.

图4 不同药物作用的Hela细胞LC3、p62、PARP、caspase-2、α-tubulin蛋白表达Fig.4 Protein expressions of LC3,p62,PARP,caspase-2,and α-tubulin in Hela cells treated with different drugs
3 讨论
在世界范围内,宫颈癌是女性第4位常见的恶性肿瘤。约85%宫颈癌发生于发展中国家,并且在这些国家宫颈癌居癌症死因的首位[6]。化疗在宫颈癌高危病例和晚期复发转移患者的治疗中是必不可缺的重要手段,然而宫颈癌细胞对化疗药物产生的耐药性严重地影响了化疗药物的治疗效果[2]。因此,寻找逆转化疗耐药的新方法及靶向治疗将为宫颈癌化疗耐药的处理提供新的视角。喜树碱(CPT)是一种天然五环的喹啉生物碱,通过抑制DNA拓扑异构酶Ⅰ导致DNA双链在复制时断裂,从而引起细胞凋亡发挥其抗肿瘤作用。CPT及衍生物被用于多种肿瘤的治疗,包括卵巢癌、宫颈癌、结直肠癌、腺癌、前列腺癌、乳腺癌、脑瘤[4,14]。本实验以宫颈癌Hela细胞为细胞模型,用不同浓度CPT处理Hela细胞,MTT检测结果显示CPT对Hela细胞的毒性作用是时间和剂量依赖性的。
自噬是真核生物普遍存在的现象。在生理条件下,细胞的基础自噬活性能清除细胞内老化、受损的生物大分子和细胞器等,以维持正常的细胞生物学功能,抑制细胞发生癌变。但在饥饿、能量缺乏、放化疗等代谢应激状态下,肿瘤细胞自噬水平升高,通过自噬降解老化的、受损的生物大分子和细胞器等,能获得能量来源和重建的物质而有助于肿瘤细胞存活。自噬作为细胞对代谢应激压力(低氧、辐射、营养缺乏等)的适应性反应,可能与肿瘤耐药有关[7,8],因此,适当调节自噬,如抑制肿瘤细胞的保护性自噬,可为肿瘤治疗提供一种新的方案[9,10]。3-MA属特异磷酸肌醇3磷酸激酶(PI3K)抑制剂,在自噬过程的早期阶段通过抑制PI3K来阻断自噬,PI3K的活性对于自噬体形成是必需的[11]。通过加入自噬抑制剂、敲除自噬相关基因抑制自噬可增强肿瘤细胞对多种细胞毒性药物的敏感性。有研究报道3-MA可加强奥沙利铂对结直肠癌的疗效[12];在人鼻咽癌及食管癌中,3-MA抑制自噬可增强癌细胞的内质网应激,增加体内外药物及放疗的效果[11,13]。因此,可见自噬对肿瘤细胞的生长具有保护作用,抑制自噬可增强肿瘤细胞对化疗药物的敏感性。但也有与上述报道不一致的结果,如Hollomon等[14]研究发现,通过敲除自噬相关基因Atg5抑制自噬可减弱CPT诱导的骨肉瘤DLM8细胞的死亡作用;An[15]发现通过3-MA/敲除Beclin-1基因抑制自噬显著减弱Mimulone(白花泡桐叶成分)诱导的肺癌A549细胞的凋亡,这与在肺癌A549细胞中,通过抑制肿瘤细胞的自噬增强5-氟尿嘧啶诱导的肿瘤细胞死亡相反[16]。因此,肿瘤细胞的自噬作用对肿瘤细胞的凋亡是促进作用还是抑制作用,可能依肿瘤细胞系及使用药物不同而不同。本实验中当3-MA与CPT联合作用于Hela细胞后,Hela细胞的增殖活性明显下降和凋亡增加,说明3-MA抑制自噬可增强CPT诱导的Hela细胞凋亡。
本实验发现CPT在诱导Hela细胞凋亡的同时可诱导自噬现象的发生。哺乳动物细胞中微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)有三种,包括LC3A、LC3B和LC3C,它们在自噬过程存在相关的翻译修饰。LC3蛋白首先在合成后立即在羧基端被Atg4剪切,产生胞浆型LC3-Ⅰ;在自噬过程中,LC3-Ⅰ会被泛素样体系脂化,产生LC3-Ⅱ,并定位在自噬小体中,因此LC3-Ⅱ可作为反映自噬体形成的指标,但LC3-Ⅱ检测须同氯喹/E64d抑制“自噬潮”相结合。p62为自噬活化过程中的一个调节分子,与多泛素化蛋白相互作用促进其聚合并靶向于自噬体,在自噬溶酶体中降解[17,18]。本实验选用LC3B、p62作为评价自噬的指标,结果显示CPT作用于Hela细胞可诱导自噬体形成,Hela细胞内LC3荧光强度及LC3-Ⅱ表达水平升高,p62则降低;CQ与CPT联合作用于Hela细胞,Hela细胞内LC3荧光强度及LC3-Ⅱ蛋白表达显著升高。
采用Western blot分析了3-MA抑制自噬对CPT诱导的Hela细胞凋亡蛋白表达的影响。结果显示,加入3-MA可抑制Hela细胞自噬,LC3Ⅱ蛋白表达降低,p62表达增加;3-MA与CPT联合作用于Hela细胞可增强凋亡蛋白的表达,cleavage-PARP蛋白水平显著升高和总caspase-2蛋白的明显降低。
总之,CPT可以诱导宫颈癌Hela细胞发生自噬,且自噬影响CPT对Hela细胞的增殖活性。利用3-MA抑制自噬可显著增强CPT诱导的细胞凋亡。因此,3-MA联合CPT可为临床治疗宫颈癌提供一种新的策略。
[1]Granados LAJ,Lopez JA.Multistep model of cervical cancer:participation of miRNAs and coding genes[J].Int J Mol Sci,2014,15(9):15700-15733.
[2]刘红,张国楠.宫颈癌化疗耐药相关问题[J].中国实用妇科与产科杂志,2015,31(3):198-201.
[3]Sui X,Chen R,Wang Z,etal.Autophagy and chemotherapy resistance:a promising therapeutic target for cancer treatment[J].Cell Death Dis,2013,10(4):1-11.
[4]Venditto VJ,Simanek EE.Cancer therapies utilizing the camptothecins:a review of the in vivo literature[J].Mol Pharm,2010,7(2):307-349.
[5]任来峰,唐子执,吴惠文,等.HCV NS3/4A基因外来表达对Huh7细胞凋亡及DNA损伤应答的影响[J].中国细胞生物学学报,2014,36(8):1110-1115.
[6]周晖,卢淮武,彭永排,等.《2015年NCCN宫颈癌临床实践指南》解读[J].中国实用妇科与产科杂志,2015,31(3):185-191.
[7]Kung CP,Budina A, Balaburski G,etal.Autophagy in tumor suppression and cancer therapy[J].Crit Rev Eukaryot Gene Exp,2011, 21(1):71-100.
[8]White E,DiPaola RS.The double-edged sword of autophagy modulation in cancer[J].Clin Cancer Res,2009,15(17):5308-16.
[9]Li X,Xu HL,Liu YX,etal.Autophagy modulation as a target for anticancer drug discovery[J].Acta Pharmacol Sin,2013,34(5): 612-624.
[10]Rubinsztein DC,Codogno P,Levine B.Autophagy modulation as a potential therapeutic target for diverse diseases[J].Nat Rev Drug Discov,2012,11(9):709-730.
[11]Chen Y,Li X,Guo L,etal.Combining radiation with autophagy inhibition enhances suppression of tumor growth and angiogenesis in esophageal cancer[J].Mol Med Rep,2015,12(2):1645-1652.
[12]Tan S,Peng X,Peng W,etal.Enhancement of oxaliplatin-induced cell apoptosis and tumor suppression by 3-methyladenine in colon cancer[J].Oncol Lett,2015,9(5): 2056-2062.
[13]Song L,Liu H,Ma L,etal.Inhibition of autophagy by 3-MA enhances endoplasmic reticulum stress-induced apoptosis in human nasopharyngeal carcinoma cells[J].Oncol Lett,2013,6(4):1031-1038.
[14]Hollomon MG,Gordon N,Santiago-O′Farrill JM,etal.Knockdown of autophagy-related protein 5,ATG5,decreases oxidative stress and has an opposing effect on camptothecin-induced cytotoxicity in osteosarcoma cells[J].BMC Cancer,2013,13(1):1-27.
[15]An HK,Kim KS,Lee JW,etal.Mimulone-induced autophagy through p53-mediated AMPK/mTOR pathway increases caspase-mediated apoptotic cell death in A549 human lung cancer cells[J].PLoS One,2014,9(12):1-20.
[16]Pan X,Zhang X, Sun H,etal.Autophagy inhibition promotes 5-fluorouraci-induced apoptosis by stimulating ROS formation in human non-small cell lung cancer A549 cells[J].PLoS One,2013,8(2):1-9.
[17]Klionsky DJ,Abdalla FC, Abeliovich H,etal.Guidelines for the use and interpretation of assays for monitoring autophagy[J].Autophagy, 2012,8(4):445-544.
[18]Mizushima N,Yoshimori T,Levine B.Methods in mammalian autophagy research[J].Cell,2010,140(3):313-326.
[收稿2016-03-28修回2016-05-11]
(编辑倪鹏)
·启事·
本刊诚聘特约审稿人
《中国免疫学杂志》是中国免疫学会会刊,主要报道我国免疫学研究的各项国家科研课题,是全面反映中国免疫学整体水平的主流媒体。为了进一步加快审稿速度,缩短稿件刊用周期,特诚聘特约审稿人数名,组建审稿专家队伍,详情请登录本刊网站,Web site:www.immune99.com;www.中国免疫学.中国。
《中国免疫学杂志》编辑部
Effect of 3-MA on camptothecin-induced cervical cancer Hela cell apoptosis
WANG Xiao-Na,REN Lai-Feng,ZHAO An-Jiang,YANG Wan-Xia,REN Yun-Qing.Fenyang College of Shanxi Medical University,Fenyang 032200,China
Objective:To explore the effect of autophagy inhibitor 3-methyladenine(3-MA) on camptothecin(CPT)-induced Hela cell apoptosis.Methods: MTT assays were carried out to determine the optimal concentration and time of CPT on Hela cells and the effect of different drugs on Hela cell proliferation activity.After Hela cells were treated with different drugs,the changes of autophagy marker protein(microtubule-associated protein 1 light chain 3,LC3),p62 and apoptosis-related protein were detected using Western blot and immunofluorescence(IF).DAPI(nuclear) staining was used to observe cell apoptosis rate.Results: In CPC-treated Hela cells,Hela cell proliferation activity declined dramatically,and autophagy could be induced to occur.Compared with CPT group,the cell proliferation activity was lower in CPT combined with 3-MA group,the level of autophagy decreased,but the apoptosis rate significantly increased.Conclusion: CPT can induce autophagy while inducing Hela cell death.Hela cells chemosensitivity to CPT treatment can be enhanced by 3-MA inhibiting autophagy.
3-methyladenine;Camptothecin;Autophagy;Apoptosis;Hela cells
10.3969/j.issn.1000-484X.2016.08.009
R737.33文献标志码A
1000-484X(2016)08-1128-05
王晓娜(1990年-),女,在读硕士,主要从事宫颈癌治疗机制方面的研究,E-mail:18135845975@163.com。
及指导教师:任云青(1964年-),女,教授,硕士生导师,主要从事生殖免疫、肿瘤免疫方面研究,E-mail:15535875200@163.com。
