不同培养条件对三角褐指藻生长及其生物活性成分积累的影响
2016-08-23张文源高保燕李爱芬张成武
张文源,高保燕,李爱芬,张成武
(暨南大学 水生生物研究中心生态学系,广州 510632)
不同培养条件对三角褐指藻生长及其生物活性成分积累的影响
张文源,高保燕,李爱芬,张成武
(暨南大学 水生生物研究中心生态学系,广州 510632)
以三角褐指藻(Phaeodactylum tricornutum)为研究材料,比较了NaNO3、NH4HCO3和CO(NH2)2为氮源的两种培养基(mL1和ASW培养基)对其生长和生物活性成分(岩藻黄素、金藻昆布糖和二十碳五烯酸(C20:5,EPA))时相积累的影响,同时分析了脂肪酸组成和总脂含量的变化。结果表明:以mL1培养基培养时,三角褐指藻的生物质质量浓度明显高于ASW培养基培养时的生物质质量质量浓度,尿素优于其他两种氮源,最大生物质质量质量浓度为3.7 g/L。不同培养条件下岩藻黄素含量的时相变化规律一致,均随着培养时间的延长呈现先增加后减少的趋势,其最高积累量分别为:13.27 mg/g (NaNO3)、13.23 mg/g(CO(NH2)2)和 13.89 mg/g(NH4HCO3)(mL1);13.2 mg/g(NaNO3)、14.92 mg/g (CO(NH2)2)和13.6 mg/g(NH4HCO3)(ASW),由此可知氮源对岩藻黄素积累量影响不大。金藻昆布糖含量随着培养时间延长逐渐增加,其最大积累量分别为9.82 mg/g(NH4HCO3)(mL1)和8.59 mg/g(NaNO3)(ASW)。不同培养条件下其总脂含量变化不显著,均在培养末期达到最大值,分别为24.18%(NH4HCO3)(mL1)和23.79%(NaNO3)(ASW);其主要脂肪酸组成为:豆蔻酸(C14:0)、棕榈酸(C16:0)、棕榈油酸(C16:1)、硬脂酸(C18:0)、油酸(C18:1)、亚油酸(C18:2)、花生一烯酸(C20:1)、木焦油酸(C24:0)和EPA,其中,EPA含量随着培养时间延长逐渐下降,尿素最有利于EPA的积累。
三角褐指藻;生物质质量浓度;岩藻黄素;金藻昆布糖;二十碳五烯酸
doi:10.11759/hykx20150706002
近年来微藻培养受到越来越多的关注,一方面是因为微藻来源丰富,生长迅速;另一方面是由于微藻具有生产高价值代谢产物的潜能,且能通过改变培养条件以提高细胞内生物活性物质的含量。其中海洋微藻的利用较为成熟,在保健食品、药物、饲料、化妆品、生物农药、废水治理等方面具有较广泛的应用前景[1]。而海洋微藻中种群数量最大的是硅藻,其作为海洋生态系统的初级生产者,生物多样性高,生物量巨大,占海洋初级生产量的40%左右[2],是天然活性产物的潜在来源[3]。在海洋硅藻中,三角褐指藻的研究较为广泛,被认为是岩藻黄素、金藻昆布糖和二十碳五烯酸(EPA)等生物活性物质的潜在生产者。另外,三角褐指藻可利用天然海水进行培养,不会竞争淡水资源,与其他硅藻相比三角褐指藻对硅的需求量较低,使其更易成为商业化生产的原料[2]。
岩藻黄素属于类胡萝卜素中的叶黄素类,是一种偏极性类胡萝卜素,它可通过甲醇、乙醇及丙酮等有机溶剂提取,再经过硅胶柱层析的纯化方法获得,亦可通过CO2超临界萃取的方法获得。研究表明岩藻黄素具有抗炎、抗氧化、抗肿瘤、抗肥胖和抗糖尿病等多种生理活性[4]。目前已有不同类型的岩藻黄素营养保健品在市场中销售,而天然的岩藻黄素主要来源于褐藻和硅藻。由于三角褐指藻能适应弱光强生长,其细胞色素组成中岩藻黄素所占的比例较高,因此,它被认为是天然岩藻黄素的最佳来源。
金藻昆布糖是一类水溶性多糖,主要由葡萄糖通过β-1,3糖苷键主链和少量的β-1,6糖苷键支链连接而成的葡聚糖[5]。研究表明金藻昆布糖是硅藻细胞中主要的储存性碳水化合物,它能为细胞代谢循环提供能量,也能转变成其他有机化合物[6],比如氨基酸、葡萄糖等。Kusaikin等[7]发现尖针杆藻(Synetra acus)中的金藻昆布糖具有明显的抗肿瘤活性。Chan等[8]发现β-葡聚糖具有抗辐射、降血脂血糖等功效,常被称作生物活性调节剂。
EPA属于ω-3系列多不饱和脂肪酸,为人体必需脂肪酸。EPA已被证实具有多种生理功效,可预防冠状动脉心血管疾病;可降低甘油三酯的含量,从而预防高甘油三酯血症;可防止血小板凝集,降低血液中胆固醇含量,从而降低动脉硬化炎症和各种瘤症的风险[9]。EPA主要来源于鱼油,但从鱼油中获取高纯度高含量的EPA面临一些问题,因为其EPA含量明显低于10%,并混有其他多种脂肪酸[9]。而许多微藻富含EPA,其中三角褐指藻是EPA的一种潜在来源,并具有两种优势,一是三角褐指藻生长迅速,二是三角褐指藻细胞中二十二碳六烯酸(DHA)和花生四烯酸(AA)的含量相对较低,从而能大大增加EPA的回收率[10]。
因此,本文以海洋硅藻三角褐指藻为研究材料,比较以NaNO3、NH4HCO3和(NH2)2CO为氮源的两种培养基对三角褐指藻生长及其细胞中岩藻黄素、金藻昆布糖和多不饱和脂肪酸积累的影响,以期为探求三角褐指藻的最适生长条件和生物活性成分积累的最佳条件提供依据。
1 材料和方法
1.1 实验藻种与培养基
本实验所用的三角褐指藻藻株来源于中国科学研究院海洋研究所,于暨南大学水生生物研究中心微藻生物资源技术实验室保存。
1.2 培养条件与方法
对处于生长对数期的三角褐指藻进行接种培养。采用φ6 cm×60 cm的柱状光生物反应器进行通气培养,搅拌气体为含1%二氧化碳的压缩空气,通气速率为0.3 vvm,单侧连续光照,光照强度为4000~4500 lx,培养温度为25℃±1℃。初始接种密度控制在0.4~0.6。
以NaNO3、NH4HCO3和(NH2)2CO为氮源的mL1 和ASW的培养基进行培养,其中氮浓度设定为14.36 mmol/L,每种条件下设定3个平行,连续培养15天。每天从各管反应器中取10 mL藻液,用于生物量测定;每隔3天再取一定量的藻液,3500 r/min离心收集藻细胞,冷冻干燥后获得冻干藻粉,储存于-20℃的冰箱 中,用于各生化组分含量测定。
1.3 生物质质量浓度测定
采用重量法。混合纤维滤膜(上海市新亚净化器件厂,孔径0.45μm,尺寸50mm)于106℃电热恒温鼓风干燥箱(上海一恒科技有限公司)中干燥过夜至恒重M1,每天各管均匀取样10mL藻液进行抽滤,并用0.5 mol/L的甲酸铵进行洗涤,测定抽滤后藻粉与滤膜总恒重值M2,则计算藻每天生物质质量浓度为(g/L)=1000×(M2-M1)/10。
1.4 岩藻黄素含量测定
采用有机溶剂提取法。取各条件下第0、3、6、9、12和15天的冻干藻粉,精确称取10 mg,分别加入5 mL甲醇,于4℃黑暗条件下磁力搅拌提取12 h,3500 r/min离心5 min,取上清经0.45 μm微空有机滤膜过滤。过滤后所得色素提取物进行高效液相色谱分析,并与岩藻黄素标准曲线进行对照,计算出各时相岩藻黄素的含量。
1.5 金藻昆布糖含量测定
采用苯酚-硫酸法。称取50 mg冻干藻粉,加入50 mmol/L的稀硫酸5 mL于60℃水浴提取1h。提取物离心后收集上清,提取后的藻渣再用蒸馏水洗涤2次,合并上清定容于50 mL容量瓶中。从容量瓶中吸取1 mL样品,加入1 mL苯酚(6%)和5 mL浓硫酸充分摇匀,室温静置30 min后,于490 nm下测定吸光度值。结合葡萄糖的标准曲线,计算出金藻昆布糖含量。
1.6 脂肪酸组成分析
采用气相色谱-质谱法(GC-MS)测定。精确称取25 mg冻干藻粉,加入2 mL 2%的硫酸甲醇甲苯溶液(90︰10,v/v),同时加入十七烷酸作为内标,充氩气后,置于80℃恒温水浴锅中搅拌1.5 h。反应结束后再在上述原位转甲酯化样品溶液中加入1 mL蒸馏水和1 mL正己烷,3500 r/min离心3 min,吸取上清至小瓶中,吹干后再加入200 μL正己烷密封,留存上样,以测定脂肪酸组成及EPA的相对含量。
1.7 总脂含量的测定
总脂含量测定采用重量法。参考Khozi-Goldberg I等方法稍加修改。称取80~100mg冻干藻粉,加入2mL二甲基亚砜-甲醇(1︰9,v/v)混合溶液,于50℃恒温水浴中磁力搅拌1.5h,再在冰浴中磁力搅拌1.5 h,3000 r/min离心5 min,吸取上清至小玻璃瓶中。剩余藻渣再加入4 mL乙醚-正己烷溶液(1︰1,v/v),冰浴磁力搅拌1.5 h,3000 r/min离心5 min,转移上清至上述对应小玻璃瓶中。以上操作重复一遍。在装有上清液的小玻璃瓶中加入4 mL蒸馏水以静置分层过夜。吸取上层相于离心管中,3000 r/min离心5 min,取上清于洁净干燥小瓶中,吹干后用乙醚洗涤浓缩转移至预先称重的EP管中(管质量为m1),用氮气吹至恒质量(m2)。得总脂含量(占藻粉干质量百分比,%)为:(m2-m1)/藻粉质量。
1.8 数据处理
运用Excel软件进行平均值及标准差值的计算。运用origin 8.5软件进行绘图。
2 结果与分析
2.1 不同氮源的mL1和 ASW培养基对三角褐指藻生长的影响
为了测定不同氮源的mL1 and ASW培养基对三角褐指藻生长的影响,在同一种氮浓度(14.36 mmol/L)下,以生物质质量浓度为检测指标。得到的生长曲线如图1所示。由图1可知,在3种形式氮源的mL1培养基和ASW培养基中,三角褐指藻的生物质质量浓度均逐渐增加,且尿素态氮和铵态氮的增长速率明显优于硝态氮,最高生物质质量浓度均在第15天获得,且均以尿素态氮条件下生物质质量浓度最高。mL1培养基条件下最高生物质质量浓度为3.7 g/L,ASW培养基条件下最高生物质质量浓度为3.3 g/L。
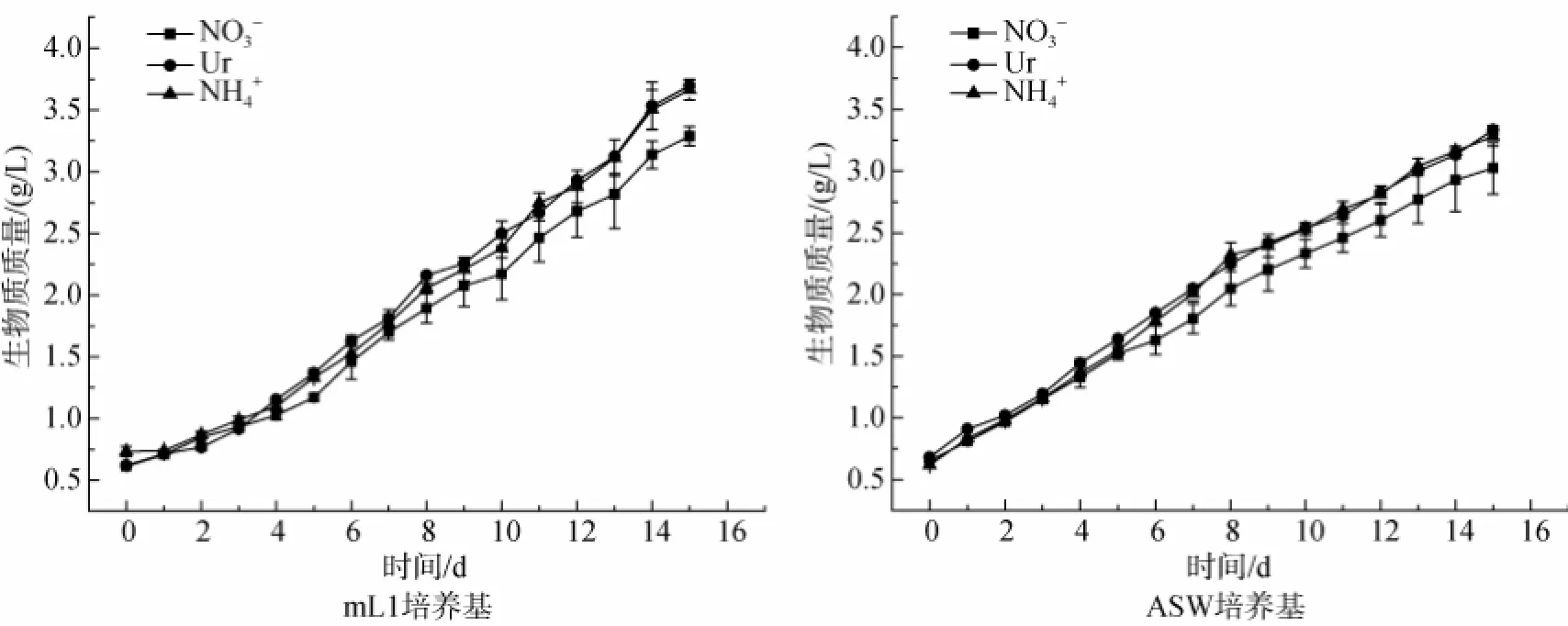
图1 不同氮源的mL1和ASW培养基培养三角褐指藻时生物质质量浓度的时相变化Fig.1 Time-course changes in the biomass concentration of Phaeodactylum trirornutum grown in mL1 or ASW media with different nitrogen sources
2.2 不同氮源的mL1和 ASW培养基对三角褐指藻总脂积累的影响
图2所示为三角褐指藻在不同氮源的mL1和ASW培养基培养时油脂积累的时相变化。由图可知,油脂积累量随着培养时间的延长呈现逐渐上升的趋势,第15天达到最大值。在整个培养周期内,油脂积累速率均比较平缓,mL1培养基培养时油脂积累量略高于ASW培养基培养时油脂积累量,其油脂最高积累量分别为24.18%(mL1)和23.79%(ASW)。同一种培养基不同氮源条件下油脂积累规律基本相同,最大积累量相差不显著。
2.3 不同氮源的mL1和ASW培养基对三角褐指藻岩藻黄素含量的影响
图3和图4分别显示了三角褐指藻在mL1和ASW培养基培养时主要色素组成及岩藻黄素的时相变化。由图可知,三角褐指藻中的主要色素组成有岩藻黄素、硅甲藻黄素、叶绿素a及β-胡萝卜素等,其中岩藻黄素含量最高。在mL1培养基中,岩藻黄素含量随着培养时间的延长呈现先增加后减少的趋势,在第12天达到最大积累量,分别为:13.27 mg/g(NaNO3)、13.23 mg/g(CO(NH2)2)、13.89 mg/g(NH4HCO3)。在ASW培养基中,岩藻黄素呈现出相同的积累规律,在第9天达到最大积累量,分别为:13.2 mg/g(NaNO3)、14.92 mg/g(CO(NH2)2)、13.6 mg/g(NH4HCO3)。由此可知,两种培养基对岩藻黄素的积累量影响不大,3种氮源中尿素氮源更有利于岩藻黄素的积累。

图2 不同氮源的mL1和ASW培养基培养三角褐指藻时总脂含量的时相变化Fig.2 Time-course changes in the total lipid content of Phaeodactylum trirornutum grown in mL1 or ASW media with different nitrogen sources

图3 不同氮源的mL1培养基培养三角褐指藻时岩藻黄素的时相变化Fig.3 Time-course changes in the pigment composition and fucoxanthin content of Phaeodactylum trirornutum grown in mL1 or ASA media with different nitrogen sources
2.4 不同氮源的mL1和 ASW培养基对三角褐指藻金藻昆布糖尿含量和单位体积产率的影响
金藻昆布糖是三角褐指藻中主要的储藏性碳水化合物。如图5所示,培养基类型对金藻昆布糖的积累有一定的影响,采用mL1培养基培养时金藻昆布糖的积累量更高,最高达到9.82%。3种氮源对金藻昆布糖的积累影响不显著,mL1培养基中金藻昆布糖积累量分别为 8.25 mg/g(NaNO3)、9.47 mg/g (CO(NH2)2)、9.82 mg/g(NH4HCO3),ASW培养基中金藻昆布糖的积累量分别为:8.59 mg/g(NaNO3)、8.13 mg/g (CO(NH2)2)、7.73 mg/g(NH4HCO3)。
图6比较了不同培养条件下金藻昆布糖的单位体积产率。在mL1培养基中,3种氮源的最高单位体积产率分别为:18.12 mg/(L·d),23.37 mg/(L·d)和23.97 mg/(L·d),在ASW培养基中,3种氮源的最高单位体积产率分别为17.3 mg/(L·d),18.06 mg/(L·d)和16.91 mg/(L·d)。

图4 不同氮源的ASW培养基培养三角褐指藻时岩藻黄素的时相变化Fig.4 Time-course changes in the pigment composition and fucoxanthin content of Phaeodactylum trirornutum grown in 1 mL or ASA media with different nitrogen sources

图5 不同氮源的mL1和ASW培养基培养三角褐指藻时金藻昆布糖含量的变化Fig.5 Time-course changes in the chrysolaminaran content of Phaeodactylum tricornutum grown in mL1 or ASW media with different nitrogen sources

图6 不同氮源的mL1和ASW培养基培养三角褐指藻时金藻昆布糖的单位体积产率Fig.6 Volumetric production of chrysolaminaran by Phaeodactylum tricornutum grown in mL1 or ASW media with different nitrogen sources
2.5 不同氮源的mL1和 ASW培养基对三角褐指藻脂肪酸组成的影响
图7所示为三角褐指藻在不同氮源的mL1和ASW培养基培养时脂肪酸的组成分析,由图可知,6种培养条件下,三角褐指藻的脂肪酸组成基本相同,主要有豆蔻酸(C14:0)、棕榈酸(C16:0)、棕榈油酸(C16:1)、硬脂酸(C18:0)、油酸(C18:1)、亚油酸(C18:2)、花生一烯酸(C20:1)、木焦油酸(C24:0)和二十碳五烯酸(C20:5),且从第3天到第15天,C16:1、C18:0、C24:0含量增加,C18:1、C20:5含量减少,其他脂肪酸含量变化不显著,表明这两种培养基及3种不同氮源对脂肪酸组成的影响不大。

图7 不同氮源的mL1和ASW培养基培养三角褐指藻的脂肪酸组成Fig.7 Fatty acid profiles of Phaeodactylum tricornutum on days 3 and 15 grown in mL1 or ASW media with different nitrogen sources
2.6 不同氮源的mL1和 ASW培养基对三角褐指藻二十碳五烯酸含量和单位体积产率的影响
图8所示为三角褐指藻在两种培养基3种不同氮源条件下培养时二十碳五烯酸(EPA)含量的变化。由图8可知,二十碳五烯酸含量随着培养时间延长而逐渐下降,以铵氮为氮源mL1培养基培养时二十碳五烯酸(EPA)含量下降的最为显著,由22.14%下降到14.58%。而以尿素为氮源时,二十碳五烯酸(EPA)含量由19.97%下降至17.45%,因而最有利于EPA的积累。EPA占总脂肪酸的最大比例为22.14%。ASW培养基条件下,二十碳五烯酸(EPA)含量由19.58%(NaNO3)、20.78%(CO(NH2)2)、20.77% (NH4HCO3)下 降 至 16.75%(NaNO3)、17.44% (CO(NH2)2)、17.71%(NH4HCO3),EPA占总脂肪酸的最大比例为20.78%。

图8 不同氮源的mL1和ASW培养基培养三角褐指藻时EPA含量的变化Fig.8 Time-course changes in the eicosapentaenoic acid(EPA)content of Phaeodactylum tricornutum grown in mL1 or ASW media with different nitrogen sources
3种氮源的mL1培养基培养三角褐指藻时,EPA的最大单位体积产率分别为:2.56 mg/(L·d)(NaNO3),2.31 mg/(L·d)(CO(NH2)2)和2.77 mg/(L·d)(NH4HCO3)。另外,3种氮源的ASW培养基培养三角褐指藻时,EPA的最大单位体积产率分别为:2.98 mg/(L·d)(NaNO3),3.09 mg/(L·d)(CO(NH2)2)和3.19 mg/(L·d)(NH4HCO3)。见图9。
综上所述,三角褐指藻分别在mL1和ASW培养基培养时,二十碳五烯酸(EPA)的含量变化规律基本相同,在以尿素为氮源时更有利于二十碳五烯酸(EPA)的积累。
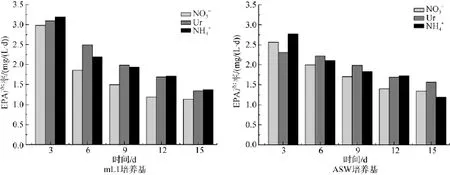
图9 不同氮源的mL1和ASW培养基培养三角褐指藻时EPA的单位体积产率Fig.9 Volumetric production of eicosapentaenoic acid(EPA)by Phaeodactylum tricornutum grown in mL1 or ASW media with different nitrogen sources
3 讨论
藻类的生长、油脂和色素的积累、多糖含量的变化及脂肪酸组成与含量均受各种环境因子和营养因子的影响,比如藻类的生长阶段[11]、培养基的组成[12]、光照和温度等,氮源类型对微藻的生长、油脂和色素的积累及多糖含量与脂肪酸组成也有着较为显著的影响[13]。三角褐指藻在不同培养条件下的生长状况已广泛研究,但均只比较其中的某一种活性物质(多为二十碳五烯酸)的差异变化。本实验比较了不同氮源、不同培养基对三角褐指藻的生长影响,并同时研究了其对岩藻黄素、金藻昆布糖和二十碳五烯酸3种活性物质含量变化的影响。
培养基提供了藻类生长所需的各种营养元素[14]。mL1培养基和ASW培养基均含有三角褐指藻生长所需的基本元素N、P、S、Si及Zn、Cu、Co、Mn等微量元素,但部分元素浓度存在差异。mL1培养基中,S的浓度是ASW培养基的10倍,NaCl的浓度相差不大,有研究报道NaCl浓度增加不会抑制三角褐指藻的生长,但会显著影响脂肪酸的组成,当培养基中NaCl浓度增加时,EPA含量也随之增加[15]。本实验的研究结果显示mL1培养基比ASW培养基更利于三角褐指藻的EPA积累。mL1培养基和ASW培养基均添加了硅藻生长所需的维生素,但Droop等[16]证实维生素对三角褐指藻中色素的积累没有特别的影响。色素的含量随着三角褐指藻的生长周期而发生变化[17]。mL1培养基和ASW培养基对岩藻黄素的积累量影响不大,且均随着培养时间的延长呈现先增加后减少的趋势,进一步印证前人的研究。
与mL1培养基相比,ASW培养基含有更少量的Si元素。但三角褐指藻在两种培养基中均能生长,表明Si元素对三角褐指藻的生长不是必需的,但添加适量的Si元素能更有利于其生长。Andreas等[18]认为三角褐指藻虽是硅藻,但对Si元素没有严格的需求,而Stigolsen等[19]发现Si元素对硅藻假微型海链藻影响较大,其能在淡水培养基生长,只要添加了Si元素。与mL1培养基相比,ASW培养基缺乏Se、Ni、Cr等微量金属元素,表明这些微量元素对三角褐指藻的生长也有一定作用。
氮是微藻生长所必需的基本元素之一,是构成藻体内蛋白质、核酸及色素的重要元素,对藻类的生长发育有着重要的作用[20]。大量研究表明,微藻能够利用多种不同形式的氮源供自身生长[21]。三角褐指藻能利用铵态氮、硝态氮、尿素态氮及其他无机氮源。Yongmanitchai等[15]研究NaNO3、CO(NH2)2和NH4Cl对三角褐指藻生长和脂肪酸组成的影响,得出以尿素为氮源进行培养时能得到最大生物量,且最利于二十碳五烯酸(EPA)的积累。Andreas等[18]以KNO3、CO(NH2)2和NH4Cl为氮源培养三角褐指藻,得出尿素最佳氮源。本实验以NaNO3、CO(NH2)2和NH4HCO3为3种不同氮源,得出尿素为最适合三角褐指藻生长的氮源,这与多数研究结果相符。通常,微藻能够利用氨氮进行生长,但随着NH4+被利用,培养液的pH逐渐下降,从而抑制了微藻的生长[22]。而硝氮被藻体吸收后,转变成NH4+,使培养液的pH增加,从而不利于微藻的生长。以尿素为氮源时,不会引起培养液pH的变动。另外从经济角度,尿素氮源成本低,且1摩尔尿素可提供2摩尔的N原子。
综上所述,(1)mL1培养基与ASW培养基相比,含有三角褐指藻培养所需的Si元素和Se、Ni、Cr、V等微量金属元素,含有更高浓度的S元素,因而更利于三角褐指藻的生长及金藻昆布糖、二十碳五烯酸(EPA)的积累,但对总脂、岩藻黄素的积累影响不显著。(2)尿素态氮与硝态氮、铵态氮相比,更利于三角褐指藻的生长、岩藻黄素和二十碳五烯酸的积累,因此尿素为最佳氮源。但氮源类型对金藻昆布糖的积累影响较小。
[1] 高亚辉.海洋微藻分类生态及生物活性物质研究[J].厦门大学学报:自然科学版,2001,40(2):566-573.
Gao Yahui.Studies on taxonomy,ecology and bioactive products of marine microalgae[J].Journal of Xiamen University:Natural Science,2001,40(2):566-573.
[2] Benavides A M S,Torzillo G,Kopecký J,et al.Productivity and biochemical composition of Phaeodactylum tricornutum (Bacillariophyceae)cultures grown outdoors in tubular photobioreactors and open ponds[J].Biomass and Bioenergy,2013,54:115-122.
[3] 周成旭,田甜,陈海敏,等.海洋微藻β-葡聚糖的生物活性分析[J].海洋与湖沼,2014,45(1):66-72.
Zhou Chengxu,Tian Tian,Chen Haimin,etal.Biatoactivities of β-glucan in six marine microalgae[J].Oceanologia et Limnologia Sinica,2014,45(1):66-72.
[4] Peng J,Yuan J P,Wu C F,et al.Fucoxanthin,a marine carotenoid present in brown seaweeds and diatoms:metabolism and bioactivities relevant to human health[J].Marine drugs,2011,9(10):1806-1828.
[5] Xia S,Wan L,Li A,et al.Effects of nutrients and light intensity on the growth and biochemical composition of a marine microalga Odontella aurita[J].Chinese Journal of Oceanology and Limnology,2013,31:1163-1173.
[6] Myklestad S M.Production,ChemicalStructure, Metabolism,and Biological Function of the(1→3)-Linked,β3-D-Glucans in Diatoms[J]. Biological oceanography,1989,6(3-4):313-326.
[7] Kusaikin M I,Ermakova S P,Shevchenko N M,et al.Structural characteristics and antitumor activity of a new chrysolaminaran from the diatom alga Synedra acus[J].Chemistry of natural compounds,2010,46(1):1-4.
[8] Chan G C,Chan W K,Sze D M.The effects of beta-glucan on human immune and cancer cells[J].J Hematol Oncol,2009,2(25):1-11.
[9] Giménez A G,González M J I,Medina A R,et al.Downstream processing and purification of eicosapentaenoic(20:5n-3)and arachidonic acids(20:4n-6)from the microalga Porphyridium cruentum[J].Bioseparation,1998,7(2):89-99.
[10]Yongmanitchai W,Ward O P.Screening of algae for potential alternative sources of eicosapentaenoic acid[J].Phytochemistry,1991,30(9):2963-2967.
[11]Huerlimann R,De N R,Heimann K.Growth,lipid content,productivity,and fatty acid composition of tropical microalgae for scale-up production[J].Biotechnology and bioengineering,2010,107(2):245-257.
[12]Valenzuela-Espinoza E,Millán-Núñez R,Núñez-Cebrero F.Protein,carbohydrate,lipid and chlorophyll a content in Isochrysis aff.galbana(clone T-Iso)cultured with a low costalternative to the f/2 medium[J].Aquacultural Engineering,2002,25(4):207-216.
[13]Huang C C,Hung J J,Peng S H,et al.Cultivation of a thermo-tolerant microalga in an outdoor photobioreactor:influences of CO2and nitrogen sourceson the accelerated growth[J].Bioresource technology,2012,112:228-233.
[14]Chisti Y.Biodiesel from microalgae[J].Biotechnology advances,2007,25(3):294-306.
[15]Yongmanitchai W,Ward O P.Growth of and omega-3 fatty acid production by Phaeodactylum tricornutum under differentculture conditions[J].Applied and environmental microbiology,1991,57(2):419-425.
[16]DroopM R.Optimum relativeandactualionic concentrations for growth of some euryhaline algae[J].Verh Int Verein Theor,Angew Limnol,1958,13:722-730.
[17]Carreto J I,Catoggio J A.Variations in pigment contents of the diatom Phaeodactylum tricornutum during growth[J].Marine biology,1976,36(2):105-112.
[18]Meiser A,Schmid-Staiger U,Trösch W.Optimization of eicosapentaenoic acid production byPhaeodactylum tricornutumin the flat panel airlift(FPA)reactor[J].Journal of applied phycology,2004,16(3):215-225.
[19]Olsen S,Paasche E.Variable kinetics of silicon-limited growth in Thalassiosira pseudonana(Bacillariophyceae)in response to changed chemical composition of the growth medium[J].British phycological journal,1986,21(2):183-190.
[20]胡章喜,安时,段舜山,等.不同氮原对布朗葡萄藻生长、总脂和总烃含量的影响[J].生态学报,2009,29(6):3288-3294.
Hu Zhangxi,An Min,Duan Shunshan,et al.Effects of nitrogen sources on the growth,contents of total lipids and total hydrocarbons of Botryococcus braunii[J].Acta Ecologica Sinica,2009,29(6):3288-3294.
[21]Liang Y,Beardall J,Heraud P.Effects of nitrogen source and UV radiation on the growth,chlorophyll fluorescence and fatty acid composition of Phaeodactylum tricornutum and Chaetoceros muelleri (Bacillariophyceae)[J].Journal of Photochemistry and Photobiology B:Biology,2006,82(3):161-172.
[22]蒋汉明,高坤山.氮源及其浓度对三角褐指藻生长和脂肪酸组成的影响[J].水生生物学报,2004,28(5):545-551.
Jiang Hanming,Gao Kunshan.Effects of nitrogen sources and concentrations on the growth and fatty acid composition of Phaeodactylum tricornutum[J].Acta Hydrobiologica Sinica,2004,28(5):545-551.
(本文编辑:梁德海)
Effects ofdifferentculture conditions on growth and accumulation ofbioactivecompoundsby Phaeodactylum tricornutum
ZHANG Wen-yuan,GAO Bao-yan,LI Ai-fen,ZHANG Cheng-wu
(Department of Ecology&Research Center for Hydrobiology,Jinan University,Guangzhou 510632,China)
Nov.26,2015
Phaeodactylum tricornutum;biomass concentration;fucoxanthin;chrysolaminaran;eicosapentaenoic acid
In this study,the effects of mL1 and ASW media containing NaNO3,CO(NH2)2,or NH4HCO3on the growth and accumulation of bioactive compounds[fucoxanthin,chrysolaminaran,and eicosapentaenoic acid(EPA)]by the marine diatom Phaeodactylum tricornutum were investigated;and the total lipid content and fatty acid composition were analyzed.The results showed that maximum biomass concentration in mL1 medium with urea as the nitrogen source was 3.7 g/L.Fucoxanthin content initially increased and then decreased during culture under different conditions,and the highest quantities that accumulated were 13.27 mg/g(NaNO3),13.23 mg/g(CO(NH2)2),and 13.89 mg/g(NH4HCO3)in mL1 medium and 13.2 mg/g(NaNO3),14.92 mg/g(CO(NH2)2),and 13.6 mg/g (NH4HCO3)in ASW medium,indicating that the nitrogen source had a weak effect on fucoxanthin accumulation.Chrysolaminaran content increased gradually during the culture period,and the highest contents were 9.82 mg/g (NH4HCO3)in mL1 and 8.59 mg/g(NaNO3)in ASW on day 15.The total lipid content changed slightly under the different conditions,and the maximum values were 24.18%(NH4HCO3)in mL1 and 23.79%(NaNO3)in ASW,which were observed during the stationary phase.The fatty acid profiles were myristic acid(C14:0),palmitic acid (C16:0),palmitoleic acid(C16:1),stearic acid(C18:0),oleic acid(C18:1),linoleic acid(C18:2),eicosaenoic acid(C20:1),tetracosanoic acid(C24:0),and EPA(C20:5).The EPA content decreased gradually as culture time was extended.Urea was the optimal nitrogen source to accumulate EPA.
Q4.3
A
1000-3096(2016)05-0057-09
2015-11-26;
2016-02-06
国家“863”项目(2013AA065805);国家自然科学基金项目(31170337);广东省低碳专项(2011-051);珠海市科技重大项目(PB20041018);珠海市科技攻关项目(PC20081008)
[Foundation:NationalHigh Technology Research andDevelopment Program ofChina (863Program),No.2013AA065805;NaturalScience Foundation of China,No.31170337;the Special Program for Low-Carbon,Reform and Development Commission of Guangdong Province,NO.2011-051;Scientific and Technological Key Program of Zhuhai,No.PB20041018;Scientific and TechnologicalProjectZhuhai,No.PC20081008]
张文源(1990-),女,湖南邵阳人,硕士研究生,主要从事海洋微藻生物活性物质的研究,E-mail:13397085106@163.com;张成武,通信作者,男,教授,博士生导师,主要从事微藻生物资源技术方面的研究,E-mail:tzhangcw@jnu.edu.cn
