刺参4个不同选育品系幼参对低盐胁迫的耐受及生理生化响应
2016-08-23侯西坦廖梅杰王印庚陈贵平荣小军孙金生范瑞用
侯西坦,廖梅杰,李 彬,王印庚,张 正,陈贵平,荣小军,孙金生,范瑞用
(1.天津师范大学 生命科学学院,天津 300387;2.中国水产科学研究院 黄海水产研究所,青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266071;3.青岛瑞滋海珍品发展有限公司,山东 青岛 266408)
刺参4个不同选育品系幼参对低盐胁迫的耐受及生理生化响应
侯西坦1,2,廖梅杰2,李 彬2,王印庚2,张 正2,陈贵平2,荣小军2,孙金生1,范瑞用3
(1.天津师范大学 生命科学学院,天津 300387;2.中国水产科学研究院 黄海水产研究所,青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266071;3.青岛瑞滋海珍品发展有限公司,山东 青岛 266408)
由于黄河口区域盐度偏低且不稳定,刺参(Apostichopus japonicus)的生长和存活受到严重威胁。为评估4个不同品系(日本刺参F2代RC-F2、抗病刺参F3代KC-F3、多刺刺参F2代DC-F2、青青刺参F1代QQ-F1)的低盐耐受力及其生理生化响应,本实验以青岛野生群体(QW)为对照,通过测定低盐胁迫下幼参的生长、存活以及非特异性免疫酶活力变化,评价了4个刺参不同选育品系对低盐的耐受状况。结果表明,在盐度17以下,除了QQ-F1表现为正生长,其他群体均为负生长。RC-F2、KC-F3、DC-F2、QQ-F1和QW的30天半致死盐度(LS50-30d)分别为15.02、15.19、16.48、14.26和15.13,QQ-F1显著低于其他4个群体;盐度14时,5个群体的半致死时间(ST50)分别为19.84 d、18.43 d、10.11 d、23.54 d 和19.01 d,QQ-F1的ST50显著长于其他4个群体。在低盐胁迫时QQ-F1的ACP、AKP、SOD、LZM酶指标的下降幅度显著低于其他4个群体。不同选育群体的低盐耐受力排序为QQ-F1>RC-F2>QW>KC-F3>DC-F2,QQ-F1群体表现出良好的低盐耐受能力,在低盐度海域或盐度不稳定的海域具有良好的推广应用前景。本实验研究结果可为刺参健康养殖、良种性状评价、选育与推广等方面提供参考依据。
刺参(Apostichopus japonicus);低盐胁迫;特定生长率;半致死盐度;半致死时间;非特异性免疫酶
doi:10.11759/hykx 20151030001
刺参,又名仿刺参(Apostichopus japonicus),隶属 于 棘 皮 动 物 门 (Echinodermata)、 海 参 纲(Holothuroidea)、楯手目(Aspidochirota)、刺参科(Stichopodidae)、仿刺参属(Apostichopus)[1],因其具有很高的营养价值和药用价值而位列“海产八珍”之首。自20世纪80年代刺参苗种繁育技术突破以后,刺参增养殖产业迅猛发展,形成了一个以山东、辽宁、河北沿海为主产区、并以“北参南养”、“东参西养”等模式延伸到闽、浙沿海和黄河口地区的刺参增养殖产业群[2],已形成年产量19.37万t、养殖面积达21万ha,产值愈200亿元的刺参增养殖产业[3]。然而,随着产业规模的急剧扩大,养殖刺参出现了生长缓慢、抗逆能力下降等种质退化现象,亟需开展具有生长、抗病、耐低盐等优良性状良种的选育工作。
盐度不仅是海水最重要的理化特性,也是影响刺参生长发育的重要因素之一,许多海洋生物的呼吸排泄、能量收支都与海水盐度有着密切的联系[4-6]。一般情况下,刺参对盐度的耐受范围是22~36[7];其最适盐度为28~34[8]。由于缺少渗透压调节器官, 棘皮动物被认为是狭盐性动物[1,9-10]。然而,最近的研究表明,许多动物可以通过调节体腔液的体积以及细胞内的渗透压平衡能够适应很宽的盐度范围[11-13]。赵斌等[14]对比低盐胁迫下3种不同规格刺参生长的差异,发现盐度20时,3种规格刺参特定生长率均为负值,刺参表现为负增长。胡炜等[15]发现当盐度降至22时体质量增长变缓,趋于停滞,但仍能维持正常的生理活动,个体死亡率为15%~20%。吕伟志等[16]认为刺参能够在盐度16的海水下生存30 d;雨季来临时,只要海水盐度不低于16,时间不超过一个月的池塘均可养殖海参。肖培华等[17]采用盐度骤降的模式,研究发现体质量在5 g以上的刺参,96 h内所能够承受的最低盐度为18。综上所述,本实验选取盐度18作为刺参低盐胁迫的起始盐度。盐度的变化模式一般分为盐度缓降和盐度骤降两种。胡炜等[15]采用逐步降低盐度(Salinity decreased gradually,DG)和盐度骤降(Salinity decreased sharply,DS)两种模式进行盐度胁迫实验,结果发现盐度22和盐度18的DG和DS实验组刺参在成活率方面均出现显著性差异(P<0.05),盐度18时DS组刺参成活率最低,仅为45.67%。Hu等[18]通过对比盐度骤降和盐度缓降两种模式,发现采用盐度骤降模式,导致刺参仅能适应很窄的盐度范围,然而采用盐度缓降的模式,刺参可以适应更广的盐度范围。鉴于盐度骤降会导致刺参产生强烈的应激反应致使我们无法区分刺参苗种死亡是盐度本身还是降低盐度的过程引发的,因此本实验采用梯度降盐(盐度缓降)这一模式进行低盐胁迫实验,以期更客观地反映不同选育群体的刺参低盐耐受极限。
自2005年起,中国水产科学研究院黄海水产研究所围绕刺参开展良种选育相关研究,引入日本及中国沿海10余个不同地理种群优质刺参资源,构建了刺参亲本库,以刺型、耐高温、抗灿烂弧菌等为目标开展优良苗种培育,目前已培育出日本刺参F2代、抗病刺参F3代、多刺刺参F2代和青青刺参F1 代4个不同刺参群体。其中抗病刺参是以抗灿烂弧菌为选育目标选育而来,而灿烂弧菌是刺参“腐皮综合征”的主要致病菌,可以导致刺参大批量化皮死亡,使刺参养殖业蒙受重大损失[19-21]。多刺刺参主要特征为刺列数为6排,刺总数≥45个。青青刺参主要特征为表皮呈青绿色,棘刺粗大且呈桔黄色。随着刺参育种工作的不断推进,对选育进程中不同世代的性状进行评定是良种选育的重要研究内容。随着海参产业规模的扩大,黄河口也形成了较大规模的养殖产业带;然而,这一地区海域存在河口排洪强度大、盐度低等特点,低盐度给海参健康养殖造成了巨大威胁和经济损失。因此,耐低盐刺参的培育对保障这些海域进行刺参健康养殖具有重要的现实意义。本文以未经选育的野生刺参苗种为对照,测定低盐胁迫条件下不同刺参品系生长、存活和非特异性免疫酶活力的差异,对不同选育品系对低盐耐受力进行评价,以期为刺参健康养殖、良种性状评价、选育与推广等方面提供参考数据。
1 材料与方法
1.1 实验材料
实验选用4个刺参不同选育品系,选育背景分别为:日本刺参F2代(RC-F2)是从日本引入的野生刺参群体自交获得的F2代群体;抗病刺参F3代(KC-F3)是以抗灿烂弧菌侵染为选育目标,以日本青刺参、烟台野生刺参和青岛野生刺参3个基础群体,经抗逆驯化后存活的个体为亲本培育的F3代;多刺刺参F2代(DC-F2)是以棘刺数量为选育目标,从青岛野生刺参中选取棘刺总数≥45的个体为亲本所培育的F2代苗种;青青刺参F1代(QQ-F1)是以青岛野生刺参中选取表皮青绿色、棘刺桔黄色的个体为亲本所培育的F1代;以未经选育的青岛野生刺参(QW)苗种为对照组,详见表1。实验所用刺参均取自青岛瑞滋海珍品发展有限公司,5个群体平均体质量分别为5.08 g±0.74g(RC-F2)、5.22 g±0.58g(KC-F3)、5.07 g± 0.53g(DC-F2)、5.14 g±0.65g(QQ-F1)和4.93 g±0.51g(QW),参龄均为6个月。

表1 本实验所用刺参不同品系的亲本来源和性状Tab.1 Source and characteristics of the parents of the 5 different A.japonicus populations used in this study
1.2 实验方法
1.2.1 刺参苗种的暂养
取4个刺参不同选育品系和野生刺参苗种各700头在水族实验车间暂养7d,暂养条件为水温18.05℃± 0.13℃,盐度31.43±0.1,溶氧7.08 mg/L±0.04 mg/L,pH 8.08±0.05。暂养所用容器为400 L的白色塑料水槽(100 cm×60 cm×60 cm)。暂养期间每天按时投喂、换水和吸底清污。
1.2.2 实验分组
低盐胁迫共分6个盐度组,盐度设置分别为:13、14、15、16、17、18,以自然海水盐度组(31.00±0.53)作为对照组,每组设3个平行,每个平行水槽中放养30头刺参,低盐胁迫所用养殖水槽为容积为40 L的白色塑料水槽(45 cm×30 cm×30 cm)。
1.2.3 实验操作与管理
实验期间水源为砂滤的自然海水,海水盐度为31.00±0.53,实验所用不同盐度海水为砂滤后的海水中添加自来水调配,盐度用YSI 550水质测量仪测定。
实验时间为2014年9月8日至2014年11月1日,实验周期为54 d。实验期间水温16.53℃±1.41℃,溶氧7.01 mg/L±0.18 mg/L,pH 8.14±0.11。本实验采用梯度降低盐度的方法:盐度为31~21,每天降低1个盐度;盐度为20~13,每2 d降低1个盐度,两个过程共24 d,整个驯化期间均无刺参死亡。以盐度降至相应低盐胁迫盐度时为相应胁迫试验起始点,对试验用刺参分组并称重记为试验初始体质量,低盐胁迫试验周期为30 d。
实验期间正常投喂,每日投喂1次,每天采用虹吸的方法吸底清污并且换水,日换水量为总水量的1/3左右。每天观察刺参吐肠、化皮头数和刺参苗种的生理状态,并记录养殖用水的盐度、温度、溶氧和pH等水质指标。
1.3 低盐胁迫下各品系刺参特定生长率的测定
胁迫期间每15 d称一次体质量,刺参体质量测量方法参考王印庚等[22]。鉴于盐度13组5个群体刺参在30 d内出现大规模死亡,仅QQ-F1有少量存活,本实验采用15 d时刺参苗种的平均体质量为评价指标。利用特定生长率 RSG(Specific Growth Rate)衡量刺参生长情况,特定生长率的计算公式为:
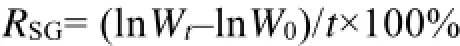
式中,Wt为最终体质量,W0为初始体质量,t为养殖天数。
1.4 低盐胁迫下各品系刺参存活率的测定
鉴于刺参死亡标准尚未统一,且死亡个体在养殖水体中对养殖水体污染过重,本实验以吐肠率和化皮率为判定依据,对刺参死亡的定义为:在实验条件下,出现吐肠或化皮,且失去正常吸附能力的个体,视为刺参死亡个体。在饲养期间每天观察和记录刺参吐肠和化皮头数,并及时将其捞出。各刺参群体存活率从进入相应低盐胁迫第1天开始统计。为衡量刺参对低盐的耐受限度,本实验选取3个耐盐评价指标,即 30 d半致死盐度(Median lethal salinity-30d,LS50-30d)、低盐度下的开始死亡时间(Time of beginning death,TBD)和半致死时间(Median survival time,ST50)[23-25]。本实验采用线性回归法求得LS50-30d、TBD和ST50[26],公式为:Y=+b(X-),公式中因变量Y为盐度或时间,变量X为死亡率,为实验组盐度或时间的平均值,为实验组死亡率的平均值,b为系数,
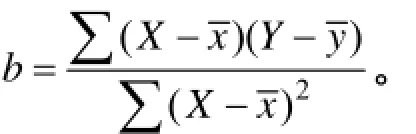
1.5 低盐胁迫下各品系刺参非特异性免疫酶活的测定
为判断低盐胁迫下刺参免疫活力的变化,实验选取刺参体腔液碱性磷酸酶(Alkaline phosphatase,AKP)、酸性磷酸酶(Acid phosphatase,ACP)、超氧化物歧化酶(Superoxide dismutase,SOD)和溶菌酶(Lysozyme,LZM)为刺参非特异性免疫酶指标。样品采集时间为上述低盐胁迫试验中进入低盐胁迫第2天抽取刺参苗种的体腔液。同时为了更客观地反映盐度下降过程中免疫酶指标的变化,增加了盐度为31、27、24、21时各群体样本,样品采集时间为驯化阶段进入相应盐度第2天降低盐度之前。体腔液抽取方法为:沿刺参腹部剪开,抽取体腔液,然后4℃,4 000 r/min离心10 min,取上清液用于非特异性免疫酶活测定。各酶活力的测定均使用南京建成生物工程研究所的试剂盒,测定方法及酶活计算公式参照试剂盒说明书。
1.6 数据统计与分析
实验数据用Excel 2010进行绘图分析,用SPSS 17.0软件进行单因子方差分析,设显著水平为P<0.05,极显著水平为P<0.01,结果用平均值±标准差(Mean±SD)表示。
2 结果
2.1 低盐胁迫对刺参不同选育品系存活的影响
低盐胁迫下对刺参不同选育品系存活的影响如图1所示。按照试验结束时各群体的存活率作为衡量指标,在低盐胁迫时,盐度越低各群体的存活率也逐步下降,但不同选育品系在各盐度低盐胁迫时存活率的变化趋势存在较显著的差异。在盐度17以上时,不同群体的存活率无显著差异(P>0.05),盐度降至16时,DC-F2出现急性死亡,存活率大幅下降至32.22%,显著低于其他4个群体;在盐度降至15时,除QQ-F1外,其他3个群体也开始出现大批死亡,到实验结束时,QQ-F1的存活率为64.45%,显著高于其他4个群体(P<0.01);在盐度降低至13时,除QQ-F1仍有少量存活外(存活率为5.56%),其他4个群体均全部死亡,死亡率达到100%。

图1 低盐胁迫对刺参不同选育品系存活的影响(平均值±标准差,n=3)Fig.1 Effects of low salinity on the survival rate of the five strains ofA.japonicus(Mean±SD,n=3)图中不同字母代表此盐度下不同品系之间有显著性差异(P<0.05),下同Different letters at the figure represent a significant difference between the strains at that salinity(P<0.05),the same as follows
根据不同低盐浓度胁迫下各群体刺参苗种死亡情况,采用线性回归法计算出各盐度梯度下不同群体开始死亡时间(TBD)和ST50见表2。在盐度16时DC-F2第5.71天开始出现死亡,在17.48 d死亡达到半数,而其他4个群体始终超过半数存活;盐度15时,仅有QQ-F1始终超过半数存活,RC-F2、KC-F3和QW分别在9.15 d、7.43 d和8.86 d开始死亡,ST50分别为26.74 d、23.41 d和25.58 d,并且显著长于DC-F2(P<0.01);在盐度14时,QQ-F1在第10.36 d开始出现死亡,第23.54天时死亡达到半数,显著长于其他4个群体(P<0.05)。盐度13时,5个群体刺参开始死亡时间均小于10 d。

表2 刺参不同选育品系在各低盐胁迫下的开始死亡时间及半致死时间(平均值±标准差,n=3)Tab.2 The TBD and ST50of the five populations of A.japonicus at different salinity conditions(Mean±SD,n=3)
采用线性回归法计算出各群体刺参LS50-30d如图2所示,DC-F2的LS50-30d为16.48,显著高于其他4个群体(P<0.01);QQ-F1的LS50-30d为14.26,显著低于其他4个群体(P<0.05)。RC-F2、KC-F3和QW 的LS50-30d分别为15.02、15.19和15.13,相互之间差异不显著(P>0.05)。由此可见,所选育的4个群体中QQ-F1具有最高的低盐耐受性。

图2 刺参不同选育品系30天半性致死盐度(LS50-30d)(平均值±标准差,n=3)Fig.2 The median lethal salinity-30d(LS50-30d)for the five strains ofA.japonicus(Mean±SD,n=3)
2.2 低盐胁迫对刺参不同选育品系特定生长率的影响
低盐胁迫对5个不同刺参群体特定生长率的影响如图3所示。在盐度31时,各刺参群体特定生长率均维持在较高水平,并且无显著性差异(P>0.05)。在受到低盐胁迫时,5个刺参群体的特定生长率随着盐度的下降而显著下降。当盐度降低到18时各群体的特定生长率均显著降低,仅有QQ-F1和QW表现为正生长(RSG>0),其他3个刺参群体均出现负生长(RSG<0);而当盐度降至17时,仅有QQ-F1依然保持正生长状态(RSG>0),当盐度低于16时,所有刺参群体均表现出负生长。从各群体在不同低盐胁迫时RSG显著性变化的盐度节点可以看出,RC-F2、KC-F3、DC-F2、QQ-F1和QW苗种分别在盐度14、15、16、13、14时较相邻上一盐度出现显著差异(P<0.05)。

图3 低盐胁迫对刺参不同选育品系特定生长率的影响(平均值±标准差,n=3)Fig.3 Effects of low salinity on the specific growth rate of the five strains ofA.japonicus(Mean±SD,n=3)
2.3 低盐胁迫对刺参不同选育品系非特异性免疫酶活的影响
2.3.1 低盐胁迫对刺参不同选育品系碱性磷酸酶(AKP)的影响
低盐胁迫对刺参不同选育品系AKP的影响如图4所示。随着盐度的降低5个群体AKP活性均出现先升高后降低的过程。在盐度由31降至21的过程中,5个群体均表现出AKP活性升高的现象,RC-F2和DC-F2在盐度为21时达到峰值,活力分别为5.06金氏单位/100mL和7.63金氏单位/100mL;KC-F3、QQ-F1和QW在盐度为24时达到峰值,活力分别为5.89金氏单位/100 mL、7.07金氏单位/100 mL和6.53金氏单位/100 mL。盐度降至18时,各群体AKP的活性较之前的高盐时显著下降(P<0.01)。不同群体在低盐胁迫时AKP的变化各不相同:RC-F2在盐度15~18时,AKP活力变化不显著(P>0.05),在盐度14时AKP活力显著下降(P<0.01)并达到最低点,活力为0.50金氏单位/100 mL;KC-F3 的AKP活力随着盐度的下降而下降,但在盐度为16~18时活力下降不显著(P>0.05),在盐度降为15时AKP活力显著下降(P<0.01);DC-F2在盐度为16时AKP活性下降幅度较其他4个群体差异极显著(P<0.01);与其他4个群体不同的是,QQ-F1的AKP活力在盐度降至13时才出现显著下降(P<0.01);QW的AKP活力变化显著下降点出现在盐度为14时(P<0.05)。

图4 低盐胁迫对刺参不同选育品系碱性磷酸酶(AKP)的影响(平均值±标准差,n=9)Fig.4 Effects of low salinity on AKP of the five strains ofA.japonicus(Mean±SD,n=9)
2.3.2 低盐胁迫对刺参不同选育品系酸性磷酸酶(ACP)的影响
低盐胁迫对刺参不同选育品系ACP的影响如图5所示。低盐胁迫下不同群体ACP活力变化与AKP活性变化相似,也是出现ACP活性先升高后降低的过程,除RC-F2在盐度为21时达到峰值外,其他4个群体均在盐度为24时达到峰值。在进入低盐胁迫后(盐度低于18以后),ACP活性较盐度21时显著下降(P<0.01)。同一低盐浓度胁迫下各群体AKP下降幅度存在较大差异,DC-F2在盐度16时的下降幅度最大,与其他4个群体差异显著(P<0.01),而QQ-F1在盐度14时仍然保持在较高的水平,活力为1.37金氏单位/100 mL。

图5 低盐胁迫对刺参不同选育品系酸性磷酸酶(ACP)的影响(平均值±标准差,n=9)Fig.5 Effects of low salinity on ACP of the five strains ofA.japonicus(Mean±SD,n=9)
2.3.3 低盐胁迫对刺参不同选育品系超氧化物歧化酶(SOD)的影响
低盐胁迫对刺参不同选育品系SOD的影响如图6所示。随着盐度的降低5个群体SOD活性相对于AKP活性和ACP活性波动比较平稳。在盐度高于21时,不同群体不同盐度SOD活力差别不显著(P>0.05),表达较平稳。进入低盐胁迫后(盐度低于18以下),各群体SOD表现出先升高后降低的趋势,且均在盐度17时SOD活力达到峰值,随后随着盐度的降低其SOD活性逐步降低。同一低盐浓度胁迫下各群体SOD下降幅度存在较大差异,其中DC-F2在盐度16和14时SOD活力均显著低于与其他4个群体(P<0.01);QQ-F1的SOD活力在14时仍然保持在较高的水平,活力为25.76U/mL,在盐度13时才出现显著下降(P<0.01);而RC-F2和KC-F3在盐度14 时SOD活力出现显著下降(P<0.01)。
2.3.4 低盐胁迫对刺参不同选育品系溶菌酶(LZM)的影响

图6 低盐胁迫对刺参不同选育品系超氧化物歧化酶(SOD)的影响(平均值±标准差,n=9)Fig.6 Effects of low salinity on SOD of the five strains ofA.japonicus(Mean±SD,n=9)
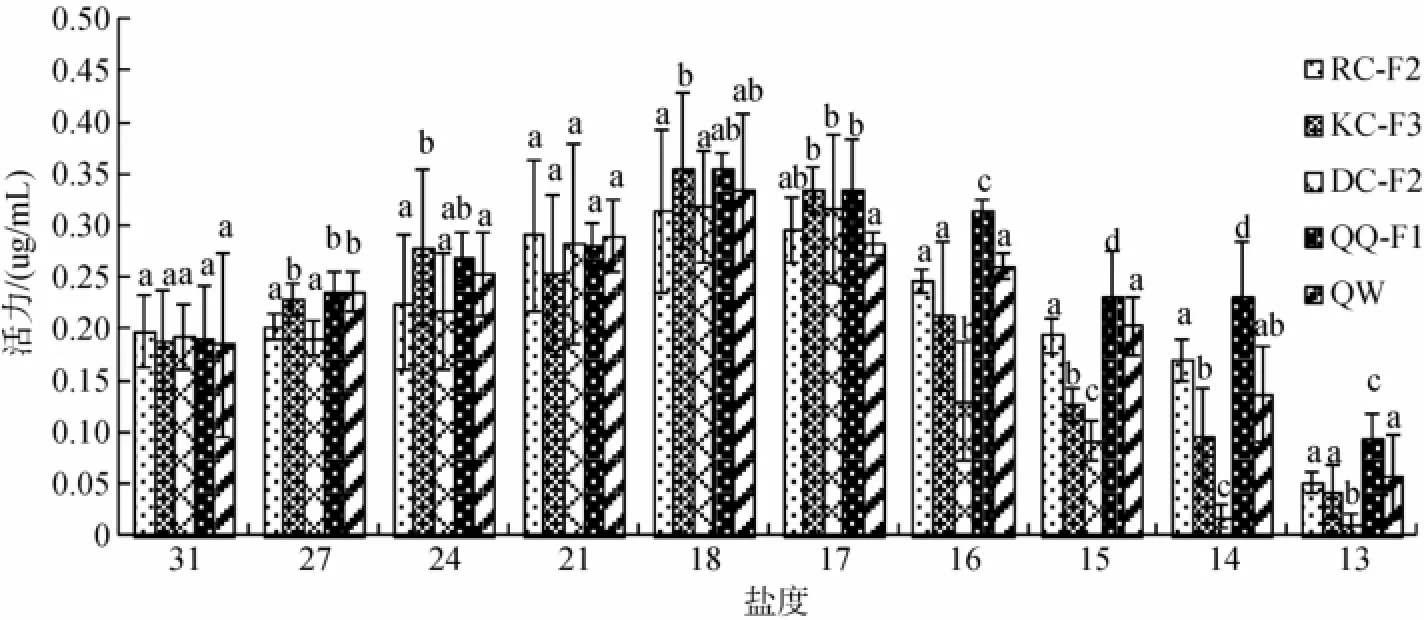
图7 低盐胁迫对刺参不同选育品系溶菌酶(LZM)的影响(平均值±标准差,n=9)Fig.7 Effects of low salinity on LZM of the five strains ofA.japonicus(Mean±SD,n=9)
低盐胁迫对刺参不同选育品系LZM的影响如图7所示。随着盐度的降低5个群体LZM活性均出现先升高后降低的过程,且均在盐度18时达到峰值,在盐度12时活力达到最低。但在低盐胁迫过程中,对于不同选育品系其LZM活力下降幅度存在较大差异,DC-F2的LZM活力下降最快,在盐度16时LZM活力下降幅度显著大于其他4个群体(P<0.05)。相对于其他群体,QQ-F1的LZM活力下降较为缓慢,在盐度14时仍保持较高的LZM活力,显著高于其他4个群体(P<0.01)
3 讨论
3.1 低盐胁迫对刺参生长和存活的影响
本实验结果表明,刺参不同品系在低盐耐受时的存活率存在较大差异,由刺参5个不同群体30d的半致死盐度(LS50-30d)可知,QQ-F1的LS50-30d最低,为14.26,而DC-F2的LS50-30d最高,为16.48,两者盐度差值为2.22,说明QQ-F1对低盐胁迫的耐受性更好。刺参不同群体各盐度下的开始死亡时间(TBD)和半致死时间(ST50)也印证了这一结论,即在相同低盐胁迫下,QQ-F1出现死亡和死亡达到半数的时间显著滞后于其他4个群体。Join[27]研究发现海参可以通过改变其结缔组织的机械强度,收缩自身体积来积极调节渗透压平衡。根据刺参不同群体的选育目标和结果发现DC-F2的显著特点为棘刺列数和棘刺总数高,表面积大,而QQ-F1的显著特点为体壁厚且棘刺粗壮,体壁机械强度较大。由此初步推测相应低盐胁迫时DC-F2需要消耗更多的能量用于维持渗透压的平衡,而导致其低盐耐受力比较弱,这可能也是DC-F2在盐度16时就出现大批死亡的原因之一。不同刺参品系在低盐耐受时的特定生长率同样存在较大差异,当盐度达到18时,除QQ-F1外,其他4个群体均开始出现负增长,QQ-F1在盐度高于17时均可表现为正增长。结合试验结束时不同群体低盐耐受存活率,鉴于不同群体在盐度13和14时的存活率均较低,在低于15盐度以下时进行RSG比较意义不大,因此选择盐度16以上时的RSG判定不同群体的耐低盐特性更为客观。根据不同群体在盐度为16、17和18时的RSG可以看出QQ-F1在低盐度下的特定生长率显著高于其他4个群体,表现出良好的耐低盐特性。综合不同群体苗种特点和对低盐胁迫的耐受性可以看出,棘刺的数目和体壁的厚度与低盐胁迫的耐受性显著相关。通过5个不同群体对低盐胁迫的耐受能力可以看出,QQ-F1在低盐海域或盐度变化较大海域的养殖具有较广阔的应用前景。
3.2 刺参不同选育品系非特异性免疫酶活对低盐胁迫的响应
刺参属于低等生物,不像高等生物一样有着发达的特异性免疫[28],因此刺参免疫防御体系主要由非特异性免疫系统来承担。刺参体腔细胞既是细胞免疫的承担者,又是体液免疫因子的提供者[29]。激活后的体腔细胞可以产生多种免疫因子以及各种具有免疫活性的酶类(如超氧化物歧化酶、溶菌酶、酸性磷酸酶、碱性磷酸酶等),提高刺参机体的免疫力[30]。因此可以通过刺参非特异免疫酶活变化,来反应其在胁迫状态下的免疫应答。本实验研究了刺参不同选育品系在不同低盐胁迫下AKP、ACP、SOD和LZM的变化过程,从变化趋势可以看出,在盐度21~31时,ACP、AKP、LZM活性随着盐度的降低酶活呈上升趋势,SOD活力变化不显著,说明在刺参适宜的盐度范围内,刺参可通过提高ACP、AKP、LZM等各种免疫酶活力来减少盐度下降对机体造成的影响,以维持机体处于正常的生理状态。而当盐度降低突破其适宜盐度后即机体处于低盐胁迫时,ACP和AKP活力迅速下降,其解毒和抗异物能力明显减弱;SOD 和LZM却在盐度17和18时酶活力显著上升并达到峰值,而在盐度降至16以下时SOD和LZM活性迅速下降,说明刺参在一定低盐范围内可通过提高SOD和LZM活性即提高抗氧化酶等活力来抵抗低盐胁迫,然而,在突破一定盐度阈值后,机体无法承受高强度低盐胁迫,SOD和LZM表达能力也随之下降,这与董晓亮等[31]研究结果一致。结合低盐胁迫死亡情况也可以看出,在盐度低于16时,各刺参群体陆续出现急性死亡。在低盐度下,其刺参的死亡原因相当复杂,但其中非特异性免疫酶活力大大下降现象也可能与死亡有一定关系。对比5个不同群体的4种非特异性免疫酶活力变化幅度可以看出,DC-F2苗种的4种酶活力均在盐度16时下降幅度最高,显著低于其他4个群体(P<0.05),说明低盐耐受力较差;而QQ-F1在盐度低于16以后4种酶活力虽然也有显著下降,但其酶活下降幅度较小,在盐度14时,仍维持在较高水平,显著高于其他4个群体(P<0.01),说明其具有较强的低盐耐受能力。
综合以上结果可以看出,以耐低盐为评判指标时,5个群体的低盐耐受力排序为QQ-F1>RC-F2>QW>KC-F3>DC-F2,QQ-F1的LS50-30d为14.26,表现出良好的低盐耐受能力和较高非特异性免疫酶活力。这是目前刺参低盐耐受能力强的品系之一,在入海口、港湾区域等低盐度或盐度不稳定的海域具有良好的推广应用前景。本次实验探究了QQ-F1、RC-F2、QW、KC-F3、DC-F2 5个刺参群体的低盐耐受能力,然而随着育种的不断开展,不同世代之间对低盐的耐受能力还有待于进一步探究,以便选择低盐耐受能力更强的品系,应用于刺参的育、繁、推工作。其中,重点研究青青刺参品系的耐低盐机理以及在低盐区开展养殖测试,为耐低盐刺参品系的养殖推广提供技术参数。
[1] 廖玉麟.棘皮动物门海参纲.中国动物志[M].北京:科学出版社,1997,148-149.
Liao Yulin.Echinoderm animal Holothurioider,Fauna Sinica[M].Beijing:Science Press,1997,148-149.
[2] 王印庚,荣小军,廖梅杰,等.刺参健康养殖与病害防控技术丛解[M].北京:中国农业出版社,2014,61-62.
Wang Yingeng,Rong Xiaojun,Liao Meijie,et al.Sea cucumber culture and disease control technology[M].Beijing:China Agriculture Press,2014,61-62.
[3] 农业部渔业渔政管理局.中国渔业统计年鉴2014[M].北京:中国农业出版社,2015,29-56.
Bureau for Chinese fishery administration,the Ministry of agriculture.Annual report for statistics of China fishery 2014[M].Beijing:China Agriculture Press,2015,29-56.
[4] 阎希柱,王桂忠,李少菁.盐度对九孔鲍能量收支的影响[J].生态学杂志,2009,28(8):1520-1524.
Yan Xizhu,Wang Guizhong,Li Shaoqing.Effects of water salinity on energy budget ofHaliotis diorsicolor aquatilis[J].Chinese Journal of Ecology,2009,28(8):1520-1524.
[5] 陈勇,高峰,刘国山,等.温度、盐度和光照周期对刺参生长及行为的影响[J].水产学报,2007,31(5):687-691.
Chen Yong,Gao Feng,Liu Guoshan,et al.The effects of temperature,salinity and light cycle on the growth and behavior ofApostichopus japonicus[J].Journal of Fisheries of China,2007,31(5):687-691.
[6] 吕富,潘鲁青,王爱民,等.盐度对异育银鲫呼吸和氨氮排泄生理的影响[J].水生生物学报,2010,34(1):184-189.
Lü Fu,Pan Luqing,Wang Aimin,et al.Effects of salinity on oxygen consumption rate and ammonia excretion rate of allogynogemeticCrucian carp[J].Acta Hydrobiologica Sinica,2010,34(1):184-189.
[7] Yuan XT,Yang H S,Zhou Y.The influence of diets containing dried bivalve feces and/or powdered algae on growth and energy distribution in sea cucumber Apostichopus japonicus (Selenka)(Echinodermata:Holothuroidea)[J].Aquaculture,2006,256:457-467.
[8] 隋锡林.影响刺参幼体发育与存活率的主要因子[J].海洋与湖沼,1989,20(4):314-321.
Sui Xilin.The main factors influencing the larval development and survival rate of the sea cucumber[J].Oceanologia etLimnologia Sinica,1989,20(4):314-321.
[9]Binyon J.The effects of diluted sea water upon podial tissues of the starfishAsterias rubbensL[J].Comp Biochem Physiol,1972,41A:1-6.
[10]Shirley T C,Stickle W B.Responses ofLeptasterias hexactis(Echinodermata:Asteroidea)to low salinity[J].Mar Biol,1982,69:155-163.
[11]Walter J D.Osmoregulation in echinoderms.Comp Biochem Physiol,1986,84A:199-205.
[12]Talbot T D,Lawrence J M.The effect of salinity on respiration,excretion,regeneration and production in Ophiophragmus filograneus (Echinodermata:Ophiuroidea)[J].J Exp Mar Biol Ecol,2002,275:1-14.
[13]Yuan X T,Yang H S,Zhou Y,et al.Salinity effect on respiration and excretion of sea cucumberApostichopus japonicus(Selenka)[J].OceanologiaetLimnologia Linica,2006,37(4):354-360.
[14]赵斌,胡炜,李成林,等.低盐环境对3种规格刺参(Apostichopus japonicus)幼参生长与消化酶活力的影响[J].渔业科学进展,2015,36(1):91-96.
Zhao Bin,Hu Wei,Li Chenglin,et al.The effects of low salinity on the growth and activities of digestive enzymes in sea cucumberApostichopus japonicus[J].Marine Fisheries Research,2015,36(1):91-96.
[15]胡炜,李成林,赵斌,等.低盐胁迫对刺参存活、摄食和生长的影响[J].渔业科学进展,2012,33(2):92-96.
Hu Wei,Li Chenglin,Zhao Bin,et al.Effects of low salinity stress on survival,growth and feeding rate of sea cucumber Apostichopus japonicus[J].Marine Fisheries Research,2012,33(2):92-96.
[16]吕志伟,戴晓军.刺参生存盐度下限的探讨[J].河北渔业,2006,147(3):13-36.
Lü Zhiwei,Dai Xiaojun.Exploration of lower sanity limit for sea cucumber(Apostichopus japonicus)[J].Hebei Fishery,2006,147(3):13-36.
[17]肖培华,谭福伟,唐永新,等.刺参对较低盐度的适应试验[J].齐鲁渔业,2006,21(6):21-22.
Xiao Peihua,Tan Fuwei,Tang Yongxin,etal.Experiment for adoption of sea cucumber (Apostichopusjaponicus)to lowersanity[J].Qilu Fishery,2006,21(6):21-22.
[18]Hu Meiyan,Li Qi,Li Li.Effect of salinity and temperature on salinity tolerance of the sea cucumber Apostichopus japonicus[J].Fisheries Science,2010,76(2):267-273.
[19]王印庚,张凤萍,李胜忠,等.刺参腐皮综合征病原灿烂弧菌检测探针的制备及应用[J].水产学报,2009,33(1):119-124.
Wang Yingeng,Zhang Fengping,Li Shengzhong,et al.Detection of vibrio splendidus causing skin ulcer symdrome of sea cucumber(Apostichopus japonicus)with DNA probes[J].Journal of Fisheries of China,2009,33(1):119-124.
[20]张春云,王印庚,荣小军.养殖刺参腐皮综合征病原菌的分离与鉴定[J].水产学报,2006,30(1):119-122.
Zhang Chunyun,Wang Yingeng,Rong Xiaojun.Isolation and identification of causative pathogen for skin ulcerative syndrome inApostichopus japonicus[J].Journal of Fisheries of China,2006,30(1):119-122.
[21]张凤萍,王印庚,李胜忠,等.应用PCR方法检测刺参腐皮综合征病原——灿烂弧菌[J].渔业科学进展,2008,29(5):100-106.
Zhang Fengping,Wang Yingeng,Li Shengzhong,et al.The PCR technique for rapid detection of Vibrio splendidus inApostichopus japonicussuffering from skin ulcerative syndrome[J].Marine Fisheries Research,2008,29(5):100-106.
[22]王印庚,廖梅杰,郝志凯,等.刺参体腔液穿刺抽取后细胞恢复过程的初步研究[J].渔业科学进展,2010,31(5):52-58.
Wang Yingeng,Liao Meijie,Hao Zhikai,etal.Coelomocyte resume of sea cucumberApostichopus japonicusafter puncturable extraction of the coelomic fluid[J].Marine Fisheries Research,2010,31(5):52-58.
[23]窦海鸽,黄捷,王秀华,等.丝足鱼(Trichogaster trichopterus)耐盐性及盐度驯化[J].中国水产科学,2006,3(5):775-780.
Dou Haige,Huang Jie,Wang Xiuhua,et al.Salinity tolerance and saltwateracclimation ofgourami Trichogaster trichopterus[J]. Journal of Fishery Sciences of China,2006,3(5):775-780.
[24]Villegas C.T.Evaluation of the salinity tolerance of Oreochromis mossambicus,O.niloticusand their F1 hybrids[J].Aquaculture,1990,85:281-292.
[25]Watanabe W O.,Ellingson L J,Olla B L,et al.Salinity tolerance and seawater survival vary ontogenetically in Florida red tilapia[J].Aquaculture,1990,87:311-321.
[26]李翠萍,吴民耀,王宏元.3种半数致死浓度计算方法之比较[J].动物医学进展,2012,33(9):89-92.
LiCuiping,WuMinyao,WangHongyuan.LC50caculated by Kochi,probit analysis and linear regression methods[J].Progress in Veterinary Medicine,2012,33(9):89-92.
[27]Eylers J P.Ion-dependent viscosity of holothurian body wall and its implications for the functional morphology of echinoderms[J].Journal of Experimental Biology,1982,99:1-8.
[28]陈效儒,张文兵,麦康森,等.饲料中添加甘草酸对刺参生长、免疫及抗病力的影响[J].水生生物学报,2010,34(4):731-738.
Chen Xiaoru,Zhang Wenbing,Mai Kangsen,et al.Effects of dietary glycyrrhizin on growth,immunity of sea cucumber and its resistance against Vibrio splendidus[J].Acta Hydrobiologica Sinica,2010,34(4):731-738.
[29]Kudriavtsev I V,Polevshchikov A V.Comparative immunological analysis of echinoderm cellular and humoral defense factors[J].Zh Obshch Biol,2004,65(3):218-231.
[30]Coteur G,Warnau M,Jangoux M,et al.Reactive oxygen species(ROS)production by amoebocytes of Asterias rubens (Echinodermata)[J]. Fish & Shellfish Immunology,2002,12(3):187-200.
[31]董晓亮,李成林,赵斌,等.低盐胁迫对刺参非特异性免疫酶活性及抗菌活力的影响[J].渔业科学进展,2013,4(3):82-87.
Dong Xiaoliang,Li Chenglin,Zhao Bin,et al.Effects of low salinity stress on the activities of non-specific immune enzymes and antibacterial activity of sea cucumberApostichopus japonicus[J].Marine Fisheries Research,2013,4(3):82-87.
(本文编辑:梁德海)
Response to low salinity of four strains of sea cucumber Apostichopus japonicus larvae
HOU Xi-tan1,2,LIAO Mei-jie2,LI Bin2,WANG Yin-geng2,ZHANG Zheng2,CHEN Gui-ping2,RONG Xiao-jun2,SUN Jin-sheng1,FAN Rui-yong3
(1.College of Life Science,Tianjin Normal University,Tianjin 300387,China;2.Yellow Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences;Qingdao National Laboratory for Marine Science and Technology,Laboratory for Marine Fisheries Science and Food Production Processes,Qingdao 266071,China;3.Qingdao Ruizi Rare Marine Animal Culture&Development Co.Ltd,Qingdao 266408,China)
Nov.11,2015
Apostichopus japonicus;low salinity stress;specific growth rate;median lethal salinity;median survival time;non-specific immune enzyme activity
The salinity of the sea in estuarine areas is low and unstable,which threatens the survival and growth of sea cucumbers.To evaluate the low salinity tolerance of four sea cucumber(Apostichopus japonicus)strains(RC-F2,KC-F3,DC-F2,and QQ-F1),the growth,survival,and non-specific immune enzyme activities were monitored at seven salinity levels(13,14,15,16,17,18,and 31);wild sea cucumber specimens from the Qingdao coast(QW)were used as controls.The RSGs(Specific Growth Rate)of all the strains,including the control,QW,decreased significantly under the stress of low salinity conditions.Only the QQ-F1 strain showed positive RSGat salinity 17.The LS50-30d of QQ-F1 was significantly lower than that of the other strains(RC-F2,KC-F3,DC-F2,QQ-F1,and QW were 15.02,15.19,16.48,14.26,and 15.13,respectively).At salinity 14,the ST50of QQ-F1 was significantly longer than that of the other strains(RC-F2,KC-F3,DC-F2,QQ-F1,and QW were 19.84d,18.43d,10.11d,23.54d,and 19.01d,respectively).Although the enzyme activities of AKP,ACP,SOD,and LZM were decreased in all 5 species under low salinity conditions(salinity<18),the QQ-F1 strain maintained a comparatively higher enzyme activity level and showed higher overall tolerance to the stress of low salinity.Based on the growth,survival,and non-specific immune enzyme activities,the tolerance to low salinity of the 5 populations was ordered as follows:QQ-F1>RC-F2>QW>KC-F3>DC-F2.The high tolerance of QQ-F1 for low salinity suggest that it would be a good candidate for popularization of low salinity sea areas or unstable salinity coastal areas.These results could be helpful for healthy farming and breeding of sea cucumbers,as well as for evaluations of their character.
A
1000-3096(2016)05-0019-10
2015-12-12;
2016-01-11
国家十二五“863”项目 (2012AA10A412-4);国家自然科学基金项目(31202016);山东省农业良种工程重大项目“速生抗病耐高温刺参良种选育”;国家948项目(2014-Z13);山东省自主创新成果转化专项(2013ZHZX2A0801)
[Foundation:NationalHigh Technology Research andDevelopment Program,China,No.2012AA10A412-4;National Natural Science Foundation of China,No.31202016;Agriculture Seed Improvement ProjectofShandongProvince;Program forinternationaladvanced agricultural science and technology introduction,No.2014-Z13;Special Research Funds for Independent Innovation and Scientific &Technology Achievements Transformation Of Shandong Province,No.2013ZHZX2A0801]
侯西坦(1990-),男,山东邹城人,硕士研究生,研究方向:海参良种选育,电话:0532-85817991,E-mail:houxitan@126.com;王印庚,通信作者,研究员,电话:0532-85841732,E-mail:wangyg@ysfri.ac.cn
