中国藤黄属植物的药理作用研究进展
2016-08-19蔡双璠孔思远谭红胜徐宏喜
张 莉 蔡双璠 孔思远 谭红胜 徐宏喜
(1 上海中医药大学中药学院,上海,201203; 2 中药创新药物研发上海高校工程研究中心,上海,201203)
中国藤黄属植物的药理作用研究进展
张莉1,2蔡双璠1,2孔思远1,2谭红胜1,2徐宏喜1,2
(1 上海中医药大学中药学院,上海,201203; 2 中药创新药物研发上海高校工程研究中心,上海,201203)

藤黄属;抗肿瘤;抗炎;抗菌
藤黄属植物多为乔木或灌木,全世界约有450种,主要分布于亚洲热带地区、非洲南部和波利尼西亚西部[1]。中国藤黄属植物有22种,主要分布于华南和西南地区,许多品种的果实可食用,并有一定的保健及药用价值。我们在本文将详细介绍中国藤黄属植物的抗肿瘤、抗菌及抗炎作用。重点对一些研究报道较多的化合物,归纳和分析其生物活性及作用机制,希望能帮助读者较全面地了解藤黄属植物相关活性的研究进展。

对中国藤黄属植物活性成分及其药效作用机制研究的文献分析显示,该类活性成分对癌症、病毒及炎性反应等一些重要疾病有一定的疗效,值得进一步深入和系统研究。可以预期,随着对藤黄属植物药理药效研究的不断深入,将为从这些宝贵资源中寻找和开发新型药物提供科学依据。此外,通过发现活性先导化合物并对其进行结构改造和化学合成,有助于发现疗效更好、特异性更高和毒性更小的化合物。
1 抗肿瘤作用及机制

Bcl-2基因家族可分为凋亡抑制基因(Bcl-2、Bcl-x等)和凋亡促进基因(Bax等)。Bcl-2在细胞凋亡蛋白抑制因子家族中占有很重要的地位,其编码的蛋白可使细胞凋亡水平降低,促进细胞的生存。与Bcl-2同源的水溶性相关蛋白Bax是Bcl-2基因家族中细胞凋亡促进基因,Bax的过度表达可拮抗Bcl-2的保护效应而使细胞趋于死亡。Gambogenic acid具有诱导HepG2肿瘤细胞凋亡的抗肿瘤活性,能够上调Bax的表达水平,降低Bcl-2/Bax比值,这可能是其诱导细胞凋亡的机制之一[13]。云南藤黄中的化合物Oblongifolin C(OC),诱导了HeLa细胞中Bax蛋白的易位,造成线粒体损伤及其中的细胞色素C释放,最终导致了细胞的凋亡[14]。大苞藤黄乙醇提取物Isobractatin可激活促凋亡蛋白Bax,抑制抗凋亡蛋白Bcl-2,进而激活Caspase 9和3,导致细胞发生凋亡[15]。研究发现,从岭南山竹子中分离得到的化合物1,3,5-Trihydroxy-13,13-dimethyl-2H-pyran[7,6-b]xanthone可以通过抑制Hsp27蛋白的表达从而抑制HCC细胞的生长,此过程是通过调节Bcl-2家族蛋白的表达和激活Caspase来实现的[16]。
1.2阻滞肿瘤细胞周期细胞周期(Cell cycle)是细胞生命活动的基本过程,是指连续分裂的细胞,从一次分裂开始到下一次分裂完成的全过程。一个完整的细胞周期可以分为间期与分裂期两个阶段,其分别负责DNA合成和细胞分裂。细胞周期的正常进程受到多种调控因子的共同作用,目前已明确的主要有3大类:细胞周期蛋白(Cyclin)、细胞周期蛋白依赖性激酶(Cyclin-dependent Kinase,CDK)及细胞周期蛋白依赖性激酶抑制剂(Cyclin-dependent Kinase Inhibitor,CKI)。其中Cyclint通过与CDK结合而发挥正性调节作用,而CKI则具有负性调控作用,不同的Cyclint及CDK共同作用从而保证细胞周期的正常进行。细胞周期调控机制的异常与肿瘤的发生发展密切相关。随着对中药及其活性成分抗肿瘤研究的深入,人们发现藤黄属植物中很多化合物能够将肿瘤细胞阻滞于不同的细胞周期,从而抑制肿瘤细胞增殖并诱导凋亡。
大苞藤黄乙醇提取物中分离得到的化合物Isobractatin可使Cyclin D1和Cyclin E蛋白表达减少,使细胞发生G0/G1期阻滞,阻断细胞进入S期而抑制肿瘤细胞增殖[15]。在乳腺癌细胞MCF-7中,藤黄酸可以破坏微管结构及引起微管解聚,使微管蛋白更多地以单体而非聚合物的形式出现,从而诱导G2/M细胞周期阻滞[17]。Gambogenic Acid可在体外将A549细胞阻滞于G0/G1期,下调细胞周期素Cyclin D1和COX-2的mRNA表达水平[18]。采用流式技术,观察云树及云南藤黄中的主要活性成分Guttiferone K(GUTK)对细胞周期的影响,发现GUTK可浓度依赖性减少S期和G2/M期的细胞,引起G0/G1细胞阻滞,增加G0/G1期的细胞。蛋白水平上的检测发现,GUTK对Cyclin D1、Cyclin D3、CDK 4、CDK 6蛋白的表达具有明显的时间和浓度依赖性,显著上调p21Waf1/Cip1和p27Kip1蛋白水平,激活JNK信号通路,而且该化合物对正常人结肠上皮细胞CCD 841CoN相关蛋白的表达没有影响,说明GUTK毒性较低,值得进一步深入研究[19]。
1.3调节自噬的作用细胞自噬(Autophagy)是溶酶体对某些受损、变性或老化的蛋白质以及细胞器消化降解的过程。自噬存在于多种生理以及病理生理学过程,如恶性肿瘤等。近年来,自噬已经成为癌症研究领域的一个热点。自噬在肿瘤细胞的发展过程中有两重作用:一方面,自噬可以抑制癌症发生,通过清理肿瘤细胞内受损的蛋白质以及细胞器等,使细胞的应激反应下降。另一方面,自噬过程中产生的能量可以用于肿瘤生长后期的能量供给,使其得以存活。另外,自噬也可以使某些抗癌疗法失效,其可以通过清除受损细胞器而阻止细胞死亡[20]。由此,自噬在肿瘤发生发展的不同阶段表现出不一样的作用。在对癌症的治疗和预防方面,充分理解自噬在肿瘤中的准确作用和功能,对于正确指导癌症的治疗与预防非常重要。
在A549和HeLa细胞中,大苞藤黄中的活性成分Neobractatin和Isobractatin可增加LC3B-I向LC3B-II的转变,引起p62累积,高通量筛选平台检测发现这两种化合物均可引起GFP-LC3荧光斑点形成,从而抑制自噬通量。因此,Neobractatin和Isobractatin具有引起细胞凋亡和抑制自噬的作用[21]。从木竹子中提取分离得到的化合物(+)-Garcimulin A和Garcimulin B均可抑制溶酶体的酸化,影响自噬过程,从而抑制肿瘤细胞的生长[22]。研究发现,在A549和HeLa细胞中Gambogenic acid可以通过诱导LC3II的堆积、增加Beclin 1激活以及升高P70S6K磷酸而来诱导细胞的自噬。并且这一结果在异种移植瘤模型中的得到验证,表明Gambogenic acid可以通过自噬而发挥抗肿瘤作用[23]。
mTOR(Mammalian Target of Rapamycin)是哺乳动物雷帕霉素的靶点。mTORT在淋巴细胞活化,神经、肌肉再生,胰岛素信号传导以及各种肿瘤的形成中都扮演着重要的作用,它可以激活细胞生长,在癌细胞中表达升高,抑制细胞自噬。mTOR通路是细胞自噬过程中比较重要的信号传导通路。云南藤黄中提取分离得到的PPAP类化合物GUTK,在营养缺乏时可通过抑制Akt/mTOR的磷酸化,进而促进自噬的发生,诱导细胞的死亡[24]。化合物OC与GUTK结构式相似,是云南藤黄中含量较高的主要活性成分,但两者在细胞自噬方面有着不一样的作用。研究显示OC可以抑制细胞的自噬通量,最终促进癌细胞的凋亡。研究发现,OC可导致自噬体大量积累,并抑制SQSTM1蛋白的降解;通过检测GFP-LC3B和LysoTracker Red的共定位,证实OC阻止了自噬体和溶酶体的融合;进一步探究发现,OC是通过影响溶酶体蛋白酶水解活性和组织蛋白酶家族蛋白的活性而抑制溶酶体活性;并且,饥饿条件可增加OC促进癌细胞凋亡的敏感性。荷瘤裸鼠经OC处理后,其肿瘤组织中出现LC3II积累、Caspase3激活以及溶酶体组织蛋白酶表达减少的现象;同时,在体内试验中,卡路里限制与OC联用可以显著提高OC的抗肿瘤活性。因此,OC可能作为自噬通量抑制剂,成为潜在的抗癌药物先导化合物[25]。
1.4抑制肿瘤细胞侵袭、迁移和黏附肿瘤细胞可通过细胞黏附作用与周边正常细胞结合并将其癌化从而引发癌症。在恶性肿瘤的治疗过程中,肿瘤转移问题成为目前临床治疗上的主要障碍,控制肿瘤细胞转移是决定患者预后以及生命质量的重要因素之一。藤黄酸可抑制肝癌细胞SK-HEP1的增殖、转移和入侵;其机制为下调整合蛋白B1/Rho家族GTP酶信号通路的表达,抑制与细胞骨架和转移相关的肌动蛋白的表达,以及减少细胞侵袭中金属蛋白酶MMP-2、MMP-9和NF-κB的表达[26]。OC能升高keratin 18蛋白的表达,抑制Akt和Erk的磷酸化,从而抑制食管癌的肺转移,而不引起明显的毒性[27]。
1.5抑制肿瘤新生血管的生成血管生成是指在原有微血管的基础上形成的新生毛细血管。肿瘤血管形成是肿瘤生长、转移的重要因素之一。肿瘤血管为肿瘤本身提供充足的营养,同时为肿瘤向远处传播提供条件,导致肿瘤的恶性复发与转移。正常成熟组织的血管系统内皮细胞更新地极为缓慢,而肿瘤血管内皮细胞的增殖更新周期可缩短至数天。血管生成是肿瘤快速增殖的关键所在。研究表明,抑制血管内皮生长因子(VEGF)能阻止肿瘤新生血管的形成,从而协助抗肿瘤作用。抑制VEGF表达是抑制肿瘤血管生成的主要有效途径之一。藤黄酸对VEGF诱导的人脐静脉血管内皮细胞(Human Umbilical Vein Endothelial Cell,HUVEC)的增殖、迁移和血管形成能力有很强的抑制作用。采用体内基质胶栓试验(Matrigel plug)和肿瘤移植实验进一步证明藤黄酸可能可以下调VEGFR-2,以及其下游激酶c-Myc、聚焦黏附激酶、Akt、Erk和p38的激活从而抗肿瘤新生血管生成[28]。Gambogenic acid也可以通过调节VEGF和COX-2的表达影响A549肺癌细胞的生长和浸润[29]。
1.6逆转肿瘤细胞的多药耐药肿瘤细胞的耐药是现今肿瘤化疗失败的主要原因之一。大多数肿瘤患者治疗的失败与耐药直接或间接相关,其可分为多药耐药和单药耐药两类,主要通过阻碍DNA修复、药物代谢以及改变DNA多聚酶活性等产生耐药。P-糖蛋白在耐药发生的过程中发挥着比较关键的作用,也是产生耐药性的关键蛋白之一。另外,通过对肿瘤细胞中Survivin基因表达的阻断,也可提高某些化疗药物的药效,但其机制尚不明确。研究证实,通过下调Survivin基因表达,藤黄酸可以逆转胃癌细胞对多西他赛的耐药[12,30],藤黄酸与5-氟尿嘧啶(5-FU)联用对人胃癌细胞BGC-823的抑制作用高于单用藤黄酸或5-FU。此外,文献报道藤黄酸还能影响5-FU的代谢酶,其能下调胸苷合成酶和二氢嘧啶二氢激酶(DPD)的mRNA表达水平,使乳清酸磷酸转移酶(OPRT)的mRNA表达水平升高。因此,藤黄酸可与化疗药物联用,增加其作用,如其能与5-FU产生协同抗肿瘤作用[31]。从菲岛福木果实中分离得到的化合物(+)-Garcinialiptone A、(-)-Garcinialiptone A、Garcinialiptone B、(-)-Cycloxanthochymol、Garcinialiptone C、Garcinialiptone D、Xanthochymol、Isoxanthochymol和Cycloxanthochymol能够抑制A549、DU145、KB以及长春新碱耐药性KB细胞株的增殖,这些化合物的IC50值在4-5 μg/mL之间,并可减少抗肿瘤药物的P-糖蛋白耐药性[32]。
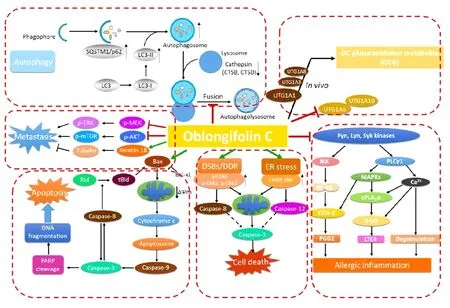
图1 化合物Oblongifolin C(OC)抗肿瘤作用机制图
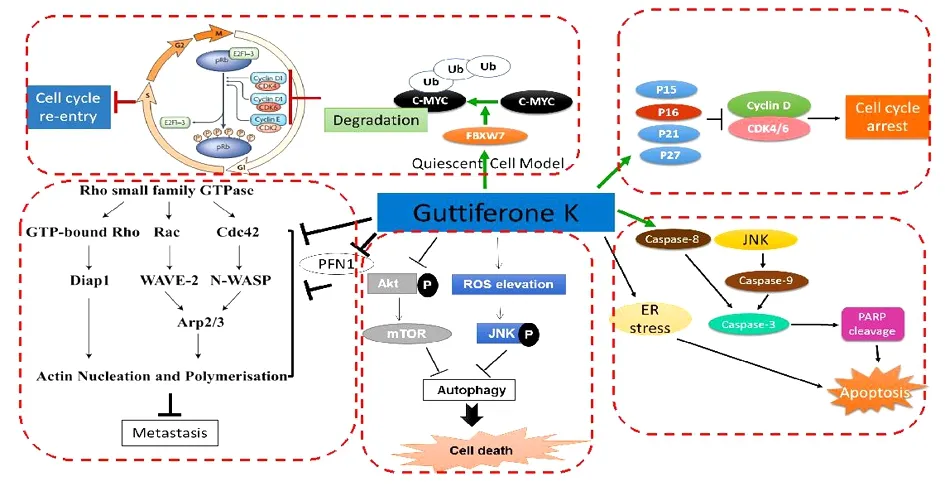
图2 化合物Guttiferone K(GUTK)抗肿瘤作用机制图

2 抗菌及抗病毒作用及机制
病毒与人类的健康密切相关,人类传染病约有80%是由病毒而引起。病毒虽然结构简单,但是其传染性强且病死率高。目前用于病毒治疗的药物主要有抗生素与干扰素等。但是,抗生素对病毒无抑制作用,而干扰素虽然可以抑制病毒复制,提高机体免疫功能,但是其费用昂贵[36]。目前研究显示,部分藤黄属植物中的提取物或有效成分对某些病毒有一定的抑制作用。
自从科学家认识到人类免疫缺陷病毒(HIV)是艾滋病的病原体,寻找安全和有效的治疗艾滋病毒感染已成为世界各地药物研发的一个主要焦点。从木竹子心材中分离得到的双黄酮类化合物GB-1a、GB-2a和Fukugetin(Morelloflavone)在抗病毒方面有着显著的药理活性。这些化合物有一定的抗HIV-1逆转录酶的活性[37]。藤黄枝叶中分离得到的化合物2-Acetoxyalphitolic acid、3-Acetoxyalphitolic acid、Betulinic acid及Betulin也具有抗HIV-1病毒的活性[5]。EV71是属于微小病毒科中的肠道病毒群。EV71是目前肠病毒群中最晚发现的病毒之一,其感染性强且致病率高,尤其是在神经系统方面的并发症,可导致婴幼儿死亡。从岭南山竹子中分离得到的化合物Oblongifolin J、Oblongifolin M和Euxanthone具有显著的抗EV71病毒的活性。其中,Oblongifolin M已被证明可通过下调ERp57蛋白的表达而抑制内部核糖体进入位点(IRES)的活性,进而抑制EV71病毒的复制[6]。
3 抗炎作用及机制
炎性反应是一种常见疾病,也是一种重要的病理过程,可发生于全身各个组织部位和器官,并严重影响患者的生活质量。目前,临床上使用的抗炎药物主要以糖皮质激素为主,但其具有作用短暂或可产生不良反应等诸多限制性因素。近年来,中药的抗炎作用已得到了广泛的关注。研究显示,云南藤黄中的活性成分OC可以抑制上游Fyn、Lyn和Syk激酶活性,进而抑制NF-κB和MAPK通路,下调细胞内Ca2+浓度,降低β-hexosaminidase(β-Hex)水平,从而抑制肥大细胞脱颗粒反应和炎性递质的释放。同时,OC可以降低过敏性小鼠血清中组胺、PGD2和LTC4的水平,具有一定的抗过敏活性。但是,该化合物对炎性因子释放和人源性肥大细胞的作用尚不知晓,有待进一步研究确认[38]。
菲岛福木中的化合物Garcinielliptones F能够抑制大鼠嗜中性粒细胞中甲酰三肽(fMLP)/细胞松弛素B(CB)诱导的β-葡萄糖醛酸酶、溶解酶和超氧离子释放。同时,该化合物能够抑制大鼠腹腔巨噬细胞中化合物48/80诱导的β-葡萄糖醛酸酶及其与组胺的释放[39]。木竹子中提取分离得到的化合物Garcimulin B可有效抑制LPS诱导的NO炎性反应因子的分泌[22]。而从木竹子的果实中提取得到的化合物Garcimultiflorone G能够抑制人体嗜中性粒细胞释放超氧阴离子(O2-)及胰肽酶E(Elastase),从而起到抑制炎性疾病发生的作用[40];此外,化合物2-Acetoxyalphitolic acid和3-Acetoxyalphitolic acid、Betulinic acid和Betulin在苯丙酸乙酯诱导的耳肿胀模型中,也显示出一定的抗炎作用[41]。
哮喘是由固有性和适应性免疫系统中多种细胞与上皮细胞共同参与的一种气道慢性炎性疾病,可引起气道高反应性、黏液过度分泌、气道重塑和气道狭窄。哮喘气道炎性反应的特征为肥大细胞活化、嗜酸性粒细胞浸润和活化的Th2细胞增多,并发生多种细胞因子的释放。Nujiangexanthone A(N7)为怒江藤黄中分离得到的新化合物。研究发现,N7可通过抑制Src激酶活性和Syk相关通路而抑制IgE/Ag介导的肥大细胞活化,包括脱颗粒反应、细胞因子和类花生酸类物质的生成。在肥大细胞介导的被动皮肤过敏反应动物模型中,N7可以抑制组胺释放、PGD2和LTC4生成。在卵白蛋白(Ovalbumin,OVA)介导的哮喘模型中,N7也可以降低IL-4、IL-5、IL-13、IgE和LTC4和PGD2的水平。组织学研究证明,在肺组织中,N7大幅减少了OVA介导的细胞浸润和黏液生成增加,降低小鼠肺组织中酪氨酸和Syk的磷酸化水平。RT-PCR结果表明,N7降低了肺组织中多种细胞因子和转录因子的mRNA表达水平,包括IL-4、IL-5、IL-13和GATA-3。因此,N7也能够抑制小鼠的过敏性哮喘反应[42]。
4 小结
我国藤黄属植物种类繁多、资源丰富,所含化学成分结构类型多样,而且具有显著的药理活性。除了上面列举的抗肿瘤、抗炎及抗病毒作用,其还有抗糖尿病、抗突变、抗疟、抗菌及神经保护等作用。近年来一些单体成分的抗肿瘤、抗炎活性受到国内外学者关注,但目前大部分研究报道多是基础性研究,值得进一步开展深入和系统的研究。此外,部分化学成分如藤黄酸及Gambogenic acid等化合物,尽管具有显著的抗肿瘤活性,但也显示出较强的毒性,其成药性受到了限制。因此,进一步深入开展对该属植物化学成分与药理活性相关性的研究,发现活性强、毒性低、选择性高的化合物,再经过化学成分的结构修饰、构效关系等方面的研究将有较大机会发现新的活性先导化合物,同时为藤黄属植物的临床用药提供科学依据和指导。
[1]付文卫,谭红胜,徐宏喜.中国产藤黄属植物中抗肿瘤活性化学成分的研究概况[J].药学学报,2014,49(2):166-174.
[2]张俊艳,韩英梅,常允平.藤黄属植物的化学成分和药理作用研究进展[J].现代药物与临床,2012,27(3):297-303.
[3]王鸣,冯煦,赵友谊,等.中药藤黄的研究和应用[J].中国野生植物资源,2003,22(1):1-4.
[4]Sukpondma Y,Rukachaisirikul V,Phongpaichit S.Antibacterial caged-tetraprenylated xanthones from the fruits ofGarciniahanburyi[J].Chem Pharm Bull(Tokyo),2005,53(7):850-852.
[5]Reutrakul V,Anantachoke N,Pohmakotr M,et al.Anti-HIV-1 and anti-inflammatory lupanes from the leaves,twigs,and resin ofGarciniahanburyi[J].Planta Med,2010,76(4):368-371.
[6]Wang M,Dong Q,Wang H,et al.Oblongifolin M,an active compound isolated from a Chinese medical herbGarciniaoblongifolia,potently inhibits enterovirus 71 reproduction through downregulation of ERp57[J].Oncotarget,2016,7(8):8797-808.
[7]李丽梅,周俊,娄洁,等.大苞藤黄中的一个新黄酮及其抗烟草花叶病毒活性[J].中国中药杂志,2015,21(4):4205-4207.
[8]Hahnvajanawong C,Ketnimit S,Pattanapanyasat K,et al.Involvement of p53 and nuclear factor-kappaB signaling pathway for the induction of G1-phase cell cycle arrest of cholangiocarcinoma cell lines by isomorellin[J].Biol Pharm Bull,2012,35(11):1914-1925.
[9]Tian Z,Shen J,Moseman AP,et al.Dulxanthone A induces cell cycle arrest and apoptosis via up-regulation of p53 through mitochondrial pathway in HepG2cells[J].Int J Cancer,2008,122(1):31-38.
[10]Rong J-J,Hu R,Qi Q,et al.Gambogic acid down-regulates MDM2 oncogene and induces p21 Waf1/CIP1 expression independent of p53[J].Cancer lett,2009,284(1):102-112.
[11]Guo QL,Lin SS,You QD,et al.Inhibition of human telomerase reverse transcriptase gene expression by gambogic acid in human hepatoma SMMC-7721 cells[J].Life Sci,2006,78(11):1238-1245.
[12]朱晗,陈宝安.藤黄酸逆转肿瘤多药耐药的实验研究进展[J].时珍国医国药,2013,24(4):794-796.
[13]Zhou J,Luo Y-H,Wang J-R,et al.Gambogenic acid induction of apoptosis in a breast cancer cell line[J].Asian Pac J Cancer Prev,2013,14(12):7601-7605.
[14]Feng C,Zhou LY,Yu T,et al.A new anticancer compound,oblongifolin C,inhibits tumor growth and promotes apoptosis in HeLa cells through Bax activation[J].Int J Cancer,2012,131(6):1445-1454.
[15]Shen T,Li W,Wang Y-Y,et al.Antiproliferative activities ofGarciniabracteataextract and its active ingredient,isobractatin,against human tumor cell lines[J].Arch Pharm Res,2014,37(3):412-420.
[16]Fu W-m,Zhang J-f,Wang H,et al.Heat shock protein 27 mediates the effect of 1,3,5-trihydroxy-13,13-dimethyl-2H-pyran.[7,6-b]xanthone on mitochondrial apoptosis in hepatocellular carcinoma[J].J proteomics,2012,75(15):4833-4843.
[17]Chen J,Gu H-Y,Lu N,et al.Microtubule depolymerization and phosphorylation of c-Jun N-terminal kinase-1 and p38 were involved in gambogic acid induced cell cycle arrest and apoptosis in human breast carcinoma MCF-7 cells[J].Life Sci,2008,83(3):103-109.
[18]Li Q,Cheng H,Zhu G,et al.Gambogenic acid inhibits proliferation of A549 cells through apoptosis-inducing and cell cycle arresting[J].Biol Pharm Bull,2010,33(3):415-420.
[19]Kan WLT,Yin C,Xu HX,et al.Antitumor effects of novel compound,guttiferone K,on colon cancer by p21Waf1/Cip1-mediated G0/G1cell cycle arrest and apoptosis[J].Int J Cancer,2013,132(3):707-716.
[20]Rosenfeldt MT,Ryan KM.The multiple roles of autophagy in cancer[J].Carcinogenesis,2011,32(7):955-963.
[21]Xu D,Lao Y,Xu N,et al.Identification and characterization of anticancer compounds targeting apoptosis and autophagy from Chinese native Garcinia species[J].Planta Med,2015,81:79-89.
[22]Fan Y-M,Yi P,Li Y,et al.Two Unusual Polycyclic Polyprenylated Acylphloroglucinols,Including a Pair of Enantiomers fromGarciniamultiflora[J].Org Lett,2015,17(9):2066-2069.
[23]Mei W,Dong C,Hui C,et al.Gambogenic acid kills lung cancer cells through aberrant autophagy[J].PloS one,2014,9(1):e83604.
[24]Wu M,Lao Y,Xu N,et al.Guttiferone K induces autophagy and sensitizes cancer cells to nutrient stress-induced cell death[J].Phytomedicine,2015,22(10):902-910.
[25]Lao Y,Wan G,Liu Z,et al.The natural compound oblongifolin C inhibits autophagic flux and enhances antitumor efficacy of nutrient deprivation[J].Autophagy,2014,10(5):736-749.
[26]Park MS,Kim NH,Kang CW,et al.Antimetastatic Effects of Gambogic Acid are Mediated via the Actin Cytoskeleton and NF-κB Pathways in SK-HEP1 Cells[J].Drug Develop Res,2015,76(3):132-142.
[27]Wang X,Lao Y,Xu N,et al.Oblongifolin C inhibits metastasis by up-regulating keratin 18 and tubulins[J].Sci Rep,2015,5:10293.
[28]Yi T,Yi Z,Cho S-G,et al.Gambogic acid inhibits angiogenesis and prostate tumor growth by suppressing vascular endothelial growth factor receptor 2 signaling[J].Cancer Res,2008,68(6):1843-1850.
[29]Yang L,Wang M,Cheng H,et al.Gambogenic acid inhibits proliferation of A549 cells through apoptosis-inducing[J].Zhongguo Zhong yao za zhi=Zhongguo zhongyao zazhi=China journal of Chinese materia medica,2011,36(9):1217-1221.
[30]Wang T,Wei J,Qian X,et al.Gambogic acid,a potent inhibitor of survivin,reverses docetaxel resistance in gastric cancer cells[J].Cancer lett,2008,262(2):214-222.
[31]Wang J,Liu W,Zhao Q,et al.Synergistic effect of 5-fluorouracil with gambogic acid on BGC-823 human gastric carcinoma[J].Toxicology,2009,256(1):135-140.
[32]Zhang L-J,Chiou C-T,Cheng J-J,et al.Cytotoxic polyisoprenyl benzophenonoids fromGarciniasubelliptica[J].J Nat Prod,2010,73(4):557-562.
[33]Islam M,Hoque M,Asif-Ul-Alam S,et al.Chemical composition,Antioxidant capacities and storage stability of Citrus macroptera andGarciniapedunculatafruits[J].Emirates Journal of Food and Agriculture,2015,27(3):275.
[34]Das M,Sarma BP,Ahmed G,et al.In vitro anti oxidant activity total phenolic content of Dillenia indica Garcinia penducalata,commonly used fruits in Assamese cuisine[J].Free Radicals and Antioxidants,2012,2(2):30-36.
[35]Zhong F,Chen Y,Wang P,et al.Xanthones from the Bark ofGarciniaxanthochymusand Their 1,1-Diphenyl-2-picrylhydrazyl Radical-Scavenging Activity[J].Chinese Journal of Chemistry,2009,27(1):74-80.
[36]邢世华,李晓波.清热解毒类中药抗病毒活性及作用机制研究进展[J].中国药理学通报,2014,30(4):464-468.
[37]Lin Y-M,Anderson H,Flavin MT,et al.In vitro anti-HIV activity of biflavonoids isolated from Rhus succedanea andGarciniamultiflora[J].J Nat Prod,1997,60(9):884-888.
[38]Lu Y,Cai S,Tan H,et al.Inhibitory effect of oblongifolin C on allergic inflammation through the suppression of mast cell activation[J].Mol Cell Biochem,2015,406(1-2):263-271.
[39]Weng JR,Lin CN,Tsao LT,et al.Novel and Anti-Inflammatory Constituents ofGarciniasubelliptica[J].Chemistry-A European Journal,2003,9(9):1958-1963.
[40]Ting CW,Hwang TL,Chen IS,et al.Garcimultiflorone G,a Novel Benzoylphloroglucinol Derivative fromGarciniamultiflorawith Inhibitory Activity on Neutrophil Pro-Inflammatory Responses[J].Chem Biodivers,2014,11(5):819-824.
[41]Ting CW,Hwang TL,Chen IS,et al.A New Benzoylphloroglucinol Derivative with an Adamantyl Skeleton and Other Constituents fromGarciniamultiflora:Effects on Neutrophil Pro-Inflammatory Responses[J].Chem Biodivers,2012,9(1):99-105.
[42]Lu Y,Cai S,Nie J,et al.The natural compound nujiangexanthone A suppresses mast cell activation and allergic asthma[J].Biochem Pharmacol,2016,100:61-72.
(2016-07-05收稿责任编辑:洪志强)
The Mechanism Study on Pharmacological Effects of Garcinia Plants in China
Zhang Li1,2,Cai Shuangfan1,2,Kong Siyuan1,2,Tan Hongsheng1,2,Xu Hongxi1,2
(1SchoolofPharmacy,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China;2EngineeringResearchCenterofShanghaiCollegesforTCMNewDrugDiscovery,Shanghai201203,China)
Recent studies have shown that Garcinia species have antitumor,anti-inflammatory and antibacterial effects.Xanthones,polycyclic polyprenylated acylphoroglucinols(PPAPs)and biflavones are the major chemicals isolated from this genus.This paper summarizes the main active compounds from Garcinia species in China and their mechanism of action.
Garcinia species; Anti-tumor; Anti-inflammation; Anti-bacteria
中国博士后科学基金面上资助项目(编号:2015M570381)
张莉(1983.10—),女,博士,讲师,研究方向:抗肿瘤中药药理作用机制研究
徐宏喜(1961.07—),男,博士,教授,院长,研究方向:中药活性成分及药理作用机制研究,E-mail:xuhongxi88@gmail.com
R285
A doi:10.3969/j.issn.1673-7202.2016.07.008
