Guttiferone K抑制静止期前列腺癌细胞重新激活的作用研究
2016-08-19席志超蔡双璠劳远至董其瀚徐宏喜
席志超 姚 睦 李 洋 蔡双璠 吴 蓉 劳远至 董其瀚,4 徐宏喜
(1 上海中医药大学中药学院,上海,201203; 2 中药创新药物研发上海高校工程研究中心,上海,201203;3 悉尼大学,悉尼,2006; 4 西悉尼大学,悉尼,2753)
Guttiferone K抑制静止期前列腺癌细胞重新激活的作用研究
席志超1,2姚睦3李洋1,2蔡双璠1,2吴蓉1,2劳远至1,2董其瀚3,4徐宏喜1,2
(1 上海中医药大学中药学院,上海,201203; 2 中药创新药物研发上海高校工程研究中心,上海,201203;3 悉尼大学,悉尼,2006; 4 西悉尼大学,悉尼,2753)
目的:观察从云南藤黄(Garciniayunnanensis)中提取分离得到的PPAPs(Polycyclic Polyprenylated Acylphloroglucinol)类化合物Guttiferone K(GUTK)对人静止期前列腺癌LNCaP细胞重新激活的影响。方法:处于对数生长期的人前列腺癌LNCaP细胞去除血清培养7d诱导其进入静止期,通过再次加入血清培养使其重新激活进入细胞周期,同时给予GUTK进行干预。用免疫细胞化学的方法检测Ki-67蛋白表达的变化;利用PI染色的流式分析法和EdU Incorporation法检测GUTK对细胞周期分布的影响;利用Western Blotting法检测Cyclin D1/3、CDK4/6和E2F1蛋白表达水平的变化。结果:GUTK呈剂量依赖性地抑制静止期LNCaP细胞的再次增殖并阻止静止期LNCaP细胞重新进入S期;GUTK在静止期LNCaP细胞激活的早期明显下调了Cyclin D1/3、CDK4/6和E2F1蛋白的表达水平。结论:从云南藤黄中提取分离得到的化合物GUTK能够抑制人静止期前列腺癌LNCaP细胞的重新激活,具有潜在的延缓前列腺癌病情发展和预防复发的作用。
云南藤黄;Guttiferone K;静止期癌细胞;前列腺癌
ofSydney,Sydney2006,Australia; 4TheUniversityofWesternSydney,Sydney2753,Australia)
前列腺癌已成为发病率最高的男性癌症[1-2],严重威胁着男性的身体健康。前列腺癌在症状表现上差异很大,有些患者甚至没有明显的症状。因其发病的隐匿性,早期的前列腺癌筛查主要是通过检测血清前列腺特异抗原值(Prostate-Specific Antigen,PSA)。但PSA水平的波动不仅仅与前列腺癌有关,良性前列腺增生、前列腺炎也会影响其水平。这种非特异性的前列腺癌生物标记就导致了前列腺癌的假阳性诊断率大幅升高,进而在一定程度上导致了前列腺癌的发病率高于死亡率6倍[1]。所以,经过筛查发现的早期低风险前列腺癌患者,一般不会立即采取放化疗等具有一定伤害性的治疗手段,而是采用动态监测的方法来观察疾病的发展。然而相关研究表明,在进行动态监测的患者中,依然有35%的患者会在47个月左右出现癌症恶化的现象[3],而目前临床上几乎没有可以延缓癌症发展进程的治疗手段。
在成年人的正常组织中,绝大部分细胞都处于静止期(G0期)[4]。同样,在多种肿瘤中也已经证实了静止期肿瘤细胞的存在[5-6]。在促有丝分裂的信号刺激下,静止期细胞重新进入G1期并启动细胞周期进程,这个过程被称为静止期细胞重新进入细胞周期。在前列腺癌发展的过程中,核增殖蛋白Ki-67呈阴性的肿瘤细胞会随着癌症的恶化而逐渐减少[7],这意味着静止期肿瘤细胞被激活转变为增殖期的肿瘤细胞,对肿瘤的临床预后将产生不良影响。
研究表明,静止期肿瘤细胞的再次增殖是导致癌症病程进展及癌症复发的重要原因之一。所以,发现和研究针对抑制静止期前列腺癌细胞激活的药物,将为延缓前列腺癌的病情发展和预防复发提供新的治疗策略。天然产物是活性化合物和新药研发的重要来源,藤黄属(GarciniaL.)植物多为乔木或灌木,在我国共有22种,分布于云南、广东、广西、海南、台湾和西藏及沿海部分地区。近年来,本课题组对多种藤黄属植物进行了系统的抗肿瘤活性成分研究,建立了藤黄属植物来源的化合物库,并发现了多个具有显著抗肿瘤活性的化合物[8-14]。在前期的筛选中,我们以藤黄属化合物库中的小分子化合物,针对静止期前列腺癌LNCaP细胞进行筛选,发现GUTK对静止期前列腺癌LNCaP细胞的重新激活具有明显的抑制作用。本研究将进一步探索GUTK对静止期前列腺癌LNCaP细胞重新激活的影响并初步探究其作用机制。
1 材料与方法
1.1材料
1.1.1细胞株人前列腺癌LNCaP细胞购自美国ATCC细胞库。用含10%胎牛血清,100 U/mL青霉素和100 μg/mL链霉素的RPMI1640培养基(美国GIBCO公司),于37 ℃、5% CO2及饱和湿度的培养箱中培养,用0.25%胰蛋白酶消化传代,取对数生长期细胞用于实验。
1.1.2药品与试剂Guttiferone K(GUTK)为本课题组从云南藤黄中提取分离得到的化合物,其纯度为98%;碘化丙啶(PI),二甲基亚砜(DMSO)和RNase A购自美国Sigma-Aldrich公司;石蜡液和琼脂糖购自美国Thermo公司;Click-ItTMEdU Flow Cytometry Assay Kit(C35002)购自美国Invitrogen公司;苏木素染料,甘油明胶封片液,免疫染色封闭液和DAB显色液购自江苏碧云天生物公司;Ki-67(ab92353),Cyclin D1(ab40754),Cyclin D3(ab52598),Cdk4(ab108357),Cdk6(ab124821)和E2F1(ab137415)抗体购自美国Abcam公司;RIPA裂解液、蛋白酶抑制剂三联试剂盒、BCA蛋白浓度试剂盒和ECL发光液购自上海威奥生物科技有限公司。
1.2仪器全波长酶标仪(美国Bio-Tek公司),光学倒置显微镜(日本OLYMPUS公司),细胞培养箱(美国Themo公司),FACSCalibur流式细胞仪(美国BD公司),离心机(美国Beckman公司)。
1.3方法
1.3.1静止期LNCaP细胞的培养方法采用去血清培养LNCaP细胞的方法,在体外建立稳定的静止期前列腺癌细胞模型。具体操作如下:当用含有10% FBS的RPMI1640培养的LNCaP细胞密度达到70%~80%时,将培养基换成无FBS的RPMI1640继续培养7d,得到静止期的LNCaP细胞。通过再次加入含有10% FBS的RPMI1640培养使其重新激活进入细胞周期,同时给予GUTK进行干预。
1.3.2免疫细胞化学法检测Ki-67蛋白的表达水平在LNCaP细胞从静止期释放的同时,分别给予5 μM/10 μM GUTK和DMSO处理细胞72 h。用1 mL 10%中性福尔马林吹打细胞,置于4 ℃过夜固定;离心,弃上清液,用1%琼脂糖包裹细胞沉淀,进行常规的石蜡包埋并切片(厚度为5 μm)。表面抗原修复后孵育一抗Ki-67(1∶500)并在4 ℃过夜;室温放置10 min,孵育二抗30 min后,与HRP生物标志链反应;苏木素染色5~20 min,蒸馏水冲洗2 min,盐酸乙醇分化15 s后蒸馏水冲洗泛蓝5 min;脱水后以中性树脂封片,晾干,置于显微镜下拍照观察。
1.3.3应用PI染色的流式分析法检测GUTK对细胞周期分布的影响将静止期人前列腺癌细胞LNCaP(2.5×105个细胞/孔)接种于6孔板中使其重新进入细胞周期,同时分别给予5 μM/10 μM GUTK和DMSO处理细胞72 h;收集细胞到15 mL的管中,1 000 r/min,离心5 min,弃上清液;用300 μL的PBS重悬细胞,逐滴加入700 μL预冷的无水乙醇,且边加边涡旋,4 ℃固定过夜;离心弃上清,并用PBS洗涤细胞;用含有100 μg/mL RNase A和20 μg/mL PI的PBS 500 μL重悬细胞,37 ℃避光孵育60 min;离心,弃上清,用500 μL PBS重悬细胞,应用流式细胞仪测定细胞周期,并用FlowJo软件(8.1.1版本)进行数据分析。
1.3.4应用EdU Incorporation法检测GUTK对静止期LNCaP细胞重新进入S期的影响将静止期人前列腺癌细胞LNCaP(2.5×105个细胞/孔)接种于6孔板中使其重新进入细胞周期,同时分别给予5 μM/10 μM GUTK和DMSO处理细胞72 h;在收集细胞前8 h加入10 μM 5-ethynyl-2′-deoxyuridine(EdU)进行孵育,收集细胞后按照试剂盒的要求进行染色,应用流式细胞仪检测,并用FlowJo软件(8.1.1版本)进行数据分析。
1.3.5Western Blotting检测Cyclin D1/3、CDK4/6和E2F1蛋白的表达水平在LNCaP细胞从静止期释放的同时,分别给予5 μM/10 μM GUTK和DMSO处理细胞1~48 h。同时取处于对数生长期的LNCaP细胞作为增殖期的细胞对照;收集细胞到1.5 mL的管中,离心,弃上清液;将RIPA细胞裂解液和去磷酸酶抑制剂、蛋白酶抑制剂和PMSF按照100∶1∶1∶1混合均匀;加入不同的细胞样品中,反复吹打并涡旋,置冰上裂解20 min;离心20 min,弃沉淀;采用BCA法测定蛋白浓度,取20 μg蛋白样品与蛋白上样缓冲液混合,置于99 ℃金属浴煮蛋白8 min;对样品进行电泳,转膜和封闭并孵育一抗,4 ℃摇床上孵育过夜;TBST洗膜3次,每次15 min,室温摇床上孵育二抗60 min;TBST洗膜3次,每次15 min;将ECL的A液和B液混合,滴加在膜上,放入成像仪进行曝光。
1.3.6统计学分析实验数据均用平均值±标准差表示,采用Excel 2013软件及SPSS 11.5统计软件进行分析。以Students′ t-test方法进行2组间的比较,用one-way ANOVA进行多组间的方差分析,P<0.05或P<0.01为具有统计学意义的标准。
2 结果
2.1GUTK抑制静止期LNCaP细胞的再次增殖Ki-67为核增殖标志蛋白,细胞处于增殖期(G0/1、S和G2/M期)时其表达呈阳性,处于静止期(G0期)时呈阴性。结果如图1所示,在去血清培养7d的静止期LNCaP细胞中,Ki-67蛋白表达呈阳性的细胞很少(图1A)。当静止期LNCaP细胞重新进入细胞周期的过程中,以5 μM/10 μM的GUTK或DMSO分别作用72 h后,可见DMSO组的大部分细胞都已经重新处于增殖期,Ki-67蛋白表达呈阳性的细胞明显增多(图1B)。而GUTK可以呈剂量依赖性的减少Ki-67蛋白表达呈阳性的细胞,说明GUTK可以抑制静止期LNCaP细胞重新增殖(图1C,图1D)。
2.2GUTK阻碍静止期LNCaP细胞重新启动细胞周期进程2.1的结果证明GUTK抑制静止期LNCaP细胞的再次增殖,表明GUTK有可能影响了静止期前列腺癌LNCaP细胞重新启动细胞周期的进程。我们通过PI染色的流式分析法检测GUTK在静止期LNCaP细胞激活的过程中对周期分布的影响。结果如表1所示,在去血清培养7 d的静止期LNCaP细胞中,G0/1、S和G2/M期的细胞比例分别为90.7%、2.2%和5.1%。在静止期LNCaP细胞重新进入细胞周期的过程中,以5 μM/10 μM的GUTK或DMSO分别作用72 h后,可见DMSO组的G0/1期细胞减少至69.0%,S和G2/M期的细胞比例增加至13.4%和17.3%,与静止期LNCaP细胞的周期分布差异具有统计学意义(*P<0.05),说明G0/1期细胞已经重新进入细胞周期。而5 μM和10 μM GUTK组的G0/1期细胞明显高于DMSO组,分别为81.5%和84.4%(△P<0.05),S和G2/M期的细胞比例也较DMSO组有明显的降低(△P<0.05)。以上结果说明,GUTK可以呈剂量依赖性地阻止G0/1期细胞的减少,以及S和G2/M期细胞的增多,说明GUTK可以阻碍静止期LNCaP细胞重新启动细胞周期的进程。
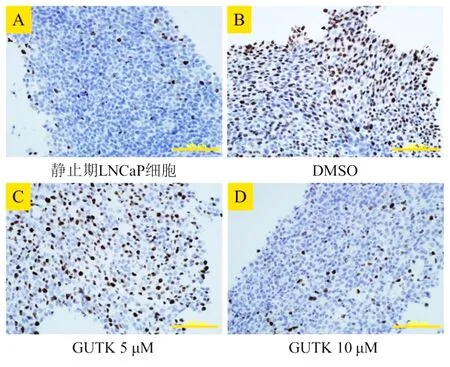
图1 免疫细胞化学法检测Ki-67蛋白的表达水平
注:标尺=100 μm。

表1 PI染色的流式分析法检测细胞周期分布
注:3次独立实验的数据以“平均值±标准差”表示,与静止期LNCaP细胞组比较*P<0.05;与DMSO组比较△P<0.05。
2.3GUTK阻碍静止期LNCaP细胞重新进入S期EdU可以在DNA合成时插入染色体,并通过荧光检测进行定量分析。为了进一步探索GUTK是如何阻碍静止期LNCaP细胞重新启动细胞周期的进程,我们采用EdU Incorporation的方法检测GUTK是否可以阻碍静止期LNCaP细胞重新进入S期。结果如图2所示,在去血清培养7 d的静止期LNCaP细胞中处于S期的细胞比例很低。当静止期LNCaP细胞重新进入细胞周期的过程中,以5 μM/10 μM的GUTK或DMSO分别作用72 h后,可见DMSO组的S期细胞有了明显增加,与静止期LNCaP细胞组相比具有统计学意义(*P<0.05),说明细胞重新进入S期。而GUTK可以呈剂量依赖性地抑制S期细胞的增多,与DMSO组比较具有统计学意义(△P<0.05),且GUTK高剂量组的作用明显优于低剂量组(△P<0.05),说明GUTK可以阻碍静止期LNCaP细胞重新进入S期,并且具有较好的剂量依赖性。

图2 EdU Incorporation法检测处于S期的细胞比例
注:3次独立实验的数据以“平均值±标准差”表示,与静止期LNCaP细胞组比较*P<0.05;与DMSO组比较△P<0.05;与GUTK 5 μM组比较△P<0.05。
2.4GUTK在静止期LNCaP细胞激活的早期下调Cyclin D1/3、CDK4/6和E2F1蛋白的表达水平Cyclin(周期蛋白)/CDK(cyclin-dependent kinases,周期蛋白依赖性蛋白激酶)-E2F1通路在静止期细胞重新激活的过程中起到了关键的调节作用[4]。为了进一步探讨GUTK抑制静止期前列腺癌LNCaP细胞激活的作用机制,我们对这一通路的主要蛋白进行了检测。结果如图3所示,增殖期LNCaP细胞(Cont)中Cyclin D1/3,Cyclin E1和CDK4/6/2的表达水平均高于静止期LNCaP细胞(Qsct)。在细胞重新进入细胞周期的过程中,这些蛋白的表达量分别在6 h到12 h开始增加,Cyclin-CDK复合物被激活,增加了E2F1蛋白的表达,促使静止期细胞重新进入细胞周期。而以5 μM/10 μM GUTK处理的LNCaP细胞,有效抑制了Cyclin D1/3,Cyclin E1和CDK4/2蛋白表达的增加,从而抑制了E2F1的增加。但对CDK6的作用不明显。以上结果可以表明,GUTK在静止期LNCaP细胞重新启动细胞周期进程的早期,通过调控Cyclin/CDK-E2F1通路的主要蛋白,从而抑制静止期人前列腺癌细胞LNCaP重新激活。

图3 Western Blotting检测Cyclin D1/3、CDK4/6和E2F1蛋白的表达水平
注:α-Tubulin为上样内参,Cont为增殖期的LNCaP细胞,Qsct代表静止期的LNCaP细胞。
3 讨论
静止期(G0/1)细胞可以重新启动细胞周期进程,分裂出新的子代细胞用以替代受损的细胞或已经发生功能转化的细胞[15]。类似地,静止期肿瘤细胞重新进入细胞周期也是癌细胞实现自我更新的重要机制,这就导致了癌症病程的进展以及癌症的复发,此外还可以降低癌细胞对放化疗的敏感性。但是,目前临床上还没有针对于静止期肿瘤细胞的治疗药物。为了发现和研究针对抑制静止期前列腺癌细胞激活的药物,我们建立了体外静止期前列腺癌细胞模型,并对藤黄属化合物进行了活性筛选,希望可以发现活性化合物,为延缓前列腺癌的病情发展和预防复发提供新的治疗策略。
在静止期细胞重新激活回到细胞周期的过程中,有很多蛋白参与调控了细胞周期的进程。促有丝分裂信号会激活Cyclin/CDK复合物,Cyclin/CDK复合物将调控细胞依次通过G0/1、S、G2和M期,完成整个细胞周期进程。Cyclin只有和CDKs形成复合物时才具有活性。形成的Cyclin-CDK复合物通过激活或抑制目的蛋白的活性,从而推动细胞周期进程有序进行。此外,Cyclin-CDK复合物还可通过泛素化降解可以抑制细胞周期进程的蛋白活性。G0期的细胞在促有丝分裂信号的刺激下,Cyclin-CDK复合物被激活并磷酸化视网膜细胞瘤蛋白Rb,导致真核生物转录因子2(E2F)的释放[16]。E2F会进一步激活其下游的靶基因[17],包括促进DNA复制的基因,从而促进细胞进入S期并启动细胞周期进程。GUTK可以在静止期LNCaP细胞激活的早期就明显下调Cyclin D1/3、CDK4/6和E2F1蛋白的表达水平,从而抑制静止期LNCaP细胞激活。但是,GUTK是如何调控这一通路的作用机制,还需要进一步的研究。
[1]R.L.Siegel,K.D.Miller,A.Jemal.Cancer statistics,2015[J].CA Cancer J Clin,2015,65(1):5-29.
[2]韩苏军,张思维,陈万青,等.中国前列腺癌发病现状和流行趋势分析[J].临床肿瘤学杂志,2013,18(4):330-334.
[3]M.R.Cooperberg,J.E.Cowan,J.F.Hilton,et al.Outcomes of active surveillance for men with intermediate-risk prostate cancer[J].J Clin Oncol,2011,29(2):228-234.
[4]M.Malumbres,M.Barbacid.To cycle or not to cycle:a critical decision in cancer[J].Nat Rev Cancer,2001,1(3):222-231.
[5]R.C.Jackson.The problem of the quiescent cancer cell[J].Adv Enzyme Regul,1989,29:27-46.
[6]L.Sang,J.M.Roberts,H.A.Coller.Hijacking HES1:how tumors co-opt the anti-differentiation strategies of quiescent cells[J].Trends Mol Med,2010,16(1):17-26.
[7]R.R.Berges,J.Vukanovic,J.I.Epstein,et al.Implication of Cell Kinetic Changes During the Progression of Human Prostatic Cancer[J].Clin Cancer Res,1995,1(5):473-480.
[8]X.Wang,Y.Lao,N.Xu,et al.Oblongifolin C inhibits metastasis by up-regulating keratin 18 and tubulins[J].Sci Rep,2015,5:10293.
[9]W.Xu,M.Cheng,Y.Lao,et al.DNA damage and ER stress contribute to oblongifolin C-induced cell killing in Bax/Bak-deficient cells[J].Biochem Biophys Res Commun,2015,457(3):300-306.
[10]Y.Lao,G.Wan,Z.Liu,et al.The natural compound oblongifolin C inhibits autophagic flux and enhances antitumor efficacy of nutrient deprivation[J].Autophagy,2014,10(5):736-749.
[11]L.Xu,Y.Lao,Y.Zhao,et al.Screening Active Compounds from Garcinia Species Native to China Reveals Novel Compounds Targeting the STAT/JAK Signaling Pathway[J].Biomed Res Int,2015:910453.
[12]M.Wu,Y.Lao,N.Xu,et al.Guttiferone K induces autophagy and sensitizes cancer cells to nutrient stress-induced cell death[J].Phytomedicine,2015,22(10):902-910.
[13]X.Li,Y.Lao,H.Zhang,et al.The natural compound Guttiferone F sensitizes prostate cancer to starvation induced apoptosis via calcium and JNK elevation[J].BMC Cancer,2015,15:254.
[14]K.Shen,J.Xie,H.Wang,et al.Cambogin Induces Caspase-Independent Apoptosis through the ROS/JNK Pathway and Epigenetic Regulation in Breast Cancer Cells[J].Mol Cancer Ther,2015,14(7):1738-1749.
[15]J.H.Meserve,R.J.Duronio.Scalloped and Yorkie are required for cell cycle re-entry of quiescent cells after tissue damage[J].Development,2015,142(16):2740-2751.
[16]L.Zhan,Y.Zhang,W.Wang,et al.E2F1:a promising regulator in ovarian carcinoma[J].Tumour Biol,2016,37(3):2823-31.
[17]L.Magri,V.A.Swiss,B.Jablonska,et al.E2F1 coregulates cell cycle genes and chromatin components during the transition of oligodendrocyte progenitors from proliferation to differentiation[J].J Neurosci,2014,34(4):1481-1493.
(2016-07-05收稿责任编辑:洪志强)
Effect of Guttiferone K on Inhibiting Reactivation of Quiescent Prostate Cancer Cells
Xi Zhichao1,2,Yao Mu3,Li Yang1,2,Cai Shuangfan1,2,Wu Rong1,2,Lao Yuanzhi1,2,Dong Qihan3,4,Xu Hongxi1,2
(1SchoolofPharmacy,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China; 2EngineeringResearchCenterofShanghaiCollegesforTCMNewDrugDiscovery,Shanghai201203,China; 3TheUniversity
Objective:To investigate the effect of Guttiferone K(GUTK),a polycyclic polyprenylated acylphloroglucinol(PPAPs)compound isolated from Garcinia yunnanensis,on inhibiting reactivation of quiescent prostate cancer LNCaP cells.Methods:LNCaP cells were induced into a quiescent stage by seven days of serum withdrawal and stimulated cell cycle re-entry with or without GUTK by serum restoration.Ki-67 protein expression level was detected by Immunocytochemistry.Flow cytometry of Propidium iodide(PI)staining and EdU Incorporation assay were used to analyze cell cycle phase distribution.Protein levels of Cyclin D1/3、CDK4/6 and E2F1 were detected by Western blotting.Results:GUTK dose-dependently blocked the re-proliferation and S phase re-entry of quiescent LNCaP cells.GUTK decreased the Cyclin D1/3、CDK4/6 and E2F1 protein levels during quiescent LNCaP cell cycle re-entry.Conclusion:GUTK,a compound isolated from Garcinia yunnanensis,has the potential to inhibit cancer progression and prevent cancer recurrence by suppressing cell cycle re-entry of quiescent prostate cancer LNCaP cells.
Garcinia yunnanensis; Guttiferone K; Quiescent cancer cell; Prostate cancer
国家自然科学基金重点项目(编号:81130069);国家自然科学基金面上项目(编号:81173485)
席志超(1987.11—),女,博士研究生,研究方向:中药抗肿瘤机制研究,E-mail:xizhichaohaerbin@163.com
徐宏喜(1961.07—),男,博士,教授,院长,研究方向:中药活性成分及药理作用机制研究,E-mail:xuhongxi88@gmail.com
R285
A doi:10.3969/j.issn.1673-7202.2016.07.005
