‘KRS’芒果发育过程中糖积累与代谢相关酶活性的关系
2016-08-11武红霞姚全胜王松标马小卫詹儒林
武红霞,姚全胜,王松标,马小卫,詹儒林
(中国热带农业科学院南亚热带作物研究所,农业部热带果树生物学重点实验室,广东湛江 524091)
‘KRS’芒果发育过程中糖积累与代谢相关酶活性的关系
武红霞,姚全胜,王松标,马小卫,詹儒林
(中国热带农业科学院南亚热带作物研究所,农业部热带果树生物学重点实验室,广东湛江 524091)
[目的]探讨芒果果实糖积累和转化的生理机制。[方法]以‘KRS’芒为试材,研究芒果果实生长发育和成熟过程中的淀粉、蔗糖、葡萄糖和果糖含量变化,与淀粉酶、蔗糖代谢相关酶——酸性转化酶(AI)、中性转化酶(NI)、蔗糖合成酶(SS)和蔗糖磷酸合成酶(SPS)活性的相关性。[结果]果实发育前期‘KRS’主要积累淀粉、葡萄糖和果糖,成熟时淀粉酶活性降至最低,淀粉水解快速积累蔗糖。在整个发育过程中AI活性维持最高,完熟时降低,SPS在果实发育中期略有降低,完熟时升至最高,SS和NI一直很低且较稳定。相关性分析表明淀粉含量与酸性转化酶活性呈显著正相关;蔗糖、葡萄糖含量与SPS、SS呈极显著正相关;果糖含量与SS、AI均呈极显著正相关。[结论]芒果成熟时淀粉分解、AI活性降低和SPS、SS活性的增加是引起‘KRS’果实蔗糖积累的主要因子。
芒果;糖积累;转化酶;蔗糖合成酶;蔗糖磷酸合成酶
芒果是著名的热带果树。我国是主要的芒果生产国之一,芒果广泛分布在我国海南、云南、广西、广东、福建、四川和贵州等热带亚热带区域。从每年2月(海南三亚)至10月(四川攀枝花和云南华坪),我国芒果果品基本可实现周年供应,极大地满足了市场需求,芒果产业发展优势和潜力十分明显。
蔗糖代谢相关酶如酸性转化酶(AI)、中性转化酶(NI)、蔗糖合成酶(SS)和蔗糖磷酸合成酶(SPS)对果实中糖的代谢和积累具有重要影响。有关糖积累与蔗糖代谢相关酶的关系在荔枝[1-2]、龙眼[3]、香蕉[4-5]、菠萝[6]等热带果树中已有报道。在国外,Fuchs等[7-8]报道,芒果果实发育过程中单果重和淀粉酶活性增加,成熟时淀粉降解其淀粉含量降低,还原糖增加,在蔗糖的快速积累阶段SPS活性增加了10倍,AI活性降低。中国热带农业科学院南亚热带作物研究所成员已报道芒果成熟阶段的糖代谢及相关酶活性[9-10],果实成熟时淀粉水解,蔗糖含量快速增加,SPS和SS酶活性升高,AI活性降低。他们收集的芒果种质资源丰富,已超过200份。不同种质资源果实所积累的糖的含量及比率是决定其品质和商品价值的主要因素。前期研究中,人们根据果实成熟时单糖、双糖比例将芒果种质分为不同糖积累型,其中台农1号属于蔗糖积累类型,‘KRS’属于己糖积累型[11],同时对台农1号果实发育成熟过程中的糖分及相关代谢酶活性进行研究,结果表明芒果成熟时淀粉分解、AI活性降低,SPS和SS活性增加是引起果实蔗糖积累的主要因子[12]。‘KRS’芒果是20世纪90年代中国热带农业科学院南亚热带作物研究所从澳大利亚引进的芒果品种,果实卵圆形,品质优良。但‘KRS’芒果实果实生长发育过程中糖积累及相关酶活性是否不同于台农1号糖积累尚未明确。鉴于此,中国热带农业科学院南亚热带作物研究所成员以‘KRS’芒果品种为试材,研究了果实发育成熟过程中糖积累和代谢相关酶活性的关系,旨在为生产实践中栽培措施的改良提供参考。
1 材料与方法
1.1材料试验于2011年在中国热带农业科学院南亚热带作物研究所芒果种质资源圃进行,选用12年生的‘KRS’嫁接苗为材料,株距4 m,行距5 m,生长结果正常,常规田间管理。
1.2方法
1.2.1样品采集。盛花时选择树冠大小、花期基本一致的健壮植株挂牌,从盛花后40 d开始,每隔10 d取样1次,直到果实青熟采收,常温放置成熟。每次随机采10~15个果实,带回实验室,去除果皮后取果肉,混匀后用液氮速冻,置于-80 ℃超低温冰箱中保存备用。试验设3次重复。
1.2.2测定指标与方法。葡萄糖、果糖、蔗糖的测定参照张秀梅等[6]的方法;蔗糖代谢相关酶活性的测定参照王惠聪等[2,6]的方法;淀粉酶活性的测定参照李雯等[13]的方法;淀粉含量的测定参照徐昌杰等[14]的方法。
2 结果与分析
2.1芒果果实发育期各组成糖分累积动态特征
2.1.1淀粉含量。由图1可知,盛花后40 d,淀粉含量最低,仅17.90 mg/g,除果实发育100 d,淀粉含量略有降低,随着果实的发育至120 d,淀粉含量一直呈上升趋势,120 d淀粉含量最高,达419.60 mg/g FW,完熟时淀粉含量仅为5.60 mg/g FW,降至最低,说明随着果实的发育进程,淀粉含量快速积累,果实完熟时淀粉分解转化成糖。
2.1.2可溶性糖类含量。芒果可溶性糖包括葡萄糖、果糖和蔗糖,对于果实品质起着重要作用。随着果实发育成熟进程,蔗糖、葡萄糖和果糖表现出不同的变化规律(图1)。‘KRS’果实发育至采收时,几乎没有蔗糖的积累,随着果实的成熟,蔗糖快速积累,其含量达最高(64.45 mg/g FW)。在整个果实发育过程中,葡萄糖含量变化较平稳,在4.90~10.90 mg/g FW波动,仅在果实完熟时迅速升至最高,达21.60 mg/g FW。在果实发育前期(花后40~70 d),果糖含量变化平稳,果实发育70 d 至青熟时,果糖含量一直上升,完熟升至最高,达47.68 mg/g FW。可见,果实发育前期主要积累淀粉、葡萄糖和果糖,果实采后完熟阶段,淀粉分解,蔗糖快速积累。

图1 ‘KRS’果实发育过程中淀粉和可溶性糖含量的变化Fig.1 The change of starch and soluble sugar content in ‘KRS’ fruit development process
2.2芒果果实发育期糖代谢相关酶活性动态特征
2.2.1淀粉酶活性。淀粉酶活性在果实发育过程中,花后40~70 d 时淀粉酶活性快速升高,70 d 时达428.3 mg/g·s,70~90 d 时淀粉酶活性降低,90~120 d 时淀粉酶活性变化较平稳,完熟时淀粉酶活性快速降低,仅为150.8 mg/g·s(图2)。
2.2.2蔗糖代谢相关酶活性。由图3可知,在果实发育过程中,在果实发育40~60 d 时蔗糖磷酸合成酶活性快速升高,60 d 时达最大,为10.60 mg/g·h,花后60~120 d 时基本呈降低的趋势,100 d 时酶活性最低,为5.66 mg/g·h,至完熟时升至最高,达19.00 mg/g·h。花后40~110 d 时蔗糖合成酶活性变化较平稳,在2.30~4.90 mg/g·h,完熟时升至最高,为11.90 mg/g·h。整个果实发育过程中,蔗糖磷酸合成酶活性高于蔗糖合成酶,说明参与蔗糖合成的酶以蔗糖磷酸合成酶为主。

图2 ‘KRS’果实发育过程中淀粉酶活性的变化Fig.2 The change of amylase activity in ‘KRS’ fruit development process
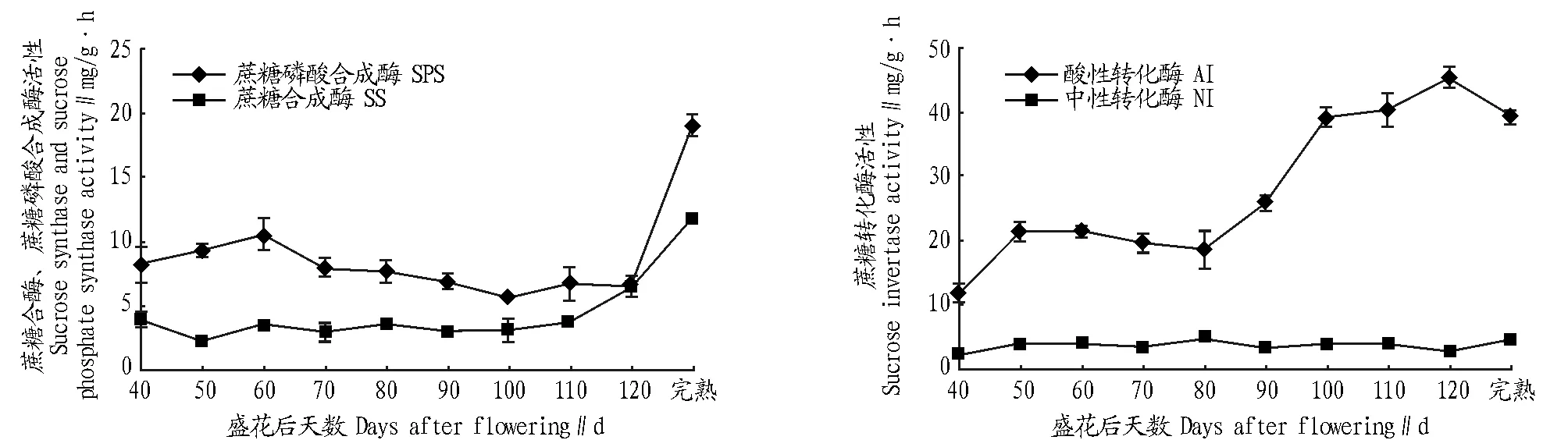
图3 ‘KRS’果实发育中糖代谢相关酶活性的变化Fig.3 The change of metabolism related enzyme activity in ‘KRS’ fruit development process
在整个果实发育过程中,酸性转化酶活性呈升高的趋势,花后40~50 d 时快速升高,花后60~80 d 时变化较平稳,花后80~120 d 时快速升高,120 d 时活性达45.50 mg/g·h,果实完熟时降低至39.20 mg/g·h。在整个发育成熟过程中,中性转化酶活性变化不大,维持在2.10~4.50 mg/g·h。总体来说,酸性转化酶活性远高于中性转化酶,说明蔗糖分解酶类以酸性转化酶为主。
2.2.3糖分与相关酶活性的关系。由表1可知,蔗糖含量与蔗糖磷酸合成酶和蔗糖合成酶活性均呈极显著正相关;葡萄糖含量与蔗糖磷酸合成酶和蔗糖合成酶活性均呈极显著正相关;果糖含量与蔗糖合成酶和酸性转化酶活性均呈极显著正相关,淀粉含量与酸性转化酶呈显著正相关。

表1 芒果果实糖和酶活性的相关性
注:*表示P<0.05;**表示P<0.01。
Note:* stands forP<0.05;** stands forP<0.01.
3 讨论
芒果属于呼吸跃变型果实,其糖积累类型为淀粉转化型[15],芒果果实发育S模式的快速生长阶段以积累淀粉为主。果实接近青熟时,芒果淀粉酶活性增加,淀粉水解作用加强,使成熟时芒果果实蔗糖、葡萄糖和果糖含量增加。果实成熟时蔗糖快速增加,占总糖的60%~75%。芒果果实发育过程中单果质量和淀粉酶活性增加,成熟时淀粉含量降低,还原糖和非还原糖增加[7]。Ito等[16]报道在果实发育过程中叶绿体中的淀粉含量增加,成熟时几乎完全水解为糖,未成熟阶段Alphonso 芒果淀粉含量为14%,成熟时仅为0.3%。成熟的Irwin芒果实几乎未检测到淀粉含量,而蔗糖含量显著增加。Haden芒成熟过程中,淀粉降解、还原糖增加,在蔗糖的快速积累阶段SPS活性增加了10倍,SS活性较稳定,AI活性在完熟时降低[8],这与笔者所在研究所之前报道的粤西1号、Irwin芒[9-10]结果相似。该研究中,在‘KRS’芒果果实快速生长期,AI活性一直较高使果实发育过程中蔗糖积累很少,果糖和葡萄糖积累较多,果实快速积累淀粉,在采收青熟时淀粉含量达最高,成熟时淀粉水解,淀粉酶活性和淀粉含量降低转化为蔗糖,使蔗糖快速积累,与蔗糖合成酶和蔗糖磷酸合成酶活性升高相一致。这与Keitt芒的研究结果相似[17-18]。该研究结果与台农1号芒果的糖积累规律相似,笔者推测不同糖积累类型的品种其糖的动态变化与相关酶活性相似。
高活性的转化酶与果实的快速膨大相关[19],‘KRS’果实从幼果期至快速膨大期,较高的酸性转化酶活性使果实中蔗糖的含量很低,蔗糖转化酶活性增强,是由于该时期运输到果实中的蔗糖主要用于分解,产生能量以供果实膨大生长的需要。这与南瓜[20]、香瓜[21]和葡萄[22]等植物中的研究结果相似。转化酶的活性下降是蔗糖积累的前提条件,在果实成熟期‘KRS’芒存在明显的蔗糖积累转折点,蔗糖积累的同时伴随着蔗糖合成酶和蔗糖磷酸合成酶活性的升高及酸性转化酶活性的下降。此时运输到果实中的蔗糖被贮存起来,这与桃[23]、芒果[18]等果实上的试验结果相似。
4 结论
芒果是淀粉转化型果实,随着果实的生长发育,‘KRS’芒果快速积累淀粉,青熟时达最高,完熟时显著降低;在果实快速生长阶段蔗糖磷酸合成酶活性略有降低,完熟时升至最高,蔗糖合成酶活性变化较小,果实成熟时快速升高;在果实发育过程中酸性转化酶活性一直维持较高,完熟时显著降低;中性转化酶变化平稳且一直较低。果实发育过程中酸性转化酶对蔗糖的影响较大,蔗糖的积累很少,果糖和葡萄糖积累较多,完熟时淀粉酶活性降低,淀粉水解转化成蔗糖,这与蔗糖合成酶和蔗糖磷酸合成酶活性升高一致。综上所述,芒果成熟时淀粉分解、酸性转化酶活性降低,蔗糖合成酶和蔗糖磷酸合成酶活性增加,是引起‘KRS’果实蔗糖积累的主要因子。
[1] 李建国,罗诗,袁炜群.荔枝果实成熟期间糖积累和糖代谢相关酶活性变化[J].华南农业大学学报,2003,24(2):87-88.
[2] 王惠聪,黄辉白,黄旭明.荔枝果实的糖积累与相关酶活性[J].园艺学报,2003,30(1):1-5.
[3] 刘丽琴,李伟才,舒波,等.蔗糖代谢相关酶在‘石硖’龙眼假种皮糖积累中的作用[J].果树学报,2015(4):653-657.
[4] HUBBARD N L,PHARR D M,HUBER S C.Role of sucrose phosphate synthase in sucrose biosynthesis in ripening bananas and its relationship to the respiratory climacteric[J].Plant physiol,1990,94:201-208.
[5] 袁扬静,胡玉林,谢江辉.温度对采后香蕉果实糖代谢及其酶活性的影响[J].热带作物学报,2011,32(1):66-70.
[6] 张秀梅,杜丽清,谢江辉,等.蔗糖代谢相关酶在卡因菠萝果实糖积累中的作用[J].果树学报,2006,23(5):707-710.
[7] FUCHS Y,PESIS E,ZAUBERMAN G.Changes in amylase activity,starch and sugars contents in mango fruit pulp[J].Scientia horticulturae,1980,13(2):155-160.
[8] CASTRILLO M,KRUGER N J,WHATLEY F R.Sucrose metabolism in mango fruit during ripening[J].Plant science,1992,84(1):45-51.
[9] 魏长宾,武红霞,马蔚红,等.芒果成熟阶段蔗糖代谢及其相关酶类研究[J].西南农业学报,2008,21(4):972-974.
[10] 魏长宾,武红霞,马蔚红,等.粤西1号芒果成熟阶段的蔗糖代谢[J].热带作物学报,2009,30(6):735-739.
[11] 武红霞,邢姗姗,王松标,等.芒果种质资源糖积累的基因型差异分析[J].中国农学通报,2011,27(10):266-270.
[12] 武红霞,邢姗姗,王松标,等.‘台农1号’芒果果实发育过程中的糖分积累与相关酶活性研究[J].西北植物学报,2011,31(9):1811-1815.
[13] 李雯,邵远志,陈维信.淀粉酶活性测定方法的改进[J].植物生理学通讯,2005,41(5):655-656.
[14] 徐昌杰,陈文峻,陈昆松,等.淀粉含量测定的一种简便方法:碘显色法[J].生物技术,1998,8(2):41-43.
[15] 张上隆,陈昆松.果实品质形成与调控的分子生理[M].北京:中国农业出版社,2007:1-2.
[16] ITO T,SASAKI,K,YOSHIDA Y.Changes in respiration rate,saccharide and organic acid content during the development and ripening of mango fruit (MangiferaindicaL.cv.‘Irwin’)cultured in a plastic house[J].Journal of the Japanese society for horticultural science,1997,66:629-635.
[17] MEDLICOTT A P,THOMPSON A K.Analysis of sugar and organic acids in ripening mango fruit(MangiferaindicaL.cv.‘Keitt’)by high performance liquid chromatography[J].Journal of the science of food and agriculture,1985,36:561-566.
[18] CORDENUNSI B R.Starch mobilization and sucrose accumulation in the pulp ofKeittmangoesduring postharvest ripening[J].Journal of food biochemistry,2008:32(3):384-395.
[19] KRISHNAN H B,PUEPPKE S G.Cherry fruit invertase:Partial purification,characterization and activity during fruit development[J].Journal of plant physiology,1990,135(6):662-666.
[20] 孙守如,杨子琴,张菊平,等.南瓜果实发育过程中糖代谢及相关酶活性的变化[J].西北农林科技大学学报(自然科学版),2008,36(6):159-164.
[21] SCHAFFER A A,ALINI B,FOGELMAN E.Sucrose metabolism and accumulation in developing fruit ofCucumis[J].Phytochem,1987,26:1883-1887.
[22] 闫梅玲,王振平,范永,等.蔗糖代谢相关酶在赤霞珠葡萄果实糖积累中的作用[J].果树学报,2010(5):703-707.
[23] MORIGUCHI T,SANADA T,YAMAKI S.Seasonal fluctuation of some enzymes relating to sucrose and sorbitol metabolism in peach fruit[J].Amer Soc Hort Sci,1990,115:278-281.
The Relationship between Sugar Accumulation and Related Enzyme Activities during the Development Process of ‘KRS’Mango Fruits
WU Hong-xia, YAO Quan-sheng, WANG Song-biao et al
(Key Laboratory of Tropical Fruit Biology of Ministry of Agriculture, South Subtropical Crops Research Institute, CATAS, Zhanjiang,Guangdong 524091)
[Objective] The aim was to discuss physiological mechanism of sugar accumulation and transformation in mango fruit. [Method]The relationship between the contents of starch, sucrose, glucose and fructose, and the activities of amylase, sucrose metabolizing enzymes including acid invertase (AI), neutral invertase (NI), sucrose synthase(SS) and sucrose phosphate synthase(SPS) during fruit development process in KRS mango were studied. [Result] The results showed that starch, fructose and glucose accumulated at the early stage of fruit development, amylase activity dropped to minimum along with the starch decomposition and sucrose accumulated at the ripening stage. The activities of AI maintained higher throughout the developmental stage, dropped slightly at the ripening stage. The SPS activities dropped slightly in middle stage of fruit development, then raised to the highest at the ripening stage. The activities of SS and NI maintained minimum and changed very little throughout the development process. The starch content had positive correlation with amylase. The contents of sucrose and glucose had significantly positive correlation with the activities of SPS and SS. The content of fructose had significantly positive correlation with SS and AI. [Conclusion] Decomposition in starch, reduction in AI, increment in SS and SPS activities are responsible for sucrose accumulation in developing fruits of mango ‘KRS’.
Mango; Sugar accumulation; Invertase; Sucrose synthetase; Sucrose phosphate synthase
农业行业科研专项子项目(201203092-3);广东省自然科学基金粤东西北创新人才联合培养项目(2016A030307006);科研院所基本科研业务费专项(1630062015001,1630062015007)。
武红霞(1975- ),女,山西万荣人,副研究员,博士,从事果树品质生理与栽培技术研究。
2016-04-29
S 601
A
0517-6611(2016)17-024-03
