海岛棉基于双色FISH的核型分析
2016-08-10肖水平王坤波柯兴盛刘新稳孙亮庆杨绍群
肖水平,王坤波,柯兴盛,杨 磊,刘新稳,孙亮庆,杨绍群,陈 宜*
(1.江西省棉花研究所/国家棉花产业技术体系鄱阳湖综合试验站,江西 九江 332105;2.中国农业科学院 棉花研究所/棉花生物学国家重点实验室,河南 安阳 455000)
海岛棉基于双色FISH的核型分析
肖水平1,2,王坤波2,柯兴盛1,杨 磊1,刘新稳1,孙亮庆1,杨绍群1,陈 宜1*
(1.江西省棉花研究所/国家棉花产业技术体系鄱阳湖综合试验站,江西 九江 332105;2.中国农业科学院 棉花研究所/棉花生物学国家重点实验室,河南 安阳 455000)
摘要:以45S rDNA作探针对海岛棉体细胞中期染色体进行荧光原位杂交(Fluorescence in situ Hybridization,FISH),检测出6个强的荧光信号(4大2小),结合DAPI图像观察发现信号分布在各自染色体随体位置,称为NOR(Nucleolar Organizer Region)信号。以二倍体A基因组棉种亚洲棉基因组DNA(gDNA)为探针对海岛棉进行FISH,结果发现52条染色体中有无杂交信号的各占一半,荧光信号分布在较长的A亚组染色体上,直接区分开海岛棉A、D亚组染色体,直观证实了海岛棉的异源双二倍体起源。以45S rDNA和A组棉种亚洲棉gDNA作探针对海岛棉进行双色FISH时,结果发现海岛棉染色体上既检测到了6个强的NOR信号又检测出了gDNA杂交信号,且清楚观察到2个NOR信号分布在A亚组上,另4个在D亚组上。基于该双色FISH图像的核型分析表明,海岛棉的核型公式为:2n=4x=52=40m(2 SAT)+12sm(4 SAT),属于2A类型,且有3对随体,其中1对定位于A9号染色体,属于中部着丝点(m)类型;另2对分别定位于D8和D12号染色体上,属于近中部着丝点(sm)类型;且发现海岛棉A亚组染色体的相对长度的并非全部大于D亚组,两亚组染色体间在长度上存在交叉,说明基于FISH的核型分析比传统方法更为准确。
关键词:海岛棉;45S rDNA;gDNA;FISH;核型分析
目前,棉属(GossypiumL.)已经定名的种(亚种)共51个[1],其中二倍体棉种(2n=2x=26)46个,包括A~G及K共8个基因组;另外四倍体(2n=4x=52)棉种5个,包括2个栽培棉种,3个野生棉种,其中海岛棉是目前世界上大面积种植的主要栽培种之一。研究表明,海岛棉染色体由异源双二倍体组成[2-3],用(AD)2表示。二倍体A和D基因组则分别是四倍体棉种A和D亚组的供体种[4-5]。
Beasley[6]和Phillips[7]在关于棉种的细胞学研究中,发现A组棉种的染色体大于D组棉种。Kadir等[8]通过棉种的基因组DNA(genomic DNA,简称gDNA)含量比较,也证实了A组棉种gDNA明显大于D组棉种。这为后来关于四倍体棉种核型分析中对确定A、D亚组染色体顺序编号提供了依据[9-10]。但王坤波等[11]在对陆地棉的核型分析中,发现仅仅依据核型图像中染色体的长短顺序确定四倍体棉种的A、D亚组未免有失偏颇,并提出了原位杂交(in situ hybridization)技术对四倍体棉A、D亚组的确定可能更为理想。
荧光原位杂交技术(Fluorescence in situ hybridization,简称FISH)于20世纪80年代中期开始应用于植物的研究当中,至今已经发展了近30年,在植物染色体识别、细胞遗传图谱构建、重复序列定位、物种起源与进化及基因组间亲缘关系等方面应用广泛[12-17]。
FISH技术在棉花上的应用远落后于其他作物,主要原因在于棉花在染色体制片过程中,其细胞质浓厚,细胞壁较坚硬,酶解细胞比较困难,再加上棉花染色体数目较多、且形态小。
本研究以45S rDNA和二倍体A基因组gDNA为探针对靶材料海岛棉根尖体细胞有丝分裂中期染色体进行FISH分析,旨在利用FISH技术对海岛棉染色体进行核型分析,为海岛棉遗传物理图谱的构建及亚组染色体的鉴定与识别提供更为准确的数据。
1材料与方法
1.1材料
用作探针的DNA为二倍体A基因组棉种亚洲棉“石系亚1号”,取自于中国农业科学院棉花研究所海南三亚野生棉种质圃;用作探针的45S rDNA是一个来源于拟南芥的克隆JHD2-15A(8.2 kb,BgⅠ+XhoⅠ片段,含拟南芥几乎全45S rDNA重复序列),由北京林业大学戴丝兰教授提供。用作原位杂交的靶材料为四倍体海岛棉品种“新海7号”根尖体细胞染色体。另外为了书写方便,本文图中所涉及到的原位杂交组合均按照“靶染色体-探针-封阻DNA”格式书写。
1.2探针的制备与标记
棉花gDNA的提取与纯化参照宋国立等[18]的方法,纯化后的棉花基因组总DNA经高压灭菌锅灭菌打断10 min,0.8%琼脂糖凝胶电泳检查片段大小,其大小要求在300~600 bp范围为宜。探针的标记:其中gDNA探针所用的标记物为DIG-11-dTUP(显示红色荧光),采用德国Roche公司的DIG-High-Prime标记系统对其进行标记,按其提供的标准流程操作;45S rDNA探针则采用该公司的biotion-Nick-Translation MIX(显示绿色荧光)标记系统对其进行标记,按其提供的标准流程操作。
1.3靶染色体的制备
染色体制片按王春英等[19]的方法稍加改进。取生长旺盛的根尖,用25×10-6的放线菌酮于20 ℃处理2 h,新鲜卡诺固定液于4 ℃下固定2~24 h。用4%的纤维素酶(Sigma)和0.5%的果胶酶(Sigma)在37 ℃下酶解1 h,水洗后,60%乙酸压片,液氮冷冻揭盖片,-20 ℃保存备用。
1.4原位杂交流程
荧光原位杂交流程参照王春英等[20]的操作方法进行。
1.5观察与图像处理
在荧光显微镜(Ziess Axioskop 2 plus)下观察各杂交信号,DAPI(4’,6-diamidino-2-phenylindole)、Avidin-Fluorescein和PI(propidium iodide)分别使用滤镜filter set 49、10和15观察。同时用ISIS(in situimaging system)软件拍摄并调节图片对比度和亮度。测量有丝分裂中期染色体的长度和臂比,染色体形态描述、核型分析参照李懋学等[21]的方法进行。同源染色体的序号确定,则以具有A基因组gDNA探针杂交信号的染色体为A亚组,无杂交信号的染色体为D亚组,两组均依据染色体长度从长到短进行编号。
2结果与分析
2.1海岛棉45S rDNA-FISH
以45S rDNA作探针,用鲑鱼精DNA(简称ssDNA)作封阻,对海岛棉根尖体细胞有丝分裂中期染色体进行FISH(图1-A),观察到6个强的绿色荧光信号(图中白色箭头所示),4个较大、2个稍小,全部位于染色体短臂端部,与DAPI(是一种与DNA特异结合的荧光染料,染色体被衬染成蓝色)图像进一步对比,发现所有信号均分布在各染色体的随体位置,称之为NOR信号(Nucleolar Organizer Region,即核仁组织区)[20],结果表明海岛棉有3对随体。
2.2海岛棉gDNA-FISH
以二倍体A组亚洲棉“石系亚1号”gDNA作探针,用ssDNA作封阻,对海岛棉体细胞中期染色体进行FISH(图1-B),结果发现海岛棉的52条染色体中,可以观察到强的红色杂交信号主要分布在较长的26条A亚组染色体上,而显示蓝色荧光信号(DAPI衬染)的则在较短的26条D亚染色体,直接将海岛棉A、D两亚组染色体区分开,直观证实了海岛棉的异源双二倍体起源[22],为后续的染色体核型分析奠定了基础。
2.3海岛棉基于双色FISH的核型分析
为了更准确地对海岛棉进行核型分析,笔者同时利用二倍体A组亚洲棉“石系亚1号”gDNA与45S rDNA作探针,ssDNA作封组,对海岛棉进行双色FISH(图1-C),结果发现不仅二倍体A组的gDNA探针杂交信号可以明显区分开海岛棉A、D亚组染色体,而且45S rDNA探针产生的6个NOR信号则清晰地定位在了3对染色体上,可以看到其中1对在A亚组上(图中绿色箭头),2对在D亚组上(图中白色箭头)。
基于该双色FISH结果,进一步获得了海岛棉的核型图(图1-D)和核型基本参数(表1),由图1和表1可知,海岛棉的染色体多为对称类型,在52条染色体中,中部着丝点类型(m)的有40条,其中A亚组占18条,D亚组占22条;近中部着丝点类型(sm)的有12条,其中A亚组占8条,D亚组占4条,无其他着丝点类型、两着丝点类型占总数的百分率依次为77%和23%,说明海岛棉染色体整体的对称程度很高,是一个比较原始的棉种。在其全部基因组中,染色体长度比(最长染色体与最短染色体的比值)为1.85,平均染色体相对长度为3.85。另外,在海岛棉全部基因组中,其臂比值最大的为2.11(A11号染色体),最小的为1.08(D9号染色体),平均臂比值为1.46。将A、D亚组分开分析,A亚组平均臂比值为1.58,D亚组的为1.32,前者大于后者。海岛棉的核型公式为:2n=4x=52=40m(2SAT)+12sm(4SAT),属于2A类型,海岛棉有3对随体,其中1对位于A亚组的第9号染色体,属于中部着丝点(m)类型;另2对分别位于D亚组的第8和12号染色体,属于近中部着丝点(sm)类型,且3对随体都分布在染色体短臂端部。基于双色FISH的核型参数分析,发现海岛棉D亚组核型的对称程度比A亚组的高,即D亚组中部着丝点染色体数多于A亚组,说明在进化程度上A亚组强于D亚组。
另外从核型参数表中发现,海岛棉A、D两亚组染色体在相对长度上存在一定程度的交叉现象,即较短染色体组的D亚组第1号(D1)染色体的相对长度(为3.70)大于A亚组染色体的最后2对(A12、A13号分别为3.69、3.62),前人的研究也发现过这种情况[23-24],这说明基于原位杂交的核型分析方法较传统的只按长度大小排序的方法更为准确可靠。
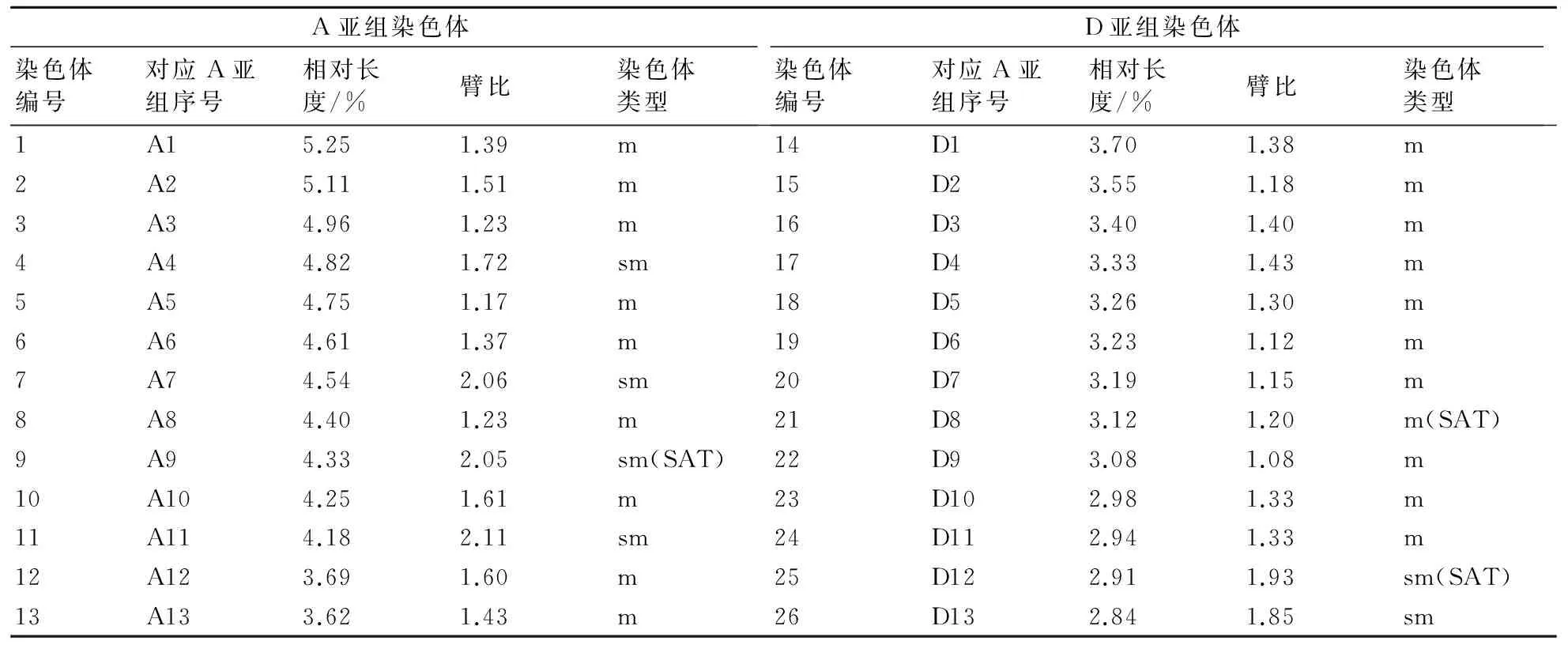
表1 海岛棉基于双色FISH核型参数
注:随体的长度不参与染色体全长的计算,m:中部着丝粒染色体,臂比范围1.01~1.7;sm:近中着丝粒染色体,臂比范围1.71~3.00;SAT:代表随体。
3结论与讨论
将本核型分析结果与聂汝芝等[22]应用传统细胞学方法对海岛棉的核型分析结果相比较,其提出的中部着丝点类型(m)的染色体数为38条,本实验的m类型染色体数为40条,相差2条;近中部着丝点类型(sm)的染色体数为12条,本实验结果与其一致,也为12条;随体数目前者为4个,本实验的随体数为6个(4大2小),比其多检测出2个,但前者还多出2条近端部着丝点类型染色体,本实验通过45S rDNA-FISH发现,其应为2个较小的随体所在的染色体,本实验结果将其归为中部着丝点类型;染色体平均相对长度前者为2.08,本实验的为3.85,两者相差较大;平均臂比值前者为1.55,本实验的为1.46,存在一定差异。
另外,本实验核型分析结果以海岛棉双色FISH图像为依据,由于A基因组gDNA探针的杂交信号,明显地区分开了A、D两亚组染色体,然后再依据各亚组染色体长短确定各自顺序编号,这种方法对于核型分析更为客观。虽然细胞学和生物化学研究表明,棉属A染色体组棉种的染色体(DNA)大于D染色体组棉种[8,25],但并非说明A亚组棉种13对染色体均大于D亚组棉种的所有染色体,本文基于双色FISH图像的核型分析结果证实了海岛棉2个亚组染色体的相对长度存在交叉现象,这也正是本文核型分析结果与聂汝芝等结果存在差别的原因。所以,核型分析中,双二倍体起源的四倍体棉种仅仅依据染色体相对长短鉴别2个亚组的染色体是不够完善的,反之,基于FISH技术来鉴别各染色体组成及确定其物理序号则更为理想,这为多倍体物种特别是异源多倍体物种的核型分析研究提供了更为准确的技术支持。
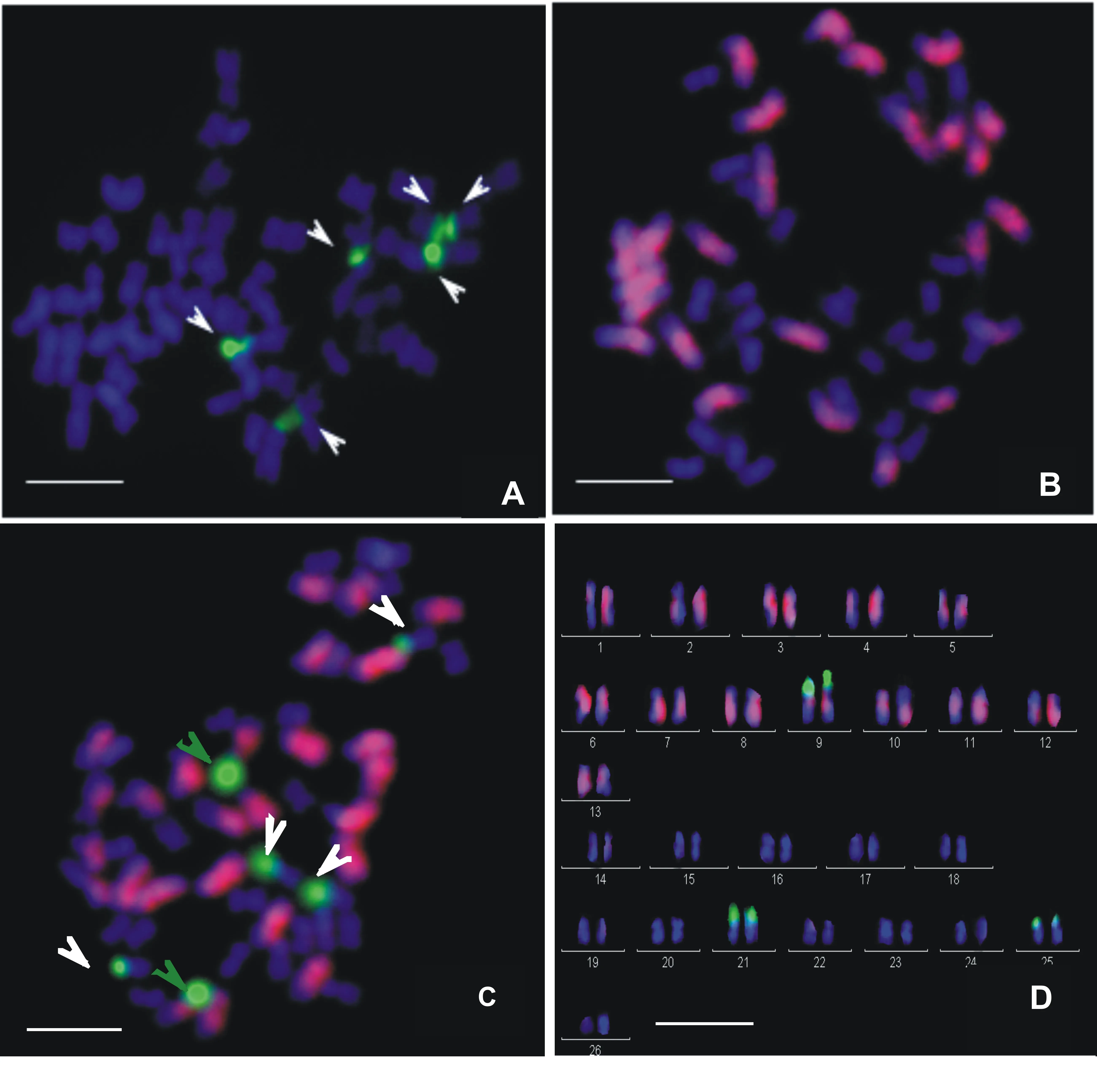
A、B分别是以45S rDNA和A组亚洲棉石系亚1号gDNA作探针,鲑鱼精DNA作封阻对海岛棉的FISH结果;C为同时以45S rDNA和A组亚洲棉石系亚1号gDNA作探针,鲑鱼精DNA作封阻的双色FISH结果;D为基于C的核型分析图,其中1~13号为A亚组染色体,14~26号为D亚组染色体;Bar=10m
图1海岛棉FISH图
参考文献:
[1] Fryxell P A. A revised taxonomic interpretation ofGossypiumL (Malvaceae)[J]. Rheedea, 1992, 2(2): 108-165.
[2] Phillips L L. The cytology and phylogenetics of the diploid species ofGossypium[J]. American Journal of Botany, 1966, 53(4): 328-335.
[3] Endrizzi J E, Turcotte E L, Kohel R J. Genetics, cytology, and evolution ofGossypium[J]. Adv Genet, 1985, 23: 271-375.
[4] Wendel J F, Albert V A. Phylogenetics of the cotton genus (GossypiumL.): Character-state weighted parsimony analysis of chloroplast DNA restriction site data and its systematic and biogeographic implications[J]. Systematic Botany, 1992, 17(1): 115-143.
[5] Wendel J F, Cronn R C. Polyploidy and the evolutionary history of cotton[J]. Advances in Agronomy, 2002, 78(2): 139-186.
[6] Beasley J O. Meiotic chromosome behavior in species, species hybrids, haploids and induced polyploids ofGossypium[J]. Genetics, 1942, 27(1): 25-54.
[7] Phillips L L. The cytogenetics ofGossypiumand the origin of New World cottons[J]. Evolution, 1963, 17(4): 460-496.
[8] Kadir Z B A. DNA evolution in the genusGossypium[J]. Chromosome, 1976, 56(1): 85-94.
[9] 聂汝芝,李愁学.三种野生和四个栽培棉种核型研究[J].植物学报,1985,27(2):113-121.
[10] 张志端,赵吉勇.陆地棉和海岛棉染色体组型比较[J].植物学通报,1988,5(3):173-175.
[11] 王坤波,宋国立,黎绍惠,等.陆地棉的核型模式[J].遗传,1995,17(6):1-3.
[12] Jiang J M, Gill B S. Current status and the future of fluorescence in situ hybridization (FISH) in plant genome research[J]. Genome, 2006, 49(9): 1057-1068.
[13] Wang K, Guan B, Guo W Z, et al. Completely distinguishing individual A-genome chromosomes and their karyotyping analysis by multiple bacterial artificial chromosome-fluorescence in situ hybridization[J]. Genetics, 2008, 178(2): 1117-1122.
[14] Nemeth C, Yang C Y, Kasprzak P, et al. Generation of amphidiploids from hybrids of wheat and related species from the generaAegilops,Secale,Thinopyrum, andTriticumas a source of genetic variation for wheat improvement[J]. Genome, 2015, 58(2): 71-79.
[15] Melo C A, Silva G S, Souza M M. Establishment of the genomic in situ hybridization (GISH) technique for analysis in interspecific hybrids ofPassiflora[J]. Genet Mol Res, 2015, 14(1): 2176-2188.
[16] Li H, Guo X, Wang C, et al. Spontaneous and divergent hexaploid triticales derived from common Wheat×Rye by complete elimination of D-Genome chromosomes[J]. PLoS One, 2015, 10(3): e0120421.
[17] Mavrodiev E V, Chester M, Suárez-Santiago V N, et al. Multiple origins and chromosomal novelty in the allotetraploidTragopogoncastellanus(Asteraceae) [J]. The New phytologist, 2015, 206(3): 1172-1183.
[18] 宋国立,崔荣霞,郭立平,等.改良CTAB法快速提取棉花DNA[J].棉花学报,1998,10(5):273-275.
[19] 王春英,王坤波,宋国立,等.棉花体细胞染色体rDNA-FISH技术[J].棉花学报,2001,13(2):75-77.
[20] 王春英,王坤波,王文奎,等.棉花gDNA体细胞染色体FISH技术[J].棉花学报,1999,11(2):79-83.
[21] 李懋学,陈瑞阳.关于植物核型分析的标准化问题[J].武汉植物学研究,1985,3(4):297-302.
[22] 聂汝芝,李懋学.棉属植物核型研究[M].北京:科学出版社,1993.
[23] 王坤波,王文奎,王春英,等.海岛棉原位杂交及核型比较[J].遗传学报,2001,28(1):69-75.
[24] 吴琼,宋国立,刘三宏,等.黄褐棉45S rDNA的FISH定位及核型分析[J].植物遗传资源学报,2008,9(4):439-442.
[25] Beasley J O. Meiotic chromosome behavior in species, species hybrids, haploids and induced polyploids ofGossypium[J]. Genetics, 1942, 27(1): 25-54.
(责任编辑:曾小军)
收稿日期:2015-12-24
基金项目:经济作物种质资源发掘与创新利用(2013BAD01B03);转基因生物新品种培育科技重大专项(2011ZX08005002-009);江西省科技支撑计划项目(20141BBF60011);国家棉花产业技术体系项目(CARS-18-36)。
作者简介:肖水平(1984─),男,江西吉安人,助理研究员,硕士,从事棉花种质资源与遗传育种研究。* 通讯作者:陈宜。
中图分类号:S562
文献标志码:A
文章编号:1001-8581(2016)07-0006-05
Karyotype Analysis ofGossypiumbarbadenseBased on Dualcolor-FISH
XIAO Shui-ping1,2, WANG Kun-bo2, KE Xing-sheng1, YANG Lei1,LIU Xin-wen1, SUN Liang-qing1, YANG Shao-qun1, CHEN Yi1*
(1. Cotton Research Institute of Jiangxi Province/ Poyang Lake Station of Cotton Comprehensive Experiment, National Cotton Industrial Technique System, Jiujiang 332105, China; 2. Institute of Cotton Science, Chinese Academy of Agricultural Sciences/ State Key Laboratory of Cotton Biology, Anyang 455000, China)
Abstract:Through the fluorescence in situ hybridization (FISH) of somatic metaphase chromosomes of Gossypium barbadense with the probe of 45S rDNA, six strong NOR (nucleolar organizer region) fluorescent signals were detected, of which 4 were big and 2 were small, and these signals were distributed at the satellite site of corresponding chromosome by combining with DAPI image observation. The FISH of G. barbadense with the probe of genomic DNA (gDNA) of diploid A-genome asiatic cotton found that: there were hybrid signals in the half of 52 chromosomes; the fluorescent signals were distributed in longer A-subgenomic chromosomes, and directly distinguished the A-subgenomic and D-subgenomic chromosomes of G. barbadense, which directly proved that G. barbadense was originated from two different diploid species. Using the gDNA of A-genome asiatic cotton and 45S rDNA as probes, we conducted dualcolor-FISH of G. barbadense, and detected not only 6 strong NOR signals but also gDNA hybrid signals in the chromosomes of G. barbadense, and clearly found 2 NOR signals in sub-genome A and other 4 NOR signals in sub-genome D. The karyotype analysis of G. barbadense based on dualcolor-FISH images indicated that: the karyotypic formula of this cotton species was 2n=4x=52=40m (2 SAT)+12sm (4 SAT), belonging to 2A type; there were three pairs of satellite chromosomes, of which one was located in the number 9 of A sub-genome (m type), and the others were located in the number 8 and number 12 of D sub-genome (sm type). It was also found that not all A sub-genomic chromosomes of G. barbadense had a bigger relative length than D sub-genomic chromosomes, suggesting that the FISH-based karyotype analysis method was more accurate than traditional methods.
Key words:G. barbadense; 45S rDNA; gDNA; Fluorescence in situ hybridization (FISH); Karyotype analysis
