姜黄素衍生物C085抑制K562/G01细胞及Bcr-Abl激酶的体外研究
2016-08-10吴丽贤许建华
吴 莺,吴丽贤,许建华
(福建医科大学药学院 1.福建省天然药物药理学重点实验室,2.天然药物学系,福建 福州 350122)
姜黄素衍生物C085抑制K562/G01细胞及Bcr-Abl激酶的体外研究
吴莺1,2,吴丽贤1,许建华1
(福建医科大学药学院 1.福建省天然药物药理学重点实验室,2.天然药物学系,福建 福州350122)
目的研究姜黄素衍生物C085对K562/G01细胞及野生型和伊马替尼耐药型Bcr-Abl 激酶的作用,以期能找到一种对IM耐药点突变激酶有效的酪氨酸激酶抑制剂。方法分别采用MTT法及流式细胞仪检测及观察C085对细胞增殖及凋亡的影响;应用Kinase-Glo®激酶发光检测试剂盒检测C085对4种Abl激酶(WT、T135I、Y253F、Q252H)活性的影响;蛋白免疫印迹检测C085对Bcr-Abl和下游信号转导通路蛋白的磷酸化水平及其他凋亡相关蛋白表达的影响;JC-1荧光染色法检测C085对细胞线粒体膜电位的影响;集落形成法观察C085对CML病人骨髓CD34+细胞增殖的影响。结果C085低浓度下即可抑制K562/G01的增殖,且可非ATP竞争性地抑制野生型及IM耐药点突变Abl激酶的活性; C085可抑制Bcr-Abl的自磷酸化,下调下游信号转通路蛋白的磷酸化水平和凋亡相关蛋白的表达,作用强于IM,具有明显的量效关系;C085通过直接作用于线粒体的PT孔使其开放,激活凋亡相关蛋白,诱导细胞凋亡,促凋亡作用强于IM;镜下观察及集落数量统计发现,C085可对已经产生IM耐药的CD34+祖/干细胞集落有明显的抑制作用。结论C085可抑制K562/G01细胞的生长可能与其抑制Bcr-Abl蛋白激酶活性,下调相关信号通路;直接作用于线粒体的PT孔使其开放,激活凋亡相关蛋白,诱导细胞凋亡有关。C085对IM敏感及耐药的白血病细胞均有杀伤作用,有望克服IM的耐药而成为新的TKI。
姜黄素衍生物;C085;CML;伊马替尼耐药;Bcr-Abl;突变
伊马替尼(imatinib,IM)又称格列卫(STI571),为 Bcr-Abl激酶抑制剂,已被证实可用于Ph+慢性粒细胞白血病 (CMLs)的治疗. 但其治疗后易复发,IM耐药的最常见的原因是Bcr-Abl激酶域点突变和 Bcr-Abl 激酶活性增强。体外试验[1-3]显示 Bcr-Abl 激酶ATP结合区内P环(P-loop)内E255V、Y253F/H点突变和T315I点突变的Bcr-Abl阳性细胞株,对IM有较高耐药性水平。
目前新型的酪氨酸激酶抑制剂基本被分为两类:ATP竞争型抑制剂和非ATP竞争型抑制剂。达沙替尼(dasatinib,BMS-354825)、AP23464、SKI-606、PD166326、尼洛替尼(nilotinib,AMN107)和INNO-406 (NS-187) 都为ATP竞争型抑制剂,与IM相比,他们能与ATP结合位点结合能力更强,可能对IM耐药的病人有效。但是,他们并不能够抑制T315I Bcr-Abl磷酸化。因此,一些非ATP 竞争型抑制剂,如 ON012380, Aurora 激酶抑制剂MK0457(VX-680)以及p38 MAP激酶抑制剂BIRB-796正被寄予希望[4]。
在我们寻找新型的Bcr-Abl激酶抑制剂的研究中,为了避免因突变引起的CML细胞耐药,我们合成了一些以酶的ATP结合位点以外的区域为靶点的化合物。姜黄素(curcumin,Cur) 为姜科姜黄属的多年生草本植物。C085是本实验室利用拼合原理合成的姜黄素衍生物(Fig 1A),其在与Bcr-Abl激酶的结合位点上与IM完全不同。在前期研究时发现其能明显抑制IM敏感的白血病细胞株的增殖[5]。在此基础上, 我们进一步研究C085对K562/G01细胞的作用及机制。并对其与Abl野生型及IM耐药点突变激酶的关系进行研究,以期能找到一种对IM耐药点突变激酶有效的新TKI。
1 材料与方法
1.1材料
1.1.1药品与试剂姜黄素衍生物C085由本课题组合成并纯化,经质谱验证、HPLC分析鉴定,纯度为95%以上;RPMI l640培养基(Hyclone,Australia);新生牛血清(杭州四季青公司);人全血CD34+分选试剂盒,MethoCult®GF H4434(Stem Cell Technologies, Vancouver,Canada);Annexin V细胞凋亡检测试剂盒、JC-1线粒体凋亡检测试剂盒、蛋白定量检测试剂盒(南京凯基生物发展有限公司)、Kinase-Glo®Luminescent Kinase Assay Platform(Promega,USA);MTT(Sigma USA); Phospho-c-Abl, Phospho-Stat5 and Phospho-CrkL)、Phospho-Erk1/2pathway sampler kit 、C-Raf、Mek1/2, Phospho- Mek1/2、Erk1/2、β-active(Cell signaling Technology, USA); DMSO(Sigma-Aldrich,USA);蛋白分子Marker(Bio-Rad,USA);ECL荧光底物(Amersham,USA); Abl激酶底物 (Enzo Life Science, Inc ,NY,USA);Abl-WT、Abl -T135I、Abl -Y253F、Abl -Q252H(Millipore,USA);ATP(Sigma,USA)。其它试剂均为进口分装分析纯。
1.1.2主要仪器5% CO2培养箱(Thermo Fisher,美国);免疫印迹成像系统(Carestream,加拿大);倒置显微镜(Olympus,日本);流式细胞仪(BD 美国);酶标仪(Thermo Fisher,美国);台式高速冷冻离心机(Beckman,美国); 384孔培养板,6孔培养板(Corning,德国)。
1.1.3细胞株及培养方法K562/G01细胞由中国医学科学院北京协和医科大学血液研究所惠赠[6]。用RPMI 1640+10%胎牛血清+双抗(1×105IU·L-1青霉素+100 mg·L-1链霉素)+4 μmol·L-1IM培养于37℃,5% CO2饱和湿度条件下,取对数生长期的细胞洗涤后用于以下实验。
1.2方法
1.2.1MTT法观察对细胞增殖的影响取对数生长期细胞, 调整细胞浓度为1×104每毫升 , 接种于96孔培养板, 每孔180 μL, 加入不同浓度的药物,每个浓度均设3个复孔。加药后置于37 ℃ 、5% CO2饱和湿度的培养箱内培养一定时间后, 每孔加入20 μL MTT( 5 g·L-1),继续培养4 h后,2 000 r·min-1离心5 min, 甩板扣干, 各孔再加入150 μL的DMSO, 震荡溶解, 在570 nm处测OD值, 计算细胞生长抑制率。实验重复3次,取平均值细胞生长抑制率/%=(对照组OD570值-实验组OD570值)/对照组OD570值×100%
以同一药物的不同浓度对细胞生长抑制率作图,可得到量效反应曲线,根据线性回归方程求出该药物的半数抑制浓度IC50。
1.2.2台盼蓝排染法观察对细胞增殖的影响取对数生长期细胞,调整细胞浓度为1×105每毫升,按每孔0.2 mL接种于96孔板内,加入梯度浓度的药物,置37 ℃、5% CO2饱和湿度的CO2培养箱内培养,每个浓度均设3个复孔。48 h后吹打均匀,吸取10 μL培养液,与10 μL 0.4%台盼蓝染液混匀,用血细胞计数板计数细胞,每个药物浓度重复计数3次,蓝染细胞判为死亡细胞,计算活细胞数量。
1.2.3Abl激酶活性的测定按Kinase-Glo®激酶发光检测试剂盒要求进行操作。此试剂盒是一个发光法的激酶检测试剂盒,激酶反应后溶液中剩余的ATP可与荧光素酶发生反应,产生发光信号。在 ATP 含量相同的体系中,ATP剩余量的多少与发光信号的强弱成正比,与激酶活性负相关。
在384孔板中操作。药物处理组每孔中依次加入1 μL C085(0.01,0.03,0.1,0.3和0.9 μmol·L-1),1 uL Abl激酶底物(30 ng EAIYAAPFAKKK),3 μL 10 nmol·L-1野生或突变型Abl激酶及5 μL ATP(0.2 或2 μmol·L-1),阳性对照组不加药物,改加1 μL。Buffer[50 mmol·L-1HEPES(pH 7.3),10 mmol·L-1MgCl2, 0.1% BSA, 2 mmol·L-1DTT],阴性对照组不加激酶,改加3 μL Buffer。每组设3个复孔。30℃孵育20 min后,每孔加入10 μL荧光素酶及底物的混合物,在酶标仪上测化学发光数值。计算酶活抑制率及IC50。
酶活抑制率/%=(阴性对照组-实验组)/(阴性对照组-阳性对照组)×100%
1.2.4蛋白免疫印迹观察细胞信号蛋白的表达[7]调整细胞浓度为3×105每毫升, 经不同浓度药物作用24 h后处理细胞,抽提30 μg蛋白进行SDS-PAGE。电泳后,将蛋白转膜至 PVDF膜(150 mA,4℃,1.5 h),封闭液(1% BSA, Tris-HCl 20 mmol·L-1, pH 7.5, NaCl 150 mmol·L-1, 0.05% Tween-20)室温封闭1 h,加一抗(anti-phospho-Bcr-Abl、phospho-Stat5或phospho-CrkL抗体)摇床4 ℃孵育过夜。TBST 洗去未结合的一抗。加二抗(1 ∶5 000稀释)室温摇床孵育1 h。将ECL试剂盒中的A和B两试剂等体积混合,滴加到Image Station 4000MM成像仪上。将PVDF 膜正面朝下覆盖在ECL试剂上,按成像仪的操作说明进行曝光。
1.2.5Annexin V-FITC/PI双荧光染色法检测细胞凋亡调整细胞浓度为3×105每毫升,经不同浓度药物作用24 h后,离心收集(2 000 r·min-1,5 min),用PBS洗涤细胞2 次(2 000 r·min-1,5 min),加入500 μL Binding buffer悬浮细胞,加入5 μL Annexin V-FITC混匀后,加入5 μL Propidium Iodide,混匀,室温避光反应5~15 min,流式细胞仪分析药物对细胞凋亡的影响。
1.2.6JC-1荧光染色法检测细胞线粒体膜电位变化取对数生长期细胞,调整浓度为3×105每毫升,经不同浓度药物作用24 h后,离心收集(2 000 r·min-1,5 min),用PBS洗涤细胞2次(2 000 r·min-1,离心5 min),加入JC-1荧光染料后置于37℃,5%饱和湿度CO2培养箱内反应15~20 min。室温离心收集细胞,用1×Incubation Buffer洗涤2次。吸取500 μL 1×Incubation Buffer重新悬浮细胞。转移入流式管中,4℃避光,冰上保存,于60 min内上机检测。流式细胞仪检测线粒体膜电位△Ψm值,通过检测红绿荧光的相对比例来衡量线粒体去极化的比例。
1.2.7集落形成法观察药物对CML患者CD34+祖/干细胞的抑制作用提取IM敏感的白血病患者及IM耐药的白血病患者的CD34+细胞,调整细胞浓度为3×105每毫升。取0.2 mL细胞加入1.8 mL的H4434中,实验组分别加入不同浓度的药物,对照组加入等量的DMSO作为对照,涡旋混匀后,静置5 min,接种于12孔培养板中,每孔1 mL,每组设2个平行孔,在12孔周围加入无菌的dd H2O,37℃ 5% CO2饱和湿度培养箱培养1周。对孔板中的细胞集落进行拍照,计数。以药物浓度为横轴,集落抑制率值为纵轴绘制量效关系曲线。
2 结果
2.1C085对K562/G01细胞增殖的抑制作用用不同浓度的C085(1.25~20 μmol·L-1)作用于K562/G01细胞24、48和72 h,IC50分别为(6.15±0.14)、(5.11±0.12)和(3.74±0.07) μmol·L-1,C085呈浓度时间依赖性地抑制这些细胞株的增殖(Fig 1B)。
为了更直观地证明C085对K562/G01的增殖抑制和杀伤作用,我们采用台盼蓝排染实验对细胞进行计数。调整细胞浓度为1×105每毫升,实验组分别加入1.25~20 μmol·L-1的C085至细胞培养体系,以经典的酪氨酸激酶抑制剂IM做为对照组,空白组加入等量的DMSO,72 h后进行台盼蓝染色试验。实验结果表明:空白组细胞呈对数生长;C085可浓度依赖性地抑制K562/G01细胞的增殖,在10 μmol·L-1即可达到完全抑制;而IM在低浓度时对K562/G01细胞无明显杀伤作用,高浓度时的杀伤作用亦明显弱于C085(Fig 1C)。
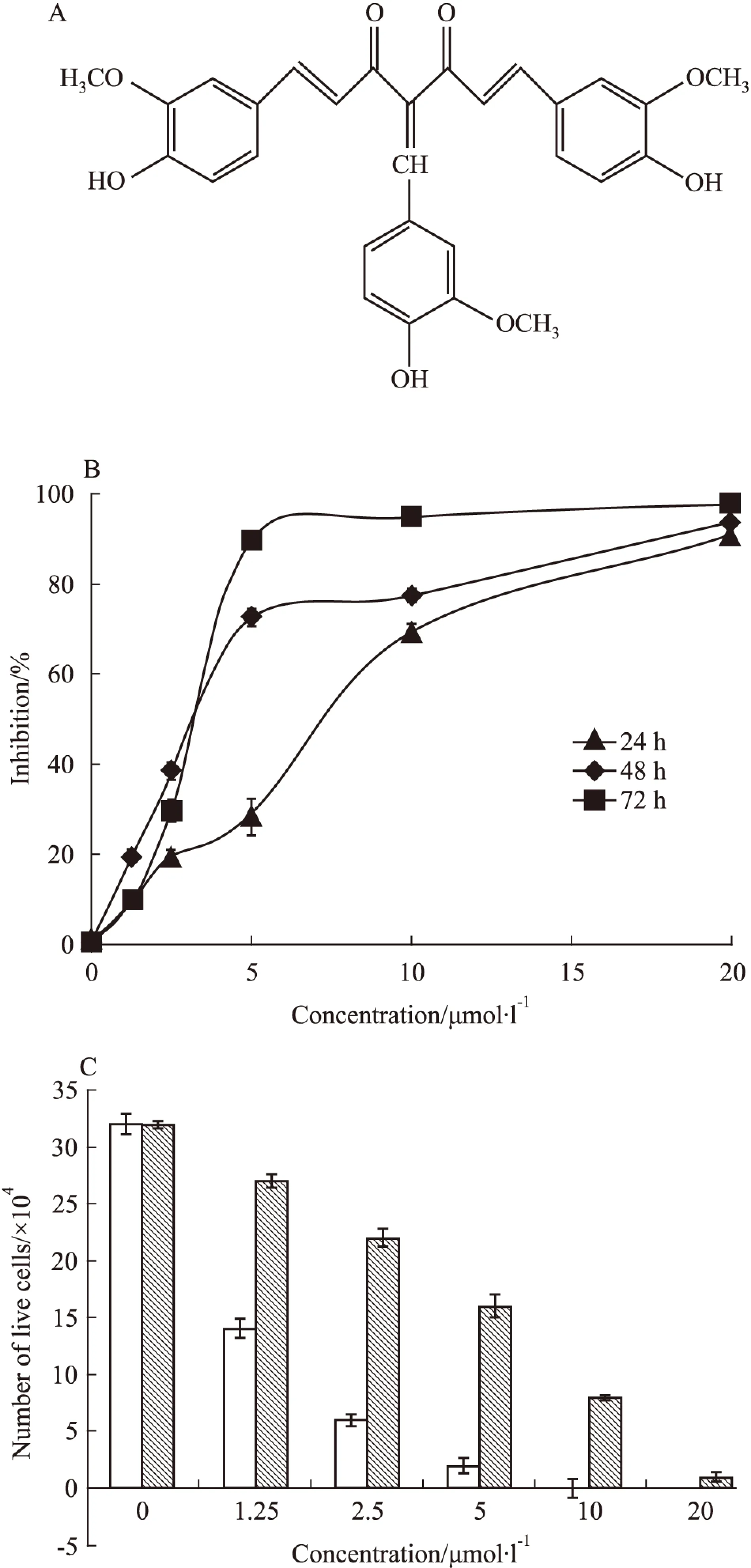
Fig 1 In vitro K562/G01 cells -killing activity of C085
A:Chemical structure of C085. B: Proliferation of K562/G01 cells in the presence of escalating concentrations of C085(0~20 μmol·L-1) for 24,48 and 72 h.C: Effect of C085 and imatinib on the viability of K562/G01 cells(72 h)
2.2C085对K562/G01细胞的促凋亡作用为了明确C085杀伤K562/G01细胞是否与其诱导凋亡有关,我们采用Annexin V-FITC/PI双荧光染色法,流式细胞术测定细胞凋亡率。
调整细胞浓度为3×105每毫升,每孔2 mL种于24孔板内,分别加入C085(2.5、5、10 μmol·L-1)及阳性对照药IM,作用24 h后,离心收集细胞,按试剂盒要求进行染色,标记Annexin V-FITC和PI,流式细胞术测定Annexin V阳性细胞(凋亡细胞)的百分数。此方法精度高、速度快、准确性好,是目前较先进的细胞定量分析技术。
实验结果提示,C085作用24 h即对细胞均有较强的诱导凋亡作用,主要是中、晚期凋亡。与阳性对照药IM相比,诱导凋亡作用明显(Fig 2)。
2.3C085体外抑制野生型及IM耐药点突变Abl激酶我们已知C085可明显抑制K562/G01细胞株的增殖,诱导其凋亡,这些作用是否与其抑制Abl激酶活性有关?C085是否对野生型及IM耐药点突变Abl激酶活性均有抑制作用?我们购买了4种激酶:Abl-WT、Abl -T135I、Abl -Y253F、Abl -Q252H 以及Kinase-Glo®激酶发光检测试剂盒对此问题进行研究[8]。
每种激酶设计2组ATP浓度,药物处理组加入0.001~2.7 μmol·L-1递增浓度的C085,并设阳性对照组(不加药物,改加1 μL Buffer)和阴性对照组(不加激酶,改加3 μL Buffer)。按试剂盒要求操作后在酶标仪上测化学发光数值。以抑制率为纵坐标,药物浓度的对数值为横坐标,绘制曲线,计算IC50(Fig 3, Tab 1)。

Tab 1 IC50(nmol·L-1) value for C085 on Abl kinase activity in vitro
抑制率/%=(阴性对照组发光值-药物处理组发光值)/(阴性对照组发光值-阳性对照组发光值)×100%
结果表明,姜黄素衍生物C085对所有Abl激酶活性均有明显抑制,IC50均在nmol·L-1级别。特别是对Abl-T315I也有相同的抑制作用,在0.2 μmol·L-1ATP条件下,IC50仅为(7.37±1.24) nmol·L-1。另外,在不同ATP浓度时,IC50未发生明显改变,即C085对激酶抑制作用无明显差异,这提示我们C085可能是非ATP竞争型激酶抑制剂。
2.4C085抑制K562/G01细胞中Bcr-Abl及其下游信号通路蛋白磷酸化Bcr-Abl主要通过持续激活下游信号转导通路促使细胞恶性转化。Bcr-Abl的下游促生长通路主要有P13K-AKT-mTOR、Ras-Raf-MEK-Erk及Stat3、Stat5。为进一步验证C085抑制K562/G01细胞增殖与抑制Bcr-Abl激酶的关系,将不同浓度DMSO、IM及 C085 作用K562/G01细胞,24 h后收集细胞,裂解后取上清蛋白进行蛋白免疫印迹。从图可知,C085可浓度依赖性的下调Bcr-Abl蛋白及其下游增殖相关通路信号分子的磷酸化水平,同时降低c-Raf、MEK、ERK的总蛋白含量(Fig 4)。结果表明,C085可能通过下调Bcr-Abl激酶活性,阻止Bcr-Abl蛋白及其下游信号分子的磷酸化,从而阻断其下游增殖相关通路来杀伤K562/G01细胞。
2.5C085 通过线粒体通路诱导K562/G01细胞凋亡线粒体是传输细胞凋亡信号中至关重要的细胞器官。线粒体跨膜电位(mitochondrial membrane potential,MMP)的耗散被认为是细胞凋亡级联反应过程中最早发生的事件,主要是由于线粒体内膜的通透性孔道(PT孔道)开放引起。PT孔道的开放释放了膜间隙中与凋亡相关的活性物质即各种促凋亡蛋白,如细胞色素C、AIF、Smac/DIABLO等;也削弱了线粒体膜两侧的质子梯度,导致ATP合成下降;释放的活性物质激活caspase,引起细胞凋亡[9]。
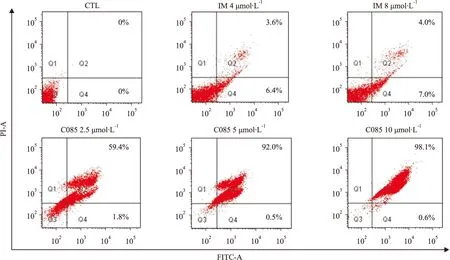
Fig 2 Effect of C085 on induction of apoptosis in K562/G01 cells
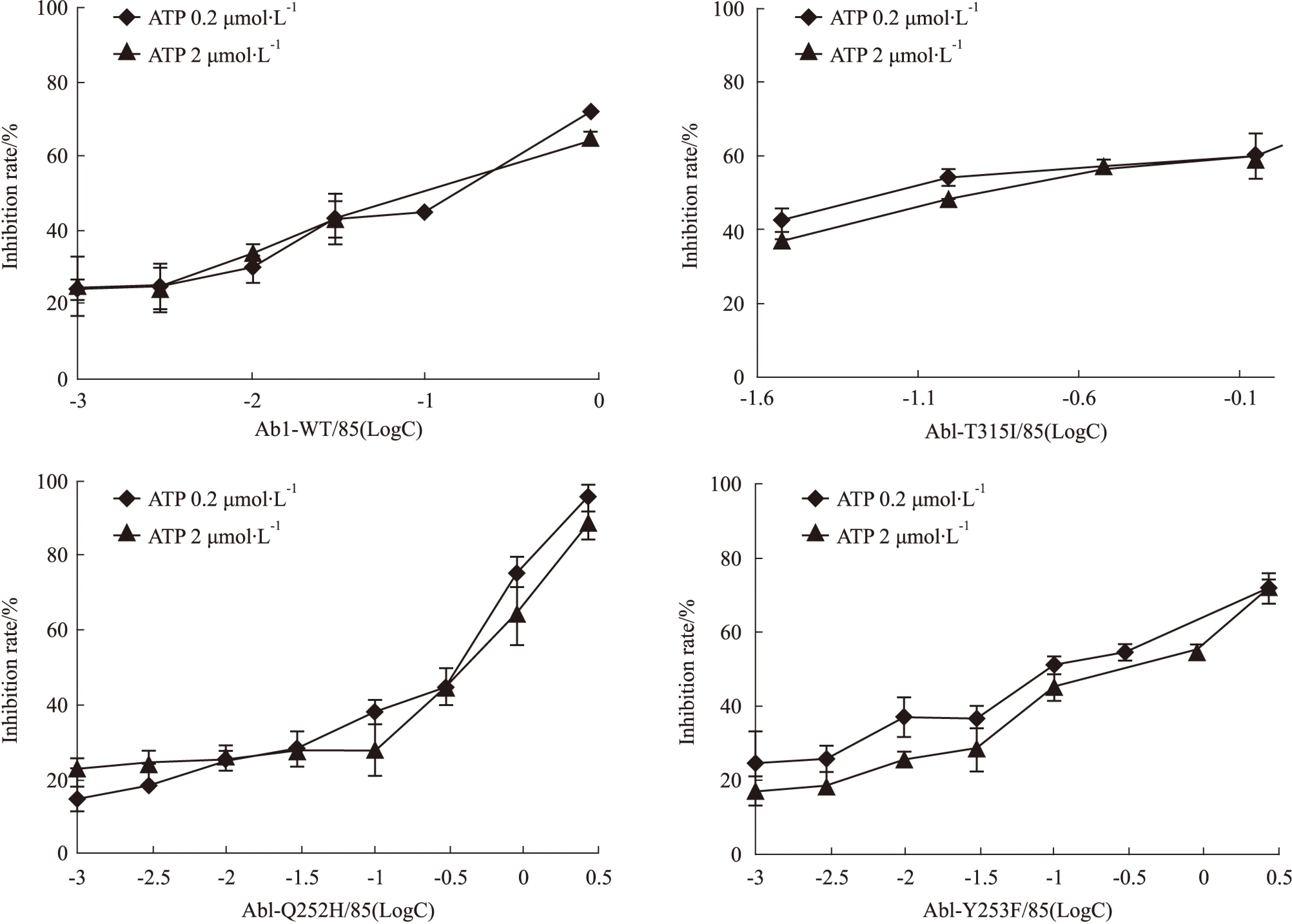
Fig 3 C085 inhibits wild-type and mutant Abl kinase in vitro
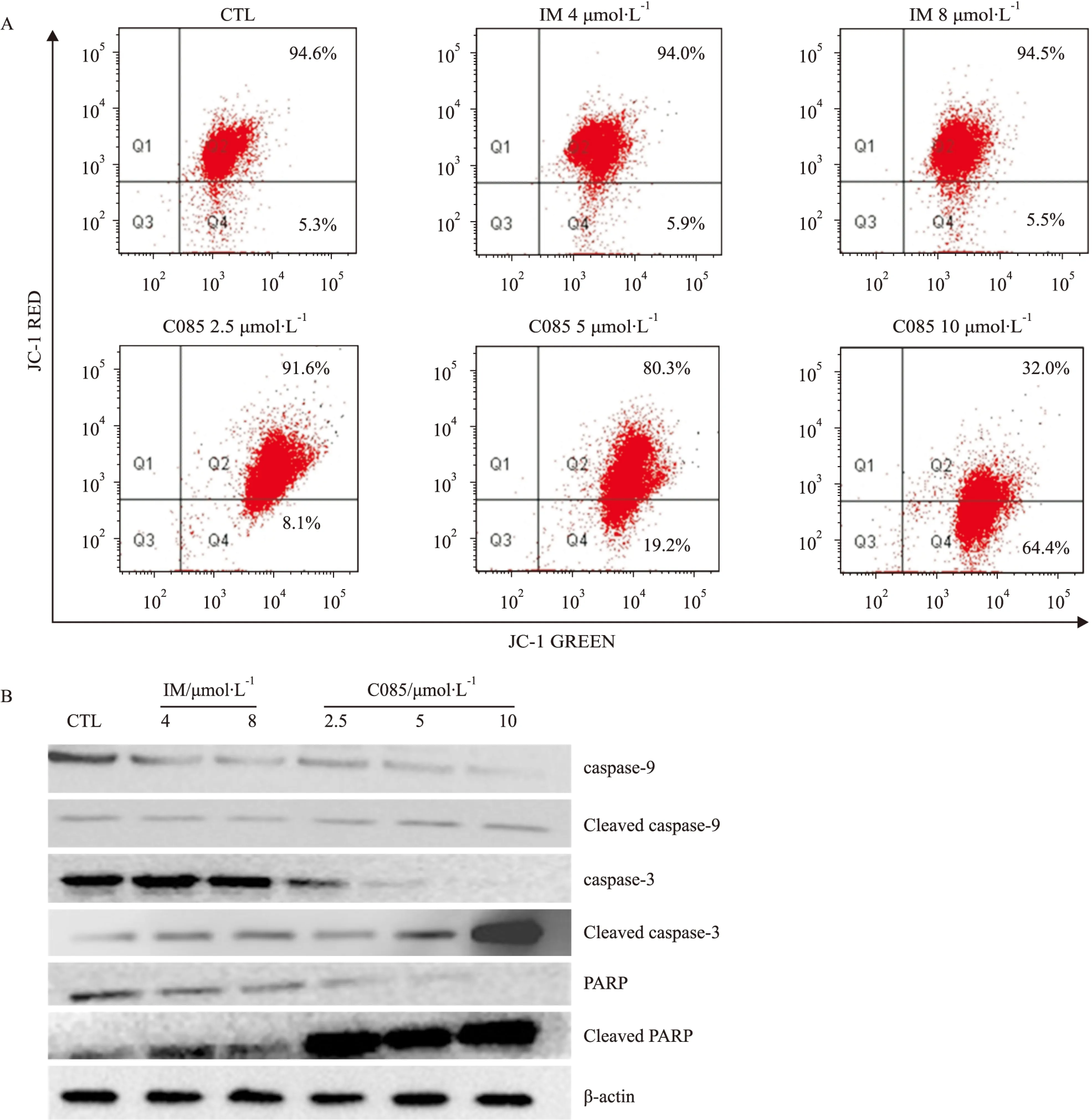
Fig 5C085 triggers mitochondrial pathway of apoptosis in K562/G01 cellsA:Treatment of K562/G01 cells with C085 at indicated concentrations for 24 h significantly led to reduction of MMP examined by JC-1 staining.B:Treatment of K562/G01 cells with C085 at indicated concentrations for 24 h activated the stream of caspase-9,3 and PARP pathway analyzed by Western blot.
JC-1为阳离子脂质突光染料,有单体和多聚体两种存在状态。在正常细胞中线粒体膜电位较高时,JC-1可选择性的进入线粒体,聚集在线粒体的基质中,形成聚合物,可逆的由绿色转变成红色;而当细胞凋亡,线粒体膜电位降低,JC-1不能聚集在线粒体的基质中,此时JC-1为单体产生绿色荧光。可通过荧光颜色的转变来检测线粒体膜电位的变化,红/绿比值可以衡量正常细胞的比例[10]。
从图看出C085对K562/G01细胞线粒体跨膜电位能产生影响,线粒体膜电位红绿比值降低,10 μmol·L-1时改变尤其明显。说明C085能够明显降低MMP(Fig 5A)。MMP的改变促进了细胞色素c的释放,进而裂解procaspases-9和3,最后裂解PARP(Fig 5B),诱导细胞凋亡。
2.6C085可抑制CML患者CD34+祖/干细胞我们已知C085对IM耐药的CML细胞敏感, 那么这种作用是否同样适用于CML患者的CD34+祖/干细胞?从对IM敏感及耐药的CML病人骨髓中分离出CD34+祖/干细胞,通过观察干细胞集落形成单位分析C085的增殖抑制作用。实验结果显示,C085(2.5、5、10 μmol·L-1)可以有效的抑制CML病人的CD34+祖/干细胞的增殖,集落抑制率分别为34.40%、47.71%和58.26%,同时,对于IM耐药的病人的CD34+细胞,抑制率也可达到30%、35.65%和50.78%(Fig 6A,B),两者之间差异无显著性(P>0.05).因此,同其他的白血病细胞一样,从IM敏感及耐药病人体内提取的CD34+祖/干细胞对C085依然敏感。
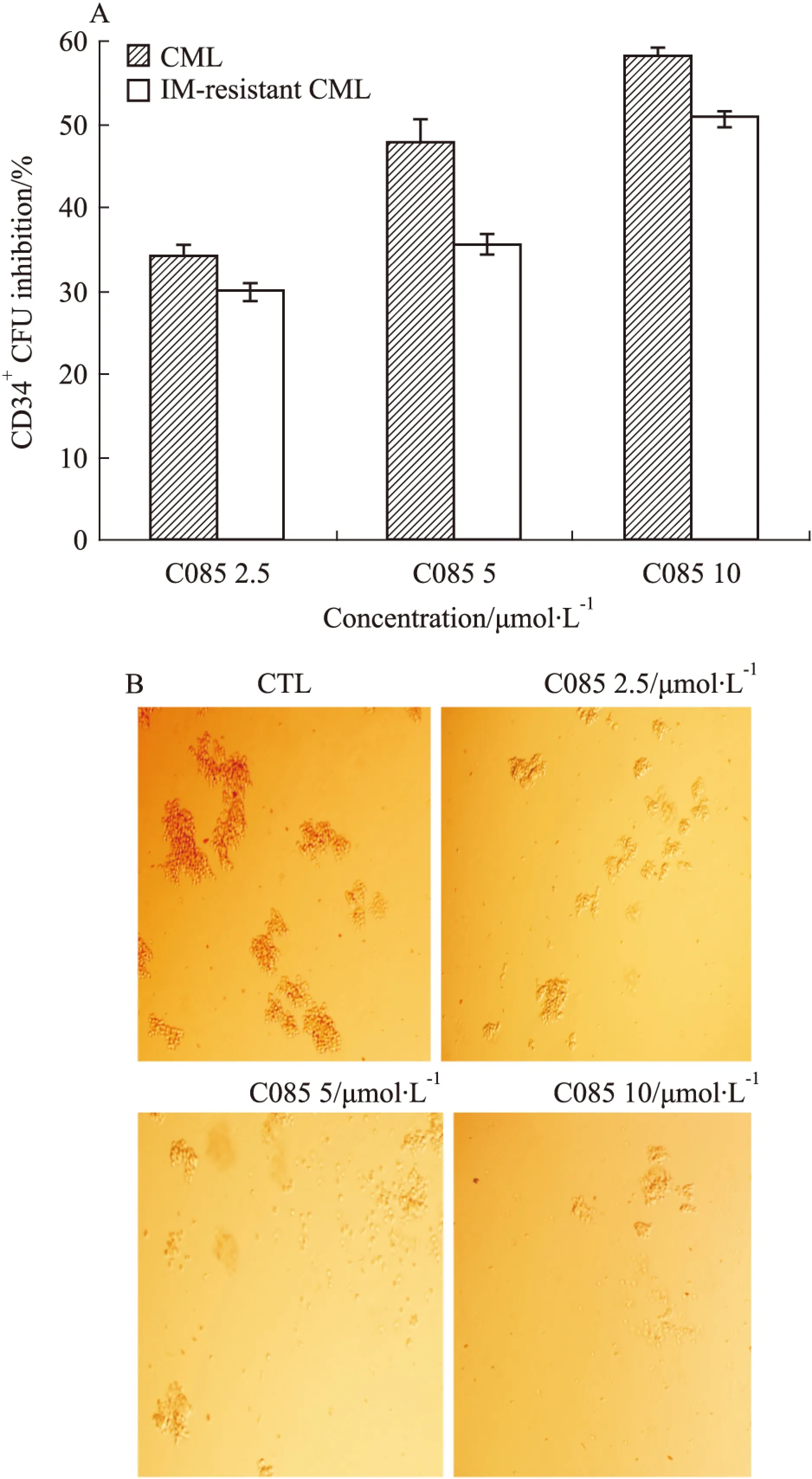
Fig 6 Effects of C085 on CML progenitor/stem cells survival from human bone arrow
A:Colony formation of imatinib sensitive or-resistant CML CD34+cells.CD34+cells were isolated and cultured with low growth factors,either without inhibitiors(control),or in the presence of graded concentrations of C085 for 24 h and then plated in methylcellulose progenitor culture for 14 d.Data are presented as the percentage of suppression of CFUs compared to untreated controls No significant differences between CML and IM-resistant CML CD34+cells are indicated; B:Pictures of C085 inhibiting the growth of CD34+cells CFU photographed by fluorescent microscope.
3 讨论
分子靶向治疗的代表性药物IM是针对Bcr-Abl激酶的药物,取得了巨大成功。但随着治疗的进行,因Bcr-Abl激酶域点突变和Bcr-Abl激酶活性增强等原因,产生的IM耐药成为目前CML治疗中亟待解决的难题。针对Bcr-Abl激酶活性继续开发新一代酪氨酸激酶抑制剂是首要解决途径。
Imatinib是ATP的竞争性Bcr-Abl抑制剂,只能高度特异性地结合于Bcr-Abl激酶非活化构象上的ATP位点。这一特性使其不良反应减小,但也易使突变株产生IM耐受[11-12]。而C085对IM耐受的CML细胞有较强的促凋亡作用,激酶实验也表明其也可强烈抑制野生型及点突变Abl激酶,特别是对Abl -T135I抑制作用也较强。IC50均在纳摩尔级别,且随着ATP浓度的增加未发生明显变化,为非ATP竞争性抑制剂。
Bcr-Abl融合蛋白是CML 恶性转化的关键蛋白。进一步的作用机制研究表明,C085可通过抑制Bcr-Abl自身磷酸化,随之抑制其下游信号分子Stat 5、Crkl的磷酸化,降低c-Raf、Mek、Erk激酶活性,并打开线粒体的PT孔降低膜电位,阻止caspase级联的激活而促进K562/G01细胞细胞凋亡。作用均强于IM。
在CML患者体内可以发现具有干细胞CD34抗原标志-CD34+伴Bcr-Abl融合基因阳性的CML细胞。临床实践表明,此类细胞具有独特的生物学特征,具有十分重要的研究价值,Ph+/CD34+/CXCR4+为CML白血病干细胞的标志物[13]。CD34+细胞与CML病情进展及转归相关,与耐药有关,包括IM在内的许多药物对其不敏感。而C085具有杀伤白血病患者CD34祖/干细胞,抑制其集落形成的能力,不仅对CML细胞有效,对IM耐药的细胞也有抑制作用,有清除白血病患者骨髓CD34祖/干细胞的作用,这为其开发成新一代的慢性粒细胞白血病治疗药物奠定了实验基础。
BCR-ABL基因是重要的凋亡抑制基因之一,而其编码的融合蛋白质是细胞恶性转化的根本原因,C085能以此为作用靶点,抑制其表达,将有望从发病本质上杀伤CML细胞。而C085对IM耐药的白血病细胞及耐药病人的CD34+细胞均有杀伤作用,有望克服IM的耐药而成为新的TKI。
(本课题完成于福建省天然药物药理学重点实验室,在此对实验室的各位老师、同学的帮助表示由衷地感谢!)
[1]O′Hare T,Walters D K,Stoffregen E P,et al.Invitroac-tivity of Bcr-Abl inhibitors AMN107 and BMS-354825against clinically relevant imatinib-resistant Abl kinase do-main mutants[J].CancerRes,2005,65(11): 4500-5.
[2]Quintás-Cardama A,Kantarjian H M,Cortes J E. Mechanisms of primary and secondary resistance to imatinib in chronic myeloid leukemia[J].CancerControl,2009,16(2):122-31.
[3]Redaelli S,Piazza R,Rostagno R,et al. Activity of bosutinib, dasatinib, and nilotinib against 18 imatinib-resistant BCR/ABL mutants[J].JClinOncol,2009,27(3):469-71.
[4]Maekawa T,Ashihara E,Kimura S.The Bcr-Abl tyrosine kinase inhibitor imatinib and promising new agents against Philadelphia chromosome-positive leukemias[J].IntJClinOncol,2007,12(5): 327-40.
[5]吴莺,陈瑞家,吴丽贤,许建华.姜黄素衍生物C085对K562细胞的作用及机制研究[J].中国药理学通报,2015,31(6):870-5.
[5]Wu Y, Chen R J, Wu L X,Xu J H.Effects of curcumin derivatives C085 on K562 cells and its mechanism[J].ChinPharmacolBull,2015,31(6):870-5.
[6]Qi J, Peng H, Gu Z L,et al. Establishment of an imatinib resistant cell line K562/G01 and its characterization[J].ChinJHematol, 2004,25(6) 337-41.
[7]Wu L X, Xu J H, Zhang K Z,et al.Disruption of the Bcr-Abl/Hsp90 protein complex: a possible mechanism to inhibit Bcr-Abl-positive human leukemic blasts by novobiocin[J].Leukemia,2008,22:1402-9.
[8]Wu L X,Wu Y,Chen R J, et al. Curcumin derivative C817 inhibits proliferation of imatinib-resistant chronic myeloid leukemia cells with wild-type or mutant Bcr-Ablinvitro[J].ActaPharmacolSin,2014,35(3):401-9.
[9]Green D R, Kroemer G. The pathophysiology of mitochondrial cell death[J].Science,2004,305(5684):626-9.
[10]Troiano L, Ferraresi R, Lugli E, et al. Multiparametric analysis of cells with different mitochondrial membrane potential during apoptosis by polychromatic flow cytometry[J].NatProtoc,2007,2(11):2719-27.
[11]Hochhaus A, Kreil S, Corbin A S,et al. Molecular and chromosomal mechanisms of resistance to imatinib(STI571) therapy[J].Leukemia,2002,16(11):2190-6.
[12]Branford S,Rudxki Z,Walsh S,et al.High frequency of point mutation clustered within the adenosine triphosphate-binding region of BCR/ABL in patients with chronic myloid leukemia or Ph-positive acute lymphoblastic leukemia who develop imatinib(STI571) resistance[J].Blood,2002,99(9):3472-5.
[13]Sillaber C,Gesbert F,Frank D A,et al.STAT5 activation contributes to growth and viability in Bcr/Abl-transformed cells[J].Blood,2000,95(6):2118-25.
Key wods:curcumin derivative;C085; chronic myelogenous leukemia; imatinib resistance; Bcr-Abl; mutation
Curcumin derivative C085 inhibits proliferation of K562/G01 cells and activity of Bcr-Abl kinaseinvitro
WU Ying1,2,WU Li-xian1,XU Jian-hua1
(1.FujianKeyLaboratoryofNaturalMedicinePharmacology,2.DeptofNaturalMedicine,SchoolofPharmacy,FujianMedicalUniversity,Fuzhou350122,China)
AimTo find new kinase inhibitors that overcome the imatinib resistance in the treatment of chronic myeloid leukemia(CML) by synthesizing C085, a novel derivative of curcumin, and testing its activities against wild-type(WT) and imatinib-resistant mutant Abl kinases, as well as in imatinib-resistant CML cellsinvitro.MethodsCell proliferation and apoptosis were examined using MTT assay and flow cytometry, respectively;Kinase activity was measured using Kinase-Glo Luminescent Kinase Assay Platform in recombinant WT and mutant(Q252H, Y253F, and T315I) Abl kinases. The phosphorylation levels of Bcr-Abl initiated signaling proteins were analyzed using Western blotting. Colony forming units(CFU) growth was used to test the effects of C085 on human leukemia progenitor/stem cells.ResultsC085 suppressed the growth of imatinib-resistant K562/G01 cells and potently inhibited both WT and mutant(Q252H, Y253F, and T315I) Abl kinase activities in a non-ATP competitive manner with the values of IC50at low nanomole levels. C085 dose-dependently down-regulated Bcr-Abl kinase activity in K562/G01 cells as judged by autophosphorylation and Stat5,Crkl phosphorylation,and inhibited the phosphorylation of downstream targets Raf,Mek and Erk with protein content reducing. C085 could directly impact mitochondrial PT hole and make it open, which prevents the activation of caspase cascade reaction and induces the apoptosis.Furthermore, C085 significantly suppressed CFU growth, implicating that C085 could inhibit human leukemia progenitor/stem cells.ConclusionC085 may inhibit K562/G01 cells through inhibiting Bcr-Abl kinase activity and down-regulating the downstream signal proteins. Directly acting on mitochondrial PT hole and then activating apoptosis- associated proteins are also involved in the pro-apoptotic effect of C085.C085 is a promising compound for the treatment of CML patients with Bcr-Abl kinase domain mutations that confer imatinib resistance.
2016-02-10,
2016-04-18
福建省教育厅中青年教师资助项目(No JA13150)
吴莺(1979-),女,硕士,讲师,研究方向:药理学,E-mail:wuying97414@tom.com;许建华(1958-),男,博士,教授,研究方向:药理学,E-mail:xjh@mail.fjmu.edu.cn
10.3969/j.issn.1001-1978.2016.07.023
A
1001-1978(2016)07-1004-08
R282.71;R329.24;R329.25;R345.57;R733.7;R979.1
网络出版时间:2016-6-20 11:49网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.046.html