小鼠平滑肌祖细胞培养及其体内外迁移功能的研究
2016-08-10李和权周建英
王 晴,李和权,周建英
(浙江大学医学院附属第一医院呼吸内科,浙江 杭州 310003)
小鼠平滑肌祖细胞培养及其体内外迁移功能的研究
王晴,李和权,周建英
(浙江大学医学院附属第一医院呼吸内科,浙江 杭州310003)
目的建立一种有效的小鼠平滑肌祖细胞的培养方法,并对其迁移功能进行研究。方法使用C57BL/6小鼠制备密质骨来源间充干细胞,PDGF-BB诱导其分化并采用形态学观察、免疫细胞化学染色及流式分析的方法进行鉴定。使用Transwell小室及流式分析方法检测其迁移能力。结果PDGF-BB诱导7 d后,镜下可见细胞呈长梭型,免疫细胞化学染色显示开始表达α-SMA。诱导21 d后,流式分析证实70%以上的细胞表达CD34+/α-SMA+双阳性,58.5%细胞开始表达SM-MHC。迁移实验表明,培养得到的平滑肌祖细胞在体内外均具有良好的迁移能力。结论通过使用密质骨来源间充干细胞制备平滑肌祖细胞具有操作简便、获取率高及培养周期短等优点,培养得到的平滑肌祖细胞在体内外均具有迁移能力,适于进行后续功能及机制研究。
平滑肌祖细胞;间充干细胞;培养;迁移;平滑肌肌动蛋白;PDGF-BB
血管重塑主要包括血管新生及血管平滑肌层病理性增厚,是导致动脉粥样硬化、糖尿病血管病变、移植血管病等众多血管增殖性疾病发病的重要因素,探索新生及增生平滑肌细胞的来源和重塑机制,寻找其干预的靶点一直是学者们关注的焦点问题[1-4]。近来,随着平滑肌祖细胞在外周血中的发现,增多的平滑肌细胞可能部分来源于骨髓的观点越来越受到人们的重视。研究表明,平滑肌祖细胞能够从外周血迁移至局部器官并进一步分化成平滑肌细胞,是导致血管重塑的一个重要原因[3-4]。新证据显示,平滑肌祖细胞的这一迁移运动不仅在血管平滑肌重塑中有着重要的作用,也可能参与了气道平滑肌重塑的过程。Makowska等[5]的研究表明,哮喘患者的外周血中CD34+祖细胞含量升高,且与疾病严重程度相关。而Wu等[6]的研究则进一步显示能够表达平滑肌特异性标志物——平滑肌肌球蛋白重链(SM-MHC)的祖细胞在哮喘模型小鼠外周血中含量增高。鉴于平滑肌祖细胞在多种疾病发生发展过程中的重要作用,如何在体外制备平滑肌祖细胞以进行相关机制的探索研究也成为众多研究者关注的热点。本文报道一种简单有效的小鼠平滑肌祖细胞的原代培养方法,并对其迁移功能进行探索分析。
1 材料与方法
1.1实验动物♂ C57BL/6小鼠,4~6周龄,清洁级,购自浙江省实验动物中心。
1.2主要试剂Ⅰ型胶原酶、Ⅳ型胶原酶、免疫组化用小鼠平滑肌肌动蛋白(α-SMA)抗体、anti-FITC-α-SMA流式抗体、卵白蛋白(OVA)、PKp6细胞染色试剂盒购自Sigma公司。血小板源性生长因子(PDGF-BB)、纤连蛋白购自Invitrogen公司。兔II抗和DAB试剂盒购自北京中杉金桥生物有限公司。anti-PE-CD34流式抗体购自Biolegend公司,anti-PE-SM-MHC流式抗体购自Santa Cruz公司,anti-FITC-SM-MHC购自biorbyt公司。小鼠重组肝素结合表皮生长因子(HB-EGF)蛋白购自Prospec公司。小鼠间充干细胞(MSC)专用培养基及低氧培养箱购自Stem cell公司。
1.3哮喘模型小鼠外周血平滑肌祖细胞检测
1.3.1哮喘模型制备[7]全部小鼠在d 0和d 12腹腔注射100 g·L-1硫酸铝钾与25 μg OVA混悬液0.1 mL致敏。实验组小鼠自d 18~d 23予质量浓度为50 g·L-1的OVA行雾化攻击,30 min·d-1,连续雾化6 d,d 24处死部分小鼠,为急性哮喘模型。自d 26起,予50 g·L-1OVA雾化攻击,30 min/次,3次/周。d 35及d 55分别处死部分小鼠,为哮喘气道重塑模型。对照组在雾化阶段用PBS代替OVA,余处理均同实验组。
1.3.2外周血中平滑肌祖细胞流式检测小鼠眼球取血制备单细胞悬液,破红后行anti-PE-CD34表面染色,避光孵育30min后,PBS洗涤并固定破膜,行anti-FITC-SM-MHC胞内染色,避光孵育30min后,PBS洗涤去除未结合抗体。离心后重悬细胞于流式PBS中,上机检测。
1.4平滑肌祖细胞培养及鉴定
1.4.1密质骨来源间充干细胞(MSC)培养[8]小鼠麻醉处死后取后腿胫骨及股骨,将骨表面肌肉分离干净后置入研钵中,轻刮骨表面去除肌肉组织及骨骺端,于研钵中碾磨并压碎骨组织,让骨髓流出并弃去。此步骤重复多次直至骨髓基本被去除干净,骨质颜色转白。将骨骼碎片继续切碎成1~2 mm的碎片,于含2.5 g·L-1Ⅰ型胶原酶的PBS液中水浴孵育(37℃, 40 min),弃去沉渣后细胞滤器过滤并离心(500×g,10 min)。取沉淀细胞培养于小鼠MSC专用培养基,并置于低氧培养箱中37℃,5% CO2培养。每2 d换液1次,直至90%融合。
1.4.2平滑肌祖细胞的诱导分化使用培养基稀释纤连蛋白至20 μg·L-1包被6孔细胞板。取生长良好,90%融合的MSC消化后重新培养于纤连蛋白包被的6孔板中。培养基中添加PDGF-BB 蛋白(50 μg·L-1)诱导MSC分化[9]。每2 d换液1次,每周传代2次。
1.4.3形态学观察倒置显微镜下观察细胞形态及生长情况。
1.4.4α-SMA免疫细胞化学染色分别以多聚甲醛固定细胞(4℃,15 min),2 g·L-1Triton X-100穿膜15 min,羊血清封闭10 min,加入α-SMA小鼠I抗(1 ∶100),37℃孵育2 h,再加入兔抗小鼠IgG Ⅱ抗,37℃孵育1 h,随后DAB显色,苏木精复染,显微镜下观察。
1.4.5流式分析鉴定平滑肌祖细胞诱导培养后的d 7、d 14及d 21,选取状态较好的细胞,经胰酶消化后收集于Epidoff管中并多次洗涤,然后将细胞重悬于流式PBS中,使用anti-PE-CD34抗体进行表面标记,anti-FITC-α-SMA抗体及anti-PE-SM-MHC抗体进行胞内染色,避光室温孵育30 min。孵育结束后,再次使用PBS液洗涤,去除未结合的抗体。离心后重悬细胞于流式PBS中,上机检测。
1.5平滑肌祖细胞功能检测
1.5.1体外迁移实验[10]胰酶消化平滑肌祖细胞后进行细胞计数,并以3×108·L-1浓度重悬于含BSA(浓度为1 g·L-1)的DMEM:F12培养基中制备细胞悬液。迁移小室置于24孔板中,每个小室中加入100 μL细胞悬液。下室中加入不含血清的DMEM:F12培养基,并添加小鼠重组HB-EGF蛋白(20 μg·L-1)进行迁移实验。24孔板置入细胞培养箱中24 h后取出。迁移小室经甲醇固定,1 g·L-1结晶紫染料染色20 min及PBS洗涤后,棉签轻轻擦去上层细胞,置于显微镜下进行观察。每个迁移小室均取中心及四周,共5个固定位置视野进行细胞计数,定量迁移细胞数。
1.5.2体内迁移实验
1.5.2.1平滑肌祖细胞标记及注射胰酶消化平滑肌祖细胞并收集制成细胞悬液,与PKp6染液混合后避光室温孵育30 min后,加入15~20 mL含FBS(浓度为10 g·L-1)的PBS终止染色并洗涤3次。最后1次洗涤后使用PBS液重悬PKp6标记的平滑肌组细胞(5×109·L-1)。1 mL无菌注射器抽取适量,于雾化周期中的d 19及d 22,以每鼠0.4 mL的剂量注入小鼠尾静脉。
1.5.2.2流式分析取哮喘模型小鼠的气管组织充分剪碎后使用0.2 g·L-1Ⅳ型胶原酶孵育(37℃, 30 min)。孵育结束后,将组织置于200目滤网上充分碾磨,并不断冲洗。冲洗3次后收集所有滤过液体离心,使用70 μm过滤器过滤杂质后得到单细胞悬液。固定破膜后行anti-FITC-α-SMA抗体胞内染色,避光孵育洗涤后上流式检测,检测PKp6标记阳性细胞在α-SMA+细胞中的比例。
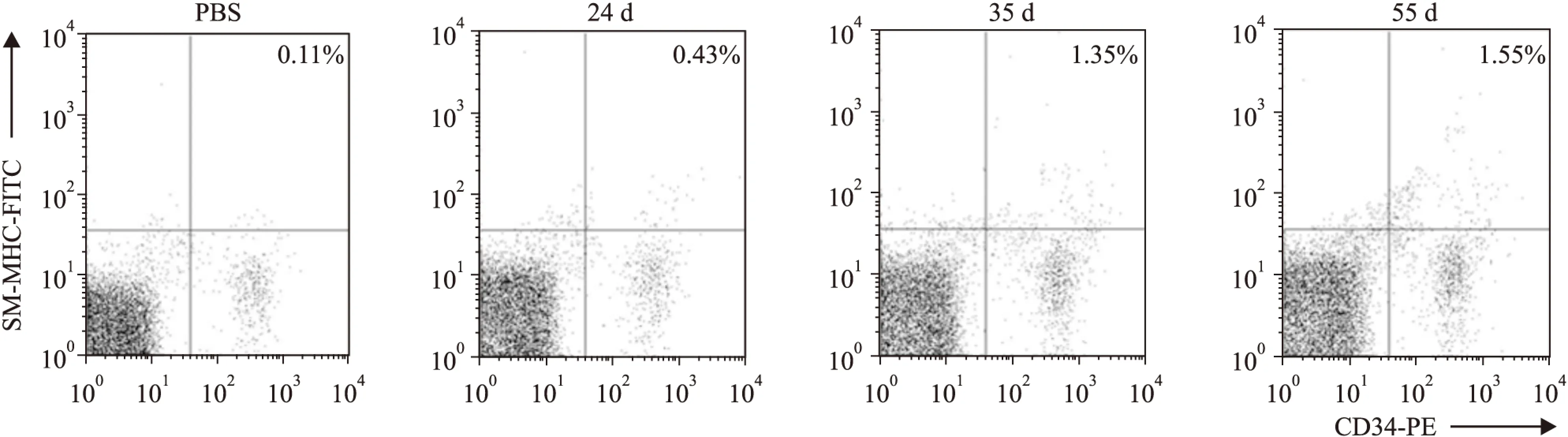
Fig 1 Number of CD34+/SM-MHC+ cells increased progressively during prolonged OVA challenge
CD34+/SM-MHC+cell numbers in blood from acute and prolonged OVA-challenged mice and PBS controls were analyzed by flow cytometry. The numbers indicated are the average values of three independent experiments
2 结果
2.1哮喘模型小鼠外周血中平滑肌祖细胞含量测定我们使用流式分析技术测定小鼠外周血中CD34+/SM-MHC+细胞含量,结果显示,急性哮喘模型外周血中CD34+/SM-MHC+细胞含量较对照组无明显增多,而随着OVA雾化时间的延长,气道重塑模型中CD34+/SM-MHC+细胞含量明显升高,表明平滑肌祖细胞参与了哮喘气道重塑的发生(Fig 1)。
2.2平滑肌祖细胞鉴定
2.2.1形态学观察培养基中添加高浓度PDGF-BB(50 μg·L-1)培养7 d后,小鼠MSC即逐渐呈现长梭形,并呈“峰谷状”分布(Fig 2)。

Fig 2 Phase-contrast micrograph of mesenchymal stem cells cultured with PDGF-BB for 7 days
The cells showed spindle shape after PDGF-BB stimulation
2.2.2细胞鉴定免疫细胞化学染色:PDGF-BB诱导分化7 d后,可见部分细胞开始表达α-SMA,对照组为未经诱导分化的MSC(Fig 3)。
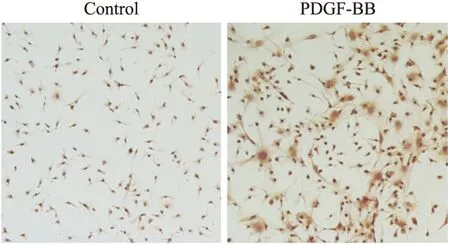
Fig 3 Cells expressed α-SMA after cultured with PDGF-BB for 7 days
Representative photomicrographs of immunocytochemical staining of the culture cells. Brown staining showed positive α-SMA expressing after PDGF-BB stimulation contrast to PBS controls.
流式分析检测:含PDGF-BB(50 μg·L-1)培养基培养7d后,部分细胞开始表达α-SMA单阳性。培养14 d后,单一表达α-SMA或CD34的阳性细胞增多,10%细胞同时表达α-SMA及CD34。培养20 d以上,71%左右的培养细胞同时阳性表达CD34、α-SMA(Fig 4A)。SM-MHC为平滑肌细胞的特异性标志物,培养3周以上约有58.5%细胞阳性表达,证实培养细胞能够向平滑肌细胞分化(Fig 4B)。
2.3平滑肌祖细胞迁移功能检测
2.3.1体外迁移我们使用具有强效促迁移作用的细胞因子HB-EGF诱发平滑肌祖细胞的迁移运动,并应用Transwell小室进行迁移功能检测,不含HB-EGF的无血清培养基作为空白对照组。结果显示,平滑肌祖细胞在体外具有较强的迁移能力(Fig 5)。
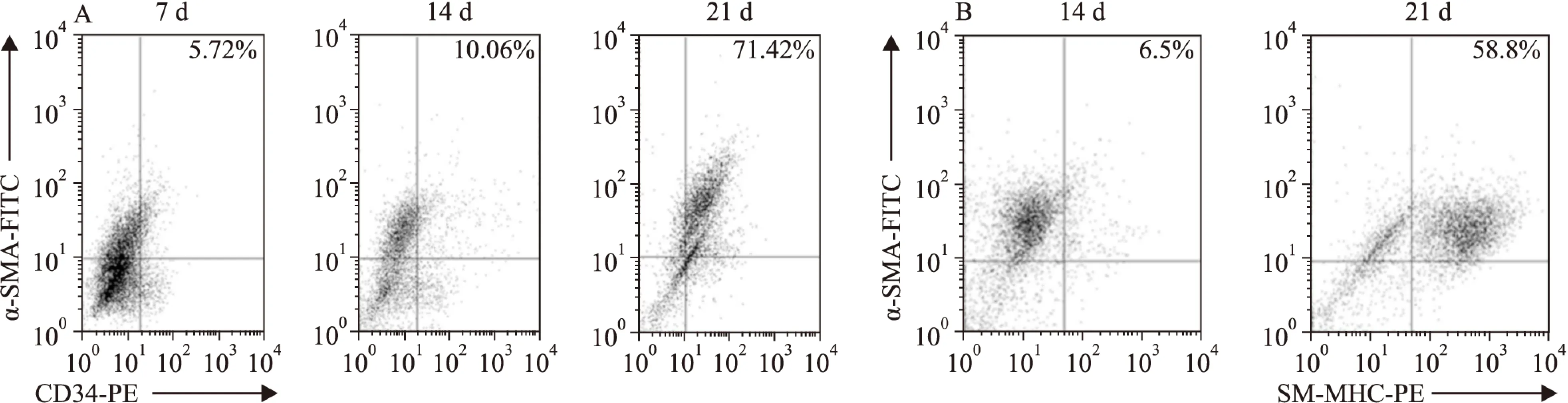
Fig 4 PDGF-BB induced mesenchymal stem cells to express α-SMA, CD34 and SM-MHC
A: α-SMA and CD34 expression after cells cultured with PDGF-BB(50 μg·L-1) were analyzed by flow cytometry on 7thday, 14thday and 21stday. B: SM-MHC and CD34 expression in the cells stimulated with PDGF-BB were analyzed by flow cytometry on 14thday and 21stday. The numbers indicated are the average values of three independent experiments
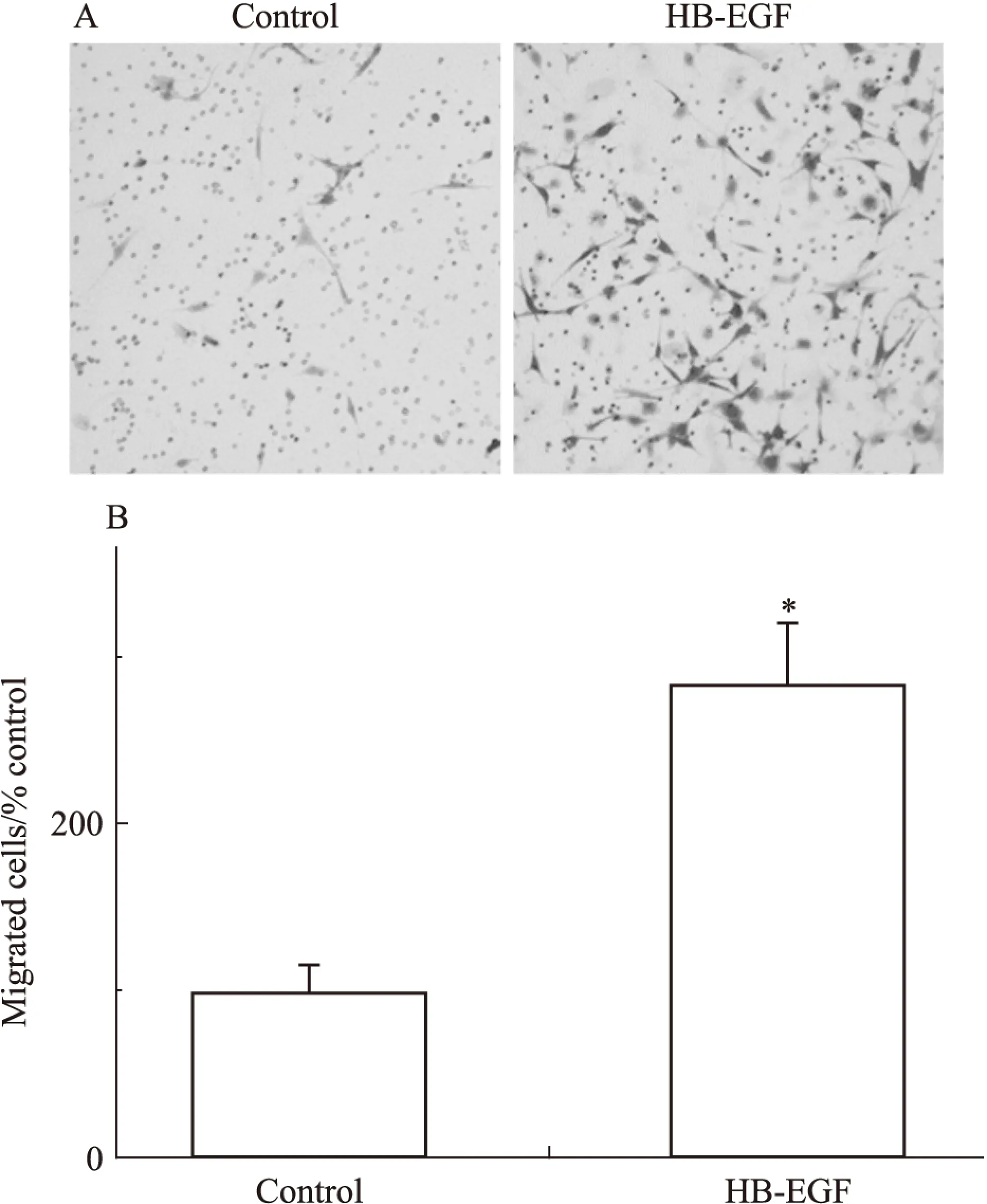
Fig 5 Smooth muscle progenitor cells migrated in vitro
A:The migration of smooth muscle progenitor cells induced by HB-EGF was investigated by Boyden chamber assay;B:The magnitude of smooth muscle progenitor cells migration was expressed as the fold change of migrationvsblank control group. Studies included three independent experiments.*P<0.05 compared to the blank control group.
2.3.2体内迁移我们使用PKp6染色剂作为体内示踪剂,通过OVA或PBS的雾化攻击观察平滑肌祖细胞在小鼠体内的迁移能力。结果显示,与空白对照组以及PBS雾化组相比,OVA雾化攻击可明显增加小鼠气道组织中阳性标记细胞的含量,证实平滑肌祖细胞在体内也具有迁移能力(Fig 6)。
3 讨论
2002年,Smiper等首先从人外周血中分离出能够向平滑肌细胞分化的CD34+祖细胞,并发现PDGF-BB能够促进这种前体细胞分化成平滑肌细胞[2]。由于骨髓是体内多种干细胞及祖细胞的重要来源,且平滑肌祖细胞最早发现于外周血,因此学者普遍认为其最可能来源于骨髓MSC。之后,许多围绕诱导骨髓MSC向平滑肌祖细胞定向分化的实验因此展开,研究者发现,使用大剂量PDGF-BB刺激骨髓MSC,能够诱导其表达α-SMA、SM-MHC及钙调蛋白等平滑肌特异性标志物,分化成为平滑肌祖细胞[4,9,11]。
然而,这种由骨髓来源MSC进行体外培养获得平滑肌祖细胞的方法虽然能够在人、大鼠等动物中得到成功实施,却不易在小鼠中进行[8]。小鼠骨髓中富含造血干细胞,而MSC的含量却极低,细胞数仅为百万分之一[12],较难通过贴壁法获取真正的MSC,且即便多次重复传代换液也很难排除造血干细胞的干扰。同时,小鼠骨髓SMC培养周期长,往往在获得纯化MSC之前细胞已衰老或分化形成异质细胞群,这都致使采用骨髓来源MSC进行体外祖细胞定向分化培养及其功能研究的小鼠模型实验极为困难。因此,本实验改为尝试采用小鼠密质骨来源MSC制备平滑肌祖细胞,并采用胶原酶消化长骨骨干40 min中后直接取游出细胞进行铺板,简化了密质骨来源MSC的提取方法。我们发现,直接提取游出细胞进行铺板,并培养于低氧培养箱内[13],48 h细胞即可贴壁且增殖旺盛,3~4 d即有70%~80%细胞融合,可开始进行诱导分化实验。使用PDGF-BB刺激1周后,细胞开始出现峰谷状排列,部分细胞即开始表达α-SMA或CD34。而诱导3~4周后,70%以上细胞为CD34和α-SMA双阳性,提示分化为平滑肌祖细胞。由此证实,密质骨来源间充干细胞同样具有向平滑肌祖细胞分化的能力。采用这种方法进行平滑肌祖细胞培养,能够明显缩短平滑肌祖细胞的培养周期,造血干细胞污染少,前期不需要添加细胞因子或其他制剂亦能获得纯度较高的MSC,后期亦无需特殊培养体系或技术。经PDGF-BB诱导2~3周后,双阳性表达CD34+/α-SMA+的细胞含量高,具有较好的细胞活性,适于进行后续细胞功能研究。
此外,我们的研究也发现,在使用PDGF-BB诱导分化的过程中,细胞首先表达单一阳性的CD34或α-SMA,后期才出现两者双阳性的细胞,这种标志物出现顺序不一致的原因目前尚不得而知,可能反映了细胞分化过程中复杂的调节机制。SM-MHC是较为特异性的平滑肌标志物,我们的实验表明,培养3周以上时可见部分细胞开始表达这一标志物,显示平滑肌祖细胞具有进一步向平滑肌细胞分化的能力。后续针对平滑肌祖细胞迁移功能的研究显示,无论在体外或体内,平滑肌祖细胞都具有较强的迁移能力,能够被促迁移细胞因子或OVA诱导的肺部炎症募集,证实用本方法培养得到的平滑肌祖细胞具有良好的细胞活性,适于进行后续的相关功能研究。综上所述,本实验介绍了一种改良的小鼠平滑肌祖细胞的培养方法,这种方法培养小鼠平滑肌祖细胞周期更短,获得细胞比率高且活性好,且更为简便,能够用于后续的平滑肌祖细胞功能及相关机制研究。
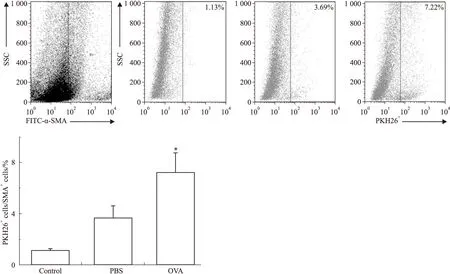
Fig 6Smooth muscle progenitor cells migratedinvivoSensitized mice were transferred with smooth muscle progenitor cells labed with PKp6 red fluorescence via tail vein on day 19 and day 22, and challenged with OVA from day 18 to day 23.Control group received PBS instead. The frequency of PKp6 labeled cells in α-SMA+cells harvested from tracheae was analyzed by flow cytometry. The data showed as the average percentage of PKp6+cells in α-SMA+cells from three independent experiments.n=5/group.*P<0.05 compared with PBS and control group.
(致谢:本文于浙江大学医学院附属第一医院呼吸内科实验室完成,感谢陈君君、卢珊、陆国华等实验人员的参与,特此致谢!)
[1]朗艳松,秘红英,刘红利,袁国强. 通心络联合阿托伐他汀、阿司匹林对家兔动脉粥样硬化早期血管外膜滋养血管新生的干预作用[J].中国药理学通报,2015, 31(1): 71-6.
[1]Lang Y S, Mi H Y, Liu H L, Yuan G Q. Interventional effects of Tongxinluo combined with Atorvastatin and Aspirin(ATS) on the angiogenesis of vasa vasorum in the early stage of atherosclerosis[J].ChinPharmacolBull,2015,31(1):71-6.
[2]郭勇英,张军芳,贾存勤,高怀林. 通心络联合外周血间充质干细胞移植对糖尿病足大鼠血管新生HIF-1/VEGF通路及miR-210表达的影响[J].中国药理学通报, 2015,31(12): 1749-53.
[2]Guo Y Y, Zhang J F, Jia C Q, Gao H L. Treatment effect of Tongxinluo combined peripheral blood derived mesenchymal stem cells transplantation on angiogenesis HIF-1/VEGF pathway and miR-210 in diabetic foot rats[J].ChinPharmacolBull,2015,31(12):1749-53.
[3]Majesky M W, Dong X R, Regan J N, Hoglund V J. Vascular smooth muscle progenitor cells: building and repairing blood vessels[J].CirRes, 2011,108(3): 365-77.
[4]Daniel J M, Sedding D G. Circulating smooth muscle progenitor cells in arterial remodeling[J].JMolCellCardiol, 2011,50(2): 273-9.
[5]Makowska J S, Grzegorczyk J, Cieslak M, et al. Recruitment of CD34+progenitor cells into peripheral blood and asthma severity[J].AnnAllergyAsthmaImmunol, 2008, 101(4): 402-6.
[6]Wu Y, Fu H, Yang H, et al. Smooth muscle progenitor cells involved in the development of airway remodeling in a murine model of asthma[J].AsianPacJAllergyImmunol, 2014, 32(3): 203-10.
[7]Wang Q, Li H, Zhang Z, et al. Prolonged ovalbumin challenge facilitates Th17 polarization in sensitized mice[J].InflammRes, 2010,59(7): 561-9.
[8]Zhu H, Guo Z K, Jiang X X, et al. A protocol for isolation and culture of mesenchymal stem cells from mouse compact bone[J].NatProtoc, 2010,5(3): 550-60.
[9]Yu J, Li Y, Li M, et al. Oxidized low density lipoprotein-induced transdifferentiation of bone marrow-derived smooth muscle-like cells into foam-like cellsinvitro[J].IntJExpPathol, 2010,91(1): 24-33.
[10]Shafi S, Lamb D, Modjtahedi H, Ferns G. Periadventitial delivery of anti-EGF receptor antibody inhibits neointimal macrophage accumulation after angioplasty in a hypercholesterolaemicrabbit[J].IntJExpPathol, 2010, 91(3): 224-34.
[11]Xie S Z, Fang N T, Liu S, et al. Differentiation of smooth muscle progenitor cells in peripheral blood and its application in tissue engineered blood vessels[J].JZhejiangUnivSciB, 2008, 9(12): 923-30.
[12]Phinney D G, Kopen G, Isaacson R L, Prockop D J. Plastic adherent stromal cells from the bone marrow of commonly used strains of inbred mice: variations in yield, growth, and differentiation[J].JCellBiochem, 1999,72(4):570-85.
[13]Ohnishi S, Yasuda T, Kitamura S, Nagaya N. Effect of hypoxia on gene expression of bone marrow-derived mesenchymal stem cells and monocuclearcells[J].StemCells, 2007,25(5): 1166-77.
Invitroculture and migration assay of mouse smooth muscle progenitor cells
WANG Qing, LI He-quan, ZHOU Jian-ying
(DeptofRespiratoryandCriticalCareMedicine,FirstAffiliatedHospitalofZhejiangUniversitySchoolofMedicine,ZhejiangUniversity,Hangzhou310003,China)
AimTo establish a reliable method for the culture of mouse smooth muscle progenitor cells and investigate their migration ability.MethodsMesenchymal stem cells from compact bones were obtained from C57BL/6 mice and stimulated with PDGF-BB to induce these cells to differentiate into smooth muscle progenitor cells. Morphological analysis, immunocytochemical and flow cytometric analysis were used to identify the cell type and the migration ability was investigated by the transwell system and flow cytometry.ResultAfter PDGF-BB stimulation for 7 days, the cells showed spindle shape and started to express α-SMA as demonstrated by immunocytochemistry. After 21 days induction, Flow cytometric analysis revealed that over 70% of the cells expressed both CD34 and α-SMA and 58.5% of the cells expressed SM-MHC. Migration assay showed that the smooth muscle progenitor cells from culture could migrateinvivoandinvitro.ConclusionsThe culture of smooth muscle progenitor cells from compact bone-derived mesenchymal stem cells is easily operated with high yield rate and shorten culture period. Obtained smooth muscle progenitor cells from culture could migrateinvivoandinvitro, which is suitable for the mechanism studies.
smooth muscle progenitor cells; mesenchymal stem cells; culture; migration;α-SMA;PDGF-BB
◇论著◇
2016-01-18,
2016-04-20
国家自然科学基金资助课题(No 81100020,81170038)
王晴(1983-),女,博士,主治医师,研究方向:呼吸病学,E-mail:wqingss@163.com,Tel:0571-87236876;周建英(1957-)女,硕士,教授,主任医师,研究方向:呼吸病学,通讯作者,E-mail:zjyhz@zju.edu.cn,Tel:0571-87236876
10.3969/j.issn.1001-1978.2016.07.007
A
1001-1978(2016)07-0915-06
R-332;R322.74;R329.24;R349.33
`网络出版时间:2016-6-20 11:49网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.014.html