诱导子和前体协同添加对悬浮培养的鸡血藤细胞产异黄酮的影响
2016-08-06吴桂容曲芬霞何彩梅陈春岚陈兴田
吴桂容,曲芬霞,何彩梅,陈春岚,陈兴田
(贺州学院化学与生物工程学院,广西 贺州 542800)
诱导子和前体协同添加对悬浮培养的鸡血藤细胞产异黄酮的影响
吴桂容,曲芬霞,何彩梅,陈春岚,陈兴田
(贺州学院化学与生物工程学院,广西 贺州 542800)
在鸡血藤细胞悬浮培养的动力学基础上,研究诱导子(茉莉酸甲酯)、前体(苯丙氨酸、乙酸钠)以及两者协同添加对鸡血藤细胞产异黄酮的影响。结果表明:悬浮培养的鸡血藤细胞的异黄酮合成与细胞生长之间存在半偶联关系,指数生长期前期的第3 d有最大生长加速度,此时是最优添加时间。诱导子和前体单独添加均能促进异黄酮的合成,茉莉酸甲酯、苯丙氨酸和乙酸钠的最佳添加浓度分别为100、300、100 μmol/L,异黄酮含量分别为对照的1.34、1.83和1.57倍。诱导子和前体协同添加对异黄酮合成的促进作用强于单独添加,茉莉酸甲酯+苯丙氨酸+乙酸钠处理下异黄酮含量高达19.32 mg/L,为对照的3.62倍。
鸡血藤;细胞悬浮培养;异黄酮;诱导子;前体;协同作用
吴桂容,曲芬霞,何彩梅,等.诱导子和前体协同添加对悬浮培养的鸡血藤细胞产异黄酮的影响[J].广东农业科学,2016,43 (5):129-134.
鸡血藤是豆科植物密花豆(Spatholobus suberectus Dunn.)的干燥藤茎,主产广西,广东、云南等地也有分布。鸡血藤是一种补血、活血的传统大宗中药材,具有促进造血、镇静催眠、抗炎、免疫调节、抗肿瘤和抗病毒等多种药理作用[1-2]。由于长期对野生鸡血藤资源的无度利用,我国野生鸡血藤数量急剧减少,资源日益枯竭。目前,虽然已成功通过扦插育苗法对鸡血藤进行人工栽培繁殖,但其扦插育苗在育苗材料选材上受到限制,需要由两年生穗条扦插才可成活,其规模化应用受到限制[3]。随着现代生物技术的发展,应用植物细胞进行悬浮培养获得次生代谢产物得到了极大发展,如大豆异黄酮青天葵[4]、烟草[5]、大豆[6]等,目前尚未见鸡血藤细胞悬浮培养的相关报道。
鸡血藤成分构成复杂,其药理作用的关键活性成分是异黄酮类化合物,主要包括大豆黄酮、染料木素、刺芒柄花素和美皂异黄酮4种异黄酮活性成分[7]。异黄酮类化合物对组织培养有抑制作用,应用植物细胞进行悬浮培养是大规模获得异黄酮活性成分的有效手段[8]。目前,本课题组已成功诱导鸡血藤愈伤组织[9],构建鸡血藤悬浮细胞系并初步完成培养工艺初步优化,但其产量尚未达到工业化要求。在植物细胞培养中添加诱导子是提高目的化合物产量的常用方法,其中茉莉酸甲酯(methyl jasmonate,MJ)是植物细胞培养中常用的一种化学诱导子,其能有效调控次生代谢途径,提高次生代谢产物产量[10]。此外,在植物细胞培养中加入目的化合物生物合成的前体也能大幅提高产物产量,苯丙氨酸(phenylalanine,Phe)和乙酸钠(sodium acetate,NaAc)是植物合成异黄酮过程中的关键化合物[11]。本研究在鸡血藤细胞悬浮培养的动力学基础上,研究诱导子、前体和两者协同添加对鸡血藤细胞产异黄酮的影响,以期为鸡血藤细胞悬浮培养产异黄酮的工业化应用提供理论基础。
1 材料与方法
1.1 试验材料
试验材料为鸡血藤愈伤组织,取自鸡血藤嫩叶部位,以MS培养基+1.0 mg/L 6-BA(6-苄基氨基嘌呤)+ 0.5 mg/L NAA(1-萘乙酸)+30 g/L蔗糖+0.1 g/L VC诱导愈伤组织[9]。愈伤组织在25(± 1)℃、暗环境下培养,每15 d继代一次。愈伤组织经过传代筛选获得浅黄色、疏松颗粒状的愈伤组织培养系,准备接种。
1.2 细胞悬浮培养条件
将上述愈伤组织(约为5 g鲜重/瓶)接入液体MS培养基+0.5 mg/L NAA+1.0 mg/L 6-BA+30 g/L蔗糖+0.1 g/L+3 g/L水解酪蛋白中。细胞置于含100 mL培养基的300 mL三角烧瓶中进行培养,于25 (±1)℃暗环境下以100 r/min的速度摇瓶悬浮培养12 d,每个处理3次重复。
1.3 添加物质的处理
茉莉酸甲酯浓度设为25、50、75、100、125、150 μmol/L,苯丙氨酸浓度设为0、50、100、200、 300、400、500 μmol/L,乙酸钠浓度设为0、25、50、100、150、200、250 μmol/L,将不同浓度的诱导子和前体经除菌过滤后添加细胞培养液中,添加时间由动力学研究结果确定。协同添加中将最佳浓度的诱导子和前体分别或者共同添加到细胞培养液中。
1.4 生物量测定
取鸡血藤细胞培养物,2 000 r/min离心10 min,于60℃干燥至恒重,生物量为每升培养基收获的细胞干重(g/L)。
1.5 异黄酮含量测定
将干燥细胞充分研磨后于95%乙醇冷浸24 h,超声波处理30 min,过滤。提取3次,合并滤液,40℃下减压浓缩,100 mL乙酸乙酯∶水(5∶1,V/V)混合溶液萃取3次。而细胞过滤发酵液经低温冷冻浓缩后直接通过乙酸乙酯萃取抽提。合并乙酸乙酯抽提液,40℃下减压蒸馏。甲醇溶解定容至5 mL,经0.45 μm微孔滤膜过滤后HPLC定量分析。
色谱条件:Agilent1100高效液相色谱仪,色谱柱:Purospher Star Cl8柱(4.6 mm ×250 mm,5 μm),流动相为甲醇:水:乙酸(10∶10∶1,V/V/V)溶液,柱温25℃,进样体积20 μL,流速1.0 mL/min,检测波长260 nm,以外标法计算总异黄酮含量。单体标准品分别是大豆黄酮、染料木素、刺芒柄花素和美皂异黄酮(购自Sigma,纯度98%)。总异黄酮含量为细胞内及发酵液上清中异黄酮含量之和,以每升培养液内4种异黄酮的总量表示(mg/L)。
用Excel 2013进行数据统计,以SPSS 19.0进行数据拟合、模型求导和多重比较分析(LSD)。
2 结果与分析
2.1 悬浮培养鸡血藤细胞的生长和异黄酮合成
悬浮培养的鸡血藤细胞的生长和异黄酮合成曲线如图1所示。鸡血藤细胞生长曲线呈现S形分布,其中培养0~3 d为细胞生长延滞期,生长缓慢,异黄酮合成也未开始。从培养3 d开始进入指数生长期,细胞快速生长,生物量至培养8 d达到最大(12.03 g/L),异黄酮含量也在培养4 d开始快速上升。指数生长期过后即快速进入衰亡期,稳定期较短,生物量从培养8 d开始衰减,但异黄酮合成继续进行,异黄酮含量在培养12 d达到最大(5.34 mg/L)。异黄酮合成与细胞生长之间存在着半偶联关系,与其他植物细胞的悬浮培养的结果类似[12]。

图1 悬浮培养的鸡血藤细胞生长和异黄酮合成曲线
2.2 悬浮培养的鸡血藤细胞生长动力学
在批次培养中,一般用Logistic曲线对细胞生长曲线进行拟合。悬浮培养的鸡血藤细胞生长的Logistic拟合曲线如图2。拟合函数为y=11.18+ (2.11-11.18)/(1+(x/4.59) 6.86)(R2=0.963),表明Logistic函能较好地对细胞生长进行拟合。进一步对拟合函数进行一阶和二阶求导,从而得出鸡血藤细胞生长的速度和加速度(图3)。结果表明细胞生长速率先增大后减小,至培养5 d有最大生长速度(图3A);而细胞生长加速度先增大再减小,再小幅回升,至培养3 d有最大生长加速度(图3B)。可见细胞生长加速度最大时(通常是指数生长期的前期)是添加物质的最佳时间,此时进行处理能显著促进植物细胞次生代谢物的合成[12-13]。因此,本研究选择继代培养后3 d添加诱导子和前体。

图2 鸡血藤细胞生长的Logistic拟合曲线
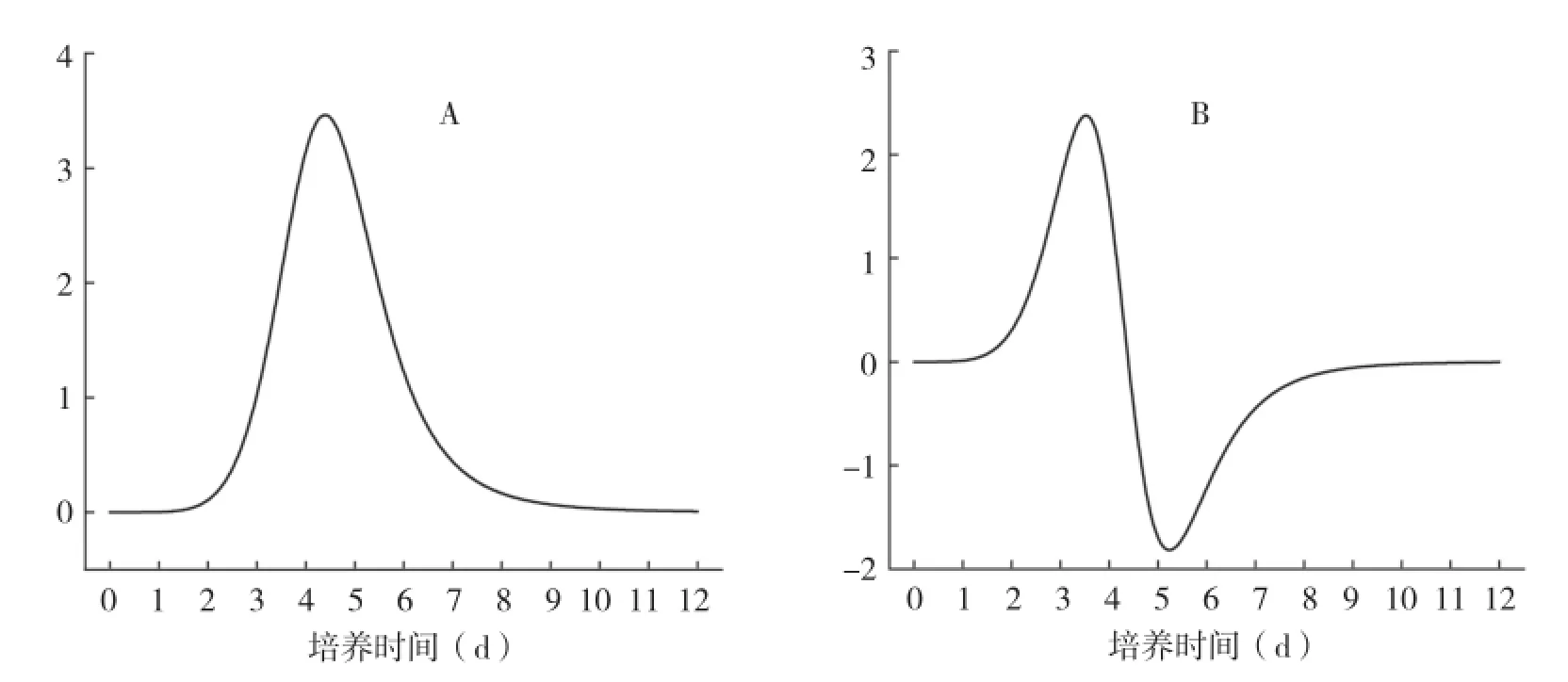
图3 鸡血藤细胞生长的Logistic函数的一阶求导(A)和二阶求导(B)
2.3 诱导子茉莉酸甲酯对鸡血藤细胞产异黄酮的影响
本研究于继代培养第3 d加入不同浓度茉莉酸甲酯,于第12 d收获细胞,结果如图4所示。随着茉莉酸甲酯浓度的升高,鸡血藤细胞生长受到的抑制作用增强,在150 μmol/L茉莉酸甲酯作用下生物量仅剩对照的55.78%。而异黄酮含量随着茉莉酸甲酯浓度的升高先增加后减少。其中低浓度的茉莉酸甲酯(25 μmol/L)对异黄酮的合成未见显著促进作用;在100 μmol/L茉莉酸甲酯作用下异黄酮含量达到最高、达8.21(±0.45 )mg/L(为对照组的1.34倍)。以上结果说明诱导子茉莉酸甲酯能显著促进异黄酮的合成,其最佳添加浓度为100 μmol/L。
2.4 前体苯丙氨酸和乙酸钠对鸡血藤细胞产异黄酮的影响

图4 不同浓度茉莉酸甲酯对鸡血藤细胞产异黄酮的影响

图5 不同浓度苯丙氨酸对鸡血藤细胞产异黄酮的影响

图6 不同浓度乙酸钠对鸡血藤细胞产异黄酮的影响
本研究对两种前体物质苯丙氨酸和乙酸钠分别进行研究,分别于继代培养后3 d添加。不同浓度的前体苯丙氨酸对细胞生长和异黄酮合成的影响如图5所示。结果显示随着苯丙氨酸浓度的升高,其对细胞生长的抑制作用增强,在500 μmol/L苯丙氨酸作用下生物量仅剩对照组的44.67%。苯丙氨酸的添加对异黄酮合成具有明显的促进作用,在50~300 μmol/L苯丙氨酸作用下异黄酮含量不断增加,随后则开始下降。其中在300 μmol/L苯丙氨酸作用下异黄酮含量达到最高、达8.21(± 0.45)mg/L(为对照的1.83倍)。以上结果说明前体物质苯丙氨酸能显著促进异黄酮的合成,其最佳添加浓度为300 μmol/L。
不同浓度的前体乙酸钠对细胞生长和异黄酮合成的影响如图6所示。在25~100 μmol/L乙酸钠作用下,其对异黄酮合成具有促进作用,其中在100 μmol/L苯丙氨酸作用下异黄酮含量最高、达8.21(±0.45)mg/L(为对照的1.57倍)。随着乙酸钠浓度的升高,其对细胞生长的抑制作用增强,在250 μmol/L乙酸钠作用下生物量仅剩对照的37.51%。说明前体物质乙酸钠也能显著促进异黄酮的合成,其最佳添加浓度为100 μmol/L,但其促进效果要低于苯丙氨酸。

图7 诱导子和前体协同添加对鸡血藤细胞产异黄酮的影响
2.5 诱导子和前体协同添加对鸡血藤细胞产异黄酮的影响
诱导子诱导和前体喂养两条途径均能促进产物合成[14],为进一步研究诱导子和前体协同添加对鸡血藤细胞产异黄酮的影响,于继代培养后3 d分别将最佳浓度的诱导子茉莉酸甲酯和前体苯丙氨酸和乙酸钠分别或协同添加于悬浮培养的鸡血藤细胞培养液中,结果见图7。诱导子和前体协同添加对细胞生长的抑制效应强于诱导子的单独添加,但弱于两种前体物质的协同添加。不同处理对类黄酮合成的促进作用依次为:茉莉酸甲酯+苯丙氨酸+乙酸钠>茉莉酸甲酯+苯丙氨酸>茉莉酸甲酯+乙酸钠>苯丙氨酸+乙酸钠>茉莉酸甲酯>对照组。前体和诱导子对异黄酮合成表现出明显的协同效应,茉莉酸甲酯联合苯丙氨酸、乙酸钠的产量〔分别为17.14(±0.45)、15.69(±0.37)mg/L〕显著高于茉莉酸甲酯的单独添加(8.21± 0.47 mg/L);茉莉酸甲酯+苯丙氨酸+乙酸钠处理下异黄酮含量高达19.32 mg/L,为对照组的3.62倍。说明茉莉酸甲酯、苯丙氨酸和乙酸钠三者的协同添加对促进异黄酮合成具有最佳促进效果。
3 结论与讨论
自19世纪40年代植物细胞的实验室培养技术建立以来,植物细胞培养快速发展,其中红豆杉、人参、长春花、三七等珍稀药用植物的细胞悬浮培养是国内外研究的热门方向[15]。药用植物的细胞悬浮培养具有生长快速、条件可控、次生代谢产物易合成的特点,是大规模获得药物有效成分、缓解珍稀中药材供应紧张的重要手段,但产量过低限制了植物细胞培养的商业化推广[15-16]。诱导子(如茉莉酸甲酯)和前体(如苯丙氨酸、乙酸钠)的添加是提高目的次生代谢物产量的常用手段,在植物细胞培养被中广泛使用[13,17]。
诱导子能够选择性地诱导植物特定基因的表达,进而促进特定的次生代谢物合成途径,是影响植物次生代谢的有效因素[14]。研究表明,外源茉莉酸甲酯主要通过提高植物细胞的苯丙氨酸解氨酶(PAL)促进异黄酮的合成[18]。而前体主要是植物次生代谢途径的中间产物,前体的添加能有效消除途径中的关键酶或化合物的阻碍作用,从而大幅度提高次生代谢物的产量[19]。如前体苯丙氨酸是黄酮类化学物B杂环和C杂环的直接组成部分,而乙酸钠则能为黄酮类化学物A杂环中乙酸提供来源[11,20]。诱导子和前体的作用机制并不重叠,两者具有协同添加的基础。曲均革等[21]研究表明,诱导子和前体具有协同作用,茉莉酸甲酯、苯丙氨酸和光照的联合使用使葡萄细胞培养合成花青素提高了2.5~5.2倍。
本研究中,悬浮培养的鸡血藤细胞的异黄酮合成与细胞生长之间存在着半偶联关系。动力学研究表明在指数生长期前期的第3 d有最大生长加速度,适宜作为诱导子和前体添加的时间。诱导子茉莉酸甲酯的最佳添加浓度为100 μmol/L,异黄酮含量为对照的1.34倍;前体苯丙氨酸和乙酸钠的最佳添加浓度分别为300、100 μmol/L,异黄酮含量分别为对照的1.83和1.57倍;诱导子和前体协同添加对异黄酮合成的促进作用强于单独添加,茉莉酸甲酯+苯丙氨酸+乙酸钠处理下异黄酮含量高达19.32 mg/L,为对照组的3.62倍。诱导子和前体的协同添加大幅度了提高异黄酮产量,为鸡血藤细胞悬浮培养产异黄酮的工业化应用提供理论基础。
[1]符影,程悦,陈建萍,等.鸡血藤化学成分及药理作用研究进展[J].中草药,2011,42(6):1229-1234.
[2]Wang Z Y,Wang D M,Loo T Y,et al.Spatholobus suberectus inhibits cancer cell growth by inducing apoptosis and arresting cell cycle at G2/M checkpoint [J].Journal of Ethnopharmacology,2011,133(2):751-758.
[3]曲芬霞,吴桂容,李忠芳,等.鸡血藤硬枝扦插繁殖技术研究[J].浙江林业科技,2010,30(6):27-30.
[4]张晓丽,梁凌玲,詹若挺,等.药用植物青天葵的悬浮培养条件优化[J].广东农业科学,2012,39 (16):32-35.
[5]Reuter L J,Bailey M J,Joensuu J J,et al.Scaleup of hydrophobin-assisted recombinant protein production in tobacco BY-2 suspension cells[J].Plant Biotechnology Journal,2014,12(4):402-410.
[6]Yan W,Han Y,Teng W,et al.Expression quantitative trait loci infer the regulation of isoflavone accumulation in soybean (Glycine max L.Merr.)seed.[J].BMC Genomics,2014,15(1):1-11.
[7]余弯弯,金晨,双鹏程,等.丰城鸡血藤异黄酮及黄烷类化学成分的研究[J].中国中药杂志,2015,40 (12):2363-2366.
[8]罗建平,曹磊,潘利华,等.稀土元素对怀槐悬浮培养细胞异黄酮合成及氧化还原态的影响[J].应用与环境生物学报,2008,14(3):362-365.
[9]吴桂容,陈春岚,曲芬霞,等.鸡血藤嫩叶愈伤组织诱导最佳培养基的筛选[J].现代农业科技,2009,37(18):93-94.
[10]Gumerova E A,Akulov A N,Rumyantseva N I.Effect of methyl jasmonate on growth characteristics and accumulation of phenolic compounds in suspension culture of tartary buckwheat[J].Russian Journal of Plant Physiology,2015,62(2):195-203.
[11]康亚兰,裴瑾,蔡文龙,等.药用植物黄酮类化合物代谢合成途径及相关功能基因的研究进展[J].中草药,2014,45(9):1336-1341.
[12]陈书安,王晓东,袁晓凡,等.藏红花细胞悬浮培养动力学研究[J].生物技术通报,2011,27(4):102-105.
[13]莫歌,黄蕾,康利平,等.不同类型诱导子对欧洲花楸悬浮细胞次生代谢的影响[J].中药材,2014,37 (6):927-931.
[14]刘冉,王振宇,崔杰,等.前体物质和诱导子对红松松多酚合成的影响[J].北京林业大学学报,2013,35(5):22-26.
[15]高文远,贾伟,段宏泉,等.药用植物发酵培养的工业化探讨[J].中国中药杂志,2003,28(5):385-390.
[16]Hu G,Jia J.Production of Useful Secondary Metabolites Through Regulation of Biosynthetic Pathway in Cell and Tissue Suspension Culture of Medicinal Plants[M].Rijeka:Intech,2012.
[17]谢腾,莫歌,张山山,等.不同诱导子对植物次生代谢的影响[J].中国实验方剂学杂志,2015,21(7):210-215.
[18]马君兰,赵越.外源茉莉酸甲酯(MeJA)对大豆异黄酮合成途径的影响[J].东北农业大学学报,2011,42(5):14-18.
[19]Moscatiello R,Baldan B,Navazio L.Plant cell suspension cultures[J].Methods in Molecular Biology,2013,953(953):77-93.
[20]Nguyen T X,方升佐,Nguyen Q H,等.培养基和植物生长调节剂对青钱柳悬浮细胞三萜产量的影响[J].西南林业大学学报,2015,35(1):6-11.
[21]曲均革,虞星炬,张卫,等.前体饲喂、诱导子和光照联合使用对葡萄细胞培养合成花青素的影响[J].生物工程学报,2006,22(2):299-305.
(责任编辑 白雪娜)
Synergistic effects of elicitors and precursors on the synthesis of isoflavones in cell suspension culture of Spatholobus suberectus Dunn.
WU Gui-rong,QU Fen-xia,HE Cai-mei,CHEN Chun-lan,CHEN Xing-tian
(College of Chemical and Biological Engineering,Hezhou University,Hezhou 542800,China)
The study investigated the effects of elicitors (methyl jasmonate,MJ),precursors (phenylalanine,Phe and sodium acetate,NaAc) and their synergistic effects on the synthesis of isoflavones in cell suspension culture of Spatholobus suberectus Dunn.,based on the result of kinetics research.The results showed that a semi-coupling relationship existed between cell growth of S.suberectus and isoflavone synthesis.At the 3rd d,the maximum acceleration of growth was found,indicating that it's suitable adding time for elicitors and precursors could promote the isoflavone synthesis,as the best added concentration for MJ,Phe and NaAc were 100 μmol/L,300 μmol/L and 100 μmol /L,which were 1.34,1.83 and 1.57 times to the control,respectively.The synergistic addition of elicitors and precursors significantly promoted isoflavone synthesis,with isoflavone content up to 19.32 mg/L in MJ+Phe+NaAc treatment (as 3.62 times to the control).This study provided the theory basis for scale amplification in suspension cell culture of S.suberectus.
Spatholobus suberectus Dunn.;cell suspension culture;isoflavone;elicitors;precursors;synergistic effect
Q814
A
1004-874X(2016)05-0129-06
10.16768/j.issn.1004-874X.2016.05.025
2016-01-18
