激活星形胶质细胞α7乙酰胆碱能受体抑制β-淀粉样蛋白的聚集
2016-08-05禹文峰官志忠
孔 欣 禹文峰 官志忠
(贵州医科大学病理学教研室,贵州 贵阳 550004)
激活星形胶质细胞α7乙酰胆碱能受体抑制β-淀粉样蛋白的聚集
孔欣禹文峰1官志忠1
(贵州医科大学病理学教研室,贵州贵阳550004)
〔摘要〕目的研究在星形胶质细胞内加入尼古丁后能否激活细胞内α7尼古丁乙酰胆碱能受体(nAChR)以及激活的α7nAChR对β-淀粉样蛋白(Aβ)的降解作用。方法分离新生乳鼠大脑皮质培养原代星形胶质细胞并纯化、传代,使用细胞免疫荧光法鉴定细胞的纯度。凝胶银染方法鉴定寡聚体聚集情况。试验分为正常对照组、激动剂组、拮抗剂组以及Aβ组激动剂+Aβ组、拮抗剂+Aβ组,用蛋白印迹法检测α7nAChR蛋白表达情况以及激活细胞内受体后对Aβ的降解作用。结果经过传代培养细胞得以纯化。体外制备好的Aβ1~42除了含少量的未聚集的单体(4 kD)外,主要以二聚体、三聚体、九聚体等不同聚集形式的寡聚体存在。尼古丁组与对照组相比α7nAChR表达明显升高(P<0.01),尼古丁组与拮抗剂组相比α7nAChR表达升高(P<0.05);收集的蛋白与上清液,尼古丁组与Aβ组相比Aβ的表达均明显降低(P<0.01),激动剂+Aβ组与拮抗剂+Aβ组相比Aβ的表达均明显降低(P<0.01)。结论尼古丁可以激活星形胶质细胞内的α7nAChR,激活的α7nAChR对Aβ具有明显的降解作用,能够为预防和治疗阿尔茨海默氏病(AD)提供一个可能的方向。
〔关键词〕尼古丁;星形胶质细胞;α7乙酰胆碱能受体;阿尔茨海默病;β-淀粉样蛋白;寡聚体
星形胶质细胞在中枢神经系统具有维持内平衡、防御、再生的基本作用。星形胶质细胞功能降低会引起大脑的老化和神经退行性疾病的发生,例如阿尔茨海默病(AD)〔1〕。AD发病早期,发现β-淀粉样蛋白(Aβ)形成的老年斑周围有持续、大量激活的星形胶质细胞聚集。激活的星形胶质细胞可产生多种炎症因子,加剧Aβ的产生,导致神经细胞的毒性损伤;同时,它可降解Aβ的毒性,降低Aβ对神经细胞的损伤,并可通过结合、吞噬细胞外的Aβ,从而减少老年斑的聚集〔2〕。Aβ与尼古丁乙酰胆碱能受体(nAChR)也有密切联系,通过浓度-效应方式激活或抑制受体。α7nAChR具有受体保护功能,降低Aβ毒性;但是α7nAChR和Aβ、淀粉样斑块可导致神经退行性病变〔3〕。本文旨在研究α7nAChR是否对Aβ具有降解作用,为预防和治疗AD提供一个可能的方向。
1材料与方法
1.1主要材料新生24 h的(Sprague-Dawley SD)大鼠由贵州医科大学动物实验中心提供。DMEM培养基、胎牛血清、F12无酚红培养基购自Gibco公司(美国);0.25%胰蛋白酶、青-链霉素购自Hyclone公司(美国);GFAP兔抗牛多克隆抗体购自Dako公司(丹麦);Cyb3标记的羊抗兔IgG购自碧云天公司;Aβ1~42肽、六氟异丙醇、DMSO、尼古丁购自Sigma公司(美国);甲基牛扁亭购自TOCRIS公司(英国);鼠抗Aβ多克隆抗体6E10购自Covance公司(美国);辣根过氧化物酶(HRP)标记的抗鼠二抗购自Santa Cruz公司(美国);一抗、二抗稀释液、封闭液购自碧云天公司;预制胶、电泳槽、预染标准品、电泳液、银染试剂盒等购自life technologies公司(美国);浓缩管、聚乙烯二氟(PVDF)膜、ECL-Plus发光试剂购自Millipore公司(美国);-80℃冰箱(美国Thermo公司)。
1.2方法
1.2.1体外制备Aβ参照Klein等〔4,5〕体外制备Aβ1~42寡聚体的方法,Aβ1~42粉末加入冷却的六氟异丙醇,使粉末彻底溶解,终浓度为1 mmol/L,室温孵育60 min后在冰上静置5~10 min,转移并等量分装至离心管,通风橱室温下过夜,使六氟异丙醇挥发完全。挥发完全后可见清晰透明的薄膜留在离心管底部。将干燥的肽膜存于-80℃冰箱。使用时将其放在冰上,用DMSO充分溶解,终浓度为5 mmol/L。接着用不含酚红的F12培养基稀释为100 μmol/L的浓度。4℃孵育24 h后,14 000 r/min冰冻高速离心机离心10 min,上清液即为寡聚体。
1.2.2寡聚体的鉴定选取4%~12%的Bis-Tris预制梯度胶,将制备好的Aβ寡聚体与不含还原剂的上样缓冲剂混合后,70℃加热10 min,加入预制胶的孔中电泳。结束后,使用银染试剂盒,按照说明书要求,对胶进行染色,最后扫描凝胶。
1.2.3分组及细胞处理将培养好的星形胶质细胞纯化、传代并鉴定后,以5×105ml的密度种入6孔板内。根据实验的要求,将细胞分为正常对照组、激动剂组、拮抗剂组以及Aβ组、激动剂+Aβ组、拮抗剂+Aβ组。其中正常对照组是正常的星形胶质细胞,不加入任何干预手段;Aβ蛋白组是在培养的细胞内加入终浓度为1 μmol/L的Aβ寡聚体;激动剂组为加入终浓度为5 μmol/L的激动剂尼古丁培养12 h;拮抗剂组为先加入浓度为10 μmol/L的α7nAchR拮抗剂甲基牛扁亭(MLA)2 h后,再加入激动剂尼古丁5 μmol/L培养12 h,激动剂+Aβ组加入浓度5 μmol/L的尼古丁培养12 h,换液,加入浓度1 μmol/L的Aβ寡聚体培养24 h;拮抗剂+Aβ组为先加入MLA培养2 h后,再加入尼古丁共同培养12 h,换液,最后加入浓度1 μmol/L的Aβ寡聚体培养24 h。37℃、 5%CO2培养箱中培养。
1.2.4蛋白印迹法的检测收集细胞的培养基后,加入浓缩管内将培养基浓缩约100倍、冰冻离心机7 500 r/min 1 h后收集备用。接着用冰PBS清洗贴壁细胞后,加入裂解液,冰置2 h后,冰冻离心机14 000 r/min、20 min后提取上清即为细胞蛋白。分别将不同组别的培养基和细胞蛋白与上样缓冲液混合后,70℃加热10 min,选取4%~12%的Bis-Tris预制梯度胶,加入预制胶的孔内,跑电泳。随后将胶上的条带转至0.22 μm的PVDF膜上。转膜成功后,将膜封闭2 h。用稀释后的α7nAChR、6E10一抗4℃孵育过夜后,再加入二抗在摇床上摇1 h。每进行下一步时,都要用含0.01%的吐温-20的TBST清洗干净。最后用ECL发光试剂观察表达情况。
1.2.5结果分析用扫描仪扫描曝光胶片,ImageJ软件分析结果时以β-actin蛋白条带作为内参照,计算目的蛋白条带与β-actin蛋白条带总灰度的百分比值作为目的条带蛋白的相对表达水平。分析培养基的结果时,以Aβ蛋白条带作为内参计算目的蛋白条带与Aβ蛋白条带总灰度的百分比值作为目的条带蛋白的相对表达水平。
1.3统计学分析采用SPSS21.0软件,多组间比较采用单因素方差分析,组间两两比较采用LSD-t法。
2结果
2.1星形胶质细胞原代培养及免疫荧光鉴定取24 h内的SD乳鼠的大脑皮质,培养7~9 d,纯化并传3~4代后,以GFAP细胞免疫荧光方法对星形胶质细胞进行染色,在倒置显微镜下观察,以Cy3标记阳性细胞呈红色,细胞计数星形胶质细胞占所有细胞的95%以上,可用于后续实验,见图1。
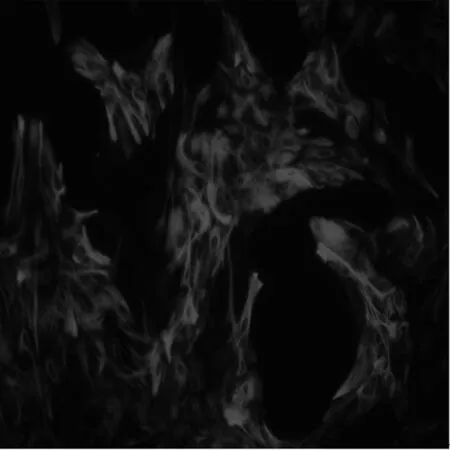
图1 星形胶质细胞GFAP细胞免疫荧光显色(×400)
2.2Aβ寡聚体聚集情况结果按照银染试剂盒的方法进行染胶。结果显示有未聚合的单体(4 kD),聚合好的Aβ寡聚体既含有低分子量的如二聚体、三聚体等,还有高分子量的如九聚体、十二聚体等不同聚集形式。见图2。
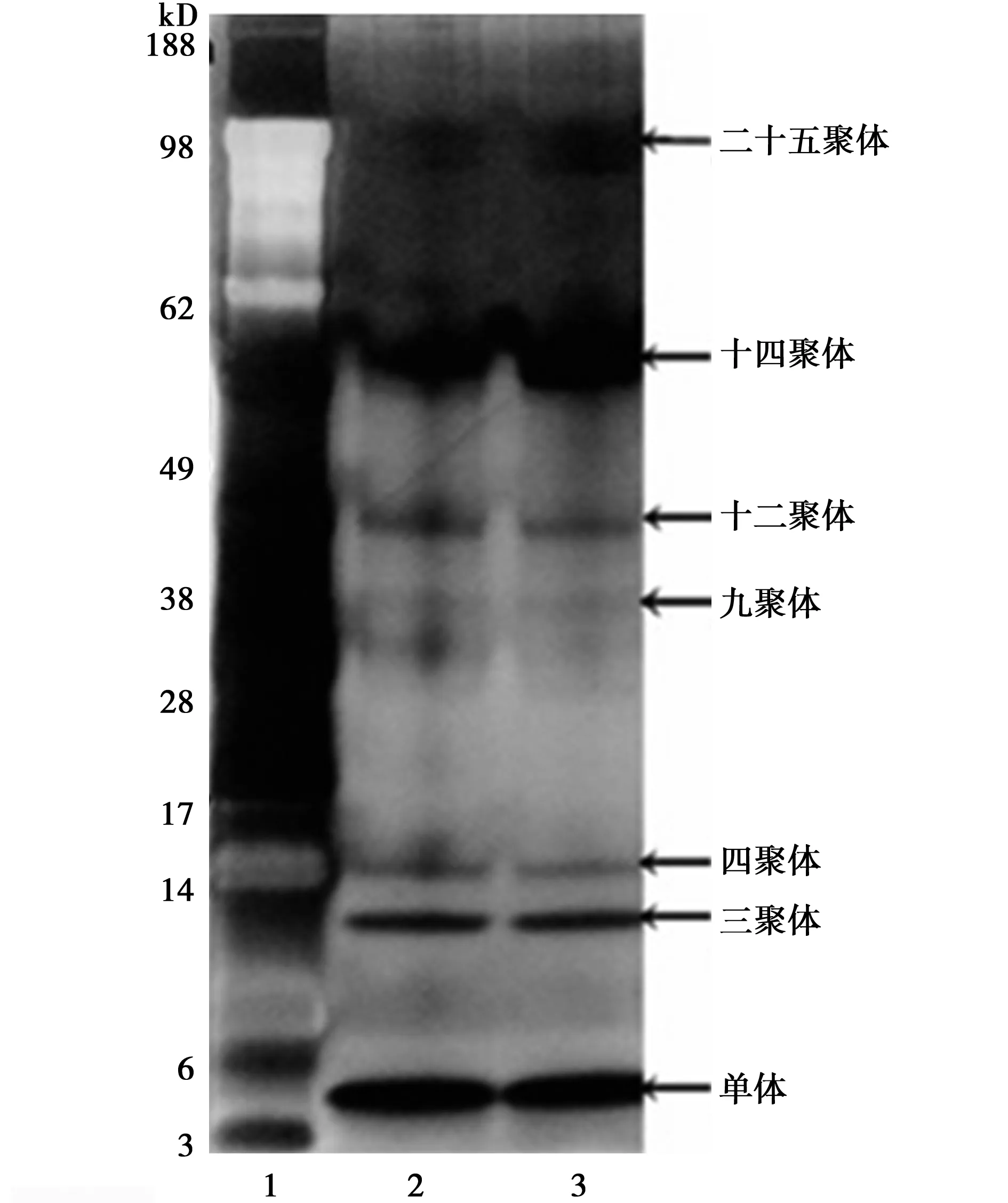
1:Marker;2、3:不同分子量的Aβ 图2 Aβ1~42寡聚体的聚集情况
2.3蛋白印迹法检测α7nAChR蛋白表达情况加入尼古丁的激动剂预处理组(137.33±17.67)与对照组(96.67±1.53)相比,α7nAChR蛋白表达水平明显升高(P<0.01);同时,激动剂组与加入拮抗剂MLA组(104.33±11.50)相比,α7nAChR蛋白表达水平升高(P<0.05),说明尼古丁能够激活星形胶质细胞内的α7nAChR。见图3。
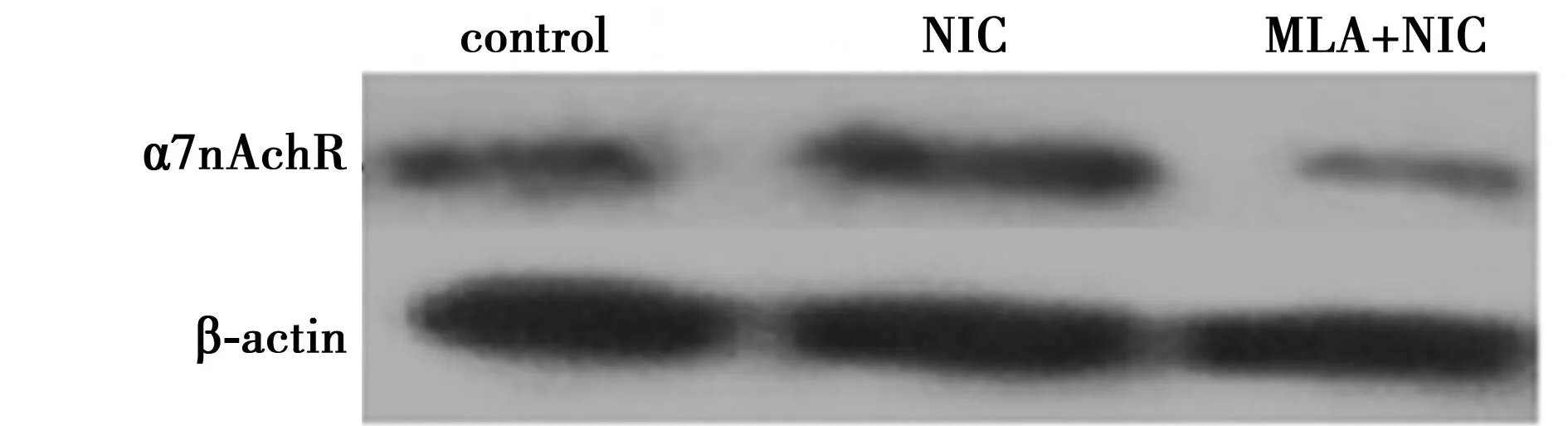
图3 加入尼古丁的α7nAChR蛋白表达情况
2.4蛋白印迹法检测Aβ蛋白表达加入尼古丁,提取总蛋白后,尼古丁预处理组(53.67±8.14)与Aβ蛋白组(100±4.58)和拮抗剂预处理组(82±8.71)相比,尼古丁预处理组(63.67±8.50)的Aβ蛋白均明显降低(P均<0.01)。收集培养基并回收浓缩后的上清液,尼古丁预处理组与Aβ蛋白组(180±12.77)和拮抗剂预处理组(93.33±6.51)相比,尼古丁预处理组的Aβ蛋白也有明显降解的变化(P均<0.01)。见图4。
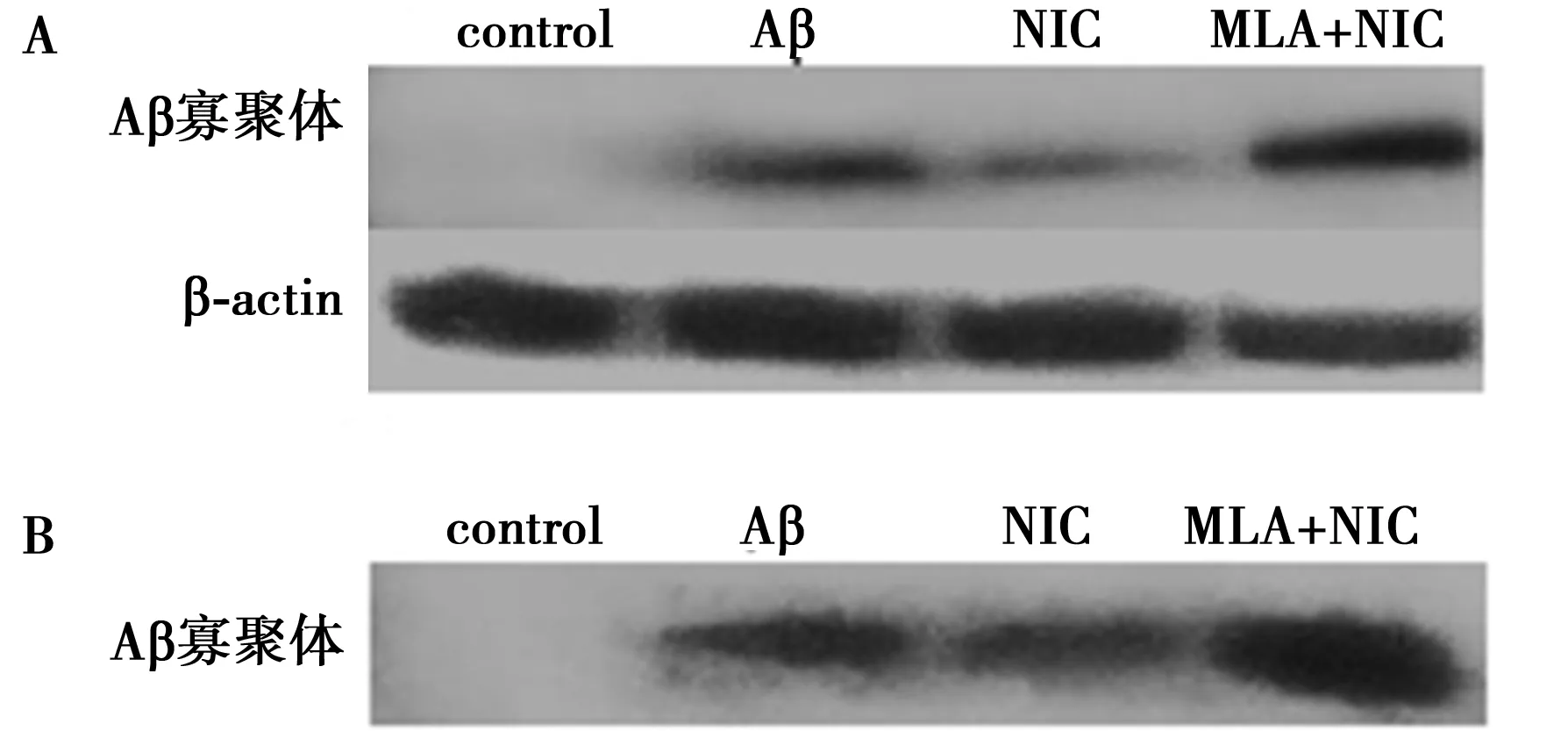
A:提取总蛋白的Aβ蛋白表达情况;B:培养基上清液的Aβ蛋白表达情况图4 尼古丁激活α7nAchR后Aβ蛋白表达情况
3讨论
AD是最常见的痴呆类型,占60%~80%〔6,7〕。Aβ的聚集和沉积不仅可以导致神经细胞凋亡,也会破坏突触结构和功能,从而导致记忆和认知功能障碍〔8~12〕。
星形胶质细胞是最多元化的胶质细胞类型,参与维持中枢神经系统内平衡〔13〕。神经退行性疾病的发生与中枢神经系统内稳态的破坏有关。由此可推测,在维持中枢神经系统内平衡中起着重要作用的星形胶质细胞是神经退行性疾病的病理学的一个关键因素〔14〕。在AD的大脑中发现增生的星形胶质细胞聚集在老年斑周围,说明内生性老年斑可导致星形胶质细胞的聚集和激活。激活的星形胶质细胞可产生多种炎症因子会加剧Aβ的产生,导致神经细胞的毒性损伤;同时,星形胶质细胞能够清除Aβ。星形胶质细胞主要是通过两种途径清除Aβ,一种是通过细胞的吞噬功能;另一种则通过分泌降解Aβ的蛋白酶:神经内肽酶、胰岛素降解酶(IDE)、基质金属蛋白酶和载脂蛋白E〔15,16〕。
胆碱能受体系统是体内最重要、最经典的神经传导通路之一。根据其药理学特性,主要分为毒蕈碱型乙酰胆碱能受体(mAChRs)和nAChRs。这两种受体类型和AD的发生都有密切联系〔17〕。nAChRs属于配体门控离子通道系统,响应乙酰胆碱神经递质的结合。nAChRs在整个脑内分布广泛,在大脑内参与认知、记忆、学习等重要功能,还调节多种其他受体的功能,并具有抵抗细胞毒性的神经保护作用〔18,19〕。nAChRs有α2~10和β2~4等12种亚单位,最主要的就是α4β2和α7nAChR,它们对于认知和记忆功能、调节神经递质突触可塑性起着重要的作用〔20〕。研究表明Aβ能够抑制α7nAChR的活力从而导致认知和记忆功能的降低〔21〕。在AD脑内发现Aβ与α7nAChR有高亲和力,能够损害这条信号通道。在Aβ毒性作用的诱导下,神经细胞nAChR的易损性导致胆碱能神经递质的传递及认知功能的障碍〔22〕。
尼古丁是烟草中主要的化学成分,能够提高注意力、学习、记忆等认知功能,还涉及治疗某些疾病,包括AD、帕金森病、精神分裂症、焦虑、抑郁等〔23,24〕。尼古丁自身的α-螺旋结构可与Aβ绑定,通过一个α-螺旋抑制β-折叠二级结构转变为β-淀粉样蛋白,从而减慢淀粉样蛋白聚集的过程。尼古丁还能够分解预成型的淀粉样纤维体。尼古丁激活α7nAChR,使α-分泌酶水解为淀粉样蛋白前体蛋白(APP),这是一条不产生完整Aβ的代谢途径,再由APP产生的较大N端片段sAPPα,可对神经细胞产生营养和保护作用。同时,尼古丁使脑脊液中甲状腺素运载蛋白升高,间接抑制毒性β-淀粉样蛋白纤维体生成。甲状腺素运载蛋白可约束Aβ,因此可以阻止Aβ聚集形成纤维体。尼古丁在自噬过程中也可促进细胞外Aβ内在化和降解〔25〕。尼古丁作为N型胆碱能受体激动剂,能够促进乙酰胆碱在突触前的释放。研究表明作为胆碱能受体激动剂的尼古丁能够提高人类和实验动物的认知功能〔26〕。
本实验证实了尼古丁能够激活星形胶质细胞内的α7nAChR,星形胶质细胞激活的α7nAChR可降解Aβ,为预防和治疗AD提供了一个可能的方向。
4参考文献
1Parpura V,Heneka MT,Montana V,etal.Glial cells in(patho)physiology〔J〕.J Neurochem,2012;121(1):4-27.
2Birch AM.The contribution of astrocytes to Alzheimer′s disease〔J〕.Biochem Soc Trans,2014;42(5):1316-20.
3Oz M,Lorke DE,Yang KH,etal.On the interaction of β-amyloid peptides and α7-nicotinic acetylcholine receptors in Alzheimer′s disease〔J〕.Curr Alzheimer Res,2013;10(6):618-30.
4Klein WL.Aβ toxicity in Alzheimer′s disease:globular oligomers(ADDLs)as new vaccine an drug targets〔J〕.Neurochem Intern,2002(41):345-52.
5Nichols MR,Colvin BA,Hood EA.Biophysical comparison of soluble amyloid-β(1-42)protofibrils,oligomers,and protofilaments〔J〕.Biochemistry,2015;54(13):2193-204.
6Alzheimer′s Association.2015 Alzheimer′s disease facts and figures〔J〕.Alzheimers Dement,2015;11(3):332-84.
7Alzheimer′s Association.2014 Alzheimer′s disease facts and figures〔J〕.Alzheimers Dement,2014;10(2):47-92.
8Finder VH,Glockshuber R.Amyloid-beta aggregation〔J〕.Neurodegener Dis,2007;4(1):13-27.
9Haass C,Selkoe DJ.Soluble protein oligomers in neurodegeneration:lessons from the Alzheimer′s amyloid beta-peptide〔J〕.Nat Rev Mol Cell Biol,2007;8(2):101-12.
10Walsh DM,Klyubin I,Fadeeva JV,etal.Naturally secreted oligomers of amyloid beta protein potently inhibit hippocampal long-term potentiation in vivo〔J〕.Nature,2002;416(6880):535-9.
11Shankar GM,Li S,Mehta THetal.Amyloid-beta protein dimers isolated directly from Alzheimer′s brains impair synaptic plasticity and memory〔J〕.Nat Med,2008;14(8):837-42.
12Finder VH.Alzheimer′s disease:a general introduction and pathomechanism〔J〕.J Alzheimers Dis,2010;22(3):5-19.
13Parpura V,Verkhratsky A.Homeostatic function of astrocytes:Ca(2+)and Na(+)signalling〔J〕.Transl Neurosci,2012;3(4):334-44.
14Verkhratsky A,Nedergaard M,Hertz L.Why are astrocytes important〔J〕.Neurochem Res,2015;40(2):389-401.
15Dorfman VB,Pasquini L,Riudavets M,etal.Differential cerebral deposition of IDE and NEP in sporadic and familial Alzheimer′s disease〔J〕.Neurobiol Aging,2010;31(10):1743-57.
16Pihlaja R,Koistinaho J,Kauppinen R,etal.Multiple cellular and molecular mechanisms are involved in human Aβ clearance by transplanted adult astrocytes〔J〕.Glia,2011;59(11):1643-57.
17Maskos LS.Role of the nicotinic acetylcholine receptor in Alzheimer′s disease pathology and treatment〔J〕.Neuropharmacology,2015;96:255-62.
18唐智,单可人,官志忠.神经型尼古丁乙酰胆碱受体在阿尔茨海默病发病机制中的作用〔J〕.中国老年学杂志,2009;29(12):1589-91.
19欧阳凯,齐晓岚,官志忠.神经型尼古丁乙酰胆碱受体在阿尔茨海默病中的神经保护作用〔J〕.中国老年学杂志,2012;32(3):653-5.
20Ni R,Marutle A,Nordberg A.Modulation of α7 nicotinic acetylcholine receptor and fibrillar amyloid-β interactions in Alzheimer′s disease brain〔J〕.J Alzheimers Dis,2013;33(3):841-51.
21Jin Y,Tsuchiya A,Kanno T.Amyloid-β peptide increases cell surface localization of α7 ACh receptor to protect neurons from amyloid β-induced damage〔J〕.Biochem Biophys Res Commun,2015;468(1-2):157-60.
22Liu Q,Xie X,Emadi S,etal.A novel nicotinic mechanism underlies β-amyloid-induced neurotoxicity〔J〕.Neuropharmacology,2015;97:457-63.
23Jensen AA,Frolund B,Liljefors T,etal.Neuronal nicotinic acetylcholine receptors:structural revelations,target identifications,and therapeutic inspirations〔J〕.J Med Chem,2005;48(15):4705-45.
24Levin ED,McClernon FJ,Rezvani AH.Nicotinic effects on cognitive function:behavioral characterization,pharmacological specification,and anatomic localization〔J〕.Psychopharmacology(Berl),2006;184(3-4):523-39.
25Dome P,Lazary J,Kalapos MP,etal.Smoking,nicotine and neuropsychiatric disorders〔J〕.Neurosci Biobehav Rev,2010;34(3):295-42.
26Guo CN,Sun L,Liu GL,etal.Protective effect of nicotine on the cultured rat basal forebrain neurons damaged by β-Amyloid(Aβ)25-35 protein cytotoxicity〔J〕.Eur Rev Med Pharmacol Sci,2015;19(16):2964-72.
〔2015-12-06修回〕
(编辑李相军)
基金项目:国家自然科学基金(81260173);教育部科学技术研究项目(2013032A);贵州省科技厅国际合作项目(黔科合外G字〔2011〕7014号);贵州省科技计划(黔科合重大专项字〔2014〕6008号)
通讯作者:官志忠(1951-),男,医学博士,教授,博士生导师,主要从事分子神经病理学研究。
〔中图分类号〕R361+.3
〔文献标识码〕A
〔文章编号〕1005-9202(2016)13-3112-04;
doi:10.3969/j.issn.1005-9202.2016.13.009
The activation of astrocytic α7 nicotinic receptor inhibit β-amyloid aggregation
KONG Xin, YU Wen-Feng, GUAN Zhi-Zhong.
The Department of Pathology, Guizhou Medical University, Guiyang 550004, Guangxi, China
【Abstract】ObjectiveTo investigate whether α7 neuronal nicotinic acetylcholine receptor(nAChR) of astrocytes of astrocytes were activated by nicotine, and the degradation effect of α7nAChR on β-amyloid.MethodsPrimary culture of rat astrocytes were prepared from the cortex and hippocampus of the brains of newborn Sprague-Dawley (SD) rats. Subculture for three or four times,the passaged cells were demonstrated purity by immunocytochemical stainings with anti-GFAP antibody. Aβ1~42oligomer was prepared by chemically synthetic Aβ1~42polypeptide in vitro and then the oligomers were identified by sliver staining.The experimental groups were divided into normal control, agonist, blocking agent, or(and) Aβ groups. The expression of α7nAChR protein and the degradation of Aβ after activation of astrocytic α7 nicotinic receptor were detected by Western blot.ResultsIn addition to discovery of several monomers, low molecular weight and high molecular weight in Aβ oligomers indicated the presence of dimer ,trimer and nonamer.Compared with that of control group, the expression of α7nAChR of Nicotine group was significantly higher (P<0.01), and the expression of α7nAChR of Nicotine group was higher than that of blocking agent group (P<0.05). Both culture medium and cell lysis, compared with those of Aβ group,the expressions of Aβin Nicotine group of were significantly lower(P<0.01),and they were significantly lower in Nicotine group than those of blocking agent group (P<0.01).ConclusionsNicotine could activate the α7nAChR in astrocytes and the activation of α7nAChR has a significant degradation effect on Aβ,which provides a possible direction for the prevention and treatment of AD.
【Key words】Nicotine; Astrocytes;α7nAChR; Alzheimer's disease; Amyloid β-protein; Oligomer
1贵州医科大学医学分子生物学重点实验室
第一作者:孔欣(1988-),女,在读硕士,主要从事神经病理学研究。
