植物油中甘油稳定碳同位素组成的测定
2016-08-02陈珊珊钟其顶俞慧红黄占斌王道兵
陈珊珊,钟其顶,俞慧红,黄占斌,王道兵,戴 祁
(1.中国矿业大学(北京)化学与环境工程学院,北京 100083;2.中国食品发酵工业研究院,北京 100027;3.全国食品发酵标准化中心,北京 100027;4.慈溪市食品药品检验检测中心,浙江 慈溪 315300)
植物油中甘油稳定碳同位素组成的测定
陈珊珊1,2,3,钟其顶2,3,俞慧红4,黄占斌1,王道兵2,3,戴祁2,3
(1.中国矿业大学(北京)化学与环境工程学院,北京100083;2.中国食品发酵工业研究院,北京100027;3.全国食品发酵标准化中心,北京100027;4.慈溪市食品药品检验检测中心,浙江 慈溪315300)
摘要:建立了气相色谱-燃烧-稳定同位素比值质谱(GC-C-IRMS)法结合酯交换技术测定植物油中甘油的稳定碳同位素组成(δ13C)。样品溶于异辛烷后,在氢氧化钾-甲醇溶液中转化为甘油和脂肪酸甲酯,去除脂肪酸甲酯后用GC-C-IRMS法测定甘油的δ13C。结果表明,食用油中甘油δ13C的测定标准偏差为0.18‰,且酯交换过程不会导致甘油碳同位素分馏。通过分别测定玉米胚芽油、大豆油和玉米胚芽油与大豆油的混合植物油中甘油的δ13C值,并进行结果比较,表明甘油δ13C值与玉米胚芽油中大豆油的含量呈显著负相关(R2=0.98),可通过测定甘油δ13C值验证大豆油掺入玉米胚芽油的比例。本方法前处理简单、测定结果准确,可用于食用油掺假的鉴定。
关键词:植物油;甘油;稳定同位素;掺假
我国是世界上最大的粮油生产国和消费国,粮油消费量逐年攀升,其质量安全事关国民健康。由于我国食用油行业准入制度并不完善,生产标准低,导致食用油产品质量良莠不齐[1]。另外,长期以来,我国食用油生产、供应、流通体系较为复杂,检测手段和含量标准尚不明确,导致质量监管、监督难度较大,难于保障食用油的品质安全。食用油中的植物油因种类不同、营养价值不同而价格差异很大,一些生产经营者为了牟取暴利,在高价植物油中掺入廉价的植物油,如在芝麻油中掺入菜籽油、棉籽油、大豆油、葵花油;在菜油中掺入棕榈油、棉籽油;在橄榄油中掺入玉米油、核桃油等;更有甚者,在植物油中直接掺入潲水油,这极大地损害了广大消费者的利益[2]。
目前,鉴别食用植物油掺杂的检测方法有气相色谱法、折光率法、红外光谱法和紫外分光光度法等,但将稳定同位素示踪技术用于食用植物油的掺杂鉴别在我国尚处于起步阶段[3-10]。稳定同位素技术在食品掺假鉴定中具有重要作用,现已成功应用于果汁掺水、掺糖分析,蜂蜜掺糖,谷物和水果酒精的质量评价及植物学来源等多个方面[7]。Kelly等[8]应用该技术测定了植物油中脂肪酸的碳同位素值,甄别了常见植物油的真伪;金青哲等[11-12]利用脂肪酸中碳同位素比值法检测花生油和玉米油掺合物,成功鉴别了花生油和玉米油。植物油中脂肪酸的种类众多,且在不同植物油中的含量差异较大,分馏影响因素不明确,但甘油是各种植物油中所共有的,是植物代谢的最终产物[13-17],各种甘油三酯中的甘油之间存在相似性[18],因此,可以通过比较植物油中甘油的碳稳定同位素比值鉴定植物油的掺假程度。虽然Fronza等[19]通过比较甘油的δ13C值鉴别了甘油来源,但是,还未见通过分析植物油中甘油稳定同位素分布鉴别植物油真伪的报道。
本工作以常见的植物油为研究对象,通过分析其中的甘油碳同位素分布特征,讨论其主要的影响因素,探索应用气相色谱-燃烧-同位素比值质谱(GC-C-IRMS)法鉴别植物油产品真伪的可行性。
1实验部分
1.1仪器与设备
Delta V advantage 气相色谱-燃烧-同位素比值质谱仪:美国Thermo Fisher公司产品;3K15冷冻离心机:美国Sigma公司产品;ZH7924电热恒温水浴箱:北京中慧天诚科技有限公司产品;AB204-N万分之一天平:瑞士Mettler Toledo公司产品;真空泵:上海置信实验仪器技术有限公司产品;涡旋振荡器:美国Scientific Industries公司产品。
1.2材料与试剂
玉米胚芽油、大豆油等植物油样品:均为购于市场的纯植物油;甘油:δ13CPDB为-30.98‰,标定方法见参考文献[8];氢氧化钾粉末,无水硫酸钠,异辛烷,甲醇:均为色谱纯,国药集团化学试剂有限公司产品。
氢氧化钾-甲醇溶液的配制:称取13.1 g氢氧化钾粉末,溶于100 mL甲醇中,可轻微加热,然后加入无水硫酸钠干燥,真空抽滤后得到澄清的氢氧化钾-甲醇溶液,于4 ℃冷藏备用。
1.3样品前处理
称取0.12 g植物油于10 mL离心管中,加入8 mL异辛烷,旋转振荡2 min,使植物油充分溶于异辛烷;再加入400 μL氢氧化钾-甲醇溶液,充分振荡,静置,使油脂水解完全。弃去上层溶液,在下层溶液中加入盐酸调至pH 5.0以下,静置30 min,去除上层多余的脂肪酸,再用氢氧化钾-甲醇溶液调至pH 7。加入1 mL甲醇,使甘油溶液中的KCl析出,用离心机离心使KCl沉淀,取上层甘油溶液,待测。
1.4GC-C-IRMS法测定甘油中δ13C
色谱条件:HP-Innowax毛细管色谱柱(30 m×0.25 mm×0.25 μm);载气为氦气;载气流速1.2 mL/min;进样口温度270 ℃;升温程序:起始温度120 ℃,保持1 min,以20 ℃/min升至220 ℃,保持10 min;进样体积1 μL;分流比20∶1。
分离甘油和甲醇后,将甲醇排出,仅将甘油倒入燃烧转化装置中进行反应。燃烧转化装置中配置陶瓷(Al2O3)氧化管,填料为CuO、NiO和Pt,工作温度为1 000 ℃,将甘油转化成CO2后,再用IRMS测定。
δ13C可用式(1)计算:
(1)
式中,R样品为样品中13C与12C的比值;R标准为美国南卡罗来纳州白垩纪皮狄组层位中的拟箭石化石标准物质(V-PDB)中13C与12C的比值,13C/12C=(11 237.2±90)×10-6。
2结果与讨论
2.1方法的重复性
按1.4节方法测定甘油标准品,m/z 44、45、46的离子谱图示于图1。由图1可见,采用该方法测定甘油的δ13C值,可有效避免其他有机物质的干扰。为考察方法的重复性,配制一定浓度的甘油标准品,按1.4节方法重复测定5次,结果列于表1。可以看出,5次重复测定的甘油标准品碳稳定同位素比值之间的标准偏差为0.21‰,这与文献[9]报道的应用液相色谱-同位素比值质谱法测定甘油δ13C得到的结果相同。

图1 甘油标准品的δ13C谱图
2.2甘油浓度对测定的影响
由于连续流-稳定同位素比值质谱法测定气体的同位素组成易受分馏效应的影响,导致同一气体在不同进样量时得到的同位素测定值可能存在一些差异,因此,本实验在分析仪器测定参考气CO2的线性范围基础上(±0.057‰),以不同浓度的甘油-甲醇溶液验证仪器的有效测定范围。分别配制3、5、7、9 g/L甘油溶液,按1.4节方法进行测定,每个浓度样品平行测定5次,结果示于图2。不同浓度的甘油-甲醇溶液对应的m/z44信号强度范围为1 800~5 000 mV,δ13C值的波动范围为-30.12‰~-31.52‰,标准偏差为0.39‰。结果表明,甘油浓度为3、5、7、9 g/L时,δ13C值的测定结果是一致的,其标准偏差分别为0.62‰、0.33‰、0.19‰、0.34‰,并且以7 g/L甘油溶液测得的δ13C值最为集中,波动范围最小。因此,选择7 g/L甘油溶液进行后续实验。
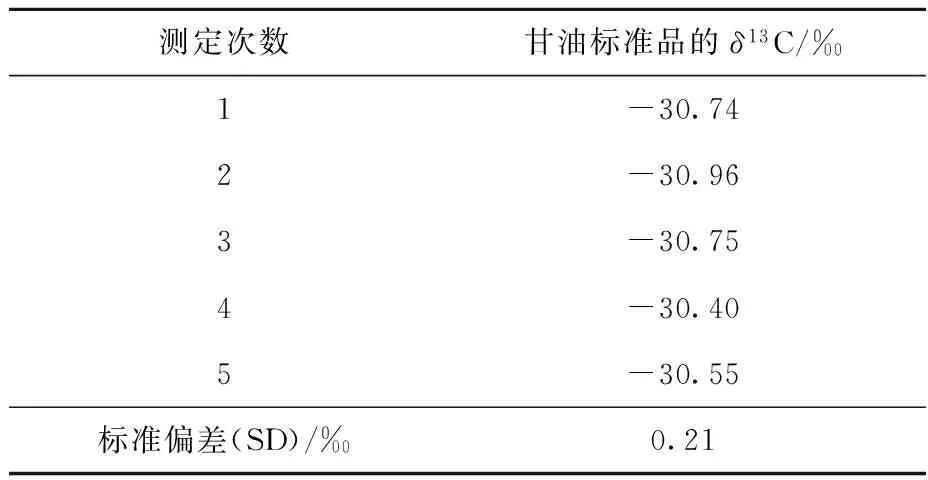
表1 甘油标准品的δ13C值重复性测定结果

图2 不同浓度甘油溶液中,甘油δ13C的测定结果
2.3样品前处理条件的优化
2.3.1提取过程对甘油碳稳定同位素分馏的影响自然界中存在着广泛的稳定同位素分馏作用,若转化/收集不完全,由于不同稳定同位素构成的分子质量差异,其含量易出现变化。为了保证甘油碳稳定同位素测定的准确性,需要验证碳稳定同位素在提取甘油的前处理过程中是否会产生分馏现象。以某种玉米油为例,称取0.12 g样品,分别加入0.01、0.02、0.05、0.10、0.20 g甘油标准品,将其编号为1、2、3、4、5。按1.3节方法进行前处理,按1.4节方法平行测定3次,得到样品的δ13C值。根据加入甘油标准品的比例计算样品中甘油碳稳定同位素比值的理论值,然后将测定值与理论值进行比较,结果列于表2。可见,添加不同比例甘油标准品的碳稳定同位素比值的测定值与理论值的差值均在1.5‰以内,处于未添加的甘油样品δ13C值的2倍标准偏差之内。
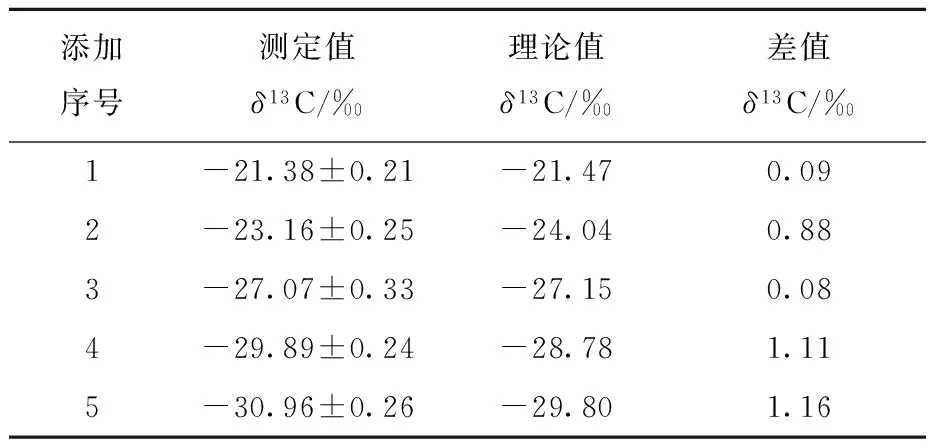
表2 添加不同比例甘油标准品后,
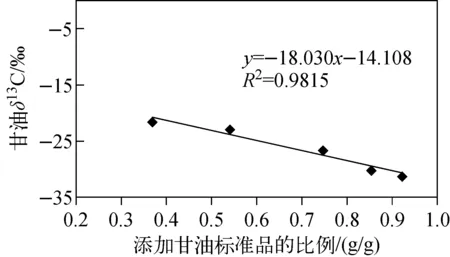
图3 添加不同比例甘油标准品后,甘油样品的δ13C测定值
为了验证该处理方法对甘油中的碳稳定同位素没有产生分馏作用,对测定值进行线性分析,结果示于图3。添加甘油标准品的比例的计算公式示于式(2):
(2)
式中:N为添加甘油标准品的比例;m1为在玉米油中添加甘油标准品的质量;m2为玉米油在水解过程中产生的甘油的质量。
玉米油的主要成分为甘油三酯,其在氢氧化钾-甲醇溶液的作用下可水解得到高级脂肪酸和甘油。玉米油在水解过程中产生的甘油质量m2可用式(3)计算:
(3)
式中:m为玉米油的质量;M1为甘油的相对分子质量(参考值92);M2为甘油三酯的相对分子质量(参考值639)。
由图3可见,添加不同比例甘油标准品的碳稳定同位素比值具有良好的线性关系,线性相关系数R2=0.98。由表2可见,随着加入甘油标准品比例的增加,甘油的δ13C值呈现不断变小的趋势,并且与计算得出的理论值十分接近,这说明在前处理过程中甘油碳稳定同位素没有发生分馏。
2.3.2前处理过程对分析的影响植物油在碱性条件下可水解得到脂肪酸和甘油,但是反应时间过短则会出现反应不充分,生成的甘油浓度过低等现象,从而造成甘油δ13C值测定不准确。油脂在水解过程中,加入氢氧化钾-甲醇溶液充分振荡后,静置1 h,平行测定3次,得到甘油δ13C值的标准偏差为0.74‰。在其他条件不变的情况下,加入氢氧化钾-甲醇溶液并充分振荡后,分别静置2、3、4、5 h,平行测定3次,结果列于表3。可见,甘油δ13C值的标准偏差分别为0.20‰、0.16‰、0.11‰和0.12‰,说明静置4 h可使前处理条件达到最优。
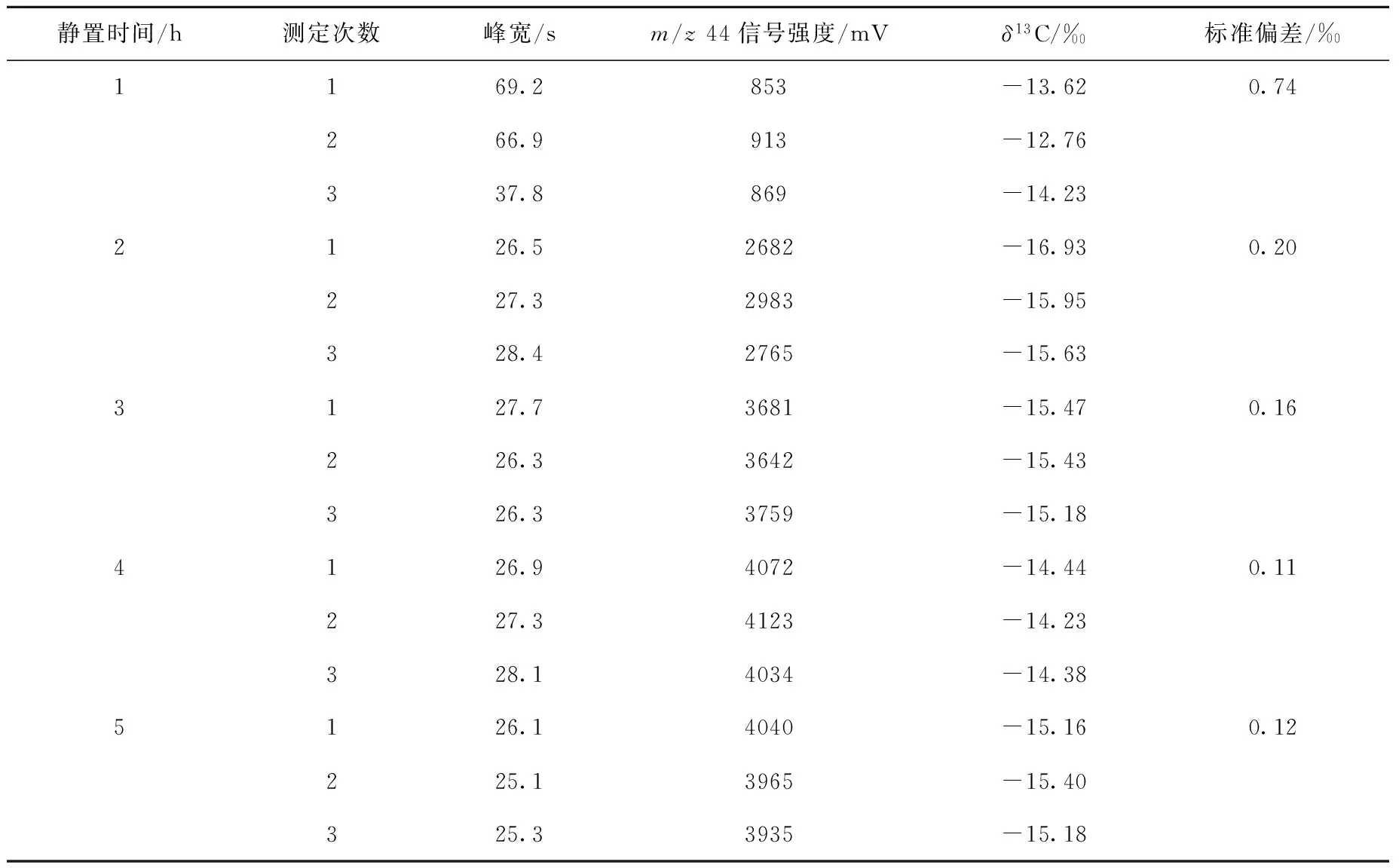
表3 不同前处理过程下,甘油δ13C值测定结果
2.4样品前处理的稳定性
为了研究该方法测定植物油中甘油δ13C的稳定性,以大豆油为研究对象,取5份样品按1.3节方法处理,按1.4节方法测定,每个样品测定3次。分析甘油的碳同位素比值测定数据之间的稳定系数,结果列于表4。由表4可见,重复测定的5份甘油样品的碳稳定同位素比值之间的标准偏差为0.18‰,说明该方法的稳定性良好。
2.5不同比例混合植物油中甘油δ13C值变化规律
作为C4植物油玉米胚芽油与作为C3植物油的大豆油的转化途径不同,它们之间的δ13C值相差较大[12]。为了验证上述方法的实际应用价值,选取玉米胚芽油和大豆油进行水解,对得到的甘油连续测定5次,测得结果显示,玉米胚芽油和大豆油的δ13C值分别为-14.71‰和-31.30‰,标准偏差分别为0.23‰和0.18‰。

表4 5份甘油样品δ13C稳定性测定结果
将大豆油按照0%、25%、50%、75%和100%的比例掺入到玉米胚芽油中,经前处理后,检测甘油碳稳定同位素值;然后以甘油的δ13C值为纵坐标,大豆油-玉米胚芽油混合比例为横坐标,绘制甘油δ13C值的线性图,示于图4。由图4可知,甘油δ13C值与大豆油的含量呈显著负相关,说明可通过测定甘油δ13C值验证大豆油中掺入玉米胚芽油的比例。
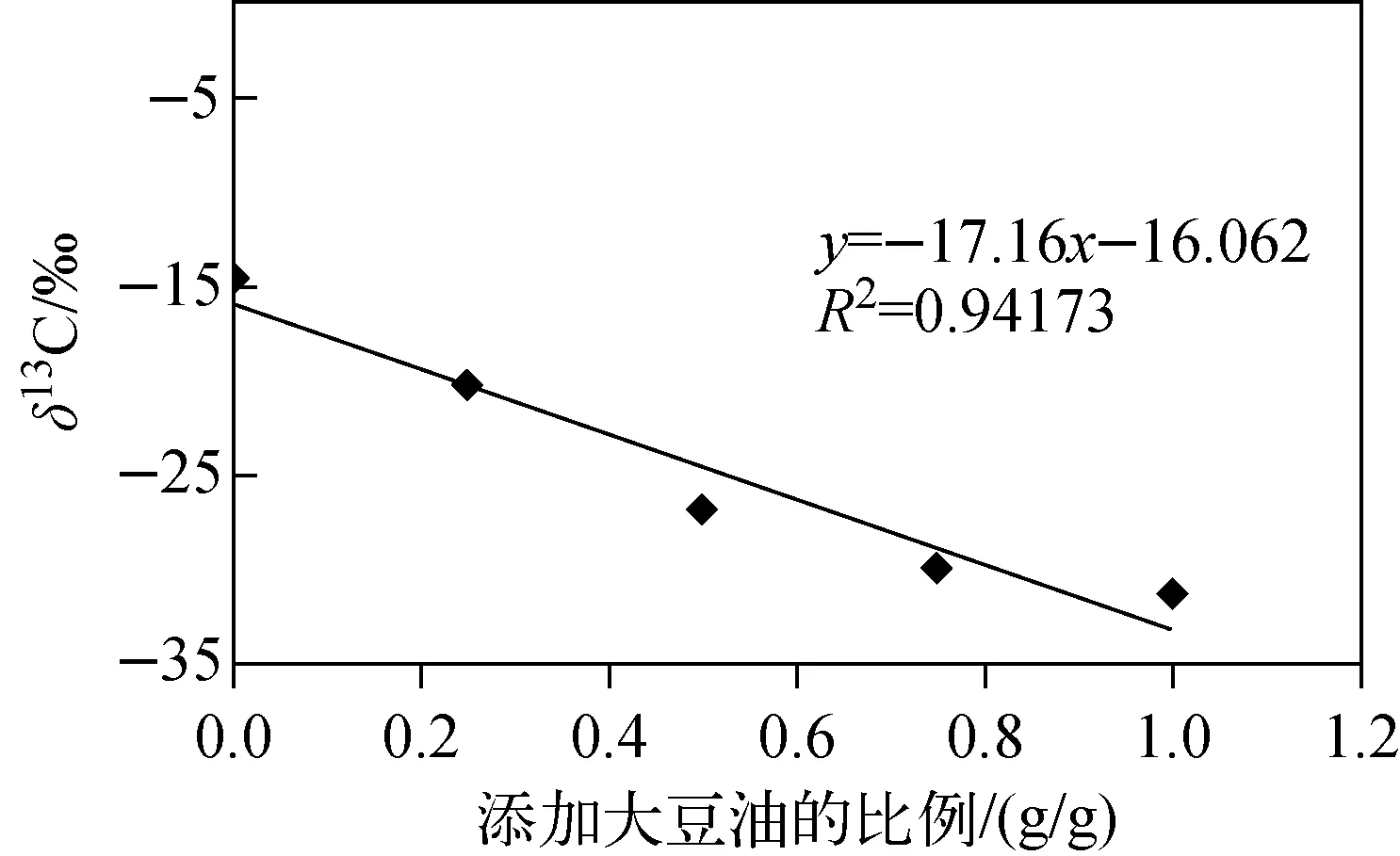
图4 大豆-玉米胚芽混合油中甘油δ13C值的线性图
3结论
本研究建立了从植物油中提取甘油的方法,该方法简单快捷、稳定性好,且对甘油中碳稳定同位素不产生分馏作用。实验采用GC-C-IRMS法测定植物油中甘油的δ13C值,该测定值可以有效地鉴别出大豆油中掺入玉米胚芽油的现象。但由于本研究的样品量较少,且仅对甘油的碳稳定同位素进行了探讨性研究,今后还需将其与植物油中脂肪酸的稳定同位素测定相结合,使其在植物油真伪鉴定方面的研究更深入。
参考文献:
[1]李文智. 食用油酸价和过氧化值快速检测试纸法的评价[J]. 广西轻工业,2002,(3):39-40.
LI Wenzhi. Evaluation for visual-comparison-based edible oil test strip[J]. Guangxi Journal of Light Industry, 2002, (3): 39-40(in Chinese).
[2]尹平河,王桂华,赵玲,等. GC-MS法鉴别食用油和餐饮业中废弃油脂的研究[J]. 分析试验室,2004,23(4):8-11.
YIN Pinghe, WANG Guihua, ZHAO Ling, et al. Study of recognition of edible oils and waste edible oils in the restaurants by GC-MS[J]. Chinese Journal of Analysis Laboratory, 2004, 23(4): 8-11(in Chinese).
[3]王桂华. 餐饮业废油脂回用饮食市场的鉴别和危害性研究[D]. 广州:暨南大学,2004.
[4]王耀,尹平河,梁芳慧,等. 紫外可见分光光度法鉴别掺兑潲水油的花生油[J]. 分析试验室,2006,25(3):92-94.
WANG Yao, YIN Pinghe, LIANG Fanghui, et al. Distinguishing hogwash oil from peanut oil by ultraviolet-visible spectrophotometry[J]. Chinese Journal of Analysis Laboratory, 2006, 25(3): 92-94(in Chinese).
[5]王江蓉,周建平,张令夫,等. 植物油掺伪检测方法的应用与研究进展[J]. 中国油脂,2007,32(6):78-81.
WANG Jiangrong, ZHOU Jianping, ZHANG Lingfu, et al. Application and research advance in determ ination method for adulterated edible oil[J].China Oils and Fats, 2007, 32(6): 78-81(in Chinese).
[6]李金城. 用稳定同位素方法鉴别食品真假和产地[J]. 食品科学,1991,(1):14-17.
LI Jincheng. Identify true and false of food and the origin of a product with stable isotope method[J].Journal of Food Science,1991, (1): 14-17(in Chinese).
[7]李学民,贾光群,曹彦忠,等. 液相色谱-同位素比质谱法同时测定葡萄酒中甘油和乙醇的δ13C值[J]. 色谱,2013,31(12):1 201-1 205.
LI Xuemin, JIA Guangqun, CAO Yanzhong, et al. Simultaneous determination ofδ13C values of glycerol and ethanol in wine by liquid chromatography coupled with isotope ratio mass spectrometry[J]. Chinese Journal of Chromatography, 2013, 31(12): 1 201-1 205(in Chinese).
[8]KELLY S, PARKER I, SHARMAN M, et al. Assessing the authenticity of single seed vegetable oils using fatty acid stable carbon isotope ratios[J]. Food Chemistry, 1997, 59(2): 181-186.
[9]AI G, SUN T, DONG X. Gas chromatography/isotope ratio mass spectrometry: Analysis of methanol, ethanol and acetic acid by direct injection of aqueous alcoholic and acetic acid samples[J]. Rapid Communications in Mass Spectrometry, 2014, 28(15): 1 674-1 682.
[10]刘文贵,唐明霞. 提高气体同位素质谱计线性的研究[J]. 化学研究与应用,2010,(12):1 569-1 572.
LIU Wengui, TANG Mingxia. How to improve the linearity of gas isotope mass spectromter[J]. Chemical Research and Application, 2010, (12): 1 569-1 572(in Chinese).
[11]金青哲,谢峰,丁志华,等. 花生油和玉米油掺合物的碳同位素比值质谱法检测研究[J]. 中国粮油学报,2010,25(5):95-99.
JIN Qingzhe, XIE Feng, DING Zhihua, et al. Detection of blend of corn oil and peanut oil by carbon isotope ratio[J]. Journal of the Chinese Cereals and Oils Association, 2010, 25(5): 95-99(in Chinese).
[12]金青哲,施峰华,谢峰,等. 碳同位素比值法检测棕榈油掺入玉米油的研究[J]. 中国油脂,2009,34(1):73-75.
JIN Qingzhe, SHI Fenghua, XIE Feng, et al. Detection of palm oil adulterated into corn oil by carbon isotope ratio method[J]. China Oils and Fats, 2009, 34(1): 73-75(in Chinese).
[13]LEE D S, NOH B S, BAE S Y, et al. Characterization of fatty acids composition in vegetable oils by gas chromatography and chemometrics[J]. Analytica Chimica Acta, 1998, 358(2):163-175.
[14]SPANGENBERG J E, MACKO S A, HUNZIKER J. Characterization of olive oil by carbon isotope analysis of individual fatty acids: Implications for authentication[J]. Journal of Agricultural & Food Chemistry, 1998, 46(10): 4 179-4 184.
[15]ZHANG B L, BUDDRUS S, TRIERWEILER M, et al. Characterization of glycerol from different origins by2H- and13C-NMR studies of site-specific natural isotope fractionation[J]. J Agric food Chem, 1998, (4): 1 374-1 380.
[16]焦杏春,王广,叶传永,等. 样品前处理过程中多环芳烃的稳定碳同位素分馏[J]. 岩矿测试,2010,(3):207-211.
JIAO Xingchun, WANG Guang, YE Chuan-yong, et al. Stable carbon isotope fractionation of polycyclic aromatic hydrocarbons during the sample preparation process[J]. Rock and Mineral Analysis, 2010, (3): 207-211(in Chinese).
[17]FRONZA G, FUGANTI C, GRASSELLI P, et al.δ13C andδ18O-values of glycerol of food fats[J]. Rapid Communications in Mass Spectrometry Rcm, 2001, 15(10): 763-736.
[18]CAMIN F, LARCHER R, PERINI M, et al. Characterisation of authentic Italian extra-virgin olive oils by stable isotope ratios of C, O and H and mineral composition[J]. Food Chemistry, 2010, 118(4): 901-909.
[19]FRONZA G, FUGANTI C, GRASSELLI P, et al. Determination of the13C content of glycerol samples of different origin[J]. J Agric Food Chem, 1998, 46(2): 477-480.
收稿日期:2015-09-29;修回日期:2015-12-22
基金项目:科技部国际合作项目(2015DFA31720);北京市重点实验室开放基金课题(2015BZ0063-04)资助
作者简介:陈珊珊(1990—),女(汉族),河南人,硕士研究生,从事粮油品种鉴别研究。E-mail: chenshan900429@163.com 通信作者:钟其顶(1980—),男(汉族),广西人,高级工程师,从事稳定同位素食品分析技术研究。E-mail: zhongqiding@163.com
中图分类号:O657.63
文献标志码:A
文章编号:1004-2997(2016)04-0359-07
doi:10.7538/zpxb.2016.37.04.0359
Determination of the Stable Carbon Isotopic Composition of Glycerol in Vegetable Oils
CHEN Shan-shan1,2,3, ZHONG Qi-ding2,3, YU Hui-hong4,HUANG Zhan-bin1, WANG Dao-bing2,3, DAI Qi2,3
(1.SchoolofChemicalandEnvironmentalEngineering,ChinaUniversityofMiningandTechnology,Beijing100083,China;2.ChinaNationalInstituteofFoodandFermentationIndustries,Beijing100027,China;3.NationalStandardizationCenterofFood&FermentationIndustry,Beijing100027,China;4.CixiCenterforFoodandDrugControl/Testing,Cixi315300,China)
Abstract:A method of gas chromatography-combustion-stable isotope ratio mass spectrometry (GC-C-IRMS) with ester exchange technology was established for the determination stable carbon isotope composition (δ13C) of glycerol in vegetable oils. After the sample was dissolved in isooctane, triglyceride produces glycerol and fatty acid methyl ester under the existence of KOH methanol solution. δ13C of glycerol was determined by GC-C-IRMS after the removal of fatty acid methyl ester. Through the optimization of reaction time, the best time is 4 h after addition of KOH methanol solution. Results show that the standard deviation is 0.18‰, and the ester exchange process does not lead to glycerol carbon isotope fractionation. By analysing the differences of δ13C value of glycerol in corn oil and soybean oil, δ13C values are -14.71‰ and -31.30‰, respectively, δ13C value of glycerol has a significant negative correlation (R2=0.98) with content of soybean oil in corn germ oil. The method has an advantage of easy and rapid operation, and which is applicable for δ13C analysis of adulteration of vegetable oil. This study provides a theoretical basis and technical support for the identification of varieties of vegetable oils.
Key words:vegetable oil; glycerol; stable isotope composition; adulteration
