布洛芬缓释胶囊单剂量与多剂量给药的人体药动学及生物等效性研究
2016-07-29骏高丽丽辉瑞制药有限公司质量部大连6600大连医科大学附属第一医院呼吸内科大连60
梁 骏高丽丽(.辉瑞制药有限公司质量部 大连 6600;2.大连医科大学附属第一医院呼吸内科 大连 60)
布洛芬缓释胶囊单剂量与多剂量给药的人体药动学及生物等效性研究
梁骏1高丽丽2*(1.辉瑞制药有限公司质量部大连116600;2.大连医科大学附属第一医院呼吸内科大连116011)
摘要:目的:研究布洛芬缓释胶囊单剂量与多剂量给药的人体药动学及生物等效性。方法:分别给予32名健康男性志愿者口服单剂量、多剂量布洛芬缓释胶囊受试制剂以及参比制剂300mg。根据双周期自身随机交叉实验设计,使用高效液相色谱法(HPLC)对血浆中布洛芬浓度进行测定。其中人体药动学参数采用DAS2.0程序进行计算,并对两种制剂生物等效性进行分析。结果:单剂量口服受试制剂以及参比制剂后tmax分别为(5.6±1.3)h、(4.9±1.1)h,Cmax分别为(12.8±5.5)μg/mL、(13.6±5.8)μg/mL,AUC0-24分别为(96.5±49.6)μg·h/mL、(95.9±45.2)μg·h/mL,AUC0-∞分别为(101.5±50.7)μg·h/mL、(101.6±46.8)μg·h/mL。多剂量口服受试制剂以及参比制剂后tss,max分别为(4.9±1.1)h、(4.6±1.0)h,Css,max分别为(14.2±5.5)μg/mL、(14.7±6.3)μg/mL,Css,min分别为(4.0±1.6)μg/mL、(3.8±2.3)μg/mL,Cav分别为(8.3±3.6)μg/mL、(8.5±4.4)μg/mL,AUCss分别为(98.8±39.8)μg·h/mL、(103.2±50.9)μg·h/mL,DF分别为(118.1±35.2)%、(132.1±34.8)%,差异均无统计学意义(均P>0.05)。经由双单侧t检验以及90%置信区间分析,根据参比制剂为标准,分别给药后,试验制剂的90%置信区间在可信区间内。结论:布洛芬缓释胶囊单剂量与多剂量给药中受试制剂与参比制剂具有生物等效性。
关键词:布洛芬缓释胶囊 人体药动学 生物等效性
布洛芬半衰期较短,若长期大剂量地给予口服治疗,可能会对胃肠道有刺激作用,从而对患者肾功能造成一定程度的损害,有出现不良反应的风险[1]。因此,对患者血浆中布洛芬浓度进行测定,有利于临床合理、安全地用药。鉴于此,研究布洛芬缓释胶囊单剂量与多剂量给药的人体药动学及生物等效性。现报道如下。
1资料和方法
1.1受试志愿者选取:纳入标准:①年龄>18岁男性;②体质量指数符合正常标准;③无吸烟喝酒嗜好;④对药物不过敏且无药物依赖史;⑤不伴有精神病以及其他慢性基础疾病;⑥15d内无服用任何药物;⑦志愿者均签署知情同意书,且经过伦理委员会批准。
1.2仪器及试药:岛津高效液相色谱仪;Eppendorf离心机;SHIMADZU AUW220D电子天平;XH-80A型漩涡混合器。受试制剂选用布洛芬缓释胶囊(浙江康恩贝制药股份有限公司,批准文号:090601)参比制剂选用布洛芬缓释胶囊(中美天津史克制药有限公司,国药准字:H10900089)。选用由中国药品生物制品检定所的含量高于99.8%布洛芬作为对照品;地西泮对照品选用中国药品生物制品检定所的含量高于99.7%样品;叔丁基甲基醚、乙腈、甲酸、醋酸(CNW Technologies GmbH公司);醋酸钠(河南焦作市化工三厂)。
1.3受试方法:以数字法随机将32名受试志愿者分为两组,选择双周期交叉设计,清洗期为7d。单剂量给药:两组志愿者均禁食12h,分别给予150mL温水送服300mg试验制剂或等量参比制剂,4h后进标准餐。服药前后0.5、1、2、3、4、5、6、7、8、10、12、14以及24h分别由肘静脉取血5mL进行药物浓度分析。7d后进行交叉给药。多剂量给药:所有志愿者早晚各空腹给予150mL温水送300mg试验制剂或等量参比制剂1次,持续给药5d。分别于d3、d4清晨服药前以及d5服药后0.5、1、2、3、4、5、6、7、8、10、12、14以及24h由肘静脉取血5mL进行药物浓度分析。7d后进行交叉给药。
1.4色谱条件:色谱柱:Inertsil ODS-SP C18(150mm×4.6mm,5μm);保护柱::Inertsil ODS-SP C18(10mm×4mm,5μm);流动相:乙腈与浓度为0.1%甲酸水溶液按照35∶65混合成缓冲液,0.5mL/min的流速,检测波长为230nm,柱温30℃,进样量20μL。
1.5观察指标:药-时曲线下面积(AUC)、峰浓度(Cmax)、峰时间(tmax)、Cav、DF。
1.5统计学方法:采用Class-VP统计学软件,应用DAS2.0对人体药动学参数进行统计分析。主要参数通过对数转换后以多因素方差进行检验,P<0.05为差异有统计学意义。
2结果
2.1单剂量给药的药代动力学参数情况:单剂量口服受试制剂以及参比制剂后tmax、Cmax、AUC0-24、AUC0-∞对比均无显著差异(P>0.05)。见表1:
表1单剂量给药的药代动力学参数情况(n=32,±s)
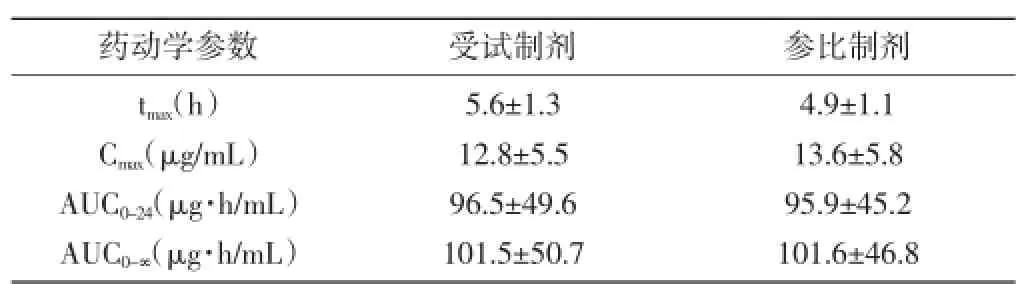
表1单剂量给药的药代动力学参数情况(n=32,±s)
药动学参数 受试制剂 参比制剂tmax(h)Cmax(μg/mL)AUC0-24(μg·h/mL)AUC0-∞(μg·h/mL)5.6±1.3 12.8±5.5 96.5±49.6 101.5±50.7 4.9±1.1 13.6±5.8 95.9±45.2 101.6±46.8
2.2多剂量给药的药代动力学参数情况:多剂量口服受试制剂以及参比制剂后tss,max、Css,max、Css,min、Cav、AUCss、DF比较均无明显差异(P>0.05)。见表2:
表2多剂量给药的药代动力学参数情况(n=32,±s)
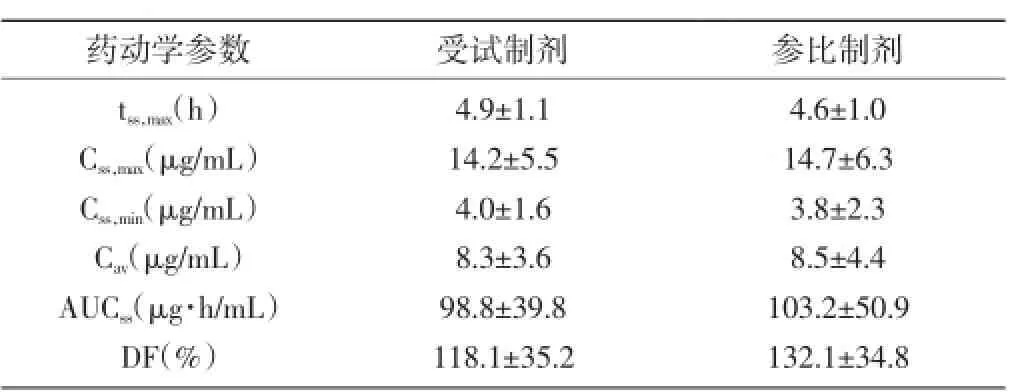
表2多剂量给药的药代动力学参数情况(n=32,±s)
药动学参数 受试制剂 参比制剂tss,max(h)Css,max(μg/mL)Css,min(μg/mL)Cav(μg/mL)AUCss(μg·h/mL)DF(%)4.9±1.1 14.2±5.5 4.0±1.6 8.3±3.6 98.8±39.8 118.1±35.2 4.6±1.0 14.7±6.3 3.8±2.3 8.5±4.4 103.2±50.9 132.1±34.8
2.3经由双单侧t检验以及90%置信区间分析,根据参比制剂为标准,分别给药后,试验制剂的90%置信区间在可信区间内,提示了受试制剂与参比制剂存在生物等效性。
3讨论
本文通过研究布洛芬缓释胶囊单剂量与多剂量给药的人体药动学及生物等效性,结果发现:单剂量口服受试制剂以及参比制剂后tmax、Cmax、AUC0-24、AUC0-∞对比均无显著差异,此外,多剂量口服受试制剂以及参比制剂后tss,max、Css,max、Css,min、Cav、AUCss、DF比较均无明显差异。这表明了布洛芬缓释胶囊受试制剂与参比制剂的平均血药浓度、时间曲线的变化趋势一致,主要药动学参数经过检验,符合生物等效性统计学要求[2]。本研究通过建立HPLC对两种布洛芬缓释胶囊的相对生物利用度进行测定,经由方法学检查,该检测手段具有灵敏、可靠、准确以及重现性好的优势。测定人血浆中布洛芬浓度主要方法有直接沉淀法,但该方法由于血浆用量较多,容易导致样本含量丢失,同时磷酸盐作为缓冲液对pH值较为敏感,可能导致液相管路堵塞,而HPLC法测定人血浆内布洛芬浓度具有操作简便、分析成本较低、准确度较高的优点[3]。
综上所述,布洛芬缓释胶囊受试制剂与参比试剂具有生物等效性,HPLC法在测定人血浆中布洛芬浓度中具有一定优势,值得推广。
参考文献
[1]彭秋燕,许煜静,许文婷,等.不同厂家布洛芬缓释胶囊体外释放度比较[J].天津医科大学学报,2013,19(1):73-75.
[2]苏方华,陈燕,庞日兰,等.布洛芬缓释片人体生物等效性研究[J].中国药业,2014,23(24):18-20.
[3]余凤玮,孙逊,张彦,等.HPLC测定扎托布洛芬缓释胶囊的含量[J].华西药学杂志,2012,27(3):330-331.
中图分类号:R969.1
文献标识码:B
文章编号:1672-8351(2016)07-0144-02
*通讯作者
