新型凝胶纯化凝血酶原复合物的工艺探讨
2016-07-24周敏曾仁勇刘园园李长清曹海军何泽超
周敏,曾仁勇,刘园园,李长清,曹海军Δ†,何泽超Δ†
(1.四川大学 化学工程学院,四川 成都 610065;2.中国医学科学院输血研究所,四川 成都 610052)
新型凝胶纯化凝血酶原复合物的工艺探讨
周敏1,曾仁勇2,刘园园2,李长清2,曹海军2Δ†,何泽超1Δ†
(1.四川大学 化学工程学院,四川 成都 610065;2.中国医学科学院输血研究所,四川 成都 610052)
目的 探索新型凝胶Capto DEAE离子交换柱层析纯化凝血酶原复合物的工艺条件。 方法 健康人混血浆经离心去除冷沉淀后,采用DEAE-Sephadex A-50凝胶进行吸附,经洗涤、洗脱得到洗脱液;将得到的洗脱液超滤脱盐后,再通过Capto DEAE凝胶柱纯化,制备凝血酶原复合物(prothrombin complex concentrates,PCC)。测定PCC中凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ及抗凝蛋白C的活性并计算收率;采用Bradford法测定PCC蛋白浓度,再根据测定的4种凝血因子和蛋白C的活性,计算有效成分的比活;以此分析所选工艺条件下Capto凝胶对PCC的纯化效果。结果 不同实验方案下,所得制品中FⅡ、FⅨ、FⅩ收率和纯度均较高,且该3种凝血因子均衡度较好;但FⅦ 收率和纯度均较低;其中A方案下PCC收率和纯度较好,即Capto DEAE 凝胶体系平衡液、洗涤液、洗脱液中柠檬酸钠、NaCl、pH分别为0.020~0.028 mol/L、0.10~0.15 mol/L、6.9~7.2;0.012~0.020 mol/L、0.10~0.15 mol/L、6.9~7.2;0.005~0.012 mol/L、2.4 mol/L、7.2~7.5时,FⅨ收率为(74.40±10.89)%,比活为(3.31±0.31)IU/mg,抗凝蛋白C的收率和比活均较高。结论 采用DEAE-Sephadex A-50批式吸附及Capto DEAE柱层析相结合的新方法制备PCC ,在所选择条件下,PCC制品的纯度为2.17~3.31 IU/mg,远优于传统工艺制得的产品,此为高品质PCC的制备提供了新的方法。
凝血酶原复合物;Capto DEAE凝胶;离子交换柱层析
人凝血酶原复合物(prothrombin complex concentrates,PCC)是从健康人混合血浆分离制备的血液制品,主要含依赖维生素K合成的凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ[1-2]。PCC制品在20世纪70年代用于临床,广泛用于治疗乙型血友病[3]、有抗凝血因子Ⅷ的甲型血友病[4]、维生素K缺乏引起的凝血因子水平低下导致的出血症[5]、以及替代新鲜冰冻血浆逆转维生素拮抗剂或香豆素类抗凝剂过量导致的各种出血性疾病[6-9]。目前国内外生产PCC主要采用DEAE-Sephadex A-50吸附进行大规模制备[10-12]。我国现生产PCC的传统工艺均采用DEAE-Sephadex A-50凝胶进行两步批式吸附,该方法使用的吸附介质DEAE-Sephadex A-50凝胶经平衡后,机械强度差、易破碎[13],不适用于柱层析技术[2];另外DEAE-Sephadex A-50凝胶在重复应用中存在补加量难估计、不易控制等一系列问题[13],从而导致制品质量不易控制。本实验研究中,对PCC的传统工艺进行了改进,采用DEAE-Sephadex A-50凝胶吸附和Capto DEAE凝胶柱层析相结合的方法制备PCC,旨在探索使用Capto DEAE新型凝胶制备PCC的工艺条件,为工业生产PCC提供新的制备方法。
1 材料与方法
1.1 材料
1.1.1 试剂:健康人混合血浆(四川省三台10人混血浆);DEAE-SephadeⅩ A-50凝胶(GE公司,批号:10091423);Capto DEAE离子交换介质(GE公司);凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ活性检测试剂盒(SIEMENS公司,批号:503630C、500749B、504107D、504009A);Super-Bradford蛋白定量试剂盒(北京康为世纪生物科技有限公司,批号:00111510);正常质控血浆(SIEMENS公司,批号:507704A);PC缺乏乏浆(HYPHEM BioMed 公司,批号:31302-1 PK:2);PC检测试剂盒(HYPHEM BioMed 公司,批号:32901-PK:2);蛋白weight Marker(Fermentas公司,批号:1671920);其余试剂均为国产分析纯。
1.1.2 主要仪器:精密天平(xS205,METTLER TOLEDO公司);大容量高速低温冷冻离心机(RC3BP+,Thermo公司);pH仪(FE20,METTLER TOLEDO公司);电导仪(FE30,METTLER TOLEDO公司);AKTA explorer 100层析系统(GE Healthcare);全自动凝血仪(CA-1500,Sysmex公司);蛋白垂直电泳仪(Mini-Protean,Bio-Rad公司);酶标仪(SpectraMax M2e,Molecular Devices公司);凝胶成像仪(ImageQuant 350,GE公司);纯水仪(Milli-Q Advantage,Millipore公司);恒温水浴箱(HH-W600,金坛市医疗仪器厂)。
1.2 方法
1.2.1 PCC的初步纯化:按照传统的批式吸附方法,使用DEAE-Sephadex A-50凝胶吸附新鲜冰冻人血浆制备出PCC粗液。参照文献[1],设定DEAE-Sephadex A-50凝胶平衡体系中柠檬酸钠、氯化钠、pH 3个可变因素分别为0.02~0.028 mol/L;0.10~0.15 mol/L;6.9~7.2;参照文献[14],设定洗涤体系中柠檬酸钠、氯化钠、pH 3个可变因素分别为0.012~0.02 mol/L、0.02~0.028 mol/L;0.10~0.15 mol/L; 6.6~6.9、7.2~7.5;参照文献[15],设定洗脱体系中柠檬酸钠、氯化钠、pH 3个可变因素分别为0.012~0.02 mol/L、0.005~0.012 mol/L;2.4 mol/L;6.6~6.9、7.2~7.5。见表1。
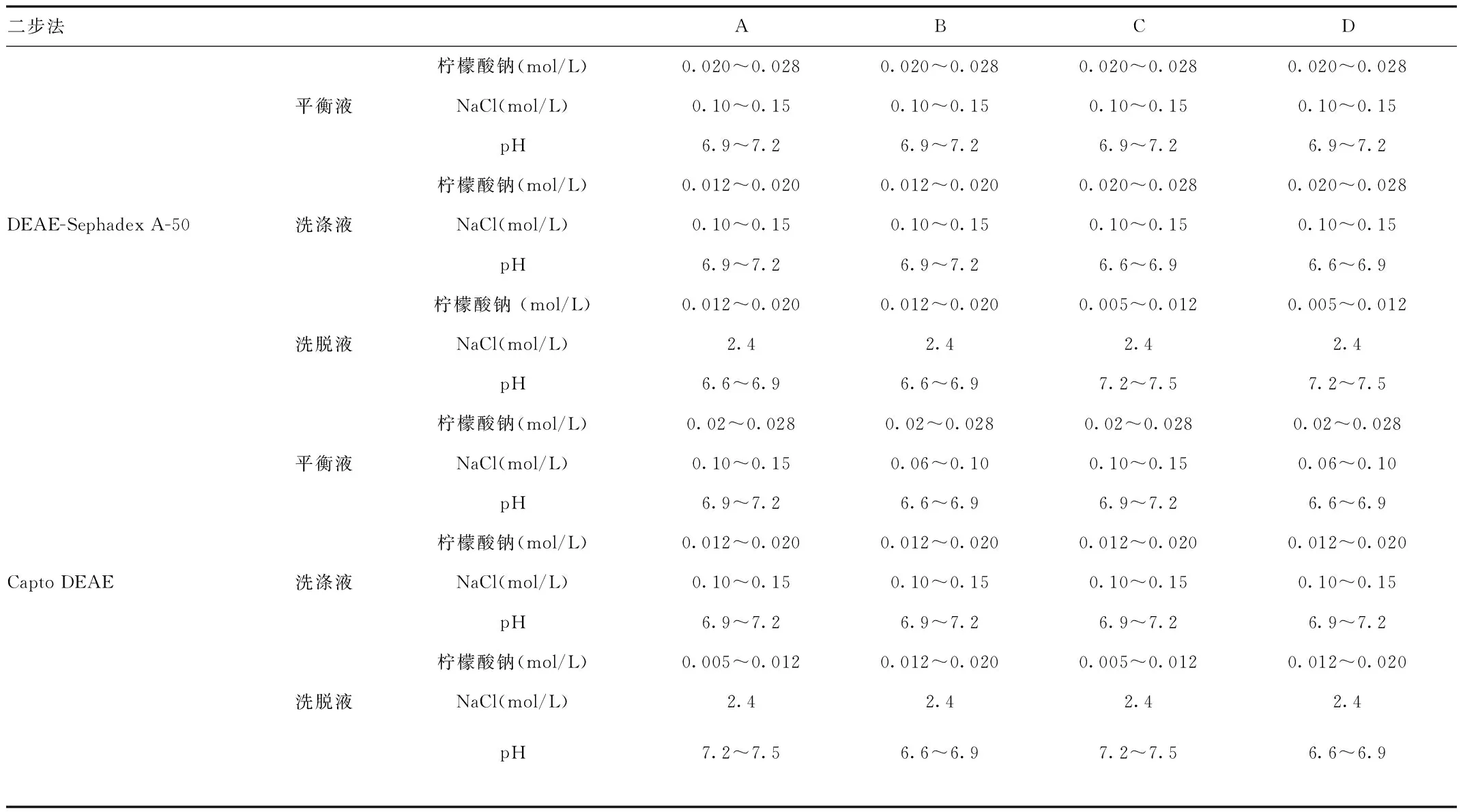
表1 4种实验方案条件设计表Tab.1 Four kinds of experimental conditions
将制备出的PCC进行超滤处理,降低电导至10~12 ms/cm。再用于Capto DEAE离子交换柱层析进一步纯化。
1.2.2 新型凝胶Capto DEAE纯化PCC 采用AKTA explorer100层析系统,根据曹海军等[2]对DEAE-Sephadex A-50的实验研究,设置Capto DEAE凝胶的平衡体系中柠檬酸钠、氯化钠、pH 3个因素分别为0.02~0.028 mol/L;0.06~0.10 mol/L;6.6~6.9、6.9~7.2;洗涤体系中柠檬酸钠、氯化钠、pH 3个可变因素分别为0.012~0.02 mol/L;0.10~0.15 mol/L;6.9~7.2;设定洗脱体系中柠檬酸钠、氯化钠、pH 3个可变因素分别为0.005~0.012 mol/L、0.012~0.02 mol/L;2.4 mol/L;6.6~6.9、7.2~7.5;具体实验条件见表1。
AKTA explorer100层析过程中,平衡、吸附、洗涤、洗脱过程流速分别为:3.5 cm/min、1.5 cm/min、2.5 cm/min、1.5 cm/min;具体操作参照AKTA explorer 100说明书。
1.2.3 凝血因子活性测定 凝固法(一期法)测定FⅡ、FⅦ、FⅨ、FⅩ活性,正常参比血浆做1/5~1/80梯度稀释;硫酸鱼精蛋白中和去冷沉淀原料混浆所含肝素,比例为10 μg硫酸鱼精蛋白中和1IU肝素;洗脱液1/12稀释;将处理好的待测样品和试剂分别置于全自动凝血仪中,检测凝血因子活性。具体操作见说明书。
1.2.4 蛋白C活性测定 发色底物法[16]测定PC活性,正常参比血浆1/5~1/80梯度稀释;去冷沉淀原料血浆1/3稀释;洗脱液1/10稀释;将处理好的样品先后与体外激活剂、发色底物试剂混合,用50%冰醋酸终止反应后,用酶标仪在405 nm处读数。具体操作见说明书。
1.2.5 总蛋白含量测定 考马斯亮蓝法检测PCC收集液的总蛋白含量,牛血清白蛋白为标准蛋白,洗脱液1/3稀释,原料血浆1/60稀释。将处理好的A-G BSA标准品和待测样品分别加入标记好的96孔板微孔中,然后加入检测试剂,充分混匀后用酶标仪测定595 nm处吸光值。具体操作见说明书。
1.2.6 SDS-PAGE 非还原性SDS-PAGE分析制备出的PCC的纯度,并与国内某公司已上市的PCC制品进行对比。PCC洗脱液1/3稀释,国内PCC制品(300 IU)1/360稀释,至所检测PCC样品中FⅨ活性均约为0.9 IU/mL。参照文献[17]方法,浓缩胶4%、分离胶10%进行非还原性SDS-PAGE;电泳过程中,浓缩胶电压设置80 V,分离胶电压设置为120 V。电泳后,凝胶用考马斯亮蓝R-250染色30 min、甲醇/乙酸混合物脱色1 h。
1.2.7 不同实验条件对凝血因子收率及比活影响分析 依据1.4和1.6测定结果,计算上述4种凝血因子的收率及比活。统计3次试验结果,依据平均值(n=3),直接分析不同实验条件对4种凝血因子收率及比活的影响趋势。

2 结果
2.1 Capto DEAE柱层析 4种实验方案下,层析图谱均相似,3个峰依次为背景杂质峰、洗涤峰及洗脱峰(目标蛋白峰)。图1显示,洗涤过程中洗去部分杂蛋白;洗脱峰均为单一峰。
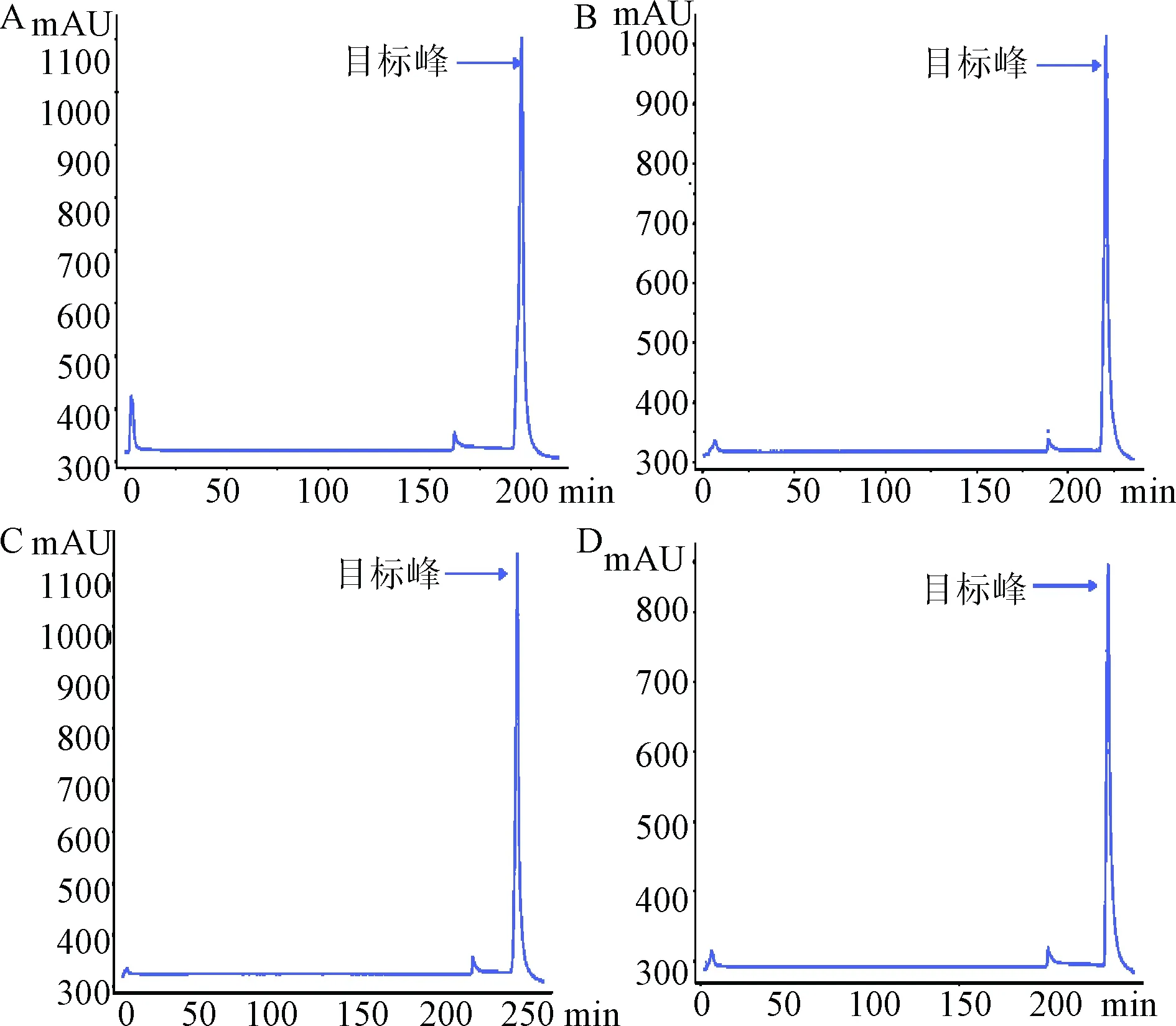
图1 4种实验方案下Capto DEAE凝胶柱层析紫外检测图谱Fig.1 Capto DEAE-gel ion-exchange chromatograms of 4 kinds of experimental conditions
2.2 不同实验方案下4种凝血因子的收率及比活 不同实验条件下,4种凝血因子收率变化有明显规律,从实验方案A至D,4种凝血因子的收率均呈递减的趋势,其中FⅨ收率分别为:(74.40±10.89)%、(71.59±5.45)%、(61.57±2.46)%、(49.20±3.73)%;FⅦ、FⅨ、FⅩ比活在A、B、C实验方案下递减,其中FⅨ分别为:(3.31±0.31)、(2.68±0.55)、(2.17±0.15)IU/mg,而在D实验条件下,均稍有升高,其中FⅨ(2.96±0.41)IU/mg。同一实验条件下,FⅨ收率最高,FⅦ收率最低。方差分析显示4种实验方案下,FⅨ的收率比较差异有统计学意义(F=6.188,P=0.018),而比活比较差异无统计学意义(F=3.172,P=0.085)。见图2。
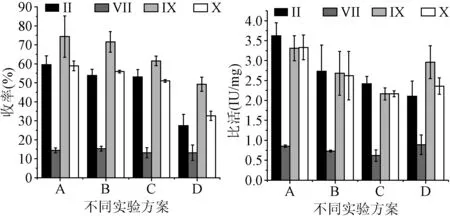
图2 4种实验方案下凝血因子的收率及比活±s)Fig.2 The yield and specific activity of coagulation factors ±s)
2.3 不同实验方案对蛋白C活性的影响 图3显示,不同实验条件下,蛋白C收率变化规律不明显,其中A、C实验方案下,蛋白C的收率较高,分别为(46.31±10.43)%、(44.95±8.49)%,D实验方案下收率最低为(32.57±8.86)%;蛋白C的比活在A、B、C实验方案下递减,分别为(0.86±0.22)、 (0.67±0.21)、(0.57±0.08)IU/mg,而在D实验方案条件下,蛋白C比活稍有升高,为(0.62±0.19)IU/mg;4种实验方案下蛋白C的收率(F=1.088,P=0.408)和比活(F=0.978,P=0.450)比较差异均无统计学意义。
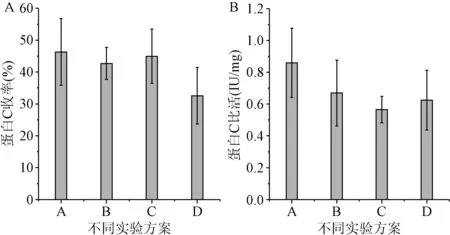
图3 4种实验方案下蛋白C收率及比活±s)Fig.3 The yield and specific activity of protein ±s)
2.4 SDS-PAGE 4种实验方案下,制品PCC所含蛋白种类基本一致(图4条带2、3、4、5),蛋白条带集中于分子量为49~198 kDa区间内,表明本实验制备的PCC不仅包含有效的凝血因子和抗凝蛋白(分子量为50~72 kDa),还包含高分子量的杂蛋白,这与国内某公司PCC制品电泳条带相似(条带6);在分子量49 kDa以下,本实验制备的PCC制品无明显蛋白条带出现,而国内某公司PCC制品则显示出较多的低分子量蛋白条带,表明本实验所探讨实验方案下制取的PCC制品所含的杂蛋白较少、纯度更高。
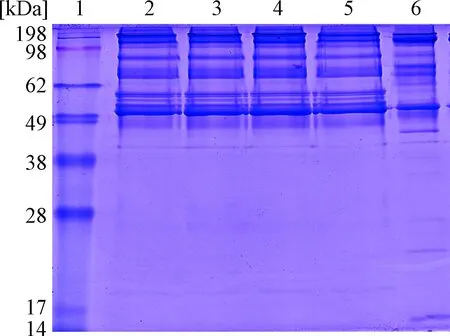
图4 不同实验方案所制备PCC的SDS-PAGE 条带1:蛋白marker ;条带2:方案A制备PCC;条带3:方案B制备PCC;条带4:方案C制备PCC;条带5:方案D制备PCC;条带6:国内某公司PCC制品Fig.4 SDS-PAGE analysis for four kinds of eluentLanes 1:protein weight marker; Lanes 2: eluet from A experimental condition;Lanes 3:eluet from B experimental condition ; Lanes 4: eluet from C experimental condition ; Lanes 5: eluet from D experimental condition; Lanes 6: PCC from a domestic company
3 讨论
目前国内外PCC多使用DEAE-Sephadex A-50批式吸附制备,但国内现有的成型PCC制品中,与凝血因子Ⅸ相比,凝血因子Ⅱ、Ⅹ含量相对较高,PCC中凝血因子活性含量的不均衡增加了其产品的致栓性[18]。随着血浆蛋白分离技术的发展,近几年也有利用扩张床吸附(expanded bed adosorption, EBA)技术制备PCC[13]的报道,但仍处于实验室探索阶段,而使用Capto DEAE新型凝胶制备PCC还未见相关研究报道。由于目前没有关于Capto DEAE生产PCC的研究报道,而Capto DEAE凝胶与DEAE-Sephadex A-50凝胶在结构上有相似之处,Capto DEAE凝胶是在Capto基质(一种高流动性的琼脂糖基质)上引入二乙基氨基乙基的新型弱阴离子交换剂,DEAE-Sephadex A-50凝胶则是在交联葡聚糖上引入二乙基氨基乙基的弱碱性阴离子交换剂[19]。所以根据曹海军等[14-15]对DEAE-Sephadex A-50凝胶制备PCC的大量工艺研究,我们选取了其中较优的制备条件,设计了A、B、C、D四种实验方案来探索Capto DEAE凝胶制备PCC的工艺条件。
通过本实验的探索,本研究发现,A到D 4种实验方案下,4种凝血因子的收率依次递减,且4种方案中FⅨ的收率差异有统计学意义(P<0.05),FⅦ、FⅨ、FⅩ比活在A、B、C实验方案下递减,而在D实验条件下,均稍有升高,但其中FⅨ比活比较差异无统计学意义。A、C实验方案下蛋白C的收率和比活均较高,在D方案下最低,4种实验方案下蛋白C的收率和比活比较差异均无统计学意义。总体而言,方案A最佳。
采用此实验方法制备PCC,在4种实验方案下,检测出制备的PCC纯度均比国内传统生产工艺生产的PCC高。在较好的实验方案A下,FⅨ的收率达到(74.40±10.89)% 、比活为(3.31±0.31)IU/mg,其比活明显高于国内厂家制备的PCC制品比活(0.51~1.04 IU/mg)[20]。本研究认为这表明此实验方法制备PCC对其纯度有所提高,且Capto DEAE对FⅨ的吸附能力较好,可以显著提高FⅨ收率。
同时,本研究也发现,在所有实验方案下,FⅦ的含量(0.25~0.30 IU/1 IU FⅨ)均低于国内传统工艺生产出的PCC(0.93~2.19 IU/1 IU FⅨ)[21],本研究认为一方面可能是Capto DEAE凝胶的处理及分离条件有待进一步优化。本实验选择的Capto DEAE凝胶处理条件,参照曹海军等[14-15]对DEAE-Sephadex A-50凝胶制备PCC的工艺条件。虽然Capto DEAE凝胶和DEAE-Sephadex A-50凝胶都属于弱阴离子交换剂、配体都是二乙基氨基乙基,在结构上有相似之处,但2种凝胶的基质不同,DEAE-Sephadex A-50凝胶基质为交联葡聚糖,而Capto DEAE凝胶基质是一种高流动性的琼脂糖。基质不同、凝胶的分离特性有区别,故处理DEAE-Sephadex A-50凝胶的最优条件并不一定适合用来处理Capto DEAE;另一方面可能是因为Capto DEAE凝胶本身对FⅦ的吸附能力不强,从而使制得的PCC制品中FⅦ水平较低;其确切原因有待进一步探讨。
另一方面,本研究所制备的PCC尽管FⅦ含量较低,但其Ⅱ、Ⅸ、Ⅹ 3种凝血因子均衡度明显优于目前国内制品(FⅡ:1.44~3.62IU/1IU FⅨ;FⅩ:1.27~4.11IU/1IU FⅨ)[21]。国际上有已上市的3-factor PCC(低七因子凝血酶原复合物)制品[20],本研究所探讨的实验条件是否为此制品的制备提供新的方法,有待进一步深入研究。
此外,我们发现本实验制备出的PCC中蛋白C的含量相对较高,表明Capto DEAE凝胶对抗凝蛋白的吸附较强,从而使得蛋白C收率较高。
[1] 曹海军, 杜晞, 叶生亮, 等. 凝血酶原复合物制备过程吸附条件的研究[J]. 中国输血杂志, 2012, 25(7): 655-660.
[2] Cao H, Li C, Huang Y, et al. Influence of washing conditions on effective components of prothrombin complex concentrates[J]. Prep Biochem Biotechnol, 2014, 44(2): 164-181.
[3] Sorensen B, Spahn DR, Innerhofer P, et al. Clinical review: Prothrombin complex concentrates-evaluation of safety and thrombogenicity[J]. Crit Care, 2011, 15(1): 201.
[4] Lusher JM, Shapiro SS, Palascak JE, et al. Efficacy of prothrombin-complex concentrates in hemophiliacs with antibodies to factor Ⅷ: a multicenter therapeutic trial[J]. N Engl J Med, 1980, 303(8): 421-425.
[5] Lorenz R, Kienast J, Otto U, et al. Efficacy and safety of a prothrombin complex concentrate with two virus-inactivation steps in patients with severe liver damage[J]. Eur J Gastroenterol Hepatol, 2003, 15(1): 15-20.
[6] Dentali F, Marchesi C, Pierfranceschi MG, et al. Safety of prothrombin complex concentrates for rapid anticoagulation reversal of vitamin K antagonists[J]. Thromb Haemost, 2011, 106(3): 429-438.
[7] Lankiewicz MW, Hays J, Friedman KD, et al. Urgent reversal of warfarin with prothrombin complex concentrate[J]. J Thromb Haemost, 2006, 4(5): 967-970.
[8] Cada DJ, Levien TL, Baker DE. Prothrombin complex concentrate[J]. Hosp Pharm, 2013, 48(11): 951.
[9] Huttner HB, Schellinger PD, Hartmann M, et al. Hematoma growth and outcome in treated neurocritical care patients with intracerebral hemorrhage related to oral anticoagulant therapy comparison of acute treatment strategies using vitamin K, fresh frozen plasma, and prothrombin complex concentrates[J]. Stroke, 2006, 37(6): 1465-1470.
[10] 余蓉, 刘文芳. 改良凝胶吸附法制备的凝血酶原复合物[J]. 中国输血杂志, 1997, 10(2): 63-66.
[11] 魏舒, 时凯, 刘国荣, 等. 冻干人凝血酶原复合物的生产工艺研究[J]. 中国输血杂志, 2008, 21(4): 282-284.
[12] Tharakan JP, Gee DM, Clark DB. A Semi‐Continuous Method for Purification of Factor Ⅸ Complex from Human Plasma[J]. Vox Sang, 1989, 57(4): 233-239.
[13] 黄亮, 赵红卫, 李长清, 等. 新型树脂扩张床吸附分离 PCC 的工艺及其放大研究[J]. 中国输血杂志, 2011, 24(6): 485-488.
[14] 曹海军, 叶生亮, 王宗奎, 等. 洗涤条件不同因素及其水平对凝血酶原复合物的影响研究[J]. 中国输血杂志, 2012 (S1): 66.
[15] 曹海军, 李志雄, 叶生亮, 等. 洗脱条件及其因素对凝血酶原复合物有效成分的影响[J]. 中国输血杂志, 2013, 26(4): 349-352.
[16] Φdegaard OR, Try K, Andersson TR. Protein C: an automated activity assay[J]. Haemostasis, 1987, 17(3): 109-113.
[17] Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. nature, 1970, 227: 680-685.
[18] Grundmann C, Plesker R, Kusch M, et al. Prothrombin overload causes thromboembolic complications in prothrombin complex concentrates: in vitro and in vivo evidence[J]. Thromb Haemost, 2005, 94(6): 1338-1339.
[19] 彭悦, 聂基兰. 交联葡聚糖凝胶吸附性能及应用[J]. 江西化工, 2001, 2:20-24.
[20] van Ryn J, Schurer J, Kink-Eiband M, et al. Successful reversal of dabigatran-induced bleeding by 3-factor coagulation concentrates in a rat tail bleeding model: lack of correlation with ex vivo markers of anticoagulation[J]. Circulation, 2012, 126(21 Supplement): A11955.
[21] Cao H, Tian Q, Huang Y, et al. Biochemical characterization of prothrombin complex concentrates in China[J]. Biologicals, 2015, 43(2): 84-91.
(编校:王俨俨)
撤稿声明
经核实,原刊载于本刊2015年2月第2期名为“开口箭对S-180细胞和实体瘤的抑制作用研究”一文,第一作者为青海省第五人民医院戚利坤,盗用南京医科大学洪鸣教授国家自然科学基金号,且文章内容存在严重学术不端行为。因此,本编辑部本着对作者、读者负责的态度,对此文进行撤稿处理,并在本刊官网、知网、万方数据库等撤除该稿件。
特此声明!
Preparation technology of new gel-purified prothrombin complexes concentrates
ZHOU Min1, ZENG Ren-yong2, LIU Yuan-yuan2, LI Chang-qing2,CAO Hai-jun2Δ†, HE Ze-chao1Δ†
(1.College of Chemical Engineering, Sichuan University, Chengdu 610065, China; 2.Institute of Blood Transfusion,Chinese Academy of Medical Science, Chengdu 610052, China)
ObjectiveTo study the process conditions for new gel Capto DEAE ion exchange chromatography to purify prothrombin complexes concentrates.MethodsAfter removal of cryoprecipitate by centrifugation, healthy human plasma was mixed with DEAE-Sephadex A-50 gel. After that, the gel were washed and eluted to obtain eluate; then, the eluate, after being ultrafiltered, was loaded on a column packed with Capto DEAE-gel for chromatography to prepare PCC which was later determined for activities of coagulation factors Ⅱ,Ⅶ,Ⅸ,Ⅹ and anticoagulation protein C, with their yield calculated. Besides, the protein concentration of PCC was determined using the Bradford method, based on which the specific activity of the four coagulation factors and protein C were calculated. According to the results, purification effect of Capto DEAE-gel on the PCC was analyzed.ResultsUnder different experimental conditions, the yield and purity of the coagulation factors FⅡ,FⅨ and FⅩ were high, and the equilibrum degree of the three factors was good; however, the yield and purity of coagulation factor FⅦ were very low. When the three variables (sodium citrate, NaCl and pH) in balanced solution, washing solution and elution were 0.020-0.028 mol/L, 0.10-0.15 mol/L and 6.9-7.2;0.012-0.020 mol/L, 0.10-0.15 mol/L and 6.9-7.2;0.005-0.012 mol/L, 2.4 mol/L and 7.2-7.5 , respectively,the yield and purity of PCC prepared from Capto DEAE-gel were good. Under this condition, yield of factor Ⅸ was (74.40±10.89)% and purity of factor Ⅸ was (3.31±0.31) IU/mL. Under different experimental conditions, yield and specific activity of anticoagulant protein C were higher.ConclusionThe purity of four coagulation factors and anticoagulation protein C of PCC prepared by the new method that combined the batch adsorption with DEAE-sephadex A-50 was combined with column chromatography packed with Capto DEAE-gel are higher than those prepared by the routine procedure. Furthermore, the PCC are better than these products obtained by traditional process, whose purity are 2.17-3.31IU/mg. Therefore, these studies will lay the groundwork for exploring novel preparation process of producing PCC.
prothrombin complex concentrate; Capto DEAE-gel; ion-exchange column chromatography
10.3969/j.issn.1005-1678.2016.11.058
四川省科技支撑计划(2014SZ0123)
周敏,女,硕士,研究方向:生物工程,E-mail:ZM_wendy@126.com;曹海军,通信作者,男,硕士,副主任技师,研究方向:血液生化与分子生物学研究,E-mail:chjr007@163.com;何泽超,共同通信作者,男,博士,副教授,研究方向:生化产品分离、污染物的生物净化,E-mail:hezechao@scu.edu.cn。
Q819;TQ464.8;R457.1+4
A
