槲皮素/壳聚糖纳米粒的制备、表征及其体外抗氧化活性研究
2016-07-24刘康秦梦杨婷婷石玮玮唐铭泽唐金宝张维芬
刘康,秦梦,杨婷婷,石玮玮,唐铭泽,唐金宝Δ†,张维芬Δ†
(1.潍坊医学院 药学院,山东 潍坊 261053;2.山东省寿光市第一中学,山东 寿光 262700)
槲皮素/壳聚糖纳米粒的制备、表征及其体外抗氧化活性研究
刘康1,秦梦1,杨婷婷1,石玮玮1,唐铭泽2,唐金宝1Δ†,张维芬1Δ†
(1.潍坊医学院 药学院,山东 潍坊 261053;2.山东省寿光市第一中学,山东 寿光 262700)
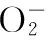
槲皮素;壳聚糖;纳米粒;体外释放;体外抗氧化活性
槲皮素(quercetin,QUE)是一种天然的多酚黄酮类化合物,主要从天然的植物中分离得到。它在自然界分布广泛,普遍存在于植物的花、叶、果实中,如槐米、槐花、车前子等[1]。槲皮素已被证明具有多种药理作用及生物活性,包括抗氧化,抗炎,抗过敏,抗肿瘤等,尤其具有明显的抗肿瘤作用,QUE被认为是目前已知最强的抗癌剂之一[2-3],具有良好的应用前景[4]。但QUE水溶性差(1 μg/mL)、亲水性差(logP=1.81)、胃肠道中不稳定、口服生物利用度低(人体不到2%),成为限制其临床应用的主要障碍[5]。为克服槲皮素的不良生物特性,很多学者开展QUE药物新剂型、给药方式等方面的研究探索如脂质体、固体脂质纳米粒等[6-8]。研究表明,雾化吸入载QUE的聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]磁性Fe3O4纳米粒对肺癌有良好的治疗效果[9]。将QUE包载于肺吸入脂质微球中能够增加QUE的稳定性及局部浓度[7]。纳米粒(nanoparticles,NPs)作为药物载体具有许多优点,能够提高药物在水溶液中的含量,以及在水溶液中的稳定性,还可以缓释药物降低药物的毒副作用[10]。天然的线性阳离子多糖壳聚糖(chitosan,CS)为载体材料具有良好的生物相容性、生物降解性,无毒,易于表面修饰等优点,并且制备纳米粒的方法简单,多样,很适合作为中药成分的有效载体[11-12]。虽然制备方法较多,但是目前对于方法和处方优化的研究相对较少。本试验以槲皮素为原料药、壳聚糖为载体材料,分别采用离子交联法和自组装法将槲皮素包载于壳聚糖中制备槲皮素/壳聚糖纳米粒(QUE-CS-NPs),筛选最优方法,采用正交设计考察最优工艺,并且系统地探讨了纳米粒的理化特性以及体外抗氧化活性,为天然高分子材料作为中药有效成分的给药载体提供实验研究依据。
1 材料与方法
1.1 材料 JEM-1200EX透射式电子显微镜(日本电子);Zetasizer Nano ZS90型激光粒度及其电位分析仪(英国Malvern公司);Agilent 1200高效液相色谱仪(美国Agilent公司);scientz-IID超声细胞破碎机(宁波新芝生物科技有限公司);槲皮素(盛天恒创生物科技有限公司);壳聚糖(海力生物制品有限公司,批号:HL130520X);三聚磷酸钠(TPP,科龙化工试剂厂,批号:20100514);甲醇(色谱纯,天津科密欧化学试剂有限公司,批号:20140102);其他试剂均为分析纯。
1.2 方法
1.2.1 槲皮素测定方法的建立:色谱条件C18色谱柱(4.6 mm×250 mm,5 μm),柱温25 ℃,检测波长254 nm,流动相水-甲醇(37:63),流速1.0 mL/min,进样量20 μL。
1.2.2 标准曲线:精密称取槲皮素对照品制备成储备液1 mg/mL摇匀。分别精密吸取一定量的储备液配置成1000、500、250、125、62.5、31.25 μg/mL的工作液。用高效液相色谱法测定每个样品的峰面积,并测定5日内的日间精密度、日内精密度(n=5)和高中低浓度(1000、250、31.25 μg/mL)的回收率。
1.2.3 载药量和包封率的测定:取制备好的QUE-CS-NPs液于12000 r/min离心30 min,收集上清液,用上述方法测定上清中QUE的含量(W1),将离心的沉淀用PBS液洗涤三次,干燥称重,质量记为(W2)。制备时加入QUE的质量记为(W3)。按照以下公式计算载药量(drug loading,DL)和包封率(entrapment efficiency,EE)。
DL=(W3-W1)/W2×100%
EE=(W3-W1)/W3×100%
1.2.4 QUE-CS-NPs的制备:参照载药纳米粒的常用制备方法,分别采用离子交联法以及自组装法[13-14],以包封率和载药量为指标,筛选QUE-CS-NPs的最佳制备方法。
① 离子交联法:称取20 mg壳聚糖粉末各4份分别溶于10 mL 1%的醋酸溶液中。用6 mol/L的NaOH溶液调节pH至5.5。不断磁力搅拌并逐滴滴加槲皮素的乙醇溶液,使载体与药物的质量比分别为8:1,6:1,4:1,2:1,然后逐滴滴加TPP(2 mg/mL)溶液,得到有乳光的淡黄色溶液。然后使用超声细胞破碎机在冰浴中超声1 h得到有乳光的淡黄色溶液。分别将胶体溶液于12000 r/min离心30 min,吸取上层清液用于测量包封率和载药量。
② 自组装法:称取20 mg壳聚糖粉末各4份分别溶于10 mL 1%的醋酸溶液中。用6 mol/L的NaOH溶液调节pH至5.5。不断磁力搅拌并逐滴滴加槲皮素的乙醇溶液,使载体与药物的质量比分别为8:1,6:1,4:1,2:1,然后使用超声细胞破碎机在冰浴中超声1 h得到有乳光的淡黄色溶液。分别将胶体溶液于12000 r/min离心30 min,吸取上层清液用于测量包封率和载药量。
1.2.5 QUE-CS-NPs的正交试验设计:实验结果的基础上,选取最优方法(离子交联法),以对制备影响较大的4个因素:壳聚糖与交联剂的浓度比(CS:TPP/mg/mL)、TPP的滴加速率(v/mL/min)、槲皮素的加入量(QUE/mg)、搅拌时间(t/min),每个因素选择三个水平,按照L9(34)正交表设计实验进行处方工艺优化(见表1)。以粒径(size)和包封率(EE)为评价指标,采用综合加权评分法处理数据,
以下面公式计算综合评分:
综合评分=0.5×100×(粒径/最大粒径+包封率/最大包封率)
其中,权重系数均为0.5,最大粒径及包封率均定为100分。

表1 L9(34)正交试验因素Tab.1 L9(34) orthogonal test factors
1.2.6 QUE-CS-NPs的表征:采用离子交联法,以最优的工艺处方制备QUE-CS-NPs进行表征,取适量QUE-CS-NPs样品溶液,加水稀释,滴至铜网上,干燥后,用JEM-1200EX型透射电镜(加速电压为80kV)观察样品形态及粒径分布。
采用马尔文激光粒度仪对所制备纳米粒子的粒径、分散系数(PDI)及Zeta电位进行测量,每个样品测量3次取平均值。
1.2.7 QUE-CS-NPs体外药物释放:用透析法测定纳米粒的体外释药特性。精密移取QUE-CS-NPs液2 mL,置于预处理好的透析袋内(截留分子量为3500);另取等质量的QUE加入PBS(0.01 mol/L,pH7.4,含0.5%的SDS)2 mL将透析袋放入盛有50 mL释放介质的锥形瓶内,并置于(37±0.5)℃,100 r/min,恒温水浴振荡器中。分别于0、0.25、0.5、0.75、1、2、3、4、6、8、10、12、24、48、72 h取透析液3 mL,同时补充等量的上述PBS。平行重复3次,用高效液相在254 nm处测定吸光度,计算累计释放率,考察其释放行为。
1.3 体外抗氧化活性试验


其中,A0为0 mL管的吸光度值,A1为样品管的吸光度值。
1.3.2 HO·清除能力测定:取6支试管,依次分别加入1.0 mL FeSO4(2.0 mmol/L),1.0 mL H2O2(1.0 mmol/L),1.0 mL水杨酸(6.0 mmol/L),摇晃均匀,放置于37 ℃水浴中加热15 min,然后分别加入0、0.1、0.2、0.3、0.4、0.5 mL槲皮素纳米粒样品溶液(以等量的槲皮素溶液作为对照),用蒸馏水补足至5 mL,摇匀,最后再用37 ℃水浴加热15 min,以蒸馏水为参比,在517 nm波长处测定吸光度,按下式计算样品HO·清除率。
HO·清除率(%)=(A0-A1)/A0×100%
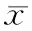
2 结果
2.1 槲皮素标准曲线及方法的精密度和回收率 得到标准曲线回归方程为Y=63.281X-111.26(r=0.9999),表明槲皮素在31.25~1000 μg/mL具有良好的线性关系。日间精密度RSD为1.75%,日内精密度RSD为1.34%。高中低3种浓度的回收率分别为(99.71±5.87)%、(98.48±5.87)%、(97.36±3.69)%,符合要求。QUE的1~8 h内每小时测定其峰面积其结果的RSD为1.59%,表明在考察时间内QUE溶液稳定性良好。
2.2 两种制备方法对纳米粒制备的影响的比较 两种方法结果相比较见表2,采用离子交联法制得的QUE-CS-NPs具有较大的载药量以及包封率,且随着载体与药物的比越大包封率越高而载药量变化不大。由于壳聚糖的两亲性使得与药物结合的疏水力要弱于阴阳离子间的结合力,从而导致自组装法的效率不高。

表2 2种制备方法以及壳聚糖和槲皮素的比例对制备槲皮素纳米粒 的载药量和包封率的影响±s,n=3)Tab.2 Effects of preparation methods and ratio of CS and QUE on entrapment efficiency and drug loading of ±s,n=3)
2.3 正交试验设计对处方及制备工艺的筛选优化 为了保证载药量和包封率,采用离子交联法制备QUE-CS-NPs,以正交试验考察其最优处方。以QUE为模型药物,CS为载体,采用离子交联法制备9批纳米粒,将载药纳米粒的粒径和包封率为指标,利用综合加权法对结果进行分析。由直观分析结果(见表3)得影响QUE-CS-NPs制备的因素主次顺序为A>D>B>C,最优工艺处方为A3B2C1D1(壳聚糖与TPP的浓度比:7 mg/mL,滴加速度:2 mL/min,槲皮素质量:0.2 mg,搅拌时间:10 min)。

表3 L9(34)正交试验结果Tab.3 L9(34) orthogonal test results
2.4 QUE-CS-NPs的表征
2.4.1 形态学粒径及电位表征:TEM结果(见图1)显示以最优处方制备的QUE-CS-NPs呈规则的圆形,粒径约为200 nm左右,粒子之间无粘连,分布均匀。DLS检测QUE-CS-NPs粒径分布及其Zeta电位结果见图2。QUE-CS-NPs平均粒径为(282.9±20)nm,PDI为0.185,Zeta电位为(30.5±2)mV。表明粒径大小分布均匀且性质稳定,粒子由于表面荷电互相排斥,不易发生聚集等现象。DLS结果稍大于TEM结果由于DLS检测是动态光散射而计算出的结果,且一直保持在水溶液中颗粒伸展使得粒径稍大。

图1 槲皮素壳聚糖纳米粒的透射电镜图Fig.1 TEM imaging of the prepared QUE-CS-NPs
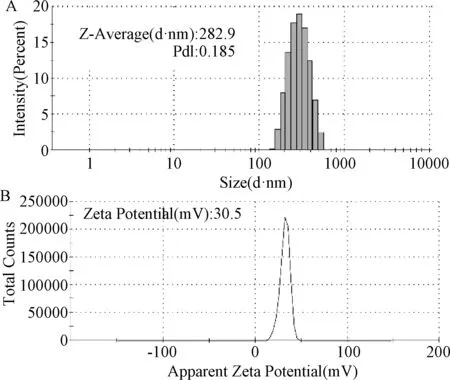
图2 槲皮素壳聚糖纳米粒的粒径(A)及Zeta电位(B)图Fig.2 The diameters (A) and Zeta potential (B) of the QUE-CS-NPs
2.4.2 载药量和包封率的测定:采用离子交联法最优处方工艺(壳聚糖与TPP的浓度比:7 mg/mL,滴加速度:2 mL/min,槲皮素质量:0.2 mg,搅拌时间:10 min)制备三批样品。以上述高效液相法测得纳米粒的平均包封率为(80.02±1.04)%,载药量为(8.81±0.65)%。并且工艺的重复性良好。
2.5 QUE-CS-NPs体外释放特性 QUE-CS-NPs体外释放结果见图3,可知QUE原料药在8h内释放完毕。而QUE-CS-NPs分为突释和缓释两个阶段,在前2h内有突释,其原因为纳米粒表面吸附的未被包裹的槲皮素的释放。总体显示出了缓释的特性并且72 h内释放了66.2%。以药物累积释放百分率和时间进行拟合,复合Korsmeyer-Peppas释放规律,拟合方程为y=3368.295tn-3405.35,(r=0.9557,n=0.004)。说明当表面吸附的槲皮素完全释放后,药物会从纳米粒的内部持续缓慢的释放且具有良好的缓释效果。
HO·清除能力测定结果如图4B所示,QUE与QUE-CS-NPs随着浓度增加HO·清除率越大且QUE-CS-NPs组高于QUE组。与QUE组相比,质量浓度为28.8 mg/mL和36 mg/mL的QUE-CS-NPs组的HO·清除率有显著性差异(P<0.05)。
与QUE的原药相比,QUE-CS-NPs体外抗氧化能力有所提高,其原因是由于QUE制备成纳米粒后的表面积增加从而与活性自由基接触更多,提高体外抗氧化能力,
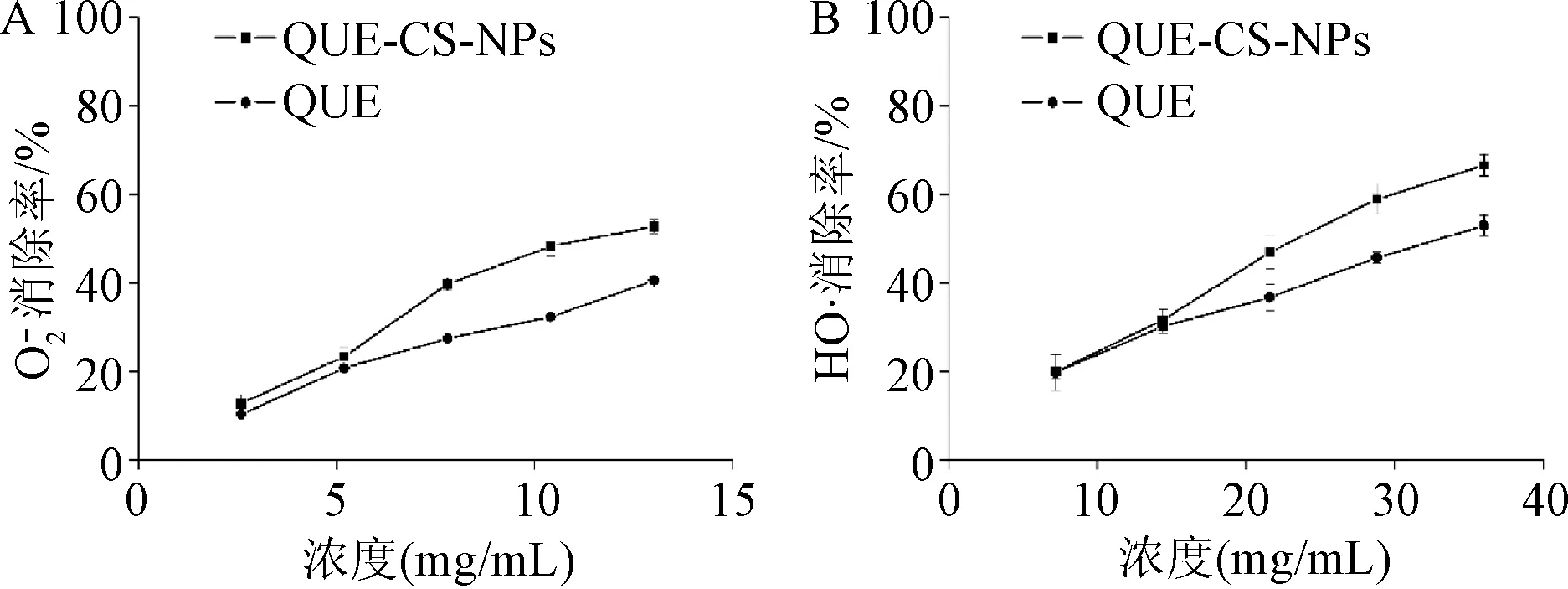
图4 槲皮素纳米粒的体外抗氧化活性实验:清除活性(A);HO·清除活性(B)(n=3)Fig.4 The antioxidation activity of QUE-CS-NPs in vitro: · scavenging ability (A); HO·scavenging ability (B) (n=3)
3 讨论
目前,有关QUE脂质体纳米粒的研究较多,但是制备这种脂质体纳米粒[16]通常使用氯仿,丙酮等有毒的有机溶剂,容易残留,并且载药量小,对药物的性质要求高。而目前以CS这种天然高分子材料制备QUE纳米粒的研究较少,只有报道以PLGA等材料制备QUE的纳米粒及纳米混悬剂[17]。壳聚糖具有无毒,成粒性好,两亲性等特点,特别适合作为水溶性差且性质不稳定的中药有效成分的载体。本研究中运用CS为载体包载QUE,通过两种方法的比较以及处方的筛选,最终以最优的方法和处方制备得到了QUE-CS-NPs,克服了QUE水溶性差、无缓释作用等缺点。因此,研究以CS作为传统中药有效成分的载体性质具有重要的意义,为CS进一步用于中药有效成分载体提供研究依据。
CS-NPs的制备方法常用自组装法和离子交联法。自组装法制备方法相对简单但是与离子交联法制备的QUE-CS-NPs相比具有较低的载药量与包封率[18],其原因可能是由于壳聚糖既有疏水性又有亲水性,使得其疏水分子基团之间相结合的力要小于正负电荷相吸引的力,从而导致了自组装法载药量和包封率低于离子交联法。采用正交实验设计优化处方,最优工艺处方为壳聚糖与TPP的浓度比:7 mg/mL,滴加速度:2 mg/mL,槲皮素质量:0.2 mg,搅拌时间:10 min。
最优处方下的研究结果表明采用离子交联法制备的QUE-CS-NPs,粒径分布均一,形态圆整,不但提高QUE的水溶性,而且延缓QUE的释放,从而实现了缓慢持续释放药物,还可以作为QUE的优良储库。粒径与用PLGA制备的槲皮素纳米粒相差不大,但载药量和包封率远高于PLGA制备的纳米粒[19],并且能提高缓释性能。与QUE的原药相比,QUE-CS-NPs体外抗氧化能力有所提高,其原因是由于QUE制备成纳米粒后的表面积增加从而与活性自由基接触更多,提高体外抗氧化能力,这与Lee等[20]研究一致。
对于具有水溶性差等诸多缺点的中药有效成分,应用天然高分子材料作为载体,将药物包裹在载体中能够克服药物的缺点,提高药物性能发挥重要的作用。研究证实,CS含有大量氨基易于在其表面修饰各种基团,从而进行改性,使其产生靶向性[21],pH敏感性[22]等,以便于更好的定位到病变部位。在后续的研究中将着重考察QUE-CS-NPs及其CS的改性纳米粒在动物体内的组织分布,及其治疗作用。
[1] Srinivas NR.Recent trends in preclinical drug-drug interaction studies of flavonoids-Review of case studies,issues and perspectives[J].Phytother Res,2015,29(11):1679-1691.
[2] Russo GL,Russo M,Spagnuolo C,et al.Quercetin:a pleiotropic kinase inhibitor against cancer[J].Cancer Treat Res,2014,159:185-205.
[3] Narayan C,Kumar A.Antineoplastic and immunomodulatory effect of polyphenolic components of achyranthes aspera (PCA) extract on urethane induced lung cancer in vivo[J].Mol Biol Rep,2014,41(1):179-191.
[4] Cote B,Carlson LJ,Rao DA,et al.Combinatorial resveratrol and quercetin polymeric micelles mitigate doxorubicin induced cardiotoxicity in vitro and in vivo[J].J Control Release,2015,213:128-133.
[5] Li H,Zhao X,Ma Y,et al.Enhancement of gastrointestinal absorption of quercetin by solid lipid nanoparticles[J].J Control Release,2009,133(3): 238-244.
[6] El-Gogary RI,Rubio N,Wang JT,et al.Polyethylene glycol conjugated polymeric nanocapsules for targeted delivery of quercetin to folate-expressing cancer cells in vitro and in vivo[J].ACS,2014,8(2):1384-1401.
[7] Liu L,Tang Y,Gao C,et al.Characterization and biodistribution in vivo of quercetin-loaded cationic nanostructured lipid carriers[J].Colloids Surf B Biointerfaces,2014,115:125-131.
[8] Long Q,Xie Y,Huang Y,et al.Induction of apoptosis and inhibition of angiogenesis by PEGylated liposomal quercetin in both cisplatin-sensitive and cisplatin-resistant ovarian cancers[J].J Biomed Nanotechnol,2013,9(6):965-975.
[9] Verma NK,Crosbie-Staunton K,Satti A,et al.Magnetic core-shell nanoparticles for drug delivery by nebulization[J].J Nanobiotechnology,2013,11:1-12.
[10] Tran TH,Guo Y,Song D,et al.Quercetin-containing self-nanoemulsifying drug delivery system for improving oral bioavailability[J].J Pharm Sci,2014,103(3):840-852.
[11] Zhang WF,Chen XG,Li PW,et al.Preparation and characterization of theophylline loaded chitosan/beta-cyclodextrin microspheres[J].J Mater Sci Mater Med,2008,19(1):305-310.
[12] Pujana MA,Perez-Alvarez L,Iturbe LC,et al.Water soluble folate-chitosan nanogels crosslinked by genipin[J].Carbohydr Polym,2014,101:113-120.
[13] Saravanakumar G,Min KH,Min DS,et al.Hydrotropic oligomer-conjugated glycol chitosan as a carrier of paclitaxel:synthesis,characterization,and in vivo biodistribution[J].J Control Release,2009,140(3):210-217.
[14] Avadi MR,Sadeghi AM,Mohammadpour N,et al.Preparation and characterization of insulin nanoparticles using chitosan and Arabic gum with ionic gelation method[J].Nanomedicine,2010,6(1):58-63.
[15] Liu D,Sheng J,Li Z,et al.Antioxidant activity of polysaccharide fractions extracted from Athyrium multidentatum (Doll.) Ching[J].Int J Biol Macromol,2013,56:1-5.
[16] 李厚丽,翟光喜,祝伟伟,等.槲皮素固体脂质纳米粒的制备及小鼠口服吸收研究[J].中国药学杂志,2008,43(6):435-448.
[17] 邸静,洪靖怡,刘营营,等.槲皮素纳米混悬剂的制备及其性能研究[J].现代药物与临床,2015,30(6):647-652.
[18] 常明泉,黄良永,叶立红,等.槲皮素固体脂质纳米粒的包封率与载药量测定[J].中国药房,2011,22(27):2525-2526.
[19] 解鹏宇,孙爽,吕邵娃,等.槲皮素-PLGA嵌段共聚物纳米粒的制备及释放机制研究[J].中医药信息,2013,30(5):62-66.
[20] Lee GH,Lee SJ,Jeong SW,et al.Antioxidative and antiinflammatory activities of quercetin-loaded silica nanoparticles[J].Colloids Surf B Biointerfaces,2016,143:511-517.
[21] Maya S,Lekshmi G,Kumar,et al.Cetuximab conjugated O-carboxymethyl chitosan nanoparticles for targeting EGFR overexpressing cancer cells[J].Carbohydr Polym,2016,93:661-669.
[22] Qi X,Qin J,Fan Y,et al.Carboxymethyl chitosan-modified polyamidoamine dendrimer enables progressive drug targeting of tumors via pH-Sensitive charge inversion[J].J Biomed Nanotechnol,2016,12(4):667-678.
(编校:师维康)
作 者 简 介

唐金宝,副教授,硕士生导师,潍坊医学院教研室主任。2005年毕业于山东大学微生物与生化药学专业,硕士研究生。主要从事生物药物技术方面的研究,研究兴趣集中为生物技术药物及新型免疫检测试剂的开发研究。近年来,主持完成省部级、厅局级科研课题4项,目前主持省部级1项,参与国家自然科学基金课题3项。授权发明专利5项,2012获山东省高等学校优秀科研成果奖一等奖,以第一或通讯作者发表多篇科研论文,其中SCI收录论文15篇。此外唐金宝教授兼任潍坊市药学会常务理事,担任《中国生化药物杂志》编委。

张维芬,教授,硕士生导师,潍坊医学院药学院实验教学中心主任,为山东省有突出贡献的中青年专家,山东省优秀研究生指导教师,首届山东省本科教育教学指导委员,首批潍坊市专业技术创新人才提升工程入选者,第五届山东省中药药理专业委员会副主任委员。主要致力于药物新剂型、新技术、新型生物材料及呼吸系统疾病治疗等方面的研究。近五年来承担国家自然科学基金、科技部星火计划及山东省科技攻关、山东省自然基金等各类计划项目16项。研究成果先后获得山东省科学技术进步二等奖、山东省专利奖二等奖、山东省医药科技二等奖等8项奖励。已获授权国家发明专利6项,公开发表论文40余篇,其中SCI收录论文30篇。担任《中国生化药物杂志》编委及国际SCI期刊ActaBiomaterialia,CarbonhydratePolymers,SpectrochimicaActa,PlantaMedica等7家SCI杂志审稿专家。
Preparation, characterization and antioxidation activityinvitroof quercetin loaded chitosan nanoparticles
LIU Kang1, QIN Meng1, YANG Ting-ting1, SHI Wei-wei1, TANG Ming-ze2,TANG Jin-bao1Δ†, ZHANG Wei-fen1Δ†
(1.College of Pharmacy,Weifang Medical University,Weifang 261053,China;2.No.1 Senior Middle School of Shouguang,Shouguang 262700,China)
ObjectiveTo prepare quercetin (QUE) loaded chitosan nanoparticles (CS-NPs), evaluate its physicochemical properties and antioxidation activityinvitro.MethodsQuercetin chitosan nanoparticles were prepared by ionic crosslinking method and self-assembly method. The preparation method was optimized using entrapment efficiency (EE), drug loading (DL) and size as indexes. The best formulation and preparation conditions were optimized by orthogonal test based on single-factor test, evaluation indicator as particle size and EE. The physicochemical properties of the obtained QUE-CS-NPs were characterized by the following methods: the transmission electron microscope (TEM), dynamic light scattering (DLS) analysis for morphology, size distribution and Zeta potential.Invitrorelease behavior in 0.5% SDS solution was evaluated by dialysis tube method.Invitroantioxidant activity assays were performed by evaluating the abilities of the microspheres for hydroxide radicals and superoxide anions.ResultsTEM results revealed QUE-CS-NPs with round and uniform. Particle-size analysis showed that the diameters and Zeta potential of the QUE-CS-NPs were (282.9±20) nm and (30.5±2) mV, with uniform distribution (polydispersity below 0.185). DL and EE of QUE-CS-NPs were (8.81±0.65) % and (80.02±1.04) %, respectively. QUE-CS-NPs showed extended administration times with 66.2% cumulative release within 72 h. QUE-CS-NPs showed pronounced antioxidant activity and a concentration dependent, even more substantial than that of pure QUE.ConclusionQUE-CS-NPs show a good size, sustain release effect and pronounce antioxidant activity.
quercetin; chitosan; nanoparticles;invitrorelease;invitroantioxidant activity
10.3969/j.issn.1005-1678.2016.11.005
国家自然科学基金(81573717);国家科技部科技计划项目(2013GA740103);山东省自然科学基金(ZR2012CM025);山东省医药卫生科技发展计划项目(2015WS0057);山东省潍坊市科技计划项目(2014WS045)
刘康,男,硕士在读,研究方向:药物新剂型与新技术,E-mail:lk843488326@163.com;唐金宝,通信作者,男,副教授,研究方向:生物技术药物,E-mail:tangjinbao2002@126.com;张维芬,共同通信作者,女,教授,硕士生导师,研究方向:药物新剂型与新技术研究,E-mail:zwf2024@126.com。
Q946.83+3
A
