酵母双杂交技术筛选与蛋白激酶Wee1相互作用的蛋白
2016-07-18刘超刘乙蒙栾治东任丽莉孟智超肖建英
刘超,刘乙蒙,栾治东,任丽莉,孟智超,肖建英
(1.辽宁医学院 基础医学院 发育生物学教研室,辽宁 锦州 121001;2. 辽宁医学院 基础医学院 神经生物学教研室,辽宁 锦州 121001;3. 辽宁医学院 基础医学实验教学中心,辽宁 锦州 121001;4. 辽宁医学院教务处,辽宁 锦州 121001)
酵母双杂交技术筛选与蛋白激酶Wee1相互作用的蛋白
刘超1,刘乙蒙1,栾治东1,任丽莉2,孟智超3,肖建英4Δ
(1.辽宁医学院 基础医学院 发育生物学教研室,辽宁 锦州 121001;2. 辽宁医学院 基础医学院 神经生物学教研室,辽宁 锦州 121001;3. 辽宁医学院 基础医学实验教学中心,辽宁 锦州 121001;4. 辽宁医学院教务处,辽宁 锦州 121001)
目的 应用酵母双杂交技术筛选出与Wee1蛋白激酶相互作用的候选分子,为进一步研究Wee1 的分子功能提供理论基础。方法 利用分子克隆的方法重组酵母双杂交质粒 pGBKT7-Wee1,并验证其在酵母中的毒性、自激活能力和表达。利用酵母双杂交技术从人卵巢cDNA文库中筛选出与Wee1蛋白相互作用的蛋白,并在酵母中重新验证其相互作用。结果 成功构建 pGBKT7-Wee1诱饵质粒,验证了其无毒性及自激活能力,且可以在酵母中表达,可进一步进行酵母双杂交的筛选工作。结论 利用酵母双杂交系统筛选出与Wee1相互作用的候选分子30个,为揭示蛋白激酶Wee1可能通过与其他蛋白相互作用进而调控细胞周期进程。
Wee1;酵母双杂交;蛋白互作
成熟促进因子(mature promoting factor,MPF)是真核生物细胞周期进程中一个关键的调节因子,在减数分裂和有丝分裂细胞周期调控中起着重要作用,可作为细胞周期调控中整合信号的中心枢纽[1-2]。从结构上看,MPF是一种复合物,由细胞周期蛋白依赖性激酶1(cyclin-dependent kinase 1,Cdk1)即细胞分裂周期2(cell division cycle 2,Cdc2)与细胞周期蛋白B(cyclinB)共同组成,其活性的调控主要是通过调节Cdc2上的3个磷酸化位点(Thr161、Thr14和Tyr15)的磷酸化状态来实现,而Wee1激酶家族和Cdc25磷酸酶主要是通过磷酸化/去磷酸化Thr14和Tyr15 进而影响 MPF的活性[3]。
在高等动物中,Wee1蛋白激酶家族有3种相关基因,Wee1、Wee2和Pkmyt1[4-5]。在裂殖酵母中,Wee1催化Tyr15位点发生磷酸化[6],而人Wee1基因编码的一段酪氨酸特殊序列也可以磷酸化Cdc2的Tyr15位点[7]。由此可见,Wee1主要通过使Tyr15位点磷酸化而负性调控Cdc2的活性,且Wee1 主要定位于细胞核中[8]。而Wee1家族的另一个成员,Pkmyt1 则结合MPF复合体,定位于细胞质,并可以通过磷酸化Thr l4和Tyr l5来调控细胞周期进程[9]。因此,在哺乳动物中,Wee1和Pkmyt1对有丝分裂负调控的作用已经很明确。随着研究的进行,人们对Wee1家族的另一成员Wee2的认识也更加深入。Wee2主要是存在于卵母细胞中[10],与Wee1相似的是其在细胞核中可以通过使Tyr15位点磷酸化而负性调控Cdc2的活性[11],可能不同的是,在某些组织中Wee2的活性要高于Wee1[12]。
Wee1蛋白激酶家族一个重要高度保守的调控方式是通过蛋白质相互作用[13],基于Wee1家族在细胞周期进程中的重要作用和Wee1家族保守的调控方式,寻找与Wee1家族的相互作用蛋白显得尤为重要。为了进一步阐明Wee1蛋白激酶的活性调控分子机制,本实验室以Wee1为诱饵,利用酵母双杂交系统从人卵巢cDNA文库筛选出与蛋白激酶Wee1家族相互作用的分子,为进一步研究Wee1 的分子功能提供理论基础。
1 材料与方法
1.1 材料 质粒pGBKT7(辽宁医学院栾治东博士惠赠);RNA PCR(AMV)Ver3.0试剂盒,SMARTScribe Reverse Transcriptase,E.coliCompetent Cell DH5α,Nde I,SalⅠ(Takara公司,日本);Mate&PlateTM Library-Human Ovary、Easy Yeast Plasmid Isolation Kit、Yeast Media Set 2 Plus和Yeast Transformation Kit(Clontch公司,日本);c-myc标签抗体(Santa Cruz公司,美国)、HRP标记的山羊抗鼠IgG (北京中杉金桥生物技术有限公司);Western细胞裂解液、BCA蛋白浓度测定试剂盒,ECL化学发光试剂盒(北京碧云天生物技术公司)。
恒温摇床QYC-200型(上海新苗医疗器械制造有限公司),电泳仪和电泳槽(Bio-Rad公司,美国),BOX-600全自动凝胶成像系统(UVP公司,美国)。
1.2 方法
1.2.1 pGBKT7-Wee1 诱饵质粒的构建:根据小鼠Wee1(Genebank ID: NM_009516.3)序列,设计特异性PCR引物,在上游引物和下游引物分别增加限制性内切酶Nde I(-CAT ATG-)和Sal I(-GTC GAC-)位点。PCR反应的引物序列如下:上游引物:5′-CGCCATATGAGCTTCCTGAGCCGACAGCAGCC-3′;下游引物:5′- GCGTCGACTCAGTATATAGTAAGGCTGACAG-3′。以小鼠脑组织cDNA为模板,通过PCR扩增出目的条带,PCR反应体系50 μL。反应条件:94 ℃、7 min,94 ℃、45 s,55 ℃、30 s,72 ℃、3 min,35个循环,72 ℃、10 min。PCR产物经1%琼脂糖凝胶电泳检测,进行胶回收和纯化。将胶回收产物与载体 pGBKT7用SalⅠ和NdeI双酶切,37 ℃中3 h,将双酶切的目的片段与载体连接,于16 ℃ 连接过夜。将连接产物转化 DH5α 感受态细胞,于 37 ℃ 培养箱中培养 16~18 h,观察平板菌落生长情况。挑取单个菌落接种于2 mL含有卡那霉素(50 μg/mL)的LB液体培养基中;37 ℃培养过夜,离心,弃上清,提取pGBKT7-Wee1质粒,可-20 ℃中保存备用。将上述得到质粒进行酶切鉴定,将经过酶切鉴定正确的重组质粒送往北京鼎国公司进行测序,并通过NCBI网站的Blast功能对测序结果进行比对,将测序结果完全正确的重组质粒扩大培养并保存,以备后用。
1.2.2 诱饵质粒pGBKT7-Wee1 转化酵母的毒性、自激活检测:复苏酵母菌Y2H Gold,并制备酵母感受态。分别将诱饵质粒pGBKT7-Wee1和pGBKT7空载转化酵母感受态细胞,分别取100 μL,涂于SD/-Trp固体培养板上,30 ℃倒置孵育3~5 d,观察2个平板酵母菌菌落生长的形态、数量、大小、颜色等差异,进行诱饵质粒pGBKT7-Wee1的毒性检测。将上述已转化好的pGBKT7-Wee1菌液取100 μL,分别涂于 SD/-Trp(SDO)、SD/-Trp/X-α-Gal(SDO/X)和SD/-Trp/X-α-Gal/AbA plates(SDO/X/A)固体培养板上,30 ℃倒置培养3~5 d,观察各个平板酵母菌菌落生长的形态、数量、大小、颜色,进行诱饵质粒pGBKT7-Wee1的自激活检测。
1.2.3 Western blot检测诱饵蛋白 Wee1在酵母细胞中的表达:从已转化 pGBKT7-Wee1和pGBKT7 的 SD/-Trp固体培养板上挑取一个新鲜的直径为 2~3 mm的酵母菌落接种于5 mLSD/-Trp液体培养基中,在恒温摇床中30 ℃,250 rpm,过夜培养12~16 h使OD600达到0.4~0.6;扩大再培养,4 ℃,2000 g离心5 min,弃上清;沉淀置于-80 ℃冰箱中,以备后用;将预热好的裂解液迅速加入沉淀中使其融化,每7.5总OD600值加80 μL glass beads;70 ℃水浴锅中加热10 min;4 ℃,14000 rpm,离心5 min;将上清转移至1.5 mL EP管;100 ℃水浴煮样5 min,可保存于-80 ℃冰箱中;配制10%分离胶,上样,电泳,转膜,封闭,用含0.5% BSA的TBST将c-myc抗体按1:1000稀释,4 ℃孵育过夜;将PVDF膜取出后,用TBST清洗3次,将PVDF膜放入HRP标记的山羊抗鼠IgG(1:3000稀释),室温摇床上孵育2 h;洗膜后,用ECL发光液进行发光成像。
1.2.4 含诱饵质粒pGBKT7-Wee1 的酵母菌与人卵巢 cDNA 文库融合 从含有pGBKT7-Wee1的SD/-Trp 培养平皿上挑取直径为2~3 mm的酵母菌落接种于1mLSD/-Trp液体培养基中,剧烈震荡涡旋;将上述液体全部转入50 mL SD/-Trp液体培养基中,于摇床中30 ℃,震荡培养至OD600达0.8;1000 g室温离心5 min,弃上清;加入4 mL SD/-Trp液体培养基,吹打混匀,要确保细胞计数达到108以上;从 -80 ℃ 冰箱取出之前冻存的人卵巢cDNA文库,水浴锅中溶解;将4 mL pGBKT7-Wee1靶菌株和1 mL人卵巢cDNA文库混合在一起,加入到2 L灭菌的锥形瓶中;锥形瓶中再加入45 mL 2×YPDA(含有50 μg/mL kana)液体培养基;用1 mL 2×YPDA(含有50 μg/mL kana)液体培养基清洗装有文库的离心管 2次,并合并到2 L锥形瓶中;在恒温摇床中 30 ℃,40 rpm,低转速培养20~24 h;20 h后,取2 μL 杂交液稀释10倍(18 μL SD/-Trp 液体培养基)滴于载玻片上,40×显微镜下查看杂交结果,若见相融合细胞则可停止培养,未见则一直培养至出现融合细胞;室温下1000g,离心10 min,弃上清;用25 mL 0.5×YPDA(含有50 μg/mL kana)液体培养基清洗锥形瓶2次,合到一起并重悬细胞沉淀;室温下1000 g,离心10 min,弃上清;用10 mL 0.5×YPDA(含有50 μg/mL kana)液体培养基重悬细胞沉淀;取1 mL杂交产物稀释成4个浓度:10-1、10-2、10-3、10-4,各浓度吸取100 μL 分别涂于铺板于SD/-Trp、SD/-leu、SD/-leu/-Trp 固体培养平板上;将剩余杂交产物涂于150 mm SD/-Trp/-Leu 平板上,每板 200 μL;30 ℃ 倒置孵育 3~5 d;用高压过的牙签挑取 DDO/X/A 盘子上的所有蓝色克隆接种到SD/-Trp/-Leu/-His/Ade /X-α-gal(QDO/X/A)盘子上;30 ℃ 倒置于培养箱中培养3~5 d;3~5 d后标记 QDO/X/A 高度缺陷培养基上的蓝色克隆,将培养板用封口膜封好4 ℃保存。
1.2.5 酵母质粒的提取和阳性克隆的分析:将上一步得到蓝色克隆接种于 3 mL SD/-Leu 液体培养基中,30 ℃,250 rpm,过夜培养 16~24 h;收集过夜培养的酵母菌液于灭菌的EP管中,5000g离心1 min,弃上清;进行酵母质粒提取。利用酵母的F-T7(5′-CTATTCGATGATGAAGATACCCCAAACCC-3′),R-3′AD(5′-GTGAACTTGCGGGGTTTTTCAGTATCTACGATT-3′)为引物按以下反应体系和条件进行 PCR 扩增。PCR反应条件:94 ℃预变性7 min;94 ℃ 30 s;55 ℃ 45 s;72 ℃ 3 min;30个循环;72 ℃终延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测。酵母质粒转化大肠杆菌,提取阳性克隆质粒送北京鼎国公司进行测序,并通过NCBI网站的Blast功能对测序结果进行比对分析,归纳,整理数据。
1.2.6 在酵母体内重新验证候选分子与 Wee1 的相互作用:诱饵质粒pGBKT7-Wee1和pGADT7-X 共转化酵母感受态细胞,同时共转化pGBKT7-53 和pGADT7-T 作为阳性对照;pGBKT7-Lam 和pGADT7-T 作为阴性对照;pGBKT7 空载和 pGADT7-X 作为对照组;具体操作过程按照1.2.4进行。
2 结果
2.1 pGBKT7-Wee1诱饵质粒的构建和鉴定 以小鼠脑组织 cDNA 为模版进行 PCR 扩增,扩增出长 1941 bp 的 Wee1 基因(见图1A),纯化后分别用NdeI /SalI 双酶切,与经同样酶切的 pGBKT7 载体连接,筛选阳性克隆,对阳性克隆进行NdeI /SalI 酶切鉴定(见图1B)及 DNA 测序分析,经Blast比对之后完全正确。
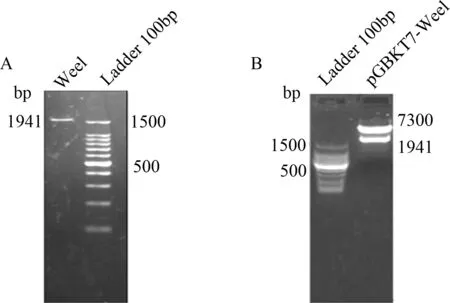
图1 Wee1琼脂糖凝胶电泳分析A:Wee1的PCR产物电泳图;B:pGBKT7-Wee1 双酶切后电泳图Fig.1 Agarose gel electrophoresis analysis of Wee1A:PCR products of Wee1 generated 1941 bp fragments; B:Double enzyme digestion results of pGBKT7-Wee1 with Nde I and Sal I
2.2 诱饵质粒 pGBKT7-Wee1 对酵母细胞毒性及自激活能力检测
2.2.1 诱饵质粒 pGBKT7-Wee1 对酵母细胞的自激活能力检测:将诱饵质粒 pGBKT7-Wee1(见图2A)和空载体 pGBKT7(见图2B)分别转入酵母感受态中,菌液接种于SD/-Trp(SDO)平板上培养,结果显示2平板上的克隆都均匀生长,且大小、形态、数量、颜色相一致,说明诱饵质粒pGBKT7-Wee1 对酵母菌无毒性作用。

图2 诱饵质粒 pGBKT7-Wee1 的毒性检测A:pGBKT7-Wee1质粒在SD/-Trp 盘子生长;B:空载体pGBKT7在 SD/-Trp盘子生长Fig.2 The bait plasmid pGBKT7- Wee1 on the toxicity of yeastA:pGBKT7-Wee1on SD/-Trp plates;B:pGBKT7on SD/-Trp plates
2.2.2 诱饵质粒 pGBKT7-Wee1:对酵母细胞的自激活能力检测:将诱饵质粒 pGBKT7-Wee1转入酵母感受态中,将菌液分别接种于SD/-Trp(SDO)、SD/-Trp/X-a-Gal(SDO/X)、SD/-Trp/X-α-Gal/AbA(SDO/X/A)平板上培养,结果显示,SD/-Trp平板(见图3A)和SD/-Trp/X-α-Gal(见图3B)平板上为有克隆生长而 SD/-Trp/X-α-Gal/AbA (见图3C)缺陷培养基上无克隆生长,说明诱饵质粒 pGBKT7-Wee1 在酵母中无自激活能力。
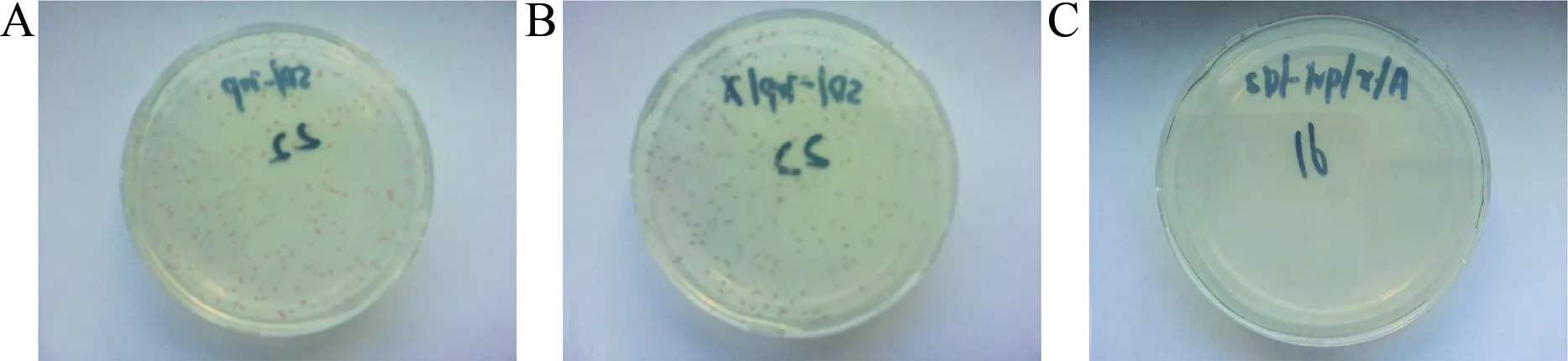
图3 诱饵质粒 pGBKT7-Wee1的自激活能力检测A:质粒pGBKT7-Wee1在SD/-Trp盘子生长;B:pGBKT7-Wee1在SD/-Trp/X-α-Gal 盘子生长;C:pGBKT7-Wee1在SD/-Trp/X-a-Gal/AbA盘子生长Fig.3 The bait plasmid pGBKT7- Wee1 on the self-activation of yeastA:pGBKT7-Wee1 on SD/-Trp plates;B:pGBKT7-Wee1 on SD/-Trp/X-α-Gal plates;C:pGBKT7-Wee1在SD/-Trp/X-a-Gal/AbA plates
2.3 诱饵蛋白Wee1在酵母细胞中的表达 pGBKT7和pGBKT7-Wee1分别转染酵母细胞,扩大培养,裂解细胞提取酵母蛋白,用 Western blot 检测 Wee1在酵母细胞中表达情况。结果表明Wee1 融合蛋白在酵母中可以很好的表达(见图4)。
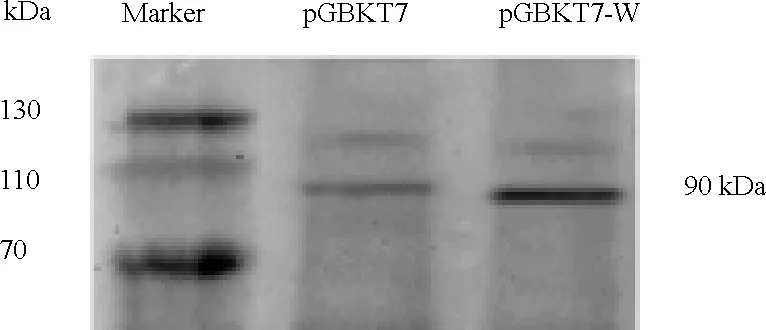
图4 诱饵质粒pGBKT7-Wee1在酵母中的表达Fig.4 Protein expression of bait plasmid pGBKT7- Wee1 in yeast
2.4 PCR验证阳性克隆 将含有诱饵质粒pGBKT7-Wee1的酵母菌与人卵巢cDNA文库相融合后进行大规模筛选上挑取QDO/X/A板上的蓝色克隆,提取酵母质粒,以酵母 F-T7,R-3’AD 为引物进行 PCR 鉴定(见图5)。将经过鉴定有阳性克隆的质粒转化大肠杆菌,提质粒送测序。共挑选出阳性克隆 242个,抽取质粒经 PCR 鉴定和测序,得到不重复且有意义的阳性克隆30个。
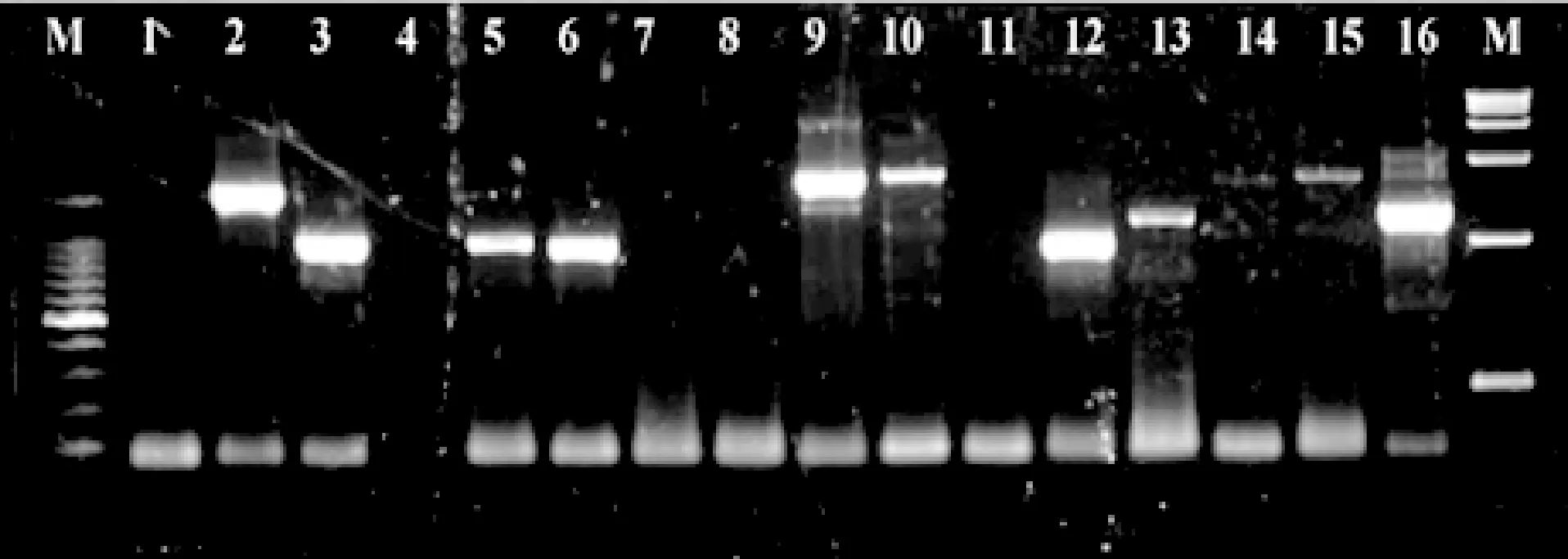
图5 PCR鉴定阳性克隆质粒M:Marker;1-16:PCR产物Fig. 5 Identification of positive clones by PCRM: Marker;1-16:PCR products
2.5 酵母体内验证 Wee1 与候选分子的相互作用 为了进一步验证文库筛选的结果,本研究将pGBKT7-Wee1和pGBKT7-jun B重新共转化酵母Y2H 感受态细胞,按4个浓度梯度 10-1、10-2、10-3、10-4,涂于 SD/-Trp-Leu-His-Ade/X-α-GAL/AbA 平板 30 ℃ 倒置温育3~5 d后,生长出蓝色菌落。这表明了候选分子和Wee1在酵母中存在相互作用(见图6)。
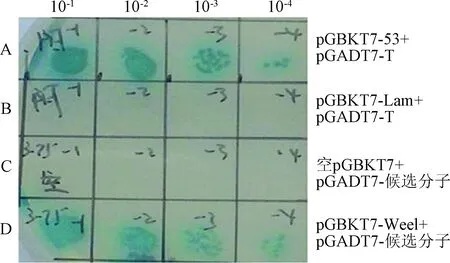
图6 候选分子与 Wee1 在酵母中存在相互作用A:pGBKT7-53和pGADT7-T共转染;B:pGBKT7-Lam和pGADT7-T共转染;C:pGBKT7 和 pGADT7-X共转染;D:pGBKT7-Wee1B 和 pGADT7-X共转染Fig.6 Candidate molecules interact with Wee1 in yeast A:Co-transformation of pGBKT7-53+pGADT7-T; B:Co-transformation ofpGBKT7-Lam+pGADT7-T; C:Co-transformation of pGBKT7 and pGADT7-X;D:Co-transformation of pGBKT7-Wee1B and pGADT7-X
3 讨论
近年来,关于Wee1的研究较多,也取得了不少的进展[14-15],但关于Wee1蛋白的磷酸化位点和关键有功能的元件,与其他细胞周期调节因子之间的关系,尤其是与14-3-3蛋白作用的具体机制、磷酸化的Wee1如何被调控去磷酸化以及Wee1如何实现核内外穿梭平衡来调控MPF活性等问题,仍是进一步需要探讨的问题。为进一步研究 Wee1 在细胞周期调控过程中的重要作用,本实验以Wee1为诱饵蛋白,利用酵母双杂交的方法从人卵巢cDNA 文库中筛选与Wee1相互作用的候选蛋白。首先本研究将Wee1构建到pGBKT7载体上,并证实了诱饵质粒 pGBKT7-Wee1在酵母中无毒性且无自激活能力,可用于酵母双杂交的筛选,进而通过Western blot检测到Wee1融合蛋白在酵母中有很好的表达,可以进行下一步的筛选工作。本研究利用酵母双杂交技术,大规模筛选人卵巢cDNA 文库,得到阳性克隆 30 个。测序后经Blast分析比对,同源分析表明编码全长目标蛋白的cDNA 片段。大致分成下列几类:①蛋白激酶类;②转录因子类;③凋亡相关蛋白类;④核糖体蛋白类;⑤未知蛋白;⑥其他类等。
综上所述,本研究通过酵母双杂交系统筛选出与Wee1互相作用的蛋白30个,并用生物信息学的方法进行分类分析,因此,深入了解Wee1调节的生物学和其催化活性的生物化学特性将有助于开发Wee1的特异抑制剂,并希望有助于癌症治疗的进展。
[1] Xiao J, Liu C, Hou J, et al. Ser149 is another potential PKA phosphorylation target of Cdc25B in G2/M transition of fertilized mouse eggs[J].J Biol Chem, 2011, 286(12): 10356-10366.
[2]Kang H, Hwang SC, Park YS, et al. Cdc25B phosphatase participates in maintaining metaphase II arrest in mouse oocytes[J].Mol Cells,2013,35(6):514-518.
[3]Coleman TR, Dunphy WG. Cdc2 regulatory factors[J].Curr Opin Cell Biol, 1994, 6(6):877-882.
[4]Liu C, Liu Y, Wu D, et al. Ser 15 of WEE1B is a potential PKA phosphorylation target in G2/M transition in one-cell stage mouse embryos[J].Mol Med Rep,2013,7(6):1929-1937.
[5]Murakami-Tonami Y, Ohtsuka H, Aiba H, et al. Regulation of wee1(+) expression during meiosis in fission yeast[J].Cell Cycle, 2014,13(18):2853-2858.
[6]Parker LL, Atherton-Fessler S, Lee MS, et al. Cyclin promotes the tyrosine phosphorylation of p34cdc2 in a wee1+ dependent manner[J].EMBO J, 1991,10(5): 1255-1263.
[7]Igarashi M, Nagata A,Jinno S,et al.Wee1-like gene in human cells. Nature, 1991,35(3):80-83.
[8]McGowan,CH, and Russell.P Cell cycle regulation of human WEE1[J].EMBO J,1995(14):2166-2175.
[9]Booher RN, Holman PS, Fattaey A.Human Myt1 is a cell cycle-regulated kinase that inhibits Cdc2 but not Cdk2 activity[J].J Biol Chem,1997, 272(35):22300-22306.
[10]Han SJ, Chen R, Paronetto MP, et al. Wee1B is an oocyte-specific kinase involved in the control of meiotic arrest in the mouse[J].Curr Biol,2005,15(18):1670-1676.
[11]Hanna CB, Yao S, Patta MC, et al. WEE2 is an oocyte-specific meiosis inhibitor in rhesus macaque monkeys[J].Biol Reprod,2010,82(6):1190-1197.
[12]Leise WF. 3rd and Mueller PR. Multiple Cdk1 inhibitory kinases regulate the cell cycle during development[J].Dev Biol,2002, 24(9):156-173.
[13]Wang Y, Jacobs C, Hook KE, et al. Binding of 14-3-3beta to the carboxyl terminus of Wee1 increases Wee1 stability, kinase activity, and G2-M cell population[J].Cell Growth Differ, 2000(4):211-219.
[14]Mueller S, Haas-Kogan DA.WEE1 Kinase As a Target for Cancer Therapy[J].J Clin Oncol, 2015,33(30):3485-3487.
[15]Guzmán-Vendrell M, Rincon SA, Dingli F, et al.Molecular control of the Wee1 regulatory pathway by the SAD kinase Cdr2[J].J Cell Sci,2015,128(15):2842-2853.
(编校:王冬梅)
Screening of proteins interacting with protein kinase Wee1 by yeast two hybrid system
LIU Chao1, LIU Yi-meng1, LUAN Zhi-dong1, REN Li-li2, MENG Zhi-chao3, XIAO Jian-ying4Δ
(1.Department of Developmental Biology, Liaoning Medical University, Jinzhou 121001, China; 2.Department of Neurobiology, Liaoning Medical University, Jinzhou 121001, China; 3. Department of Experimental Teaching Center of Basic Medicine, Liaoning Medical University, Jinzhou 121001, China; 4. Department of Teaching Affairs, Liaoning Medical University, Jinzhou 121001, China)
ObjectiveTo screen out the candidate molecules interacting with Wee1 protein kinase by yeast two hybrid technique, and to provide theoretical basis for further study of the molecular function of Wee1.MethodsThe yeast two hybrid plasmid pGBKT7-Wee1 was cloned by molecular cloning method, and its toxicity, self-activation ability and expression in yeast were verified. Screening of proteins interacting with Wee1 from human ovary cDNA library and the interaction between them was verified by yeast two hybrid technique.ResultsThe bait plasmid pGBKT7-Wee1 was successfully constructed, and the plasmid had no toxicity and self-activation ability, and the bait plasmid could be expressed in yeast.Conclusion30 candidate molecules interacting with Wee1 are screened by yeast two hybrid system, which reveales that protein kinase Wee1 might regulate cell cycle progression by interacting with other proteins.
Wee1; two-hybrid system; protein-protein interaction
国家自然科学基金资助课题(81270698;31371173;81401199),辽宁省科学技术计划项目(2015020697)
刘超,女,博士,副教授,研究方向:生殖生理,E-mail:jzyxyshlc3333@sina.com;肖建英,通信作者,女,博士,教授,研究方向:分子生殖和分子肿瘤,E-mail: xiaojianying@lnmu.edu.cn。
Q132.7
A
10.3969/j.issn.1005-1678.2016.03.06
