二萜类化合物微生物转化研究进展
2016-07-18吴亦晴虞劲祥程志红
吴亦晴,虞劲祥,程志红
(复旦大学 药学院,上海 201203)
二萜类化合物微生物转化研究进展
吴亦晴,虞劲祥,程志红Δ
(复旦大学 药学院,上海 201203)
二萜类(diterpenoids)化合物是一类含有20个碳原子的天然萜类成分,许多著名的药物分子如紫杉醇、穿心莲内酯、银杏内酯等均为二萜类化合物。由于该类化合物显著的生物和药理活性,已成为当今天然药物研究领域的热点。利用微生物转化(microbial transformation)这种高度区域性和立体选择性的结构修饰方法对二萜类化合物进行结构改造,已成为发现新型二萜类先导化合物的一种重要手段。本文就主要二萜类化合物(半日花烷型二萜、克罗烷型二萜、银杏内酯型二萜;松香烷型二萜、海松烷型二萜、紫杉烷型二萜;贝壳杉烷型二萜、贝叶烷型二萜;假白榄烷二萜、金钱松二萜)的微生物转化研究进行综述,为该类化合物在微生物转化体系下可能发生的化学反应类型、转化产物的结构多样性以及活性变化等提供科学参考。
二萜;微生物转化;半日花烷;松香烷
二萜类(diterpenoids)化合物是由4个异戊二烯基单元组成、含有20个碳原子的一类天然化合物,其生源上都是由前体物焦磷酸香叶基香叶酯(geranylgeranyl-PP,GGPP)衍生而成,此类化合物广泛存在于植物界、真菌、昆虫和海洋生物中。二萜类化合物化学结构丰富多样,根据骨架环系主要可分为链状、单环、二环、三环、四环和大环二萜等多种类型(见图1)。其多变的化学结构和丰富的自然界来源,决定了二萜类成分生物活性的多样性,如具显著抗癌活性的紫杉醇[1]、冬凌草甲素[2]和巨大戟醇[3]等;显著抗炎活性的穿心莲内酯类[4];显著心脑血管保护活性的银杏内酯类[5]等等。这些活性化合物的发现使得二萜类化合物至今一直是药学和天然产物化学研究中的热点。
微生物转化(microbial transformation,MT)是利用微生物在其在生长过程中合成的大量酶系的催化作用对化合物(底物)进行结构修饰的转化反应[6]。微生物转化利用肠道菌、放线菌、真菌等微生物作为发酵工厂,底物通过其酶系的作用发生多种化学反应,如氧化(羟基化、酮基化、脱氢)、水解、(脱)乙酰化、糖苷化等反应,少数底物在适当的微生物作用下会发生特异性的碳原子迁移反应和骨架重排反应。早在上世纪50年代,微生物转化就已经在甾体药物结构合成领域成功应用,利用常见的根霉菌在甾体底物的C-11位合成羟基,进而极大地加速了甾体激素类药物的合成效率和产率[7]。由于三萜类化合物在结构上与甾体类化合物的相似性,其非化学活泼位点难以用有机催化进行结构修饰,开始有越来越多研究采用微生物转化法对三萜类化合物进行结构修饰和优化[8-9]。
二萜类化合物结构复杂、骨架多变、来源广泛,多具有明显的生物和药理活性。而微生物转化具有区域选择性高、立体选择性强和反应类型多等特点。因此,近年来,有越来越多的研究者用微生物转化对该类化合物进行结构修饰,获得一些难以用化学合成、结构新颖的二萜衍生物,进而为新药研发提供更具价值的先导化合物[9]。本文依据二萜类化合物的结构类型,对国内外研究较多的主要二萜类化合物的微生物转化(不包括肠内菌转化)进行概述。
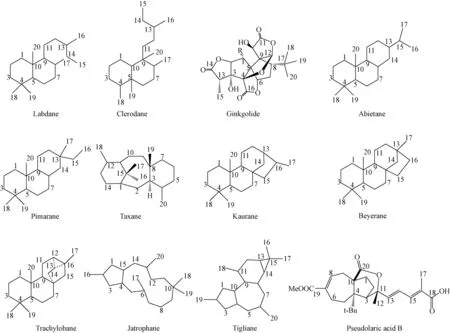
图1 主要二萜类化合物的骨架结构Fig.1 The major structure skeletons of diterpenoids
1 双环类二萜的微生物转化
1.1 半日花烷型二萜(Labdanes)的微生物转化 半日花烷型二萜以十氢萘为母核,结构类型多变,根据其是否含有特殊的结构基团,可将其进一步分为一般半日花烷型、内酯环型、环氧型、螺环型、呋喃型和重排型。大多数半日花烷型二萜具有丰富的生物活性[10],其中最具代表性的是从中药穿心莲Andrographispaniculata中分得的穿心莲内酯类(andrographolides)和从毛喉鞘蕊花Coleusforskohlii中分得的毛喉素(forskolin)。该类化合物的结构多样性和良好的生物活性促使许多研究者采用微生物转化法对其进行结构修饰研究。对于一般半日花烷型二萜,酶催化反应主要发生在十氢萘骨架上,羟基化反应主要发生在C-2、C-3以及C-18位的角甲基上,环内双键也易发生双键重排与氧化反应。Aranda等[11]利用毛霉属的Mucorplumbeus对香紫苏醇(sclareol)、香紫苏内酯(sclareolide)和泪杉醇(manool)进行微生物转化研究,发现无论使用生长中的M. plumbeus还是过滤并水洗的菌丝,都能将香紫苏醇转化为3β、6α或18位羟基化产物。在同样的转化条件下,香紫苏内酯可得到3β羟基化产物和其进一步的C-3羰基化产物,而泪杉醇则得到2α羟基化产物。该研究表明M.plumbeus可作为此类二萜的立体和区域选择性羟基化手段,用于增强此类衍生物的水溶性及进一步修饰的位点。Haridy 等[12]利用黑曲霉Aspergillusniger对从菊科Madia属多种植物中分得的一个C-7/8位环内双键的半日花烷二萜(13R,14R,15-trihydroxylabd-7-ene)进行微生物转化,除了得到C-3羟基化衍生物外,还得到一个8α,9β-不饱和酮类化合物。此外,Orden等[13]研究发现黑曲霉A.niger无法对C-8/9位环内双键、不含五元环氧基团的半日花烷二萜发生转化反应。比较2者的研究结果,说明黑曲霉对半日花烷二萜的生物转化有严格的区域选择性。Lin等[14]发现诺卡氏菌属的Nocardiaaurantia可以将异柏油酸(isocupressic acid)转化为降异柏油酸(nor-isocupressic acid),即C-13/14位双键通过环氧化中间体得到C-13羰基化产物。此研究结果表明,选择合适的菌种也能在非十氢萘骨架上发生酶催化反应。
内酯环在半日花烷二萜骨架中存在较为普遍,典型化合物为穿心莲内酯,是穿心莲中抗炎作用的主要活性成分。关于穿心莲内酯的微生物转化研究有较多报道,如Wang等[15]利用毛霉属的M.spinosu对穿心莲丙素(neoandrographolide)进行结构修饰,并比较了转化产物与底物的活性差异。研究结果表明,该微生物的酶系可以催化穿心莲丙素发生羟基化、水解及糖苷化反应,其中双键羟基化的转化产物具有更好的抑制LPS诱导巨噬细胞释放NO的活性。Deng等[16]用短刺小克银汉霉Cunninghamellablakesleana对去氧穿心莲内酯(deoxyandrographolide)进行微生物转化研究,得到多个转化产物,其中包括4个C-3羰基化产物、1个具C-1/2环内双键的产物和1个内酯环开裂的产物。对比转化产物和底物抑制LPS诱导巨噬细胞释放NO的活性发现,具C-1/2位双键的转化产物可提高该抗炎活性,而C-3位羰基化对活性改变影响较小。而He等[17]用赭曲霉A.ochraceus对穿心莲内酯(andrographolide)进行转化,可得到其C-8/17位双键羟基化产物、C-19羟甲基的羧基化产物以及C-12/13位双键的迁移化产物。对转化产物的人乳腺癌细胞(MCF-7)、人结肠癌细胞(HCT-116)和人恶性白细胞(leukemia)的细胞毒活性进行评价,发现转化产物中同时具有8β羟基化、19位羧基化以及C-12/13位双键迁移至C-11/12位的转化产物细胞毒活性明显高于底物。该研究表明,虽然微生物转化为生物体进行解毒代谢的过程,但仍能从中获取保留底物活性或活性增强的转化产物。
1.2 克罗烷型二萜(Clerodanes)的微生物转化 克罗烷型二萜的基本骨架也为十氢化萘,是半日花烷二萜的结构重排类型,按其是否存在特殊基团,可进一步分为一般克罗烷型、呋喃型、内酯型和环氧型。克罗烷型二萜的分布也较为广泛,许多该类型二萜,尤其是其多氧取代的衍生物具有较强的昆虫拒食、抗菌和抗肿瘤活性[18]。Choudhary等[19]通过植物病原菌Rhizopusstelonifer对克罗烷内酯(clerodane lactone)和克罗烷甲酯(clerodane methyl ester)进行了微生物转化研究,除了得到A环和B环两个六元环不同位置的羟基化产物外,两底物还均得到呋喃环发生氧化开环的产物。值得注意的是,该开环的转化产物与其在P450酶体外生物催化反应的产物一致[20]。Mafezoli等[21]用刺孢小克银汉霉C.echinulata催化同样含有呋喃环的克罗烷二萜,仅得到C-3位羟基化衍生物。与此不同的是,而上述Choudhary等的研究,发现可在克罗烷二萜骨架的多个非活泼碳上都可以发生羟基化反应,同时转化产物具有高度的立体选择性[19]。由此可见,转化底物的微小差别以及微生物转化体系的不同,可导致转化反应的不同,进一步说明了微生物转化的特异性和选择性。
1.3 银杏内酯型二萜(Ginkgolides)的微生物转化 银杏内酯类是银杏叶中所独有的成分,骨架中含有六个五元环(其中包括一个螺壬烷、一个四氢呋喃环和三个内酯环)和一个叔丁基。银杏内酯类是公认的血小板活化因子受体拮抗剂,其中活性最强的是银杏内酯B,其次为银杏内酯A,但目前对其的微生物转化研究报道较少。Ding等[22]采用食用真菌Coprinuscomatus对银杏内酯类化合物进行了微生物转化研究,发现多种银杏内酯类化合物经羟基化反应可转化成活性更好的银杏内酯B,且部分转化产率高达88%。
2 三环类二萜的微生物转化
2.1 松香烷型二萜(Abietanes)的微生物转化 松香烷二萜基本骨架为氢化菲,C-4位存在一个偕二甲基,其代表性的化合物是从唇形科植物迷迭香Rosmarinusofficinalis中分得的鼠尾草酸(carnosic acid)。van Beek 等[23]对从欧洲赤松Pinussylvestris中分得的一个微生物毒性成分脱氢枞酸(dehydroabietic acid)进行了微生物转化,分别以两种真菌Phlebiopsisgigantean和Trametesversicolor为转化体系,采用HPLC-DAD-ELSD法进行跟踪检测,从两株菌株发酵产物中得到种类不同的氧化产物,主要为在发生在氢化菲骨架C-1、C-7和边链C-17位的羟基化反应产物,以及C-7位的羰基化反应产物。而Fraga等[24]同样以脱氢枞酸的类似物dehydroabietanol和teideadiol为底物,采用毛霉属M.plumbeus进行转化,也得到了C-1和C-17位羟基化产物,但羰基化反应发生在C-2位。以C-20位为羧基的鼠尾草酸为底物,利用诺卡氏菌属的Nocardiasp. NRRL 5646进行转化,则得到C-7羟基与C-20羧基发生分子迈克尔加成的产物-鼠尾草酚(carnosol)[25]。综合以上研究结果发现,羟基化及其进一步的氧化反应主要发生在饱和的十氢萘环和偕二甲基上,而骈合的苯环基本不发生转化反应。
松香烷二萜中的碳原子常发生迁移,除常见的甲基迁移外,一些分子骨架中的碳原子也易发生迁移。雷公藤二萜是卫矛科植物雷公藤Tripterygiumwilfordii的主要有效成分,属于松香烷型二萜C-18位甲基迁移的产物,形成特有的A环α,β-不饱和内酯结构[26]。雷公藤二萜具有免疫抑制和抗肿瘤等多种显著的生理活性,但由于肾毒性大,其临床应用受到一定的限制。果德安教授课题组利用黑曲霉A.niger对雷公藤主要成分雷公藤甲素(triptolide)和雷公藤内酯酮(triptonide)进行转化反应,分别得到4个新雷公藤甲素衍生物(5α-羟基雷公藤甲素、19α-羟基雷公藤甲素、19β-羟基雷公藤甲素和1β-羟基雷公藤甲素)以及3个新雷公藤内酯酮衍生物(5α-羟基雷公藤内酯酮、16-羟基雷公藤内酯酮和17-羟基雷公藤内酯酮)。活性评价结果表明,除C-19羟基化产物外,其他转化产物均表现出对人胃癌细胞BGC-823、人宫颈癌细胞Hela和人白血病细胞HL-60等较强的体外细胞毒活性,但均比底物略有下降[27]。Chen 等[28]利用粗糙脉孢菌Neurosporacrassa也对雷公藤内酯酮衍生物(14-deoxy-14-methylenetriptolide)进行了微生物转化,但仅得到其C-5羟基化产物。值得注意的是,雷公藤二萜B/C环上特殊的三元氧环均未有酶催化发生开环反应的报道。
丹参酮二萜类成分是唇形科植物丹参Salviamiltiorrhiza的主要脂溶性有效成分,其结构为松香烷型C-20降二萜[29]。以雅致小克银汉霉C.elegans为转化体系,隐丹参酮(cryptotanshinone)为底物,得到一对C-3位羟基化差向异构体和C-18位羟基化产物,该转化产物与隐丹参酮经灌胃小鼠胆汁中的代谢产物结构一致[30]。该研究结果的重要意义在于,用微生物转化试验可用于预测及合成药物在哺乳动物体内的代谢产物,且微生物转化法具有微量代谢产物易制、耗费低、重复性强等显著优点。
2.2 海松烷型二萜(Pimaranes)的微生物转化 与松香烷二萜一样,海松烷二萜最初也是从松香中分离出来的,根据分子中手性中心的差异可以分为4大类:海松烷型、异海松烷型、对映-海松烷型和对映-异海松烷型。海松烷型二萜具有解痉和肌肉松弛等活性。Fraga等[31]用弗基克罗赤霉Gibberellafujikuroi对蒲包花属植物Calceolariapetioalaris中分得的异海松烷型二萜进行了微生物转化,得到一系列C-7/8位双键发生氧化反应的转化产物。此后,该研究组利用该菌对含有C-9/11双键的海松烷二萜酸(1)进行生物转化,得到C-1羰基化产物和一个经Baeyer-Villiger 氧化重排的七元内酯环产物(2)(见图2)[32]。该重排产物推测可能是由C-2-oxo插入氧原子形成的,该研究是第一次发现弗基克罗赤霉可以催化Baeyer-Villiger氧化重排反应。Severiano等[33]分别用真菌围小丛壳菌Glomerellacingulata和鲁西毛霉菌M.rouxii对一个具有抗菌作用的异海松烷二萜(ent-pimara-8(14),15-dien-19-oic acid)进行微生物转化,得到3个双键重排产物,其中一个产物存在8α,9β-不饱和酮结构,推测该产物是先由底物生成C-7/8位环氧中间体,该中间体进而氧化形成邻二醇中间体,最后经脱水而成。通过比较以上海松烷型二萜微生物转化研究发现,除了骨架中C-1、C-2和C-7位容易发生羟基化反应外,环内双键也容易发生氧化或重排反应。
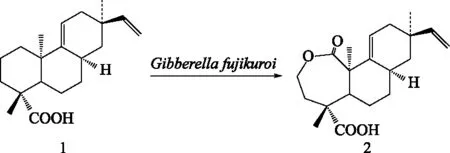
图2 海松烷型二萜酸(1)经Gibberella fujikuroi转化得到的结构重排产物(2)Fig.2 A rearrangement product(2)obtained by biotransformation of 1 with Gibberella fujikuroi
2.3 紫杉烷型二萜(Taxanes)的微生物转化 紫杉烷型二萜是从红豆杉属植物TaxusLinn.中得到的一类二萜成分,其中最具代表性的化合物紫杉醇(paclitaxel),是目前临床上使用最广泛的抗癌药物之一。对紫杉烷二萜的生物转化研究引起了各国学者的重视,以期将紫杉醇类似物转化为紫杉醇或者寻找到活性和水溶性更好的紫杉醇衍生物。主要的微生物催化反应包括氧化反应、双键还原反应、酯水解反应、酰化反应、重排反应和C-7位羟基的差向异构化反应等[34]。近年来研究发现灰色链霉菌Streptomycesgriseus能将一紫杉烷衍生物(4)转化成罕见的带有罕见6/8/6/5环状结构的重排产物(5)(见图3)[35]。戴均贵教授课题组对紫杉烷型二萜的微生物转化及生物合成进行了较为深入的研究,利用兰色犁头霉Absidiacoerulea和日内瓦毛霉M.genevensis2种培养体系对4个紫杉烷型二萜(sinenxan、yunanxane和2个sinenxan衍生物)进行转化,得到53个转化产物,其中对转化产物9α-羟基取代sinenxan A的进一步化学反应得到的9α-肉桂酰取代sinenexan A,具有良好的逆转肿瘤多药耐药活性[36]。该研究的重要意义在于,对于二萜结构中不活泼的碳原子,可利用微生物酶进行选择性羟基化反应,并在此基础上结合化学反应进行结构修饰,这是一个合成先导化合物的有效途径之一。

图3 紫杉烷型二萜(4)经Streptomyces griseus转化得到的结构重排产物(5)Fig.3 A rearrangement product(5)obtained by biotransformation of 4 with Streptomyces griseus
同样含有紫杉烷骨架的化合物还有三尖杉宁碱(cephalomannine),用一种从东北红豆杉根际土壤中分离得到的细菌Luteibactersp.,可将三尖杉宁碱转化生成8个代谢产物,其中两个产物为糖苷化产物。糖基的引入能大大提高三尖杉宁碱的水溶性,增加其成药性[37]。
3 四环类二萜的微生物转化
3.1 贝壳杉烷型二萜(Kauranes)的微生物转化 贝壳杉烷型二萜是一类具有重要生物活性的二萜类化合物,自然界以对映-贝壳杉烷型(ent-kauranes)化合物居多。此类化合物在医药和食品方面有着广泛的应用,有许多此类化合物的微生物转化研究报道。Fraga等[38]采用毛霉类M.plumbeus对从植物Sideritiscandicans分得的对映-贝壳杉二萜类化合物candidiol进行了生物转化,得到C-3和C-11位羟基化产物,以及一个C-6/11桥氧环化合物,并推测这个桥氧环化合物是由C-16/17形成的三元氧环开环形成的。该课题组又用M.plumbeus转化candidiol的C-4位羟基差向异构体,也得到发生相似桥氧环反应的产物,同时得到2个糖苷化产物[38],这是首次利用M.plumbeus对二萜类化合物进行糖苷化反应的报道。Candicandiol和epicandicandiol是2个C-7位羟基差向异构化的贝壳杉烷型二萜,利用该毛霉菌对它们进行微生物转化发现,2者转化产物主要区别在前者能得到9β-羟基化物,后者能得到3α-羟基化物,推测可能是由于C-7位羟基的立体方向影响了氧化酶在A环和B环的羟化行为[39]。
3.2 贝叶烷型二萜 (Beyeranes)的微生物转化 贝叶烷型二萜包括贝叶烷类及对映-贝叶烷类,在自然界多数以对映体的形式存在。对于该类二萜的生物活性文献报道较少,代表性化合物为异甜菊醇(isosteviol)及其C-3位取代的类似物,具有良好的昆虫拒食活性。Shwu-Jiuan Lin课题组采用多种微生物系统对异甜菊醇进行了微生物转化研究,得到多个非活性碳位点的羟基化衍生物[40-44]。当异甜菊酮通过Baeyer-Villiger反应生成酯后的产物(6),再用真菌班尼小克银汉霉C.bainieri进行微生物转化,可得到两个重排产物(7-8)和一个裂环产物(9),其结构经X射线单晶体衍射确定(见图4)[44]。为了得到更多结构新颖且具有生物活性的贝叶烷型化合物,该课题组将异甜菊醇经过碱水处理得到肟化产物,再经A.niger和犁头霉属的A.pseudocylindrospora进行微生物转化,不仅得到一定数量的C-1或C-7位羟基化衍生物,还得到含有内酰胺基团和腈基基团的衍生物[43,45]。以上研究提示,异甜菊醇C-8/13位桥环的结构改造可以结合化学反应与微生物转化法,能得到更多结构新颖、活性提高的贝叶烷型二萜。此外,异甜菊醇的生物转化产物7β-hydroxy-isosteviol以及11β、12β或17位发生羟基化的异甜菊醇具有抑制埃-巴二氏病毒抗原(Epetein-Barr virus early antigen)的活性[46]。
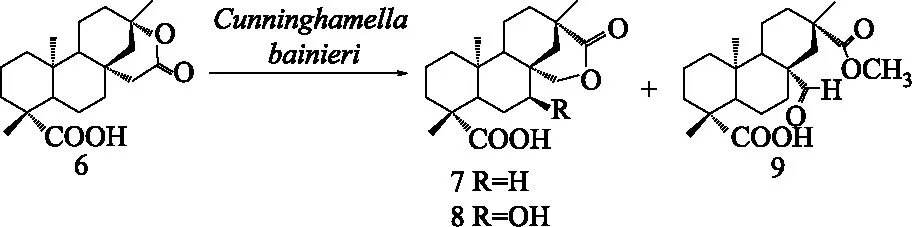
图4 贝叶烷二萜衍生物(6)经Cunninghamella bainieri转化得到的结构重排产物(7-8)和内酯环开环产物(9)Fig.4 Two rearrangement products(7-8)and a lactone ring-cleavage product(9) obtained by biotransformation of 6 with Cunninghamella bainieri
3.3 其他四环二萜的微生物转化 贝壳杉烷型、阿替生烷型(astisanes)、贝叶烷型和绰奇烷型(trachylobanes)二萜在生物合成和化学结构上有着紧密联系,四类结构在酸水条件下易通过碳正离子重排相互转换。其中,绰奇烷二萜与其他3种四环二萜最大的区别在于其C-12、C-13和C-16位形成三元碳环,严格说为五环二萜。有相关研究表明微生物产生的酶系可以促使四类二萜发生骨架转化。Fraga等用M.plumbeus对一个对映-绰奇烷二萜(trachinodiol,9)进行转化,得到一系列A环羟基化产物和一个对映-贝壳杉烷二萜(10),并推测该对映-贝壳杉烷二萜产物是通过开环、重排和氧化产生的(见图5)[47],说明了绰奇烷型与贝壳杉烷型二萜之间的转化。该重排过程与之前推测的毒马草属SideritisL.植物中对映-绰奇烷二萜与对映-贝壳杉烷二萜相互衍生的途径相似[47]。类似的,Leverrier等[48]用匍枝根霉R.arrhizus对木瓣树属植物Xylopiacaudata中分得的一个对映-绰奇烷二萜(ent-trachyloban-18-oic acid,11)进行转化,得到了3个对映-贝壳杉烷型二萜骨架的羟基化衍生物(12-14)。该结果进一步表明绰奇烷型二萜能经微生物酶发酵后可转化为贝壳杉烷型二萜(图6)。此外,还得到一个绰奇烷型骨架重排的化合物(15)(图6),该重排产物的三元环由C-12/13/16位重排至C-11/12/13位,此类二萜骨架是首次在自然界发现[48]。
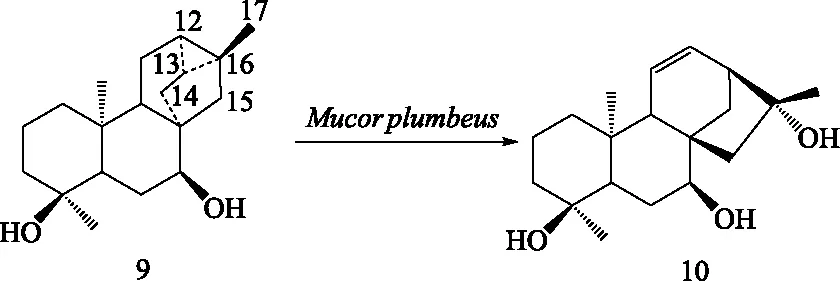
图5 绰奇烷二萜衍生物(trachinodiol,9)经Mucor plumbeus转化得到的结构重排产物(10)Fig.5 A rearrangement product(10)obtained by biotransformation of 9 with Mucor plumbeus
另有研究表明贝叶烷型二萜和贝壳杉烷型二萜经过微生物发酵后也能发生骨架转化。Chang等[41]用灰色链霉菌S.griseus和班尼小克银汉霉C.bainieri对骨架为对映-贝壳杉烷型二萜16α,17-环氧甜菊醇(steviol-16α,17-epoxide)进行转化,得到8个对映-贝叶烷型二萜羟基化衍生物。该研究表明,特定的微生物酶系能将贝壳杉烷型二萜转化为贝叶烷型二萜。
4 大环二萜的微生物转化
常见的大环二萜类骨架包括西松烷型(cembranes)、假白榄烷型(jatrophanes)、续随子烷型(lathyranes)、巴豆烷型(tiglianes)、瑞香烷型(daphnanes)、巨大戟烷型(ingenanes)、麻风树烷型(jatropholanes)及曼西烷型(myrsinanes)等,这类多元大环二萜类化合物从生源上绝大多数是从香叶基香叶醇磷酸酯衍生而成。大环二萜类衍生物多具有明显生理活性,如从大戟科植物中发现的巴豆烷型二萜具有显著的抗肿瘤和抗HIV病毒活性[49],一直是天然药物研究中的热点,但目前为止,对该类二萜的微生物转化研究报道较少。
假白榄烷二萜多数具有如羟基、酯、酮等氧化官能团,该类二萜主要分布在大戟科大戟属等植物中。此类二萜具有多种生物活性,最引人注目的是其逆转肿瘤细胞多药耐药性活性和P-蛋白抑制活性。Pertino等[50]用黑曲霉A.niger对从大戟科植物Jatrophaisabelli中分得的一个假白榄型二萜假白榄酮(jatrophone)进行微生物转化,得到其C-8/12闭环的产物,但该转化产物对人胃癌细胞AGS和人胚肺成纤维细胞MRC-5的细胞毒活性降低。
金钱松二萜是从土槿皮中分得的一系列结构独特的二萜类化合物,土槿皮PseudolaricisCortex为传统中药,为松科植物金钱松Pseudolarixkamefer的干燥根皮。该类二萜具有三环骨架,其中五元环与七元环反式稠合,并在稠合碳位置上含有一个内酯环。这类二萜化合物有明显的抗真菌、抗生育、抗血管生成等活性。Zhang等[51]用真菌球毛壳菌Chaetomiumglobosum对土槿皮乙酸(pseudolaric acid B,图6)进行微生物转化,分别得到18-酰基丙氨酸(pseudolaric acid B 18-oyl-alanine)和18-酰基丝氨酸(pseudolaric acid B 18-oyl-serine)取代的产物,并经X射线单晶体衍射确定其结构和绝对构型,不过其抗真菌活性要明显低于底物土槿皮乙酸。
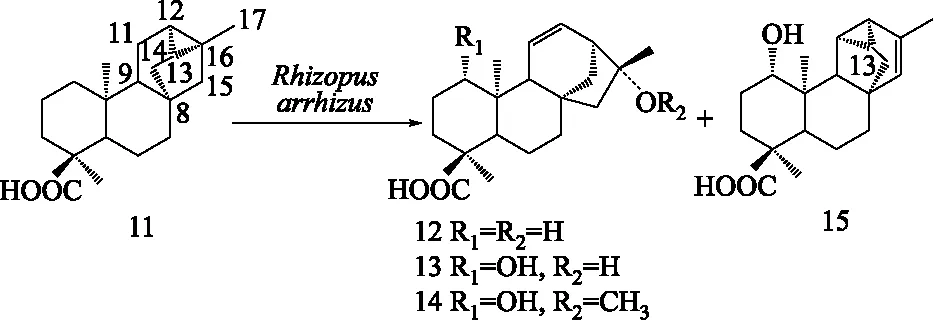
图6 对映绰奇烷二萜衍生物(11)经Rhizopus arrhizus转化得到的结构重排产物(12-15)Fig.6 Four rearrangement products(12-15)obtained by biotransformation of 11 with Rhizopus arrhizus
5 小结与展望
微生物转化是改变各种二萜衍生物底物结构的重要手段,其中最主要的修饰结构反应是区域选择性和立体选择性羟化反应,羟基化位置与构型是由底物结构特点和微生物体酶系共同决定的。不同微生物体系转化底物得到的产物数量和产率有很大不同,而且转化产物在转化体系下可进行多步的转化反应。通过微生物转化方法,几乎可实现在二萜衍生物的所有位置进行羟基化。这些羟基化产物不但增加了水溶性,而且为进一步的结构修饰提供活性位点。另一类重要的转化反应为重排反应,这种复杂的酶催化体系下的碳骨架重排结构为研究药物的构效关系以及各种二萜结构之间的生源关系提供了重要的科学素材。此外,通过微生物转化产物与底物在哺乳动物中的代谢产物比较,可对药物在人体内的代谢途径和产物进行预测,利用微生物转化制备相关代谢产物,具有成本低、重现性好、易批量制备等特点。
但是现阶段的微生物转化尚具有较大的盲目性。微生物转化主要还是通过底物与微生物混合体系共发酵方法进行生物转化。这个孵化过程变量多、体系复杂、难以进行分解研究,在合成上无法进一步阐述真正催化化学反应的酶系特点。加之菌株一旦发生变异,酶系类型也可能发生变化。因此,现阶段微生物转化产物并不能提前预测反应结果,更难以从底物合成目标转化产物。因此,为了增加生物合成效率,应增加对微生物转化菌株酶系的研究,利用多种生化手段,对转化酶系的分离、提纯、表征和功能进行研究,阐明底物在特定酶系下的转化过程和转化机制,最终实现微生物转化的机制清楚和目标可控的目标。
[1] Wani MC,Taylor HL,Wall ME,et al.Plant antitumor agents.VI.Isolation and structure of taxol,a novel antileukemic and antitumor agent from Taxus brevifoli[J].J Am Chem Soc,1971,93(9):2325-2327.
[2]左海军,李丹,吴斌,等.冬凌草的化学成分及其抗肿瘤活性[J].沈阳药科大学学报,2005,22(4):258-263.
[3]Ferreira MJU,Duarte N,Reis M,et al.Euphorbia and Momordica metabolites for overcoming multidrug resistance[J].Phytochem Rev,2014,13(4): 915-935.
[4]Zhou B,Zhang DY,Wu XM.Biological activities and corresponding SARs of andrographolide and its derivatives[J].Mini-Rev Med Chem,2013,13(2):298-309.
[5]Nabavi SM,Habtemariam S,Daglia M,et al.Neuroprotective effects of ginkgolide B against ischemic stroke:a review of current literature[J].Curr Topics Med Chem,2015,15(21):2222-2232.
[6]Loughlin WA.Biotransformations in organic synthesis[J].Biores Technol,2000,74(1):49-62.
[7]Mahato SB,Garai S.Advances in microbial steroid biotransformation[J].Steroids,1997,62(4):332-345.
[8]Parra A,Rivas F,Garcia-Granados A,et al.Microbial transformation of triterpenoids[J].Mini-Rev Org Chem,2009,6(4):307-320.
[9]Bhatti HN,Khera RA.Biotransformations of diterpenoids and triterpenoids:a review[J].J Asian Nat Prod Res,2014,16(1):70-104.
[10]Peters RJ.Two rings in them all:The labdane-related diterpenoids[J].Nat Prod Rep,2010(27),1521-1530.
[11]Aranda G,El-Kortbi MS,Lallemand JV.Microbial transformation of diterpenes:hydroxylation of sclareol manool and derivatives by Micrastur plumbeus[J].Tetrahedron,1991,47(39):8339-8350.
[12]Haridy MSA,Ahmed AA,Doe M.Microbiological transformation of two labdane diterpenes,the main constituents of Madia species,by two fungi[J].Phytochemistry,2006,67(14):1455-1459.
[13]Orden AA,Cifuente DA,Borkowski EJ,et al.Stereo- and regioselective hydroxylation of grindelic acid derivatives by Aspergillus niger[J].Nat Prod Res,2005,19(6):625-631.
[14]Lin SJ,Rosazza JPN.Microbial transformations of isocupressic acid[J].J Nat Prod,1998,61(7):922-926.
[15]Wang Y,Chen L,Zhao F,et al.Microbial transformation of neoandrographolide by Mucor spinosu (AS 3.2450)[J].Mol Catal B Enzym,2011,68(1):83-88.
[16]Deng S,Zhang BJ,Wang CY,et al.Microbial transformation of deoxyandrographolide and their inhibitory activity on LPS-induced NO production in RAW 264.7 macrophages[J].Bioorg Med Chem Lett,2012,22(4):1615-1618.
[17]He XJ,Wang YH,Hu H,et al.Novel bioconversion products of andrographolide by Aspergillus ochraceus and their cytotoxic activities against human tumor cell lines[J].J Mol Catal B:Enzym,2011,68(1):89-93.
[18]Rico-Martinez M,Medina FG,Marrero JG,et al.Biotransformation of diterpenes[J].Rsc Advances,2014,4(21):2046-2069.
[19]Choudhary MI,Mohammad MY,Musharraf SG,et al.Biotransformation of clerodane diterpenoids by Rhizopus stolonifer and antibacterial activity of resulting metabolites[J].Phytochemistry,2013(90):56-61.
[20]Peterson LA.Reactive metabolites in the biotransformation of molecules containing a furan ring[J].Chem Res Toxicol,2013,26(1):6-25.
[21]Mafezoli J,Oliveira MC,Paiva JR,et al.Stereo and regioselective microbial reduction of the clerodane diterpene 3,12-dioxo-15,16-epoxy-4- hydroxycleroda-13(16),14-diene[J].Nat Prod Commun,2014,9(6):759-762.
[22]Ding HX,Zhang ZC,Cao SN,et al.Transformation of multi-component ginkgolide into ginkgolide B by Coprinus comatus[J].BMC Biotechnol,2015(15):17.
[23]van Beek TA,Claassen FW, Dorado J,et al.Fungal biotransformation products of dehydroabietic acid[J].J Nat Prod,2007,70(2):154-159.
[24]Fraga BM,Hernández MG,Artega JM,et al.The microbiological transformation of the diterpenes dehydroabietanol and teideadiol by Mucor plumbeus[J].Phytochemistry, 2003,63(6):663-668.
[25]Hosny M,Johnson HA,Ueltschy AK,et al.Oxidation,reduction,and methylation of carnosic acid by Nocardia[J].J Nat Prod,2002,65(9):1266-1269.
[26]Kupchan SM,Court WA,DaileyJr RG,et al.Triptolide and tripdiolide,novel antileukemic diterpenoid triepoxides from Tripterygium wilfordii[J].J Am Chem Soc,1972,94(20):7194-7195.
[27]叶敏,宁黎丽,占纪勋,等.雷公藤内酯及蟾毒配基类化合物的生物转化研究进展[J].北京大学学报(医学版),2004,36(1):82-89.
[28]Chen Z,Li JA,Lin H,et al.Biotransformation of 14-deoxy-14-methylenetriptolide into a novel hydroxylation product by Neurospora crassa[J].J Biosci Bioeng,2013,116(2):199-202.
[29]马晓驰,果德安.中药活性成分生物转化的研究思路与方法[J].中国天然药物,2007,5(3):162-168.
[30]Sun JH,Yang M,Ma XC,et al.Microbial biotransformation of cryptotanshinone by Cunninghamella elegans and its application for metabolite identification in rat bile[J].J Asian Nat Prod Res,2009,11(6):482-489.
[31]Fraga BM,Hernández MG,González P,et al.The biotransformation of 18-hydroxy-9-epi-ent-pimara-7,15-diene by Gibberella fujikuroi[J].Phytochemistry,2000, 53(3):395-399.
[32]Fraga BM,Guillermo R,Hernandez MG,et al.Biotransformation of two ent-pimara-9(11),15-diene derivatives by Gibberella fujikuroi[J].J Nat Prod,2009,72(1):87-91.
[33]Severiano ME,Simao MR,Porto TS,et al.Anticariogenic properties of ent-pimarane diterpenes obtained by microbial transformation[J].Molecules,2010,15(12):8553-8566.
[34]Liu X,Chen RD,Xie D,et al.Microbial transformations of taxadienes and the multi-drug resistant tumor reversal activities of the metabolites[J].Tetrahedron,2012, 68(47):9539-9549.
[35]Liu X,Xie D,Chen RD,et al.A furantaxane with an unusual 6/8/6/5 ring system and potent tumor MDR reversal activity obtained via microbial transformation[J].Org Lett,2012,14(16):4106-4109.
[36]Dai JG,Qu RJ,Zou JH,et al.Structural diversification of taxanes by whole-cell biotransformation[J].Tetrahedron,2008,64(35):8102-8116.
[37]Li JH,Dai JG,Chen XG,et al.Microbial transformation of cephalomannine by Luteibacter sp[J].J Nat Prod,2007,70(12):1846-1849.
[38]Fraga BM,de Alfonso I,Gonzalez-Vallejo V,et al.Microbial transformation of two 15α-hydroxy-ent-kaur-16-ene diterpenes by Mucor plumbeus[J].Tetrahedron,2010,66(1):227-234.
[39]Fraga BM,Alvarez L,Suarez S.Biotransformation of the diterpenes epicandicandiol and candicandiol by Mucor plumbeus[J].J Nat Prod,2003,66(3):327-331.
[40]Hsu FL,Hou CC,Yang LM,et al.Microbial transformations of isosteviol[J].J Nat Prod,2002,65(3):273-277.
[41]Chang SF,Yang LM,Hsu FL,et al.Transformation of steviol-16r,17-epoxide by Streptomyces griseus and Cunninghamella bainieri[J].J Nat Prod,2006,69(10):1450-1455.
[42]Chang SF,Yang LM,Lo CH,et al.Microbial transformation of isosteviol and bioactivities against the glucocorticoid/ androgen response elements[J].J Nat Prod,2008,71(1):87-92.
[43]Chang SF,Chou BH,Yang LM,et al.Microbial transformation of isosteviol oxime and the inhibitory effects on NF-(B and AP-1 activation in LPS-stimulated macrophages[J].Bioorg Med Chem,2009,17(17):6348-6353.
[44]Chou BH,Yang LM,Chang SF,et al.Microbial transformation of isosteviol lactone and evaluation of the transformation products on androgen response element[J].J Nat Prod,2008,71(4):602-607.
[45]Chou BH,Yang LM,Chang SF,et al.Transformation of isosteviol lactam by fungi and the suppressive effects of its transformed products on LPS-induced NOS expression in macrophages[J].J Nat Prod,2011,74(6):1379-1385.
[46]Akihisa T,Hamasaki Y,Tokuda H,et al.Microbial transformation of isosteviol and inhibitory effects on Epstein-barr virus activation of the transformation products[J].J Nat Prod,2004,67(3):407-410.
[47]Fraga BM,Gonzalez-Vallejo V,Guillermo R.On the biotransformation of ent-trachylobane to ent-kaur-11-ene diterpenes[J].J Nat Prod,2011,74(9):1985-1989.
[48]Leverrier A,Martin MT,Servy C,et al.Rearranged diterpenoids from the biotransformation of ent-trachyloban-18-oic acid by Rhizopus arrhizus[J].J Nat Prod,2010,73(6):1121-1125.
[49]Wang HB,Wang XY,Liu LP,et al.Tigliane diterpenoids from the Euphorbiaceae and Thymelaeaceae families[J].Chem Rev,2015,115(9):2975-3011.
[50]Pertino M,Schmeda-Hirschmann G,Santos LS,et al.Biotransformation of jatrophone by Aspergillus niger ATCC 16404[J].Zeitschrift für Naturforschung B,2007,62(2):275-279.
[51]Zhang X,Ye M,Gong YJ,et al.Biotransformation of pseudolaric acid B by Chaetomium globosum[J].Process Biochem,2011,46(10):2064-2067.
(编校:王冬梅)
《中国生化药物杂志》征稿启事
创刊于1976年,面向海内外公开发行。
中文核心期刊,具有较高学术地位和权威性。
发表文章被美国《化学文摘》、《中国生物学文摘》、《中国药学文摘》等重要检索系统收录;是中国科技论文与引文数据库、中国期刊全文数据库、中国科技期刊数据库、中国学术期刊综合评价数据库、中国科学引文数据库、中文生物医学期刊文献数据库、中国生物学文摘数据库的来源期刊。
本刊主编由中国工程院院士,中国医学科学院副院长,北京协和医学院副校长詹启敏教授担任,编委会成员涵盖多学科人才,遍布全国一类医药学高等教育机构、科研机构和临床机构。
热忱欢迎从事药学、药理学、临床药理学、生物化学、医学免疫学、分子生物学、医学微生物学、细胞生物学、临床医学、生物医药技术等基础及相关临床医学专家、学者投稿。
本刊设置栏目有:基础研究(论著类)、临床与药物(论著类)、生化药物技术(论著类)和综述四大栏目,您的著述尽有发表空间。
投稿方式:
编辑部地址:北京市朝阳区芍药居38号楼3层(100029)
联系电话: 010-84280076-8711; 传真:010-84662099
投稿网站:www.cbcpharm.com “在线投稿/查稿”
杂志社监督邮箱:qiulei@cyberzone.cn
Research progress on microbial transformations of diterpenoids
WU Yi-qing, YU Jing-xiang, CHENG Zhi-hongΔ
(School of Pharmacy, Fudan University, Shanghai 201203, China)
Diterpenoids are important plant secondary metabolites, which contain 20 carbons. Many well-known drug molecules belong to diterpenoids, such as paclitaxel, andrographolides and ginkgolides. Diterpenoids are a research hotspot in natural product chemistry. Structural modification of diterpenoids by microbial transformations is an important approach for discovery of leading compounds of diterpenoids derivatives. This review article focuses on the microbial transformation of diterpenoids(Labdanes,Clerodanes,Ginkgolides;Abietanes,Pimaranes,Taxanes;Kauranes,Beyeranes;Jatrophanes,Pseudolaricis,et al) including different reaction types, the structure diversity of biotransformed products, and their biological activity changes between substrates and products.
diterpenoids; microbial transformation; labdanes; abietanes
吴亦晴,女,硕士在读,研究方向:中药成分的微生物转化,E-mail: yiqingwu13@fudan.edu.cn;程志红,通信作者,男,博士,副研究员,研究方向:中药成分的微生物转化,E-mail: chengzhh@fudan.edu.cn。
R284.3
A
10.3969/j.issn.1005-1678.2016.03.03
