结核分枝杆菌对巨噬细胞岩藻糖转移酶家族基因表达的影响
2016-07-18胡锋潘勤章晓联
胡锋,潘勤,章晓联
(武汉大学病毒学国家重点实验室/湖北省过敏及免疫相关疾病重点实验室/武汉大学医学研究院/ 武汉大学基础医学院 免疫学系,湖北 武汉 430071)
结核分枝杆菌对巨噬细胞岩藻糖转移酶家族基因表达的影响
胡锋,潘勤,章晓联Δ
(武汉大学病毒学国家重点实验室/湖北省过敏及免疫相关疾病重点实验室/武汉大学医学研究院/ 武汉大学基础医学院 免疫学系,湖北 武汉 430071)
目的 研究结核分枝杆菌标准株H37Rv(inactivated H37Rv, iH37Rv)刺激巨噬细胞RAW264.7细胞后,对岩藻糖转移酶家族中的10个糖基转移酶表达的影响。方法 用热灭活的iH37Rv刺激小鼠巨噬细胞系RAW264.7,用qRT-PCR(quantitative real-time polymerase chain reaction)检测iH37Rv分别刺激RAW264.7细胞0 h、4 h、8 h、12 h后对巨噬细胞中10个岩藻糖基转移酶的mRNA表达水平的影响。凝集素染色和流式细胞术检测岩藻糖转移酶对应的糖苷的表达变化。结果 iH37Rv分别刺激RAW264.7细胞0 h、4 h、8 h、12 h后,岩藻糖转移酶1(FUT1)基因的表达随着刺激时间的延长而逐步下调。凝集素染色和流式细胞术检测显示特异性结合岩藻糖转移酶-FUT1对应糖苷的小扁豆凝集素(lens culinaris agglutinin,LCA)在iH37Rv刺激巨噬细胞12 h后结合巨噬细胞上对应的糖苷的能力下降了4.6%。 结论 FUT1糖基转移酶在iH37Rv刺激巨噬细胞后发生下调,其有可能作为结核分枝杆菌感染的诊断分子标志和治疗新靶点。
结核分枝杆菌;巨噬细胞;糖基转移酶
结核病(tuberculosis)仍然是世界上传播得最广的传染性疾病之一,全世界大约有1/3的人口感染了结核分枝杆菌(Mycobacteriumtuberculosis, MTB)[1],在2012年有近130万人因感染了MTB而死亡[2],死亡的患者中大部分是由于感染了多重耐药性结核(multidrug resistant tuberculosis, MDR TB)、广谱耐药性结核(extensive drug resistant tuberculosis, XDR TB)或者同时感染了艾滋病毒[2]。MTB是结核病的主要致病原,患者在感染MTB后,可产生固有免疫应答和适应性免疫应答来清除MTB,而MTB在被患者体内的巨噬细胞吞噬后,部分细菌可因此躲避患者其他免疫杀伤而潜伏起来,在巨噬细胞中长期、缓慢地复制,最终导致巨噬细胞死亡[3-5]。
作为MTB最主要的宿主靶细胞,巨噬细胞是一种功能非常强大的细胞,在吞噬病原体后能分泌多种酶和免疫活性物质来杀伤病原体[6]。糖基转移酶作为糖基化修饰中重要的一环,专门负责催化糖基化反应,它们将活性糖基从糖基供体转移到糖基受体,并形成糖苷键[7],在真核生物的基因组中约有1%的基因编码糖基转移酶[8]。蛋白质糖基化参与免疫分子的包装及蛋白的降解和翻译的调控过程,与细菌、病毒的感染和肿瘤细胞的转移密切相关[9-11]。由于巨噬细胞糖基转移酶参与了免疫分子的加工过程,其本身的表达水平势必将影响免疫分子正常的结构和功能。有报道[12],糖基转移酶的表达水平的不同会影响巨噬细胞的功能和膜表面分子的表达。患者在接受了移植手术后,其体内的巨噬细胞高表达糖基转移酶2,6-ST(α-2,6-sialyltransferase),促进患者机体对移植物的杀伤[13]。糖基转移酶ST6GAL I(β-galactoside α 2-6-sialyltransferase-1)能调节巨噬细胞的凋亡[14]。
岩藻糖转移酶是一类功能强大且重要的酶,有报道岩藻糖转移酶表达的降低会影响单核细胞来源的巨噬细胞的形成[15]。岩藻糖转移酶FUT4在被沉默后,会通过影响基质金属蛋白酶2(matrix metallopeptidase 2,MMP-2)或MMP-9的表达或活性来抑制细胞的迁移[16]。研究[17]通过分别沉默FUT4、FUT7、FUT9这3个岩藻糖转移酶发现,FUT7和FUT4均参与了对人和小鼠的细胞因子PSGL-1(P-selectin glycoprotein ligand-1)的N端合成, 而FUT9被沉默后,白细胞的粘附功能大幅降低。
但目前国内外尚未有关于MTB感染巨噬细胞后对岩藻糖转移酶表达影响的相关研究,本课题旨在通过用灭活的MTB标准株H37Rv刺激小鼠巨噬细胞RAW264.7细胞系,研究其对岩藻糖转移酶家族中的10个糖基转移酶mRNA的表达的影响,以进一步探讨结核分枝杆菌感染的诊断分子标志物,并为探讨巨噬细胞在结核感染中的免疫调控机制提供一定线索。
1 材料与方法
1.1 材料
1.1.1 细菌和细胞:RAW264.7细胞(鼠巨噬细胞细胞系,由本实验室保存),H37Rv(结核分枝杆菌标准株,由武汉大学生物安全三级实验室经65 ℃,2 h灭活后提供)
1.1.2 试剂:DMEM培养基(Hyclone,美国);胎牛血清(Gibco,美国); Trizol Reagent(Invitrogen,美国);ReverseTra Ace 逆转录试剂盒(Toyobo,日本)。
1.1.3 仪器:SYBR Green Real-time PCR Master Mix(Toyobo,日本);实时荧光定量PCR仪(step one plus)(ABI 美国)。
1.2 方法
1.2.1 细胞培养及iH37Rv刺激:将RAW 264.7细胞接种于含有10%灭活胎牛血清和抗生素(100 U/mL青霉素和0.1 mg/mL链霉素)的DMEM高糖培养基中,在37 ℃、5% CO2的饱和湿度培养箱内培养。取处于对数生长期的细胞,以2×105细胞/孔的密度接种到无菌的6孔板,培养过夜,按2×106/mL的浓度加入适量的iH37Rv到每孔中,分别培养4、8、12 h,之后收获细胞,用无菌的PBS温和离洗5次除尽残留的培养基,加入适量的Trizol Reagent重悬。
1.2.2 qRT-PCR检测10个岩藻糖转移酶mRNA水平:采用Trizol法分别抽提iH37Rv刺激0、4、8、12 h的RAW264.7细胞的总RNA,用ReverseTra Ace 逆转录试剂盒,按照其说明书,取1 μg RNA,以随机引物反转录为cDNA;以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)做内参,实时荧光定量PCR法检测10个岩藻糖转移酶mRNA的表达。反应体系如下:2 μL cDNA、1μL上游引物(10μm)、1μL下游引物(10 μM)、10 μL 2×SYBR Green mix、6 μL无RNase水。反应条件如下:95 ℃ 1 min;95 ℃ 15s、58 ℃ 15 s、72 ℃ 45 s,后3步40次循环。按ΔΔCT = 2-(Cttarget gene-CtGAPDH)计算。实验重复3次。
1.2.3 凝集素染色和流式细胞术检测:以细菌:细胞=10:1的比例加入适量的iH37Rv刺激RAW264.7细胞12 h,收获细胞,用无菌的PBS温和离洗3次,调整细胞浓度至106/mL左右,加入生物素标记的LCA凝集素,4 ℃孵育30 min,用无菌的PBS温和离洗3次,加入FITC标记的链霉亲和素,4 ℃孵育1 h,用无菌的PBS温和离洗1次,上流式细胞仪检测,实验重复3次。

2 结果
2.1 iH37RV刺激RAW264.7细胞后差异表达的岩藻糖转移酶的筛选与鉴定 根据NCBI中公布的10个岩藻糖转移酶的序列设计的引物见表1,采用qRT-PCR检测10个岩藻糖转移酶mRNA的表达,结果显示:iH37Rv分别刺激RAW264.7细胞0、4、8、12 h后,FUT1的mRNA的表达水平随着刺激时间的延长而逐步下调,12 h时FUT1 mRNA的表达下降为未刺激组(即0 h组)的0.02倍; 其余的糖基转移酶的表达变化与时间点无相关性。iH37Rv刺激12h后,FUT4和FUT的表达上调,FUT9的表达下调。见图1、表2。
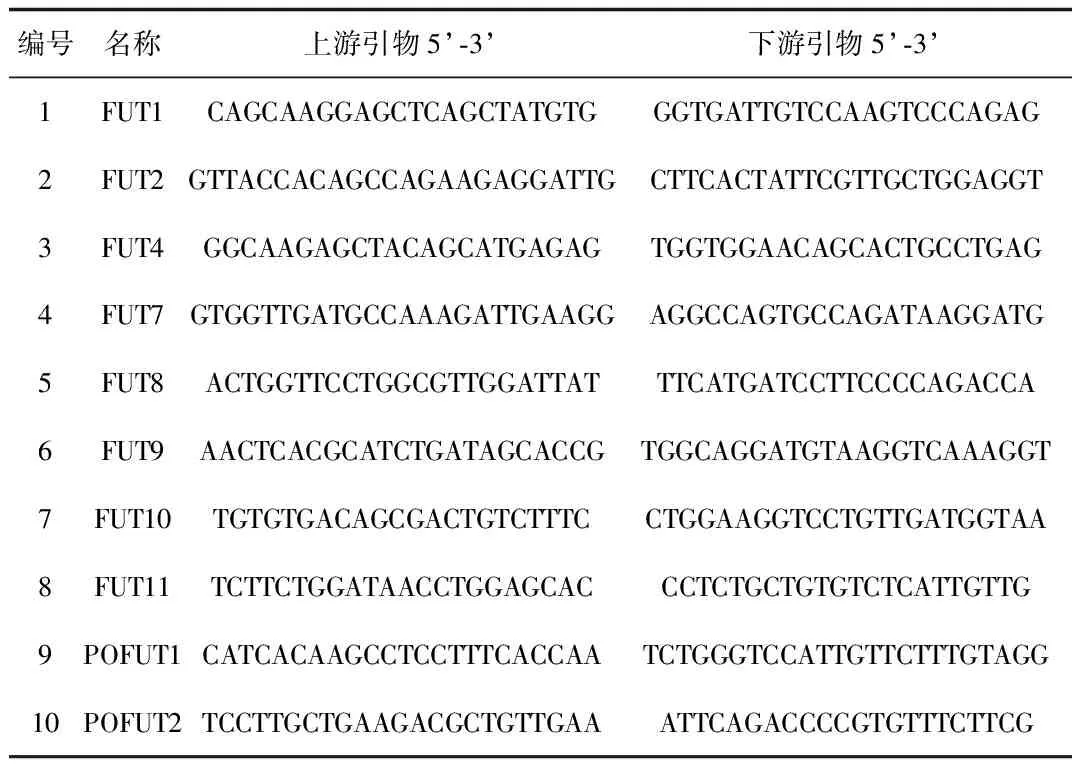
表1 10个小鼠岩藻糖转移酶的引物
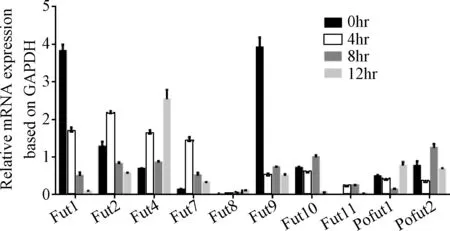
图1 iH37RV刺激RAW264.7细胞后10个岩藻糖转移酶的mRNA表达的变化Fig.1 Measurement of mRNA expressions of 10 kinds of fucosyltransferases in iH37Rv stimulated RAW264.7 ±s,n=3)
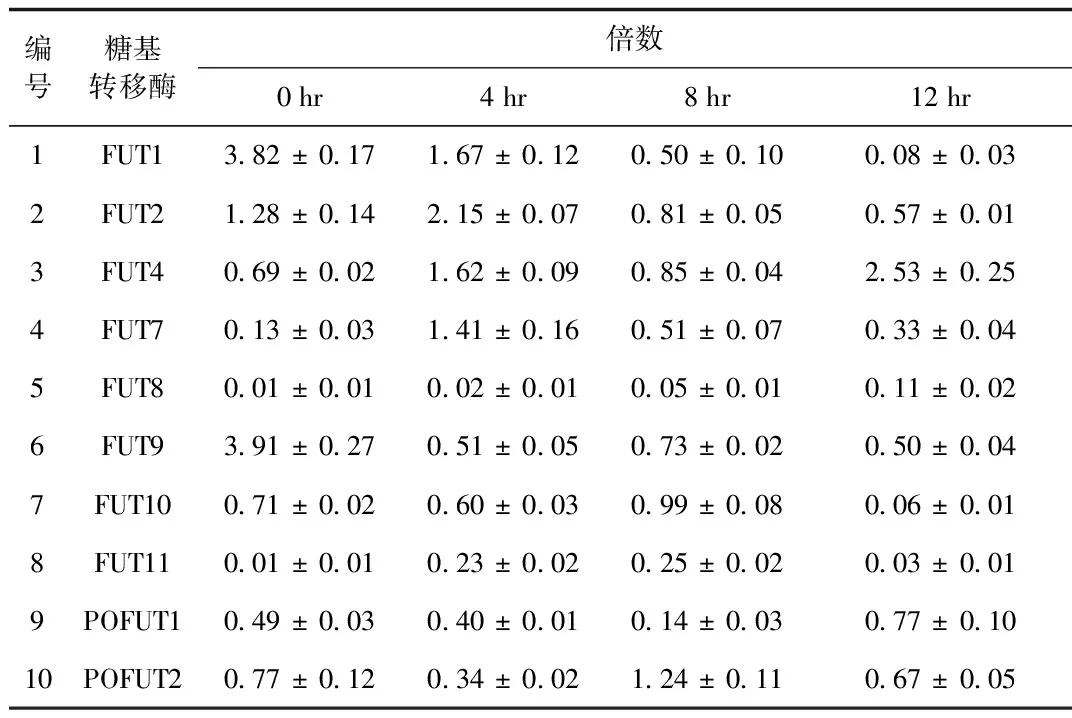
编号糖基转移酶倍数0hr4hr8hr12hr1FUT13 82±0 171 67±0 120 50±0 100 08±0 032FUT21 28±0 142 15±0 070 81±0 050 57±0 013FUT40 69±0 021 62±0 090 85±0 042 53±0 254FUT70 13±0 031 41±0 160 51±0 070 33±0 045FUT80 01±0 010 02±0 010 05±0 010 11±0 026FUT93 91±0 270 51±0 050 73±0 020 50±0 047FUT100 71±0 020 60±0 030 99±0 080 06±0 018FUT110 01±0 010 23±0 020 25±0 020 03±0 019POFUT10 49±0 030 40±0 010 14±0 030 77±0 1010POFUT20 77±0 120 34±0 021 24±0 110 67±0 05
2.2 凝集素染色和流式细胞仪检测iH37RV刺激后RAW264.7细胞表面岩藻糖转移酶对应的糖蛋白表达的变化 通过荧光FITC标记的LCA凝集素染色结果显示:凝集素LCA结合iH37Rv刺激后的巨噬细胞中岩藻糖转移酶催化的糖配体的能力从91.3%下降到86.7%,结合能力下降了4.6%。荧光强度的变化也显示iH37Rv刺激12 h后,LCA结合巨噬细胞上对应的糖配体的能力下降。见图2。
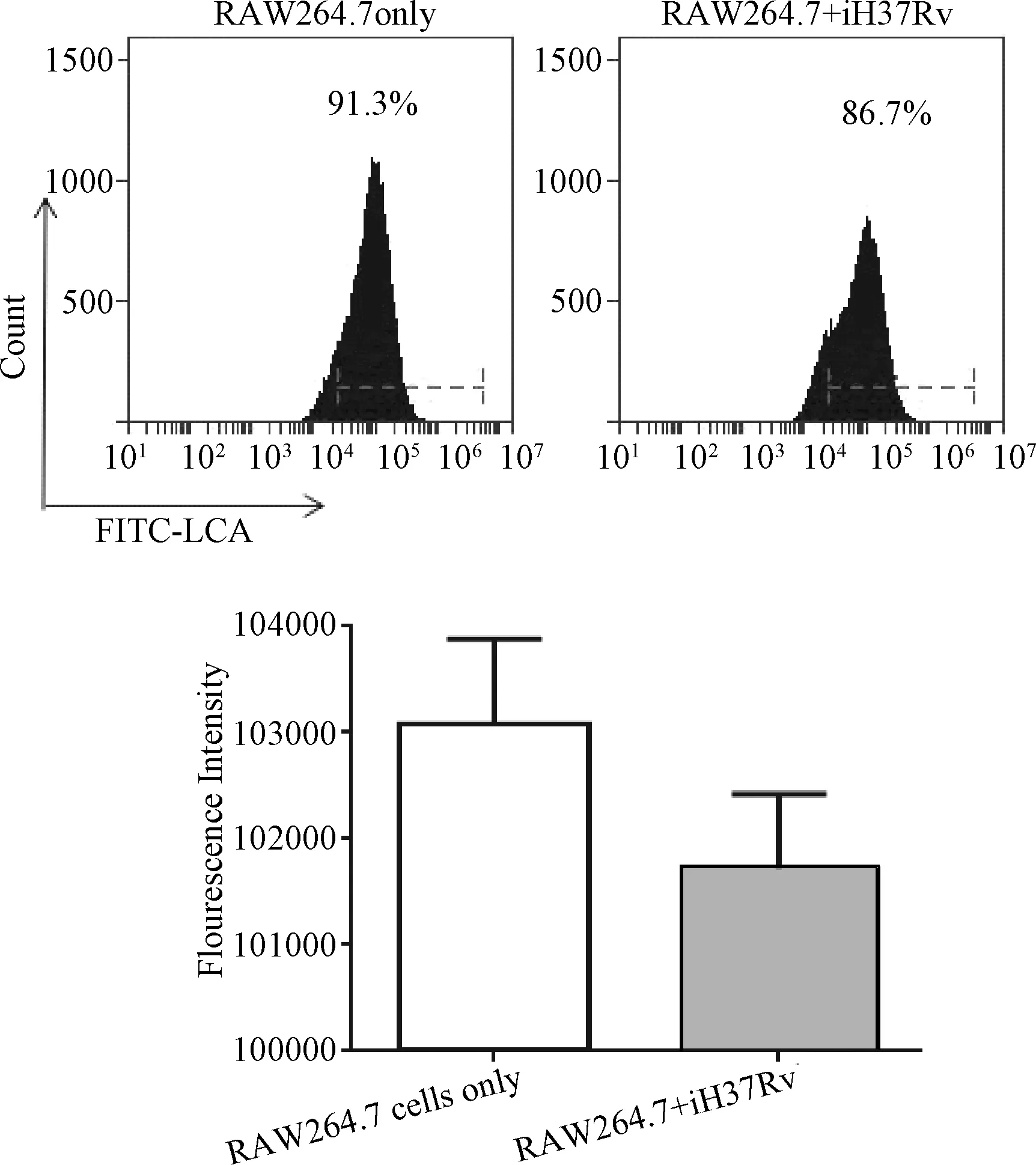
图2 iH37RV刺激RAW264.7细胞后LcA凝集素结合RAW264.7细胞表面糖配体的结合力的变化Fig.2 Expression levels assessed by lectin binding analysis of membrane glycoproteins of fucosyltransferases when RAW264.7 cells were stimulated by iH37Rv
3 讨论
结核病作为一种潜伏性疾病,其发病是一个长期而缓慢的过程,结核分枝杆菌在进入人体后,仅在少数人中发展为活动性结核,而在大部分的宿主中潜伏下来[18],当宿主的免疫力低下时,发展为活动性结核的几率增加,合并感染HIV的患者发展为活动性结核的几率随着感染年数的增长,每年增加10%[19-20]。
结核分枝杆菌在人体内的主要宿主是巨噬细胞,正是因为巨噬细胞的吞噬,结核分枝杆菌能躲避其他免疫途径的攻击,而结核分枝杆菌在巨噬细胞内存活、逃逸巨噬细胞的杀伤的具体分子机制尚未明确。在结核分枝杆菌进入巨噬细胞后,巨噬细胞的糖基转移酶的表达及活性均发生了改变,本研究拟通过研究这些糖基转移酶,探讨结核病逃逸巨噬细胞杀伤的分子机制。
有报道称,FUT1的表达降低会促进感染[21],这与本研究结果一致。有研究称[22],FUT1能促进血管的生成并能调节炎症因子ICAM-1的表达,有报道称[23],FUT1还参与了MUC-1和整合素等粘附分子的合成和结构调整,FUT1在血管生成、细胞粘附中发挥重要调节作用,并参与调节类风湿关节炎患者的成纤维细胞的增殖[24],FUT1被沉默后会对细胞的粘附及复制产生负面影响[25],这说明FUT1在细胞粘附中发挥了非常重要的作用,而免疫系统在发挥功能时,免疫细胞需要通过粘附分子与病原微生物或者靶细胞相接触,FUT1的表达的下调可能会影响免疫细胞正常的细胞粘附功能和某些炎症因子的表达,从而影响机体抗感染的免疫应答水平。还有报道称FUT1的存在对于细胞的内吞作用必不可少[26],而本研究表明iH37Rv刺激巨噬细胞12 h后,其FUT1的表达是下调的,这说明iH37Rv导致巨噬细胞的FUT1下调可能会影响巨噬细胞正常的吞噬功能,从而使结核分枝杆菌持续刺激机体,导致巨噬细胞聚集和更多的巨噬细胞被结核分枝杆菌感染。
本研究发现RAW264.7细胞受到iH37Rv刺激后,随着刺激时间的延长,而FUT1的表达逐步下调,说明FUT1这个岩藻糖转移酶可能在RAW264.7细胞对抗H37Rv的感染中发挥了重要作用,从而有作为治疗结核新靶点的潜力,下一步将研究iH37Rv刺激与FUT1表达变化的内在关系和具体的分子机制,以及FUT1在H37Rv感染中的具体功能,并在结核病患者的临床血液样本中验证,以期找到结核感染的诊断新分子标志物以及治疗结核感染的新药物靶点。
[1] Guideline. Nutritional care and support for patients with tuberculosis[M].Geneva: World Health Organization,2013.
[2]Alderwick LJ, Lloyd GS, Ghadbane H, et al. The C-terminal domain of the Arabinosyltransferase Mycobacterium tuberculosis EmbC is a lectin-like carbohydrate binding module[J]. PLoS Pathog, 2011,7(2):e1001299.
[3]Xiong X, Zhang HM, Wu TT, et al. Titer dynamic analysis of D29 within MTB-infected macrophages and effect on immune function of macrophages[J]. Exp Lung Res, 2014, 40(2):86-98.
[4]Danelishvili L, Everman J, Bermudez LE. Mycobacterium tuberculosis PPE68 and Rv2626c genes contribute to the host cell necrosis and bacterial escape from macrophages[J]. Virulence, 2015(25):1-10.
[5]Chandra P, Ghanwat S, Matta SK, et al. Mycobacterium tuberculosis Inhibits RAB7 Recruitment to Selectively Modulate Autophagy Flux in Macrophages[J]. Sci Rep, 2015(5):16320.
[6]Krapp S, Mimura Y, Jefferis R, et al. Structural analysis of human IgG-Fc glycoforms reveals a correlation between glycosylation and structural integrity[J].J Mol Biol, 2003, 325(5):979-989.
[7]Coutinho PM, Deleury E, Davies GJ, et al. An evolving hierarchical family classification for glycosyltransferases[J].J Mol Biol, 2003,328(2):307-317.
[8]Gan Y, Guo S. Controlling strategy of dormant Mycobacterium tuberculosis[J].Chin Med J(Engl), 2014,127(18):3316-3321.
[9]Kim YS, Yoo HS, Ko JH. Implication of aberrant glycosylation in cancer and use of lectin for cancer biomarker discovery[J].Protein Pept Lett, 2009,16(5):499-507.
[10]Taniguchi N, Korekane H. Branched N-glycans and their implications for cell adhesion, signaling and clinical applications for cancer biomarkers and in therapeutics[J].BMB Rep, 2011,44(12):772-781 .
[11]Takahashi M, Kuroki Y, Ohtsubo K, et al. Core fucose and bisecting GlcNAc, the direct modifiers of the N-glycan core: their functions and target proteins[J]. Carbohydr Res, 2009, 344(12):1387-1390.
[12]Maeda A, Kawamura T, Nakahata K, et al. Regulation of macrophage-mediated xenocytotoxicity by overexpression of alpha-2,6-sialyltransferase in swine endothelial cells[J]. Transplant Proc, 2014, 46(4):1256-1258.
[13]Trottein F, Schaffer L, Ivanov S, et al. Glycosyltransferase and sulfotransferase gene expression profiles in human monocytes, dendritic cells and macrophages[J]. Glycoconj J, 2009, 26(9):1259-1274.
[14]Liu Z, Swindall AF, Kesterson RA, et al. ST6Gal-I regulates macrophage apoptosis via α2-6 sialylation of the TNFR1 death receptor[J]. J Biol Chem, 2011,286(45):39654-39662.
[15]Cullen P, Mohr S, Brennhausen B, et al.Downregulation of the selectin ligand-producing fucosyltransferases Fuc-TIV and Fuc-TVII during foam cell formation in monocyte-derived macrophages[J]. Arterioscler Thromb Vasc Biol, 1997,17(8):1591-1598.
[16]Hu Y, Blair JD, Yuen RK, et al. Genome-wide DNA methylation identifies trophoblast invasion-related genes: Claudin-4 and Fucosyltransferase IV control mobility via altering matrix metalloproteinase activity[J].Mol Hum Reprod, 2015, 21(5):452-465.
[17]Buffone A Jr, Mondal N, Gupta R, et al. Silencing α1,3-fucosyltransferases in human leukocytes reveals a role for FUT9 enzyme during E-selectin-mediated cell adhesion[J]. J Biol Chem, 2013,288(3):1620-1633.
[18]Mariotti S, Pardini M, Gagliardi MC, et al. Dormant Mycobacterium tuberculosis fails to block phagosome maturation and shows unexpected capacity to stimulate specific human T lymphocytes[J]. J Immunol, 2013,191(1):274-282.
[19]Joshi RR, Barchha A, Khedkar VM, et al. Targeting dormant tuberculosis bacilli: results for molecules with a novel pyrimidone scaffold[J]. Chem Biol Drug Des, 2015, 85(2):201-207.
[20]Collins HL, Kaufmann SH. Prospects for better tuberculosis vaccines[J].Lancet Infect Dis, 2001, 1(1):21-28.
[21]Wang SJ, Liu WJ,Yang LG, et al. Effects of FUT1 gene mutation on resistance to infectious disease[J]. Mol Biol Rep, 2012, 39(3):2805-2810.
[22]Amin MA, Campbell PL, Ruth JH, et al. A key role for Fut1-regulated angiogenesis and ICAM-1 expression in K/BxN arthritis[J]. Ann Rheum Dis, 2015,74(7):1459-1466.
[23]López-Ferrer A, de Bolós C. The expression of human FUT1 in HT-29/M3 colon cancer cells instructs the glycosylation of MUC1 and MUC5AC apomucins[J]. Glycoconj J, 2002,19(1):13-21.
[24]Isozaki T, Ruth JH, Amin MA, et al. Fucosyltransferase 1 mediates angiogenesis, cell adhesion and rheumatoid arthritis synovial tissue fibroblast proliferation[J]. Arthritis Res Ther, 2014,16(1):R28.
[25]Palumberi D, Aldi S, Ermini L, et al. RNA-mediated gene silencing of FUT1 and FUT2 influences expression and activities of bovine and human fucosylated nucleolin and inhibits cell adhesion and proliferation[J]. J Cell Biochem, 2010,111(1):229-238.
[26]Sasamura T, Ishikawa HO, Sasaki N, et al. The O-fucosyltransferase O-fut1 is an extracellular component that is essential for the constitutive endocytic trafficking of Notch in Drosophila[J]. Development, 2007,134(7):1347-1356.
(编校:谭玲)
Influence ofMycobacteriumtuberculosisstimulation on the expression of fucosyltransferases in macrophages
HU Feng, PAN Qin, ZHANG Xiao-lianΔ
(The State Key Laboratory of Virology/Hubei Province Key Laboratory of Allergy and Immunology/Medical Rresearch Institute, Wuhan University/Department of Immunology, Wuhan University School of Medicine, Wuhan 430071, China)
ObjectiveTo study afterMycobacteriumtuberculosis(MTB) H37Rv stimulation on mouse macrophage RAW 264.7 cell lines, the effect on the expression of Fucose transfer 10 glycosyl transferase enzyme family.MethodsRAW264.7 cell lines were treated with heat inactivated H37Rv(iH37Rv) stimulation for 0 h, 4 h, 8 h and 12 h, qRT-PCR was used to measure the expressions of mRNA of fucosyltransferases. Lectin staining and flow cytometry were used to examine the binding ability of lectin Lens culinaris agglutinin(LCA)to glycoprotein ligand by fucosyltransferase on macrophages.ResultsThe expression of FUT1 were found progressively decreased in RAW 264.7 cells at different time points of iH37Rv stimulation and the macrophage binding ability of lectin LCA which specifically binds to glycoprotein ligand by fucosyltransferase decreased 4.6% after 12 h of iH37Rv stimulation.ConclusionThe expression of FUT1 in macrophages decrease after iH37Rv stimulation and thus FUT1 has potentials as a diagnosis molecular marker or drug target for tuberculosis.
Mycobacteriumtuberculosis; Macrophages; glycosyltransferases
国家重大传染病专项(2012ZX10003002-015);国家自然科学基金项目(31221061,31270176,81471910,31370197,21572173)和湖北省医学领军人才项目(523-276003)
胡锋,男,硕士,研究方向:感染与分子免疫,E-mail:fenghu5818@163.com;章晓联,通信作者,女,博士,二级教授,研究方向:病原微生物糖生物学和感染免疫,E-mail:zhangxiaolian@whu.edu.cn。
S852.61
A
10.3969/j.issn.1005-1678.2016.03.05
