干细胞龛位调控皮肤上皮干细胞增殖与分化机制的研究进展
2016-07-18公美华杨大平
隋 冰, 公美华, 杨大平
综 述
干细胞龛位调控皮肤上皮干细胞增殖与分化机制的研究进展
隋 冰, 公美华, 杨大平
胚胎干细胞是产生并分布在人体许多器官的多潜能子代干细胞,后者即成体干细胞,是维持组织平衡、细胞更新和修复损伤的先决条件。干细胞的数量、分裂、增殖、分化等是干细胞内因素和周围的微环境提供的胞外因素所共同调控的,这种干细胞的微环境,被称为干细胞龛位。龛位不仅是干细胞生理所在的位置,当干细胞被移出正常的细胞微环境时,干细胞丧失自我更新的潜力,也是来自微环境的信号能够直接决定干细胞子代的命运。笔者就干细胞龛位调控皮肤上皮干细胞增殖分化及皮肤老化的机制进行综述。
上皮干细胞; 间充质干细胞; 短暂扩充细胞; Wnt/β-catenin信号通路; 龛位
发育生物学的一个普遍原则是,胚胎干细胞是产生并分布于人体多个器官的多潜能子代干细胞,后者即成体干细胞,是维持组织平衡、修复损伤和内源性细胞更新的先决条件[1]。对成体干细胞最初的研究重点是快速更新的组织,如骨髓和上皮细胞组织,或富含干细胞的器官,因为这些干细胞承担未来再生医学的应用潜力[2]。
1 上皮干细胞
上皮干细胞主要位于表皮增殖单位(epidermal proliferative unit, EPU)、毛囊隆突区(follicle bulge)及基底细胞层[3-4]。上皮干细胞在毛囊再生中起重要作用,然而贴近基底膜的干细胞涉及滤泡表皮的更新。皮脂腺通过每个腺体基底的干细胞维持更新,但是这些干细胞的龛位仍在很大程度上是未知。皮肤的平衡是由位于内层真皮的间充质干细胞和位于最外层表皮的表皮干细胞共同维持的。皮肤干细胞的数量减少和功能受损与皮肤平衡失调有关(如皮肤过早老化和皮肤癌)[5]。
上皮干细胞的表面标记物是Integrin β-1(+)、Keratin 19(+)、Keratin 14(-)、Keratin 10(-)。上皮干细胞一般位于毛囊Bulge区或基底层,创伤后应用合成型人上皮生长因子后,上皮干细胞遍布棘层、颗粒层、基底层。而未应用rhEGF的创面,上皮干细胞位于基底层[6]。
在自体细胞治疗中的一个关键的问题是干细胞的提取时间。许多公认的目标疾病随着年龄增大而发病,来自动物模型的研究表明,干/祖细胞库随着年龄的增长稳步下降。一些研究称啮齿类动物和人类的皮肤来源的前体细胞(skin-derived precursor, SKP)具有产生神经和中胚层细胞子代的能力。这种容易获取的多能细胞群具有应用于神经退行性疾病的细胞治疗潜力。然而,我们对人类SKPs的时空性和细胞表型仍然缺乏清晰的认识。人类SKPs的分化潜能随着年龄的增长急剧下降,当要从老年人皮肤获取SKPs时,细胞分离、扩增、分化都很难。因此,应在生命早期获取和保存SKPs细胞库,用于年老后目标疾病的治疗[7]。
2 短暂扩充细胞
毛囊隆突区是上皮干细胞最集中的部位。在毛发生长周期内,隆突区最近端毛囊从休止期转变为新的生长期时,1个上皮干细胞在经过有丝分裂后形成1个上皮干细胞和1个短暂扩充细胞(transit-amplifying cell, TA),两者都位于基底层。TA的主要功能是增加由1个干细胞分裂产生分化细胞的数量。如果1个TA能够分裂3次,那么每个干细胞只需要分裂1次,产生1个干细胞和8个分化细胞。TA的最终任务是分化,离开基底膜,不断向棘层、颗粒层、角质层迁移。
老化上皮是TA动力学,而不是干细胞动力学维持稳定的。一直认为,缓慢的上皮干细胞增殖率是老化的表皮愈合速度缓慢的原因。而MC Winter等(2009年)的研究证明了上皮干细胞动力学是保持稳定的。证实是TA的补偿行动改变老化的皮肤,是减缓伤口愈合的主要因素。A Charruyer等(2009年)研究表明,将老化的上皮干细胞放置到新生上皮干细胞所处的实验环境中,老化TA会改变其动力学特征。上皮干细胞龛位是干细胞的成活和维持功能必不可少的因素,如果龛位的成分长期不足,将无法维持组织再生。有研究表明,上皮干细胞和TA能在短期内快速再生上皮组织,真皮细胞和基底膜特殊的成分。但有关上皮保持稳定是干细胞固有特性重要,还是龛位的影响更为重要,目前尚未明确。
3 干细胞龛位
3.1 干细胞龛位假说 干细胞龛位假说(stem cell niche hypothesis)起源于对成体干细胞,如造血干细胞的观察,当干细胞被移出正常的细胞环境时,干细胞丧失自我更新的潜力,而来自微环境的信号能够直接决定干细胞子代的命运。干细胞龛位假说指出,特定的干细胞自我更新信号来源于龛位。如果干细胞龛位的空间只能容纳1个子代细胞,其他的子代不能留在龛位,可能后者会因为缺乏自我更新信号而分化为成体细胞。如果龛位的空间可以容纳2个子代细胞,或相邻的龛位是空的,那么这2个子代细胞都可以保留干性(R Schofield, 1978年)。其次干细胞经过细胞分裂后将2个子代细胞置于不同的微环境中,可能是微环境通过细胞外信号作用于子代细胞,而导致2个子代细胞不同的命运。干细胞的数量、分裂、自我更新、分化等是由干细胞内因素和干细胞龛位提供的胞外因素所共同调控的[8]。
3.2 干细胞龛位的组成 ⑴间质支持细胞,包括细胞-细胞间黏附因子,分泌可溶性因子,其位于干细胞邻近处。⑵细胞外基质蛋白,作为干细胞的铆钉(anchor),构成一个机械式支架单元,用于传输干细胞信号。⑶携带营养物质和来自其他器官生态位系统信号的血管,也参与循环内干细胞的招募和干细胞归巢。⑷有利于动员干细胞离开其龛位的神经输入和来自不同器官系统的整合信号。表1为鼠皮肤内干细胞龛位的细胞及分子成分[9],这些干细胞的龛位仍在很大程度上是未知的。
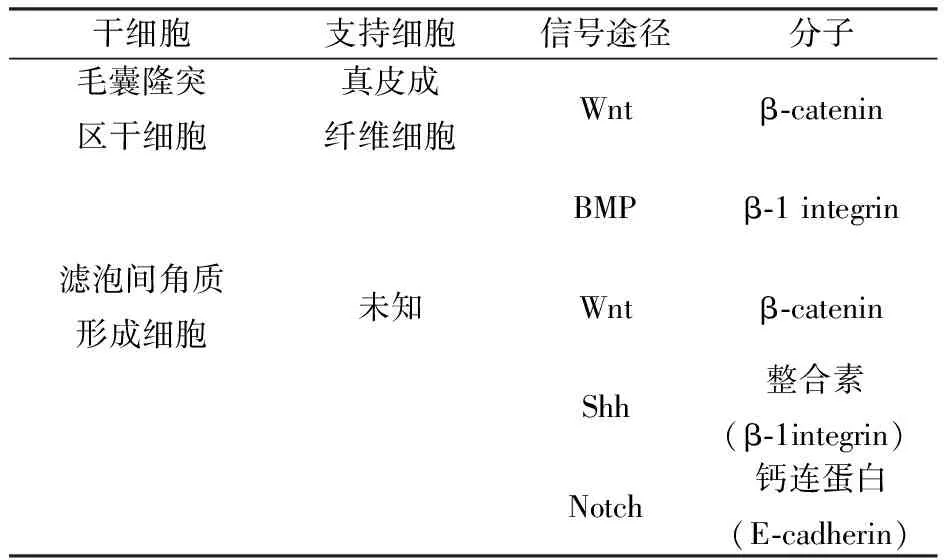
表1 小鼠皮肤内干细胞龛位的细胞及分子成分
人体大致有1014个细胞,一些细胞是心肌细胞,一些是肝脏、肾脏、神经、肌肉细胞等。相同的祖细胞在发育过程中经历不同的命运。这些细胞所在的微环境提供的信号决定这些细胞的命运,指导它们在相应的时间形成不同类型的细胞。这些信号通过细胞-细胞传递,经细胞膜传导进入细胞核,激活特定的基因。一些基因对于这些信号起反应,一些基因对这些信号无反应。几种信号途径指导胚胎的发育,其中特别重要的有:Notch、TGF-β、Wnt、Hedgelog,这4种信号通路或以跨膜受体命名,或以受体分子命名,在多细胞生物体内高度保守。这些通路调控基因表达程序,以便具有特定命运的细胞在正确的时间和正确的地点而产生正确的子代细胞,后者表现出不同的形态[9]。
已经提出毛囊隆突(follicular bulge)的干细胞龛位,其中涉及毛囊形成的所有分化细胞,如外根鞘、内根鞘和毛干。毛囊隆突(Bulge)沿着外根鞘定位,与滤泡间表皮相邻。维持滤泡间表皮的干细胞位于表皮基底,分裂产生短暂扩充细胞,后者经过终期分化,迁移至皮肤表面。滤泡间表皮干细胞呈斑点状,由短暂扩充细胞包绕,形成滤泡间表皮干细胞内在联系网[9]。
3.3 Wnt/β-catenin在毛囊形成中的作用 Wnt/β-catenin信号通路控制许多细胞过程,如细胞增殖、分化、细胞命运、迁移,且在胚胎发育过程中起着至关重要的作用[10]。目前已知19个小鼠的WNT基因,其结合Frizzled(Fz)家族受体,其中10个Fz受体已经在小鼠上得以证实,还有一些结合低密度脂蛋白相关的受体。配体和受体结合激活不同的下游通路,如Wnt/β-catenin,Wnt /planar和Wnt/Ca2+[11]。同时,也发现了几个调节Wnt信号的分泌型蛋白,包括DKK家族,secretory frizzled-related proteins (sFRPs)、Wnt抑制因子-1(WIF-1)。经典的Wnt信号由多功能蛋白β-catenin控制。正常情况下,β-catenin与糖原合成酶激酶(glycogen synthase kinase)-3β(GSK-3β)、Axin、腺瘤性息肉病-相关抑制蛋白(adenomatous polyposis coli)组成的复合物结合。胞质内的β-catenin通过GSK-3β的丝氨酸磷酸化致其泛素化,且通过蛋白酶体的降解,从而保持胞质和核内低水平的β-catenin。
Wnt/β-catenin信号对于不同的组织,产生不同的效果:在造血系统或小肠内,Wnt/β-catenin是调节干细胞自我更新和增殖,是重要的调节者。然而在皮肤中,Wnt/β-catenin会促进毛囊前体细胞分化。在哺乳动物的脑中,通过Wnt信号过度表达β-catenin,会导致神经元干细胞的数量扩增。在胚胎发育的过程中构建上皮的完整性是一个复杂的过程,在生命周期中通过上皮干细胞维持皮肤完整性。虽然Wnt调控正常的上皮干细胞更新,但异常的Wnt信号会促发肿瘤形成。RM Castilho等(2009年)研究表明,上皮干细胞可能被赋予保护性机制,在增殖通路持续性刺激激活mTOR时,造成细胞衰竭,同时抑制肿瘤形成。
胚胎期单层上皮可以分层形成上皮,也可以发生Wnt信号应答形成毛囊。出生后,干细胞继续有差异地应答Wnt信号以维持组织长期的动态平衡。Tcf3是毛囊干细胞的可靠表面标记物。胚胎祖细胞和出生后的毛囊干细胞都表达Tcf3和Tcf4,Tcf3和Tcf4是转录激活子或抑制子。皮肤缺乏Tcf3和Tcf4的后果为:组织学显示毛囊开始生成,但在随后出现毛囊生长缺陷。此外,虽然表皮组成包括棘层、颗粒层、角质层等,它通常比正常薄,基底细胞呈扁平状,而不是柱状,与β-catenin不足的结果部分重叠。这说明TCF有长期维持上皮和毛囊自我更新和创伤修复方面的作用,也表明TCF蛋白质谱系既有Wnt信号依赖性,也有独立于Wnt信号的途径[12]。
2008年,Lo Celso等研究表明,β-catenin作为Wnt信号通路中重要因子,其过度表达却能促进毛囊数量增加。毛囊隆突区干细胞的缺失是皮肤对β-catenin缺失的最早反应[13]。在新生毛发过程中,β-catenin在毛囊和表皮基底层之间转导,诱导毛囊干细胞生成新生毛发,而抑制皮脂腺分化。
Wnt信号与大多数皮肤疾病相关,如炎症、肿瘤、创伤修复、干细胞生物学和皮肤老化相关。但是,目前仍有很多Wnt通路未知的问题,特别是其在人类疾病中的作用。
4 脂肪组织对皮肤组织再生功能及毛发周期的影响
Mojallal等[14]研究结果,注射过脂肪的真皮层厚度增加,胶原纤维增加,并且局部新生血管增加。Covarrubias等[15]研究显示,自体脂肪颗粒移植后真皮层增厚,可新生胶原蛋白,增加局部血流量。这些实验推断出自体脂肪移植到皮肤具有提高皮肤组织再生功能。Festa等[16]研究认为,真皮内脂肪组织的动态变化与快速的毛囊生长周期变化一致。在毛发生长中期,激活脂肪系细胞增殖程序,使得在毛发生长终止期及毛发生长初期,脂肪前体细胞的数量增加。在以Azip鼠(不含成熟脂肪细胞,但有脂肪前体细胞及和野生型大鼠相近的毛囊生长周期)为研究对象时,Ebf1大鼠在毛发生长中期后无脂肪前体细胞,导致真皮内脂肪组织减少,且无干细胞活动。应用过氧化物酶体增生物激活受体(为脂肪形成转化因子拮抗剂),对大鼠进行处理后,在毛发生长中期阻止了皮下脂肪组织的生长和毛囊生长。
5 间充质干细胞对再上皮化的影响
伤口再上皮化是一个由角质形成细胞的迁移、增殖和分化为主导,恢复完整的表皮屏障功能,以防止感染和过多的水分损失的多因素共同作用的过程。然而,在伤口愈合不良,如慢性难愈性伤口或肥大性瘢痕中,伤口往往无法进行再上皮化。因此,必须探索一种合适的方法来缓解异常愈合,促进表皮细胞再生和伤口Ⅰ期愈合。间充质干细胞(mesenchymal stem cells, MSCs)具有自我更新能力以及潜在的多向分化潜能。这些细胞在许多生物过程,包括抗炎、细胞迁移、增殖和分化的信号通路,激活或抑制中起着重要的作用。骨髓间充质干细胞(BM-MSCs)在促进表皮细胞再生机制的研究仍然不充分。大量的证据表明,MSCs通过抑制过度炎症反应,分泌的重要因子,分化成多种类型的皮肤细胞,并招募其他宿主细胞,以参与上皮再生。BM-MSCs在上皮化过程中所起的作用是其用于治疗烧伤、糖尿病、创伤导致的再上皮化能力降低的创口愈合不良的重要依据[17]。MSCs与胚胎干细胞相比,因其不易诱发免疫反应可用于异种移植或同系移植[18]。
虽然已经取得了MSCs有助于皮肤创伤愈合的重大进展,但是仍有很多问题是未知的。虽然很多研究发现创口中MSCs呈现出细胞表型转变,有助于推导出转分化,但是细胞融合可能是MSCs促进创伤愈合的另一个机制。缺乏充分的数据证明:由MSCs再生出的皮脂腺细胞、汗腺细胞具有功能[19]。更多研究应该针对于MSCs来源的细胞是否拥有这些细胞原位组织所拥有的功能。因为大部分MSCs是循环着的,对于MSCs的迁移和归巢到特定组织的机制应该同样重要。
[1] Takeo M, Lee W, Rabbani P, et al. EdnrB governs regenerative response of melanocyte stem cells by crosstalk with wnt signaling[J]. Cell Rep, 2016,15(6):1291-1302.
[2] Ruetze M, Knauer T, Gallinat S, et al. A novel niche for skin derived precursors in non-follicular skin[J]. J Dermatol Sci, 2013,69(2):132-139.
[3] Moore KA, Lemischka LR. Stem cells and their niches[J]. Science, 2006,311(5769):1880-1885.
[4] Torkamani N, Rufaut NW, Jones L, et al. Epidermal cells expressing putative cell markers in nonglabrous skin existing in direct proximity with the distal end of the arrector pili muscle[J]. Stem Cells Int, 2016:1286315.
[5] Panich U, Sittithumcharee G, Rathviboon N, et al. Ultraviolet radiation-induced skin aging: the role of DNA damage and oxidative stress in epidermal stem cell damage mediated skin aging[J]. Stem Cells Int, 2016:7370642.
[6] Garcin CL, Ansell DM, Headon DJ, et al. Hair follicle bulge stem cells appear dispensable for the acute phase of wound re-epithelialization[J]. Stem Cells, 2016,34(5):1377-1385.
[7] Gago N, Pérez-López V, Sanz Jaka JP, et al. Age-dependent depletion of human skin-derived progenitor cells[J]. Stem Cells, 2009,27(5):1164-1172.
[8] Doucet YS, Owens DM. Isolation and functional assessment of cutaneous stem cells[J]. Methods Mol Biol, 2015,1235:147-164.
[9] Ferraro F, Celso CL, Scadden D. Adult stem cels and their niches[J]. Adv Exp Med Biol, 2010,695:155-168.
[10] Contreras-Jurado C, Lorz C, García-Serrano L, et al. Thyroid hormone signaling controls hair follicle stem cell function[J]. Mol Biol Cell, 2015,26(7):1263-1272.
[11] Dijksterhuis JP, Petersen J, Schulte G. WNT/Frizzled signalling: receptor-ligand selectivity with focus on FZD-G protein signalling and its physilolgical relevance: IUPHAR Review 3[J]. Br J Pharmacol, 2014,171(5):1195-1209.
[12] Nguyen H, Merrill BJ, Polak L, et al. Tcf3 and Tcf4 are essential for long-term homeostasis of skin epithelia[J]. Nat Genet, 2009,41(10):1068-1075.
[13] 许永安, 付小兵. 毛囊干细胞增殖与分化相关信号通路研究进展[J]. 中国修复重建外科杂志, 2010,24(2):161-164.
[14] Mojallal A, Lequeux C, Shipkov C, et al. Improvement of skin quality after fat grafting: clinical observation and an animal stu-dy[J]. Plast Reconstr Surg, 2009,124(3):765-774.
[15] Covarrubias P, Cárdenas-Camarena L, Guerrerosantos J, et al. Evaluation of the histologic changes in the fat-grafted facial skin: clinical trial[J]. Aesthetic Plast Surg, 2013,37(4):778-783.
[16] Festa E, Fretz J, Berry R, et al. Adipocyte lineage cells contribute to the skin stem cell niche to drive hair cycling[J]. Cell, 2011,146(5):761-771.
[17] Chen D, Hao H, Fu X, et al. Insight into reepithelialization: how do mesenchymal stem cells perform?[J]. Stem Cells Int, 2016:6120173.
[18] Li H, Fu X. Mechanisms of action of mesenchymal stem cells in cutaneous wound repair and regeneration[J]. Cell Tissue Res, 2012,348(3):371-377.
[19] Fu X, Li H. Mesenchymal stem cells and skin wound repair and regeneration: possibilities and questions[J]. Cell Tissue Res, 2009,335(2):317-321.
150086 黑龙江 哈尔滨,哈尔滨医科大学附属第二医院 整形美容科 第一作者:隋 冰(1984-),男,黑龙江哈尔滨人,硕士研究生. 通信作者:杨大平,150086,哈尔滨医科大学附属第二医院 整形美容科,电子信箱:dapingyang@hotmail.com
10.3969/j.issn.1673-7040.2016.12.018
2016-10-28)
