荷斯坦奶牛乳腺组织冻存及乳腺上皮细胞原代培养技术改进
2016-07-16王旭荣张景艳王学智孟嘉仁杨志强李建喜
林 杰,王旭荣,王 磊,张景艳,王学智,孟嘉仁,杨志强,李建喜
荷斯坦奶牛乳腺组织冻存及乳腺上皮细胞原代培养技术改进
林 杰,王旭荣,王 磊,张景艳,王学智,孟嘉仁,杨志强*,李建喜*
(中国农业科学院兰州畜牧与兽药研究所,甘肃省中兽药工程技术研究中心,兰州730050)
摘 要:为了改进奶牛乳腺上皮细胞原代培养技术和探究乳腺组织冻存方法,选用24月龄无泌乳史荷斯坦奶牛,采用组织块种植法,通过侧置和倒置两种方式,分别从新鲜和冻存(8个月)的乳腺组织中分离培养奶牛乳腺上皮细胞。结果表明,侧置处理能使乳腺细胞爬出时间缩短1~2d,并改善组织块贴壁速度和效果;回收于前次培养后的乳腺组织块再分离培养,贴壁第2天即有乳腺上皮细胞爬出;一步冷冻(-80℃)液氮保存较大奶牛乳腺组织块,冻存液A(FBS∶DMSO∶DMEM/F12=7∶2∶1)冻存的组织块存活率为50%,冻存液B(FBS∶DMEM/F12∶DMSO∶HEPES/丙酮酸钠贮存液=10∶7∶2∶1)冻存的组织块存活率为56%。可见,作者建立的侧置处理法和组织块回收法可以用于奶牛乳腺上皮细胞的分离培养,可以缩短组织块种植法实验周期,冻存液中加入缓冲液HEPES/丙酮酸钠后有利于组织块生物活性保持。
关键词:乳腺上皮细胞;侧置处理;组织冻存;原代培养;奶牛
体外培养的奶牛乳腺上皮细胞适宜建立细胞模型,是开展生理、病理、药理等研究的重要实验材料。国外已有成熟永生化奶牛乳腺上皮细胞系,如MAC-T、BME-UV1[1-2]。国内也有永生化奶牛乳腺细胞系研究的报道,如朱佳杰、李吉霞、上官陶、代瑞等通过转染hTert、SV40T等获得永生化乳腺上皮细胞[3-6]。但是,目前仍没有成熟的商品化奶牛乳腺上皮细胞系,多数实验室只能通过原代培养获取奶牛乳腺上皮细胞。通常获取原代奶牛乳腺上皮细胞的方法有以下4种:组织块种植法、酶消化法、机械剪切法和乳汁分离法,其中以组织块种植法和酶消化法最为常用。由于组织块种植法培养周期较长,酶消化法和机械剪切法会对细胞产生一定损伤,乳汁分离法细胞得率较低,故需要不断完善和改进奶牛乳腺上皮细胞原代培养技术。本研究对组织块种植法分离乳腺上皮细胞的关键技术步骤进行改进,提出了侧置处理法和组织块回收培养法。该方法改善了组织块种植法培养奶牛乳腺上皮细胞过程中的组织块贴壁效果,缩短了试验周期。同时,为了解决用于细胞分离培养过程中奶牛乳腺组织获取成本高的问题,笔者对奶牛乳腺组织块冻存技术进行了探索,成功建立了冻存乳腺组织分离培养奶牛乳腺上皮细胞的方法。
1 材料与方法
1.1 材料
1.1.1 动物 24月龄健康荷斯坦奶牛,无泌乳史,购自甘肃省荷斯坦奶牛繁育中心,运送至兰州海石湾屠宰场宰杀。
1.1.2 主要试剂 DMEM/F12(Gibco)、胎牛血清(FBS)(四季青)、青霉素钠(160万单位)(哈药集团有限公司兽药厂)、硫酸链霉素(100万单位)(浙江金力制药有限公司)、两性霉素B(Biosharp)、鼠尾胶原蛋白(gibco)、DMSO(Vetec)、角蛋白18单克隆抗体(Abcom)、FITC标记的兔抗鼠IgG(Abcom)。
1.1.3 主要溶液 配制方法如下。
DMEM/F12培养液:pH为7.0~7.2,0.22 μm微孔滤膜过滤。完全培养液:DMEM/F12基础培养液+20%FBS+500U·mL-1青霉素+500 U·mL-1链霉素+5μg·mL-1两性霉素B。
D-Hank’s溶液:pH为7.0~7.2,0.22μm微孔滤膜过滤。应用液:D-Hank’s溶液+500 U·mL-1青霉素+500U·mL-1链霉素+5 μg·mL-1两性霉素B。
胰酶消化液:准确称取20.0mg EDTA-2Na、250mg胰蛋白酶,D-Hank’s液溶解,定容至100 mL,0.22μm微孔滤膜过滤,于-20℃保存备用。
冻存液A:按FBS∶DMSO∶DMEM/F12=7∶2∶1比例配置(DMSO、DMEM/F12均用0.22 μm微孔滤膜过滤除菌),现配现用。
冻存液B:FBS∶DMEM/F12∶DMSO∶HEPES/丙酮酸钠贮存液=10∶7∶2∶1比例配置(贮存液中HEPES 0.8mol·L-1、丙酮酸钠0.02 mol·L-1,DMEM/F12、DMSO均用0.22μm微孔滤膜过滤除菌),现配现用。
1.1.4 主要仪器 细胞培养箱(HERACELL 150i),倒置显微镜及相机(Nikon eclicse TS100-F;Nikon DS-U2;SAMSUNG WB150F),荧光显微镜(OLYMPUS IX71DP72),扫描电镜(JEOL JSM-6510)。
1.2 方法
1.2.1 乳腺组织取样 试验奶牛屠宰后,乳房表面用清水充分冲洗,75%酒精消毒,高压灭菌解剖刀剖离整个乳房,置于75%酒精处理过的采样箱中,1 h内带回实验室,再用75%酒精消毒组织表面,避开脂肪组织、结缔组织和血管,剪取约2.5cm3的乳腺实质,75%酒精浸泡3min后转移入细胞间。
1.2.2 乳腺上皮细胞分离培养及纯化 用DHank’s液浸洗组织4次以去除酒精,剔除外部泛白组织,将乳腺实质剪碎至1mm3小块。D-Hank’s液清洗后均匀接种于铺满鼠尾胶原蛋白的细胞培养瓶,分别取不同培养瓶侧置和倒置(图1),培养箱中分别静置30min和1h,吸除瓶底液体,缓慢加入完全培养液至刚好淹没组织,继续培养。待细胞铺满瓶底后,移除组织块,并将组织块回收再接种培养。待细胞铺满瓶底约80%时,差时胰酶消化法纯化奶牛乳腺上皮细胞。

图1 培养瓶摆放方式Fig.1 Placement of cell culture flask
1.2.3 奶牛乳腺上皮细胞形态学观察 采用倒置显微镜和扫描电镜观察细胞形态特点。扫描电镜样品制备如下:参照刘莉莉[7]方法制作细胞爬片,待细胞融合至70%~80%,D-Hank’s液清洗后用2.5%戊二醛4℃下固定1h;弃去戊二醛,D-Hank’s液和蒸馏水充分清洗后,依次用40%、50%、60%、70%、80%、90%、95%、100%、100%酒精逐级脱水,自然干燥后喷晶观察。
1.2.4 奶牛乳腺上皮细胞鉴定 参照刘莉莉[7]试验方法制作细胞爬片。对角蛋白18进行免疫荧光标记,用PI染料核染,荧光显微镜下观察[8],鉴定上皮细胞并判断其纯度。
1.2.5 奶牛乳腺上皮细胞传代 当细胞铺满瓶底约80%时,胰酶消化,显微镜下观察到多数细胞回缩、变圆、细胞间隙扩大时,终止消化,反复吹打后,以1×105·mL-1细胞密度传代培养。
1.2.6 奶牛乳腺组织冻存 将乳腺实质剪至约4~5mm3的小块,每5mL冻存管中放入5~6块组织,分别加入冻存液A和B。纱布包裹冻存管,于-80℃冻存24h后转移至液氮中保存。
1.2.7 乳腺组织复苏及细胞培养 8个月后冻存管37℃水浴快速解冻,D-Hank’s液充分清洗组织块后,按照新鲜组织处理方法分离培养奶牛乳腺上皮细胞。接种组织块时每30块为一组,每组3个重复,连续观察10d,对有细胞爬出的组织块进行计数,并计算其平均值,比较A、B冻存液保存的奶牛乳腺组织爬出细胞的活力。
2 结 果
2.1 奶牛乳腺上皮细胞分离培养
试验奶牛乳腺组织脂肪含量较高(脂肪颗粒如图2A所示),清洗小组织块过程中易漂浮、接种后不易贴壁。相同时间内侧置处理组织贴壁效果优于倒置处理组织,30min即可达到较好贴壁效果。侧置处理的组织块培养至第4~5天可见细胞爬出,倒置处理的组织块培养至第6天可见细胞爬出。鹅卵石样乳腺上皮细胞后于成纤维细胞爬出,两者间有明显界限(图2A);部分组织可直接爬出鹅卵石样上皮细胞,无成纤维细胞爬出(图3)。回收的组织接种后第2天即有细胞爬出,且鹅卵石样细胞比例较高。
2.2 奶牛乳腺上皮细胞纯化
成纤维细胞消化30~60s,乳腺上皮细胞消化2~3.5min,纯化2~3次即可得到较纯的奶牛乳腺上皮细胞。纯化过程中,对乳腺上皮细胞进行一次瓶内消化平铺,可解决细胞团块中心部位密度过大的问题(图2B)。
2.3 奶牛乳腺上皮细胞形态学特征
奶牛乳腺上皮细胞呈单层生长,鹅卵石样聚集,呈岛屿状生长,有少部分细胞呈多角型、摊鸡蛋样和梭形等,大小不一(图4A),但其与成纤维细胞的形态差异极大(图4C、D)。乳腺上皮细胞的细胞核呈圆形或椭圆形,细胞间可见上皮细胞特有的拉网结构,存在接触抑制现象。细胞传至20代后,扁平圆饼状极性细胞数量增多,也有三角形、长形、多边形极性细胞(图4B)。
在扫面电镜下细胞轮廓清晰,大小不一。鹅卵石样乳腺上皮细胞的细胞核呈椭圆形,边缘不光滑,摊鸡蛋样细胞中央有皱褶,表面较光滑,细胞体积较大(图4E、F)。电镜扫描下新鲜组织培养的上皮细胞和冻存组织培养的细胞形态基本相同。
2.4 奶牛乳腺上皮细胞的鉴定
用荧光标记第5代乳腺上皮细胞角蛋白18,荧光显微镜下可观察到大量阳性细胞,且其细胞核位置与细胞核染色位置基本重合,表明本研究成功获得纯化的奶牛乳腺上皮细胞(图5A、B、C)。
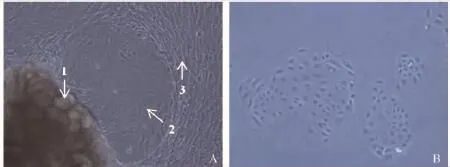
图2 细胞原代培养(Nikon,10×)Fig.2 Cell primary culture(Nikon,10×)

图3 形态学观察比较(10×)Fig.3 Comparison of morphology(10×)
2.5 奶牛乳腺上皮细胞稳定性
侧置与倒置处理得到的细胞生长速度和形态学无明显差异,传至第10代的细胞形态和生长速度基本一致;20代后细胞生长速度虽无明显变化,但形状不规则的极化细胞逐渐增多(图5D、E、F)。
2.6 冻存奶牛乳腺组织活性与培养细胞形态观察
分别取冻存液A和B中的组织块进行分离培养,每天爬出细胞的组织块数见表1。来自于冻存液A的组织块存活率为50%,来自冻存液B的组织块存活率为56%。结果显示冻存液B对组织块的保存效果较好。
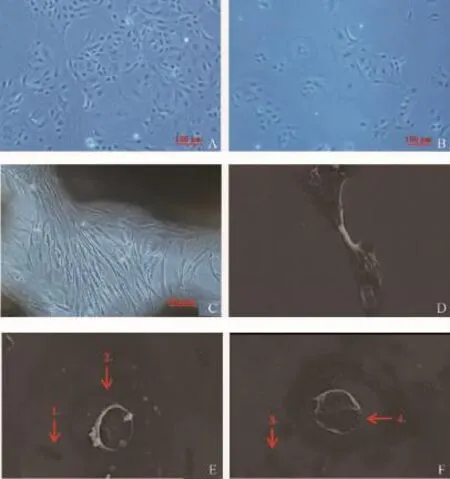
图4 奶牛乳腺上皮细胞形态学观察Fig.4 The morphology of bovine mammary epithelial cell

图5 免疫荧光鉴定角蛋白18(20×)Fig.5 The immunofluorescence assay of cytokeratin 18(20×)
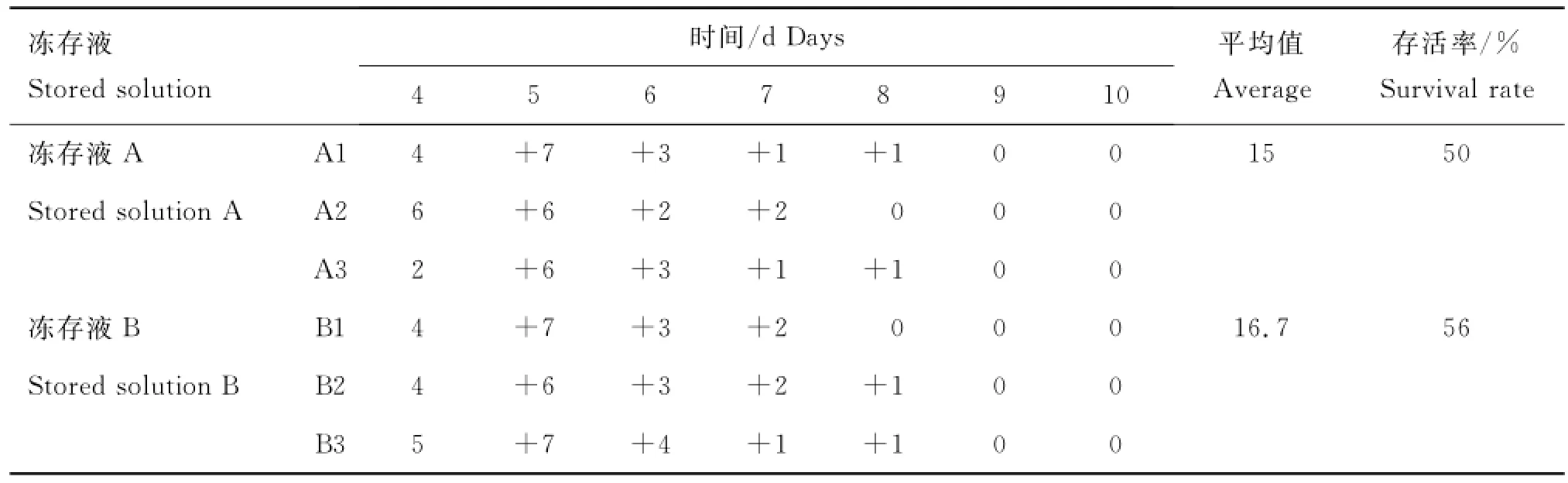
表1 组织块存活率Table 1 Survival rate of tissue piece 块·d-1
形态学观察结果表明,冻存组织在第4天有细胞爬出,且其与新鲜组织爬出的细胞形态无明显差别;部分组织块也可直接爬出鹅卵石样奶牛乳腺上皮细胞(图3)。鉴定纯化结果显示,乳腺上皮细胞有角蛋白18表达。
3 讨 论
3.1 组织材料的选择
哺乳动物乳腺腺泡通常到妊娠中晚期或泌乳期才能充分发育,泌乳后期又开始萎缩,是一个循环的组织重塑过程[9]。一般认为,取自妊娠中晚期或泌乳期的乳腺组织较易获得乳腺上皮细胞,因此利用健康的4~7岁泌乳高峰期或泌乳中后期的奶牛乳腺组织,培养乳腺上皮细胞报道较多[1,10-12]。也有研究表明,非泌乳期乳腺组织也可用于乳腺上皮细胞的分离培养。如M.Jedrzejczak等和G.Rauner等报道,利用小母牛乳腺组织分离、培养乳腺上皮细胞的效率高,获得的原代细胞活性好[13-14]。本试验所选奶牛(24月龄)已达到性成熟,无泌乳史,可避免泌乳期乳腺组织初乳不易清洗的问题,获得的乳腺上皮细胞生长速度快,可隔天传代。试验结果提示,腺泡未得到充分发育的奶牛乳腺组织也可用于乳腺上皮细胞的分离培养。
3.2 组织材料的处理
细菌污染是困扰奶牛乳腺上皮细胞原代培养的主要问题,其主要原因有两方面:一是奶牛患隐性乳房炎,其乳腺组织带菌,一般难控制、不易消除;二是人为污染。本研究通过三个环节克服以上问题:(1)选择无泌乳史奶牛,患隐性乳房炎概率极低,可以保证乳腺组织不带菌;(2)注意无菌转移,组织块短时间浸于75%酒精中转移至无菌操作台,可保证组织表面无菌;(3)提高培养液和D-Hank’s中抗生素浓度,高于报道用量5倍,待细胞爬出后,再逐渐降低抗生素浓度,可保证组织块处理和初期培养过程中对可能存在细菌产生及时有效的抑制作用。
3.3 侧置处理的优势
本试验中采用侧置处理组织块中乳腺上皮细胞爬出时间为4~5d,倒置处理组织块中乳腺上皮细胞爬出时间为6~7d,侧置比倒置缩短了1~2d。分析认为,侧置处理能够尽快沥干组织块表面液体,这有利于组织块的快速贴壁,能更好地保持组织活力。乳腺上皮细胞免疫荧光鉴定和传代试验结果表明,两种方法得到的乳腺上皮细胞特异性角蛋白18表达水平和增殖效果基本一致。可见,侧置处理较常用的倒置[15]处理优势在于缩短组织块种植法培养乳腺上皮细胞的周期。
3.4 形态学特征
据报道,体外培养的上皮细胞有3种类型:分泌上皮细胞、导管上皮细胞、肌上皮细胞。传统的差速贴壁法和差时消化法很难将这3种上皮细胞分开,需要通过密度梯度离心的方法才能将其分开[16-17]。本试验荧光鉴定结果显示,分离获得的乳腺上皮细胞均能表达上皮细胞特有的角蛋白18,但其形态不一,推测可能有以上3种类型上皮细胞。扫描电镜下分离到的乳腺上皮细胞呈鹅卵石样,这与刘明江观察到的结果[18]类似。但本试验观察到的摊鸡蛋样乳腺上皮细胞还未见报道。
3.5 奶牛乳腺组织冻存法
组织冻存技术目前在遗传育种、生物医疗领域已得到广泛应用,不仅可以保存稀缺组织,同时可以减少某些研究需要反复取材培养的麻烦。本研究采用冻存较大组织块(4~5mm3)的方法保存奶牛乳腺组织,经-80℃一步冷冻过夜后于液氮中保存8个月,冻存液A保存的乳腺组织成活率为50%,冻存液B保存的乳腺组织成活率为56%。本方法虽比孙苏军等[19]采用小组织块(d<0.3mm)和梯度冻存法保存的山羊乳腺组织块复苏后成活率(89.8%)低,但可大大简化组织块剪切、清洗、冻存和复苏等操作过程,且冻存液中加入缓冲液HEPES/丙酮酸钠后有利于组织块生物活性的保持,能够满足细胞分离培养的需要。
4 结 论
在利用组织块种植法培养奶牛乳腺上皮细胞过程中,应用侧置处理法与组织块回收法,从无泌乳史奶牛乳腺组织中成功分离培养出了奶牛乳腺上皮细胞;在乳腺组织冻存过程中,发现冻存液中加入缓冲液HEPES/丙酮酸钠后有利于组织块生物活性的保持,采用一步冻存较大奶牛乳腺组织块仍可保持其活性,能满足乳腺上皮细胞分离培养需要。
参考文献(References):
[1] STRANDBERG Y,GRAY C,VUOCOLO T,et al.Lipopolysaccharide and lipoteichoic acid induce different innate immune responses in bovine mammary epithelial cells[J].Cytokine,2005,31(1):72-86.
[2] BASIRICÒL,MORERA P,DIPASQUALE D,et al.Conjugated linoleic acid isomers strongly improve the redox status of bovine mammary epithelial cells (BME-UV1)[J].J Dairy Sci,2015,98(10):7071-7082.
[3] 朱佳杰.沼泽型水牛乳腺上皮细胞体外培养体系建立及永生化研究[D].广西:广西大学,2008.ZHU J J.Studies on the culture system and immortalization of mammary epithelial cells in swamp buffaloes [D].Guangxi:Guangxi University,2008.(in Chinese)
[4] 李吉霞.牛乳腺上皮细胞永生化及其多能性的研究[D].杨陵:西北农林科技大学,2010.LI J X.Immortalization of bovine mammary epithelial cell with multipotency[D].Yangling:Northwest Agriculture and Forestry University,2010.(in Chinese)
[5] 上官陶,王洪梅,冯敏燕,等.表达hTERT及SV40T永生化奶牛乳腺上皮细胞系的建立[J].山东农业科学,2013,45(2):1-4.SHANGGUAN T,WANG H M,FENG M Y,et al.Establishment of immortalized bovine mammary epithelial cell line expressing hTERT and SV40T[J].Shandong Agricultural Sciences,2013,45(2):1-4.(in Chinese)
[6] 代 瑞.奶山羊乳腺上皮细胞永生化细胞系的建立[D].杨陵:西北农林科技大学,2014.DAI R.The establishment of immortalization of dairy goat mammary epithelial cells[D].Yangling:Northwest Agriculture and Forestry University,2014.(in Chinese)
[7] 刘莉莉.脂肪酸与PPARγ基因互作对奶牛乳腺上皮细胞乳脂肪合成的调节作用及机理[D].哈尔滨:东北农业大学,2014.LIU L L.The effect of interaction between fatty acid and PPARγgene on regulation and mechanism of milk fat synthesis in dairy cow mammary epithelial cells[D].Harbin:Northeast Agricultural University,2014.(in Chinese)
[8] 王立娜.氨基酸与STAT5A基因互作对奶牛乳腺上皮细胞泌乳的调节作用及机理[D].哈尔滨:东北农业大学,2014.WANG L N.Effect of interaction between Aminocids and STAT5Aon lactation of dairy cow mammary epithelial cells and its mechanism[D].Harbin:Northeast Agricultural University,2014.(in Chinese)
[9] 王治国.奶牛乳腺上皮细胞的体外培养及应用[D].北京:中国农业科学院,2007.WANG Z G.In vitro culture and application of bovine mammary epithelial cells[D].Beijing:Chinese Academy of Agricultural Science,2007.(in Chinese)
[10] WELLNITZ O,KERR D E.Cryopreserved bovine mammary cells to model epithelial response to infection[J].Vet Immunol Immunopathol,2004,101(3-4):191-202.
[11] HOU X,LI Q,HUANG T.Microarray analysis of gene expression profiles in the bovine mammary gland during lactation[J].Sci China Life Sci,2010,53 (2):248-256.
[12] SORG D,DANOWSKI K,KORENKOVA V,et al.Microfluidic high-throughput RT-qPCR measurements of the immune response of primary bovine mammary epithelial cells cultured from milk to mastitis pathogens[J].Animal,2013,7(5):799-805.
[13] JEDRZEJCZAK M,SZATKOWSKA I.Bovine mammary epithelial cell cultures for the study of mammary gland functions[J].In Vitro Cell Dev Biol Anim,2014,50(5):389-398.
[14] RAUNER G,BARASH I.Xanthosine administration does not affect the proportion of epithelial stem cellsin bovine mammary tissue,but has a latent negative effect on cell proliferation[J].Exp Cell Res,2014,328(1):186-196.
[15] 陈亚冰,符 梅,兰道亮,等.牦牛乳腺上皮细胞体外培养及鉴定[J].畜牧兽医学报,2015,46(1):69-76.CHEN Y B,FU M,LAN D L,et al.Culture and identification of yak mammary epithelial cells[J].Acta Veterinaria et Zootechnica Sinica,2015,46(1):69-76.(in Chinese)
[16] ZAVIZION B,VAN DUFFELEN M,SCHAEFFER W,et al.Establishment and characterization of a bovine mammary epithelial cell line with unique properties[J].In Vitro Cell Dev Biol Anim,1996,32(3):138-148.
[17] PANTSCHENKO A G,BARBER M R,WOODCOCK-MITCHELL J,et al.Establishment and characterization of a caprine mammary myoepithelial cell line(CMMyoEC)[J].In Vitro Cell Dev Biol Anim, 2000,36(6):351-356.
[18] 刘明江.咖啡酸抗LPS诱导的奶牛乳腺上皮细胞炎性损伤作用及其分子机制[D].北京:中国农业大学,2014.LIU M J.The protective effect and molecular mechanisms of caffeic acid against inflammation injury of primary bovine mammary epithelial cells induced by lipopolysaccharide[D].Beijing:China Agricultural University,2014.(in Chinese)
[19] 孙苏军,安志兴,彭新荣,等.山羊乳腺组织块冷冻保存试验[J].西北农林科技大学学报(自然科学版),2005,33(4):5-8.SUN S J,AN Z X,PENG X R,et al.The research of cryopreservation goat mammary tissue[J].Journal of Northwest A&F University(Natural Science Edition),2005,33(4):5-8.(in Chinese)
(编辑 白永平)
Cryopreservation of the Mammary Gland and Improvement on the Culture of the Primary Epithelial Cells in Holstein Dairy Cows
LIN Jie,WANG Xu-rong,WANG Lei,ZHANG Jing-yan,WANG Xue-zhi,MENG Jia-ren,YANG Zhi-qiang*,LI Jian-xi*
(Engineering &Technology Research Center of Traditional Chinese Veterinary Medicine of Gansu Province,Lanzhou Institute of Husbandry and Pharmaceutical Science of CAAS,Lanzhou730050,China)
Abstract:The present study was performed to improve the process of tissue explant method and explore the cryopreservation method of bovine mammary gland.The mammary epithelial cells were isolated and cultured from the fresh and cryopreserved(8mouths)mammary gland that collected from a 24months’Holstein dairy cow without history of lactation by tissue explant method including the side-place and inversion pattern respectively.Side-place method could shorten 1-2 days for appearance of cell,and improve the speed and adherence effect of tissue pieces,and the cells could climb out on the second day from the tissue pieces that were cultured and moved another flask.The survival rate was 50%for the tissue mass by liquid nitrogen storage followed by one-step cryopreservation(-80℃)with freeze-stored solution FBS∶DMSO∶DMEM/F12=7∶2∶1while the survival rate was 56%with freeze-stored solution FBS∶DMEM/F12∶DMSO∶HEPES/sodium pyruvate=10∶7∶2∶1.The side-place method and tissue pieces recycling method were established for mammary epithelial cells culture in the presented study,which couldshorten the cycle of tissue explant method.And the buffer HEPES/sodium pyruvate was benefit for maintaining the tissue bioactivity.
Key words:mammary epithelial cells;side-place method;tissue cryopreservation;primary cultural;dairy cow
中图分类号:S858.237.26
文献标志码:A
文章编号:0366-6964(2016)05-1067-08
doi:10.11843/j.issn.0366-6964.2016.05.027
收稿日期:2015-09-21
基金项目:国家奶牛产业技术体系(CARS37);公益性行业专项(20130304)
作者简介:林 杰(1991-),女,满族,河北唐山人,硕士生,主要从事奶牛疾病研究,Tel:0931-2115262,E-mail:qielinjie2009@163.com
*通信作者:杨志强,研究员,主要从事临床兽医学与奶牛疾病防治研究,E-mail:zhiqyang2006@163.com;李建喜,研究员,主要从事兽医药理毒理与中兽医学研究与应用,E-mail:lzjianxil@163.com
