生长激素受体基因突变对西藏藏猪生长迟缓的影响
2016-07-16田雨光吴清洪王玉珏
岳 敏,田雨光,万 斌,庞 炜,吴清洪,王玉珏
生长激素受体基因突变对西藏藏猪生长迟缓的影响
岳 敏#,田雨光#,万 斌,庞 炜,吴清洪*,王玉珏*
(南方医科大学实验动物中心,广州510515)
摘 要:本研究旨在探索西藏藏猪生长迟缓成因和分子机理。采用逆转录聚合酶链反应(RT-PCR)技术对西藏藏猪生长激素受体(GHR)基因克隆,采用生物信息学方法分析西藏藏猪生长激素受体基因与其他常见品种猪基因与蛋白序列差异,并构建GHR基因的真核过表达质粒,转染到西藏藏猪胚胎成纤维细胞(PEFs)上进行瞬时表达,通过MTT检测细胞增殖活性,利用实时荧光定量PCR技术检测细胞的胰岛素样生长因子-1(IGF-1)表达的情况。西藏藏猪GHR基因编码区1 716bp,编码572个氨基酸;与普通猪GHR基因序列进行比对分析表明,在西藏藏猪GHR基因编码区1 225bp处发生T→G突变,导致丝氨酸突变为丙氨酸;GHR基因真核过表达质粒成功转染PEFs后,PEFs生长活性显著提高;qPCR检测表明,细胞株中IGF-1表达显著上调。综上表明,GHR基因的表达可以提高PEFs细胞的增殖活性,诱导IGF-1基因的表达,GHR基因在1 225bp处的点突变可能影响西藏藏猪的生长迟缓。
关键词:西藏藏猪;GHR;IGF-1;胚胎成纤维细胞
动物的生长是一个复杂的生理过程,受到体内外多种因素的影响。其中由GHRH-GH-IGF构成的神经内分泌生长轴是调控的关键[1-4]。生长激素(Growth hormone,GH)分泌后与生长激素结合蛋白(Growth hormone binding protein,GHBP)结合,经血液循环运输到体内各组织器官,与靶器官上的生长激素受体(Growth hormone receptor,GHR)结合,启动细胞内的信号转导机制,促进胰岛素样生长因子-1 (IGF-1)的表达[5-7]。IGF-1主要由肝合成后释放到血液中,再与胰岛素样生长因子结合蛋白结合运输至动物体内的多种组织,促进蛋白质的合成,促进细胞增殖,从而促进动物以骨骼肌为主的生长发育[8-10]。
西藏藏猪来源于青藏高原,是非常纯正的小型猪品种,成年的体重仅25~40kg,是普通猪体重的15%~20%[11]。从免疫学、遗传学研究发现,该品系具有独特的免疫相关指标和遗传特征,加上其独特的外形,是一种优良的试验用小型猪品种,研究其生长发育具有特别意义。本研究通过对普通猪的生长相关基因GHR进行克隆,构建其野生型真核表达质粒和突变型过表达质粒,并在西藏藏猪胚胎成纤维细胞中表达,旨在研究导致西藏藏猪生长迟缓成因,从而为进一步探讨西藏藏猪GHR基因的功能及信号的转导提供理论基础。
1 材料和方法
1.1 材料
6月龄西藏藏猪肝组织取自南方医科大学实验动物中心(SCXK(粤)2011-0015),麻醉后,活体取部分肝,置于去RNA酶的1.5mL EP管中,做好标记后,立即放入液氮中保存备用。
克隆菌株JM109(北京Solarbio公司);DH5α感受态细胞、真核荧光表达质粒:pIRES2-EGFP(北京天恩泽基因科技有限公司);Prime Script RTPCR Kit、pMD 18TVector、T4-ligase(TaKaRa公司);质粒提取试剂盒(北京天根生物公司;SalⅠ、NheⅠ内切酶(Fermentas公司);Lipofectamine2000和Opti-MEM培养基(Invitrogen公司)。
1.2 方法
1.2.1 GHR基因的克隆 参照GenBank猪GHR基因mRNA序列(Gene accession:NM_214254.2)设计克隆引物,由上海捷瑞生物技术有限公司合成,正向引物:CTAGCTAGCGCCACCATGGATCTC(含NheⅠ酶切位点),反向引物:GCGTCGACCTAAGGCATGATTTTGTTC(含SalⅠ的酶切位点)。以普通大型肉食猪cDNA为模板进行扩增。通过1%琼脂糖凝胶检测PCR扩增结果,回收目的DNA片段。
1.2.2 GHR基因真核表达载体的构建 PCR产物和pIRES2-EGFP进行双酶切连接,连接的反应液于4℃过夜,然后在感受态细胞中转化,挑选单个菌落进行扩大培养,进行PCR鉴定,鉴定正确后测序。测序鉴定正确的重组质粒GHR-pIRES2-EGFP,经感受态细胞转化后,提取表达质粒。
1.2.3 重组质粒转染西藏藏猪胚胎成纤维细胞
操作按照Lipofectamine2000转染试剂说明书进行。使用24孔板准备细胞,转染前1d,对细胞株进行传代,使其汇合度为70%~80%,第2天进行转染。细胞转染前30min,在离心管中制备A、B液,A液:用OPTI-MEM稀释每个孔质粒1μg,总量100μL,B液:取1μL Lipofectamine2000溶解于OPTI-MEM培养基中,室温放置5min,轻轻混合A、B液,室温孵育20min。孵育4~6h后,换为细胞生长培养基。24h后倒置荧光显微镜下荧光拍照,并收集细胞。
1.2.4 相关基因表达量检测 以细胞总RNA反转录产物为模板,采用荧光定量的方法,对pIRES2-EGFP和GHR-pIRES2-EGFP质粒转染后48h的西藏藏猪的胚胎成纤维细胞IGF-1以及Leptin基因进行荧光定量分析。目的基因与内参基因引物:IGF-1-F:5′-CGTGCTGGAACCACCTTA-CT-3′,IGF-1-R:5′-CGTGCTGGAACCACCTTA-CT-3′;Leptin-F:5′-GACCCCTGTGCCGATTCCTG-3′,Leptin-R:5′-CAGGACAGGATGGAGCCCA-3′;β-actin-F:5′-AGGGAAATCGTGCGTGACA-3′,β-actin-R:5′-GAACCGCTCATTGCCGATA-3′。根据荧光定量PCR试剂盒说明书进行分析,重复3次。
1.2.5 MTT检测 用0.25%胰酶消化转染后的细胞,轻摇成细胞悬液,调节细胞浓度每孔为105个,接种于48孔细胞板上,37℃,5%CO2培养箱中培养24h后,弃去旧的培养液,用PBS漂洗2次,之后每孔加入无血清RPMI-1640培养液100μL和5mg·mL-1的MTT溶液20μL,继续培养4h后,用移液枪小心吸出孔内液体,每孔加入150μL的DMSO,放入酶标仪中,37℃振荡孵育10min,促进结晶物充分溶解。每24h于分光光度计490nm处测定每孔的吸光度OD值,每组平行3次,计算并绘制细胞生长曲线。
2 结 果
2.1 西藏藏猪GHR基因序列生物信息学分析
基因测序及生物信息数据分析,GHR基因编码区1 716bp,编码572个氨基酸,基因的编码序列与版纳微型猪(JF276446.1)、五指山小型猪(DQ422962.1)的GHR基因高度同源达99%,西藏藏猪GHR基因编码区与普通猪GHR基因(NM_214254.2)序列进行比对分析发现,西藏藏猪基因1 225bp处发生了T→G突变,此突变造成409aa处的丝氨酸变为丙氨酸的突变(图1),通过SWISSMODEL软件对西藏藏猪与普通猪GHR蛋白进行建模后比对发现,西藏藏猪GHR蛋白在空间结构上与普通猪具有较为明显的差异(图2黑色箭头处)。
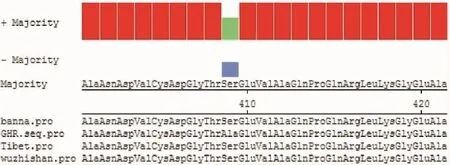
图1 不同品种猪GHR氨基酸的序列比对Fig.1 Amino acid sequence alignment of GHR in different pig breeds
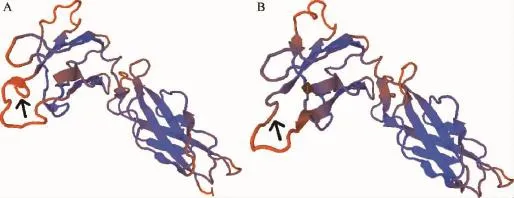
图2 不同品种猪GHR蛋白的空间结构比对(SWISS-MODEL)Fig.2 Protein spatial structure alignment of GHR in different pig breeds
2.2 重组质粒在胚胎成纤维细胞中的过表达
取质粒pIRES2-EGFP和pIRES2-EGFP-GHR转染48h的西藏藏猪的胚胎成纤维细胞,荧光共聚焦显微镜下拍照发现pIRES2-EGFP(图3A~C)和pIRES2-EGFP-GHR(图3D~F)质粒在胚胎成纤维细胞中均有表达。
2.3 GHR对西藏藏猪胚胎成纤维细胞增殖的影响
经MTT检测发现,西藏藏猪胚胎成纤维细胞经转染GHR基因过量表达载体后,其细胞生长活性明显较空白对照组与GFP空载体组为高(图4)。
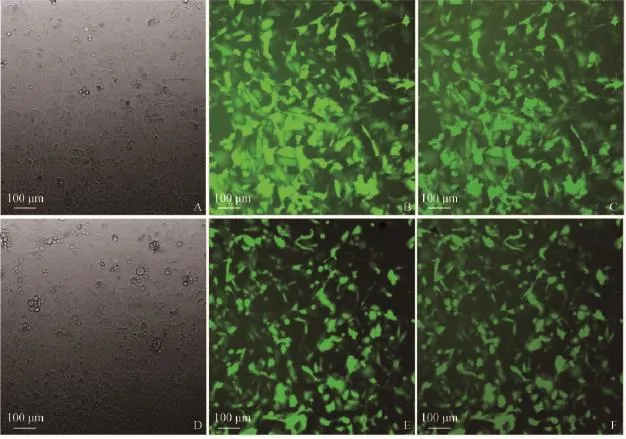
图3 西藏藏猪胚胎成纤维细胞转染EGFP质粒后荧光观察(10×10)Fig.3 Eukaryotic expression after transfection 48hin embryo fibroblast of Tibet mini-pig(10×10)
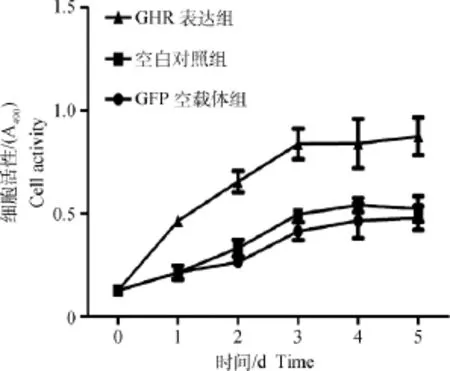
图4 西藏藏猪胚胎成纤维细胞活性检测Fig.4 Activity of embryo fibroblast of Tibet mini-pig
2.4 GHR对IGF-1mRNA表达量的影响
转染生长激素受体基因后,西藏藏猪的胚胎成纤维细胞中的GHR与IGF-1mRNA相对表达量显著上调(P<0.05),这表明西藏藏猪生长激素受体基因能在体外诱导IGF-1的表达;而各组间瘦素lepin基因mRNA相对表达量无显著差异(P>0.05)(图5)。这进一步表明,西藏藏猪GHR可以通过影响IGF-1的表达从而引起西藏藏猪生长迟缓,此过程与瘦素基因的表达关系不明显。
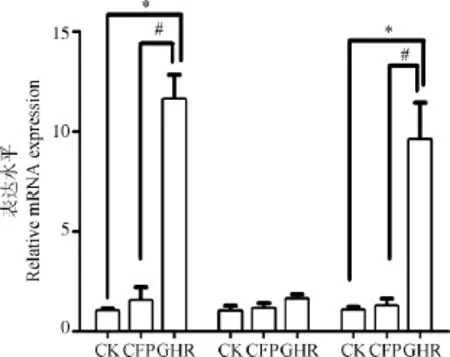
图5 西藏藏猪胚胎成纤维细胞mRNA相对表达Fig.5 The relative expression of mRNA of Tibet mini-pig embryo fibroblasts
3 讨 论
猪GHR是由单一基因编码的跨膜糖蛋白,其编码GHR的基因定位于16号染色体的NC_010458.3位置,全长212kb,共包含10个外显子,外显子1编码信号肽,外显子2~7编码GHR细胞外区域,外显子8编码跨膜区域,外显子9~10编码细胞内区域,剪切成熟的GHR mRNA共计编码572个氨基酸[12]。早期对GHR基因研究,绝大多数集中在对人类自身的研究上,而对西藏藏猪生长迟缓的原因探索较少。人的GHR蛋白属细胞因子受体超家族成员,是由630个氨基酸残基构成的单链糖蛋白,包括胞外区、跨膜区、胞内区3个部分[13]。胞外区包含与GH 结合的位点,同时也是GH结合蛋白的前体,迄今为止,在已有人类的绝大多数关于GHR基因的突变,均位于GHR的胞外区;跨膜区较短小,只形成一次跨膜;胞内区是细胞信号转导的功能区。GH与特异性GHR结合,进而激活受体后信号转导系统而发挥促生长的生物学效应[14-16]。
本研究通过对普通猪与西藏藏猪的GHR基因进行生物信息学分析发现,西藏藏猪GHR基因在1 225bp处发生T→G的突变,该位点的突变引起相应编码氨基酸的变化,由丝氨酸变成丙氨酸,从而使GHR基因所表达的蛋白,出现结构上的差异。GH能促进动物生长发育,其在体内表达后必须与靶器官上的GH受体(GHR)结合才能发挥作用,GH与GHR正常结合后,将激活下游信号通路,其中IGF-1是下游信号通路中较为重要的物质,其直接影响蛋白质的合成以及细胞的增殖。如果GHR基因发生突变而引起其编码蛋白发生结构变异,将直接影响动物的生长发育。在本研究中,笔者发现西藏藏猪的生长激素受体基因发生突变位于1 225 bp处,同样属于GHR的胞外区,这一突变直接影响GHR蛋白的折叠结构,将大大降低其与胞外生长激素的结合率,通过这一信号通路的抑制作用,将直接影响西藏藏猪的生长迟缓。基于此,本研究通过克隆普通大型肉用型猪的生长激素受体基因GHR,将其构建成真核过量表达质粒 GHR-pIRES2-EGFP,并将质粒转染到西藏藏猪胚胎成纤维细胞中,使GHR基因的表达量得到提高。生长激素受体表达提高后,自然与之结合的生长激素也会增加,将进一步增强生长激素在细胞内的信号转导机制,促进IGF-1表达,引起IGF-1基因表达量上调。该结果与邓景致[17]构建的pGHR-pIRES2-EGFP质粒转染到猪肾PK-15细胞内IGF-1表达有上调现象相一致。正常情况下,西藏藏猪GHR的表达对IGF-1的表达上调作用显著低于普通大型食肉猪;而通过克隆普通大型食肉猪GHR转化到西藏藏猪胚胎成纤维细胞后,西藏藏猪胚胎成纤维细胞的生长活性得到显著提高,同时,调节细胞生长的关键因子IGF-1的表达也显著上调,说明GHR基因点突变时导致其生长迟缓,因此,可推断西藏藏猪的GHR基因1 225bp处T→G的突变,造成编码氨基酸的变化而导致下游IGF-1表达降低,进而导致西藏藏猪生长发育迟缓。
参考文献(References):
[1] CASTELLANO G,AFFUSO F,CONZA P D,et al.The GH/IGF-1axis and heart failure[J].Curr Cardionl Rev,2009,5(3):203-215.
[2] BERNASCONI S,BERGOMI A,MILIOLI S,et al.Genetics and molecular biology of the GHRH-GHIGF-I axis[J].Minerva Pediatr,1999,51(11-12):375-394.
[3] 同海妮,白 淑,王树迎,等.GHR和IGF-IR在济宁青山羊子宫内分布和表达的发育性变化[J].畜牧兽医学报,2013,44(9):1392-1399.TONG H N,BAI S,WANG S Y,et al.Developmental changes of the distribution of GHR and IGF-IR and the expression of its mRNA in the uterus of Jining Grey goats[J].Acta Veterinaria et Zootechnica Sinica,2013,44(9):1392-1399.(in Chinese)
[4] 王淑燕,霍金龙,潘伟荣,等.版纳微型猪近交系GHR基因克隆及生物信息学分析[J].中国实验动物学报,2014,22(1):48-56.WANG S Y,HUO J L,PAN W R,et al.Cloning and bioinformatics analysis of GHRgene in Banna minipig inbred line[J].Acta Laboratorium Animalis Scientia Sinica,2014,22(1):48-56.(in Chinese)
[5] MULLIS P E.Genetics of GHRH,GHRH-receptor,GH and GH-receptor:its impact on pharmacogenetics [J].Best Pract Res Clin Endocrinol Metab,2011,25 (1):25-41.
[6] RIEDL S,KLUGE M,SCHWEITZER K,et al.Adaptation of ghrelin and the GH/IGF axis to high altitude [J].Eur J Endocrinol,2012,166(6):969-976.
[7] FUSCO A,MIELE L,D'UONNOLO A,et al.Nonal coholic fatty liver disease is associated with increasedGHBP and reduced GH/IGF-I levels[J].Clin Endocrinol(Oxf),2012,77(4):531-536.
[8] MILES H L,DERRAIK J G,CHIAVAROLI V,et al.Response to IGF-1generation test in short prepubertal children born very preterm or at term[J].Horm Res Paediatr,2015,84(5):298-304.
[9] FRYSTYK J,DJURHUUS C B,JOHANSEN T,et al.Measurement of free GH and bioactive IGF-I in non-diabetic haemodialysis patients treated with GH for 7days[J].Nephrol Dial Transplant,2012,27 (11):4211-4218.
[10] AISENBERG J,AUYEUNG V,PEDRO H F,et al.Atypical GH insensitivity syndrome and severe insulin-like growth factor-I deficiency resulting from compound heterozygous mutations of the GH receptor,including a novel frameshift mutation affecting the intracellular domain[J].Horm Res Paediatr,2010,74 (6):406-411.
[11] 岳 敏,范 沛,吴丽红,等.广州地区三种小型猪血液生理生化指标的比较[J].中国比较医学杂志,2011,21(8):24-26.YUE M,FAN P,WU L H,et al.Comparison of blood physiological and biochemical parameters among three types of minipigs in Guangzhou[J].Chinese Journal of Comparative Medicine,2011,21(8):24-26.(in Chinese)
[12] TIAN Y G,YUE M,GU Y,et al.Single-nucleotide polymorphism analysis of GH,GHR,and IGF-1 genes in minipigs[J].Braz J Med Biol Res,2014,47(9):753-758.
[13] 于 意,王 伟,王 莹,等.生长激素受体基因多态性与特发性矮小遗传易感性的关系[J].上海交通大学学报(医学版),2011,31(7):932-936.YU Y,WANG W,WANG Y,et al.Associations of single nucleotide polymorphisms of growth hormone receptor with susceptibility to idiopathic short stature [J].Journal of Shanghai Jiaotong University (Medical Science),2011,31(7):932-936.(in Chinese)
[14] LAN H,LI W,JIANG H,et al.Intracellular signaling transduction pathways triggered by a well-known anti-GHR monoclonal antibody,Mab263,in vitro and in vivo[J].Int J Mol Sci,2014,15(11):20538-20554.
[15] GAN Y,PATERSON A J,ZHANG Y,et al.Functional collaboration of insulin-like growth factor-1receptor(IGF-1R),but not insulin receptor(IR),with acute GH signaling in mouse calvarial cells[J].Endocrinology,2014,155(3):1000-1009.
[16] MA F,WEI Z,SHI C,et al.Signaling cross talk between growth hormone(GH)and insulin-like growth factor-I(IGF-I)in pancreatic isletβ-cells[J].Mol Endocrinol,2011,25(12):2119-2133.
[17] 邓景致.版纳微型猪近交系生长相关基因遗传背景分析[D].吉林:吉林大学,2012.DENG J Z.Analysis of genetic background of the growth related genes in Banna Miniature inbreeding pig[D].Jilin:Jilin University,2012.(in Chinese)
(编辑 程金华)
The Impact of GHR Mutation on Suppressing the Growth in Tibet Mini-pig
YUE Min#,TIAN Yu-guang#,WAN Bin,PANG Wei,WU Qing-hong*,WANG Yu-jue*
(Laboratory Animal Center,Southern Medical University,Guangzhou510515,China)
Abstract:This study aimed to explore the genetic and molecular mechanism of Tibet mini-pig growth retardation.RT-PCR technique was used to amplify Tibet mini-pig GHRgene.Bioinformatics method was used to analyze the differences of GHRgene and protein sequence between Tibet mini-pig and other common variety pigs.The eukaryotic expression vector of common pig GHRgene was transfected into Tibet mini-pig’s embryonic fibroblasts.The MTT assay was used to detect the cell proliferation activity after transfected GHR-pIRES2-EGFP vector.The real-time PCR was used to detect the mRNA expression of the IGF-1gene.There were 1 716bp in Tibet mini-pig GHRgene coding region,and 572amino acids were encoded.Compared with common meat pig GHRgene sequence,the base T in Tibet mini-pig GHRgene coding region 1 225bp mutated into G,and then serine was replaced by alanine.The growth activity of Tibet mini-pig’s embryonic fibroblasts were significantly improved after transfected with GHR-pIRES2-EGFP,and the mRNA level of IGF-1was up-regulated significantly.The results showed that GHRcould improve the activity of PEFs cell proliferation,and induce the expression of IGF-1gene;The mutation of GHRgene in 1 225bp might involve in the process of growth retardation in Tibet mini-pig.
Key words:Tibet mini-pig;GHR;IGF-1;embryonic fibroblasts
中图分类号:S828.2
文献标志码:A
文章编号:0366-6964(2016)05-0882-06
doi:10.11843/j.issn.0366-6964.2016.05.004
收稿日期:2015-10-12
基金项目:国家自然科学基金(801402625);中国博士后自然科学基金(2014M550439);广东省自然科学基金(S2013010014720);广东省科技计划项目(2011B060300014);南方医科大学2015科研助手项目(C1032246)
作者简介:岳 敏(1982-),医学博士,实验师,主要从事实验动物分子遗传学研究和人类疾病动物模型制作研究,Tel:020-62789009,E-mail:343779791@qq.com;田雨光(1987-),博士生,主要从事比较医学研究,Tel:020-62789009,E-mail:yuguang.tian@qq.com。岳 敏和田雨光为共同第一作者
*通信作者:吴清洪,高级实验师,主要从事实验动物学研究,Tel:020-61648424,E-mail:wuqhvip@126.com;王玉珏,医学博士,副教授,主要从事人类疾病动物模型制作研究,Tel:020-62789158,E-mail:75848808@qq.com
