山羊FTO基因克隆及其表达谱
2016-07-16林亚秋廖红海贺庆华
林亚秋,廖红海,贺庆华,李 倩,2,王 永,2*
山羊FTO基因克隆及其表达谱
林亚秋1#,廖红海1,2#,贺庆华1,李 倩1,2,王 永1,2*
(1.西南民族大学生命科学与技术学院,成都610041;2.青藏高原动物遗传资源保护与利用四川省重点实验室,成都610041)
摘 要:本研究旨在阐明山羊FTO基因的表达特性,并分析其表达与肌内脂肪沉积的相关性。以简州大耳羊为试验动物,采用RT-PCR方法克隆FTO基因,利用实时荧光定量PCR和Western blotting技术检测其组织表达差异,同时检测该基因在不同发育阶段不同部位山羊肌肉组织中的表达水平,并与IMF含量进行相关分析。结果表明,山羊FTO基因CDS区为1 518bp,编码505个氨基酸,为无跨膜结构的非分泌蛋白。FTOmRNA在山羊的脂肪、脾和肺中表达水平较高(P<0.01),在背最长肌中表达最低;FTO蛋白在背最长肌和脾中表达较高(P<0.01),脂肪组织中表达次之。同时结果显示,FTOmRNA在24月龄山羊背最长肌和股二头肌中表达水平显著高于1~3 和8~10月龄的表达水平(P<0.05)。FTOmRNA表达量与背最长肌IMF含量呈显著负相关(P<0.05),与股二头肌及臂三头肌IMF含量呈不同程度的正相关。本研究指出,FTO基因表达与IMF含量存在相关性,推测可作为IMF沉积的候选基因。
关键词:山羊;FTO;克隆;组织表达;肌内脂肪含量
近年来,随着人们消费水平的提高及消费观念的转变,对动物肉品质的要求越来越高。山羊肉具有蛋白含量高,脂肪、胆固醇含量低,且含有多种人体必需氨基酸等优点,因此备受人们推崇。我国是山羊养殖的大国,其分布地区广,在我国畜牧业中占有非常重要的地位。肉用山羊是当前养殖业的主体,简州大耳羊是以努比山羊和简阳本地山羊为育种材料培育出的具有自主知识产权的优良地方肉用品种,因此阐明其优良肉质性状形成的分子机制具有重要的理论与实际意义。
肌内脂肪(Intramuscular fat,IMF)是影响其肉质性状的一个极其重要的指标,被认为与肉质呈正相关[1-2],是山羊的重要经济性状之一。IMF受多因素影响,其中从分子水平上阐明影响IMF的候选基因的调控作用是研究者所关注的焦点问题。脂肪肥胖相关基因(Fat mass and obesity associated gene,FTO)又叫FATSO,是2007年新发现的与人类肥胖相关的等位基因[3],属于非血红色加双氧酶基因超家族,编码2-酮戊二酸依赖的核酸脱甲基酶。研究发现该基因广泛存在于脊椎动物中[4],并在动物多种组织中均表达,在食物摄入、能量代谢[5]、肥胖[3,6-7]和2型糖尿病[8-10]等方面发挥重要的调控作用。关于FTO的研究比较深入的主要集中在人和鼠的能量平衡,基于该基因的重要性,畜牧工作者对该基因在动物生产中的作用也非常重视,X.Jia等于2012年研究指出,鸡FTO基因序列的多样性与家禽的体重、肥胖等相关[11],并且FTO基因的单核苷酸多态性(Single nucleotide polymorphism,SNP)与猪、牛和兔子的肉质性状和生长存在相关性,推测其可作为动物肉质和生长的候选基因[1215]。但FTO基因在山羊上的研究目前尚未见相关报道,NCBI上仅见山羊FTO的预测序列,关于山羊FTO的基因特性,在山羊各组织和不同发育阶段的表达谱,及其是否可作为山羊肉质性状的候选基因皆需要通过试验来阐明。
因此本研究通过克隆得到山羊FTO基因,并对该序列进行生物信息学分析,利用实时荧光定量PCR和Western blotting分析该基因在不同组织中的表达情况,并对该基因的时序表达情况及与肌肉中的IMF含量进行关联分析,为进一步研究山羊FTO基因功能及解析简州大耳羊优质肉质性状形成的分子机制提供重要的理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试验动物与组织样品采集 本试验选择1~3月龄(羔羊)、8~10月龄(育成羊)和24月龄左右(成年羊)的简州大耳羊公羊为试验动物(每个阶段各9只),购自四川省简阳市。屠宰后迅速取其皮下脂肪、背最长肌、股二头肌和臂三头肌组织;并同时采集成年公羊心、肝、脾、肺、肾、脂肪、背最长肌、股二头肌和臂三头肌等组织。采集的组织样品用锡箔纸包好,置于液氮内带回实验室,-80℃放置备用。用于测定肌内脂肪含量的样品去除结缔组织后带回实验室置于-20℃备用。
1.1.2 主要试剂 Trizol、SYBR?Premix Ex Taq TM(2×)、pMD-19T载体购自TaKaRa公司,Taq DNA聚合酶和Revert Aid First Strand cDNA Synthesis Kit购自Thermo公司,2×Taq PCR Master Mix购自Fermentas公司,胶回收试剂盒购于Axygen公司,感受态细胞DH5α购自天根生化科技有限公司,抗FTO多克隆抗体购自美国Abcom公司,抗β-actin购自北京博奥森生物技术有限公司,牛血清白蛋白(BSA)购自Sigma公司。
1.2 试验方法
1.2.1 山羊FTO基因的克隆测序 按照Trizol试剂盒说明书操作步骤提取山羊皮下脂肪组织总RNA,用紫外分光光度计测得总RNA的OD值为1.8~2.0,符合试验要求。然后按照反转录试剂盒说明书以Oligo(dT)为引物合成cDNA第一链。利用Primer Premier5.0软件,根据GenBank数据库中登陆的牛、牦牛及山羊预测序列设计PCR扩增引物(表1),产物长度预计为1 731bp。PCR反应体系为2×Long Taq PCR Master Mix 12.5μL、Primer F(10μmol·L-1)1.0μL、Primer R(10 μmol·L-1)1.0μL、DNA 1.0μL,ddH2O 9.5μL。PCR反应条件:94℃预变性4min;94℃30s,57 ℃90s,72℃1min,40个循环;72℃延伸10min。用DNA回收试剂盒回收1%琼脂糖凝胶电泳检测后的目的条带,然后连接于PMD-19T载体,转化DH5α后筛选阳性克隆,最后送交生工生物工程上海股份有限公司进行序列测定。

表1 引物信息Table 1 Primer information
1.2.2 山羊FTO基因生物信息学分析 利用NCBI的BLAST在线工具进行同源性比对,利用MEGA5.0构建系统进化关系树;利用ExPASy分析推导蛋白质的基本理化性质,利用ProtScale对山羊FTO蛋白疏水区进行预测,利用TMHMM预测跨膜结构域,利用SignalP 4.0预测信号肽序列,利用NetPhos 2.0、NetOGlyc 3.1、NetNGlyc 1.0分析预测FTO蛋白磷酸化位点、O糖基化位点、N糖基化位点,通过PsortⅡ对亚细胞定位进行预测,相关蛋白相互作用网络由STRING交互式数据库所构建,Hopfield预测二级结构,SWISSMODEL预测三级结构。
1.2.3 山羊FTO基因组织表达谱 提取成年山羊的心、肝、脾、肺、肾、背最长肌和皮下脂肪等组织的总RNA(n=6)和总蛋白(n=3)。采用实时荧光定量PCR(Quantitative Real-time PCR,qPCR)和Western blotting检测FTO基因的组织表达差异。
qPCR反应体系:SYBR?Premix Ex Taq TM (2×)PCR 10μL,10μmol·L-1上下游引物各0.5 μL,模板cDNA 1μL,ddH2O 8μL。PCR反应条件:95°C预变性1min;95°C 30s,60℃/62℃30 s,45个循环。引物序列见表1。
Western blotting步骤:将上述提取的各个组织蛋白利用BradFord方法对总蛋白质进行定量。提取的总蛋白100℃煮样10min,12%SDS-PAGE分离蛋白,接着以200mA的电流将蛋白转移到PVDF膜上,封闭缓冲液封闭1h,用抗FTO和βactin的抗体(1∶1 000),室温孵育2h。再与对应的辣根过氧化物酶偶联的二抗(1∶2 000)室温下孵育2h,最后利用Bio-Rad GS-800曝光系统检测目的蛋白,并用Quantity One软件分析蛋白表达量。
1.2.4 山羊FTO基因时序表达谱 分别提取1~3月龄、8~10月龄和24月龄左右的公羊皮下脂肪、背最长肌、股二头肌和臂三头肌的总RNA(每个阶段每个组织n=9),并取1μg总RNA反转录成cDNA。利用qPCR检测FTO在3个发育阶段的表达差异。反应体系及反应条件同1.2.3。
1.2.5 IMF的测定 采用索氏抽提法测定1~3月龄、8~10月龄和24月龄左右的3个阶段山羊背最长肌、股二头肌和臂三头肌的IMF含量(每个阶段公羊各9只),按照公式计算IMF含量:
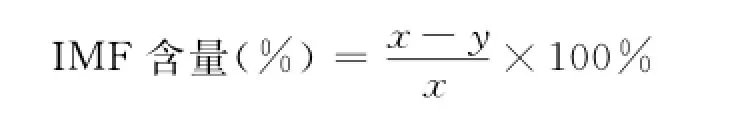
式中,x表示浸提前样品干重,y表示浸提后的样品干重。
1.2.6 数据统计分析 数据用“平均值±标准差(Mean±SD)”表示,组织差异定量分析结果以脂肪组织的Ct值为对照来计算,不同发育阶段以1~3月龄为对照,结果用2-ΔΔCt方法进行统计分析[16]。最终结果以SPSS 18.0软件中的One-way ANOVA进行显著性检验分析,基因的表达量与IMF含量的相关用Bivariate Correlations的Pearson Correlation进行分析。当P<0.05时,认为差异显著,当P<0.01时,认为差异极显著。
2 结 果
2.1 山羊FTO基因CDS扩增及克隆测序
利用RT-PCR方法扩增,1%琼脂糖凝胶进行电泳检测,获得与预期目的片段大小一致的特异条带,经过测序进一步验证获得山羊FTO基因核苷酸序列1 731bp,其中5'非翻译区为34bp,3′非翻译区为179bp,ORF为1 518bp,编码505个氨基酸(图1),将获得序列提交GenBank(KR013052)。进一步分析其碱基组成显示A=25.8%,C=23.6%,G=27.9%,T=22.7%,X=0.0%,(G+C)>(A+T)%,说明该基因CDS区DNA双链较稳定。
2.2 物种间FTO同源性比较以及进化树构建
本试验克隆得到的山羊FTO核苷酸序列与GenBank上登陆的山羊序列(XM_005691984.1)比较有4个SNPs位点,即139位的C-T、865位的CG、1 105位的G-A和1 573位的A-G。利用NCBI在线比对程序BLAST将山羊FTO推测的氨基酸序列与绵羊、牛、印度水牛、马、野骆驼、人、猕猴、猪和小鼠的氨基酸序列进行比对,发现同源性较高,为82%~100%。同时利用各物种的氨基酸序列构建了系统进化树(图2),结果显示,FTO基因在各物种间具有较高的保守性,山羊FTO与反刍动物在同一分支,亲缘关系最近。
2.3 山羊FTO蛋白结构与功能预测
2.3.1 FTO理化性质分析 推测的山羊FTO蛋白序列经分析发现该蛋白由505个氨基酸残基组成,利用ExPASy在线工具对该蛋白的理化性质进行分析显示,该蛋白分子式为C2609H4053N709O771S27,分子质量为58.55ku,理论等电点为5.28,说明为酸性蛋白。原子总数为8 169,不稳定系数为51.24,为不稳定蛋白。带负电荷的氨基残基(Asp+Glu)总数为79,带正电荷的氨基酸残基(Arg+Lys)总数为60,因此整体上带负电。
2.3.2 FTO蛋白结构与功能的预测 疏水性预测结果显示,山羊FTO蛋白在12位点处存在最小亲水指数-3.222,在438位点存在最大亲水指数2.000。疏水性平均值-0.523,为亲水性蛋白。跨膜结构域分析显示,山羊FTO蛋白无跨膜结构;信号肽分析发现该蛋白无信号肽,为非分泌蛋白。蛋白修饰分析发现,该蛋白具有7个丝氨酸磷酸化位点(分别位于56、183、229、256、319、355、358位点)、5个苏氨酸磷酸化位点(分别位于4、6、32、282、320)、5个络氨酸磷酸化位点(39、108、127、220、475),2个N-糖基化位点,无O-糖基化位点。蛋白质结构域分析结果显示,山羊FTO蛋白的35~326位氨基酸序列为FTO催化结构域,329~500位氨基酸为C端结构域(图1、图3)。亚细胞定位分析指出,FTO主要在细胞质(73.9%)、细胞核(21.7%)和细胞骨架(4.3%)中发挥生物学作用。FTO二级结构预测显示,α-螺旋为208个,占41.19%,82个β折叠占16.24%,无规则卷曲215个占42.57%(图4)。利用网上在线工具SWISSMODEL分析了该蛋白的三级结构(图5),进一步证明了二级结构的预测。
2.3.3 FTO蛋白相互作用分析 利用STRING交互式数据库搜索山羊FTO蛋白相互作用蛋白(条件限制在10个蛋白内),结果表明,FTO蛋白可能与MC4R、NPY、UCP1、CDKAL1等存在相互作用(图6),通过这个分析可为更深入的研究山羊FTO蛋白的功能提供重要的支持。
2.4 山羊FTO基因的组织表达分析
qPCR和Western blotting检测结果发现,FTO基因在山羊7个不同组织中均存在广泛表达(图7)。但FTOmRNA和蛋白表达存在不同,mRNA结果显示,其中在山羊脂肪、脾和肺中存在高水平表达,极显著高于其他各个组织(P<0.01),其次在肝和肾中也存在较高水平的表达(P<0.01),在背最长肌中的表达水平最低。但FTO蛋白表达则在背最长肌和脾中表达最高(P<0.01),脂肪组织中表达次之,显著高于肝和肺组织(P<0.05)。
2.5 山羊FTO基因的时序表达分析
qPCR结果显示,FTO基因在3个生长发育阶段的脂肪和肌肉组织均被检测到表达,其中在8~10月龄与24月龄的脂肪组织FTOmRNA表达水平显著高于1~3月龄的表达水平(P<0.05);FTO mRNA在24月龄的背最长肌和股二头肌的表达水平显著高于其他两个阶段的表达水平(P<0.05),但在臂三头肌的3个阶段该基因表达水平均无显著差异(P>0.05)(图8)。

图1 山羊FTO核苷酸及其推测的氨基酸序列Fig.1 Nucleotide sequences and deduced amino acid sequences of goat FTO
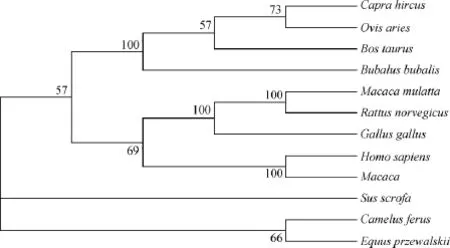
图2 不同物种间FTO基因的进化树Fig.2 Phylogenetic tree of FTOof various species

图3 山羊FTO推测的氨基酸序列生物学功能预测Fig.3 Prediction of biological function of the deduced amino acid sequence of goat FTO

图4 FTO氨基酸序列二级结构预测Fig.4 The predicted secondary structure of amino acid sequence of FTO
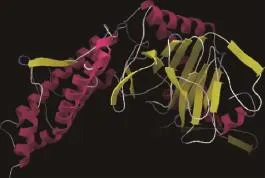
图5 FTO氨基酸序列三级结构预测Fig.5 The predicted tertiary structure of amino acid sequence of FTO
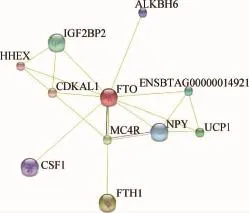
图6 山羊FTO蛋白与其他蛋白相互作用网络Fig.6 The interaction network of goat FTO with other proteins
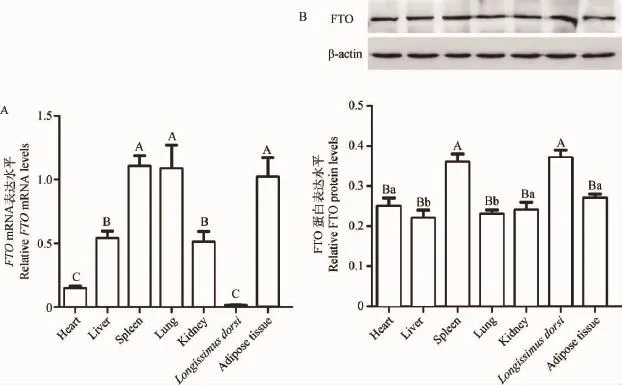
图7 山羊FTO的组织分布Fig.7 Tissue distribution of goat FTO
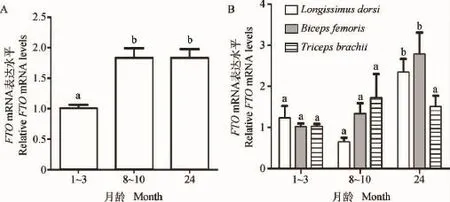
图8 FTO在不同发育阶段山羊组织中的表达水平Fig.8 FTOmRNA expression in tissues of goat at different ages
2.6 山羊不同肌肉组织FTO mRNA表达与IMF含量的相关分析
不同部位肌肉IMF含量测定结果显示(图9),24月龄背最长肌IMF含量显著高于1~3月龄与8~10月龄的IMF含量(P<0.05);股二头肌和臂三头肌的3个阶段IMF含量无显著变化;且24月龄背最长肌的IMF含量高于同阶段的股二头肌和臂三头肌的IMF含量(P<0.05)。山羊不同部位肌肉组织FTO基因表达水平与IMF含量的相关分析结果表明,FTO基因在山羊背最长肌各个阶段的表达水平与相对应的IMF含量呈显著负相关(P<0.05),相关系数为-0.415,与股二头肌和臂三头肌的IMF含量呈正相关,相关系数分别为0.014和0.093(表2)。
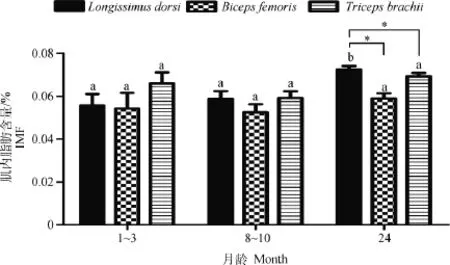
图9 山羊不同肌肉部位肌内脂肪含量的发育性变化Fig.9 IMF content developmental changes in muscles of different parts of goat
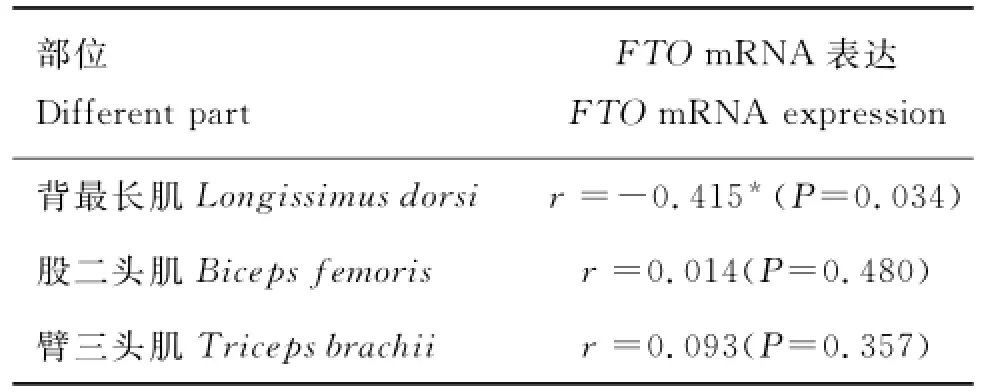
表2 山羊FTO基因的表达水平与IMF含量的相关性分析Table 2 The correlation of FTOgene expression and IMF content in muscles of different parts in goat
3 讨 论
FTO基因最初由科学家1994年在脚趾融合的变异小鼠中发现[17],并在1999年克隆得到该基因[18],但前面对该基因一直未引起重视,直到2007年发现其与肥胖相关后才引起科研工作者(包括畜牧研究者)的广泛关注。本研究首先克隆得到山羊FTO基因序列,发现其有4个多态位点,并未导致氨基酸序列的改变,经分析发现,推测的氨基酸序列含有FTO特有的结构域,并且该蛋白属于无跨膜结构的非分泌蛋白。该基因具有多个磷酸化位点和2个糖基化位点,推测这些位点是调控山羊FTO蛋白功能的关键位点,这符合蛋白质磷酸化和糖基化是蛋白质翻译后的修饰方式的说法[19-20]。同源性分析发现,山羊FTO氨基酸序列与绵羊、牛、马、人、猪等动物的同源性较高,且2-酮戊二酸的配基结合位点组氨酸(H231,H307)、天冬氨酸(D233)和精氨酸(R316,R322)完全一致,这与该基因具有高度保守性的报道相一致[21-23]。
为进一步研究FTO基因在山羊肉质中的作用,本研究检测了该基因在山羊各个组织中的表达差异,获得其组织表达谱。研究结果指出,FTO mRNA和蛋白在所选山羊7个组织中均存在广泛表达,但其mRNA和蛋白表达水平在各个组织中存在差异。比如FTO mRNA在皮下脂肪、脾和肺中表达水平最高,在背最长肌中表达最低,但FTO蛋白在背最长肌中表达水平最高,其原因可能是由于该基因在肌肉组织中所转录的mRNA比较稳定,降解速度慢,因此翻译的蛋白质比较多。FTO在山羊各个组织中的表达谱与其他动物存在着一些相似及不同之处。如FTO基因在人、小鼠与大鼠的下丘脑中表达最丰富,调控食物摄入和能量平衡[2122,24];Y.F.Wang等2012年发现,FTO在鸡的下丘脑、肝、内脏脂肪和小脑中高表达,说明其主要参与鸡的能量调节[25],并且A.Tiwari等指出,饲养条件的改变可以导致鸡FTOmRNA和蛋白水平的变化[26];M.B.Madsen等指出,FTO mRNA在哥廷根小型猪的肌肉、肝、肾、心等均检测到了较高水平的表达,但还是在小脑中表达水平最高[27];S.P.Sébert等在研究产前营养和肥胖对绵羊FTO基因表达影响时候发现,FTO在1岁绵羊的下丘脑中表达最高,其次是肌肉,在胰腺和肾中表达水平最低[28]。综上所述,FTO基因的组织表达谱具有物种和品种特异性,这也决定了该基因在各个物种中所发挥的主要作用不同。
由上述FTO基因的保守性及组织表达特性可以推测,该基因在进化中可能有着重要调控作用,并且关于FTO基因在脂肪组织中的表达与肥胖的关系尤受人关注[29-30,7],FTO的多态性是通过身体质量指数(Body mass index,BMI)来介导肥胖的。研究指出,FTO基因突变小鼠(FTO-/-)和正常小鼠(FTO+/+)相比,当敲除FTO基因后,脂肪含量显著下降[31]。并且畜牧科研工作者在某些物种上发现FTO基因与动物肉质性状有关,如Z.L.Hu等研究指出猪FTO基因位于背膘、平均日增重相关的QTL附近[32],并且后续有试验证明猪FTO基因的c.594C>G和g.276T>G两个多态位点与肌内和肌间脂肪沉积有关[33,12]。L.A.Rempel和S.J.Wei等分别报道FTO多态性与牛的体重及背最长肌面积存在显著相关[34,14]。G.W.Zhang等指出,兔FTOSNPs与生长性状及肉质性状相关[15]。本试验研究发现,FTO基因在山羊的3个典型发育阶段(羔羊、育成羊和成年羊)的皮下脂肪、背最长肌、股二头肌和臂三头肌4种组织中均存在表达,推测该基因的作用可能贯穿于山羊的整个生长发育阶段。但该基因在不同肌肉中的表达模式不同,说明其表达具有部位特异性。为了阐明FTO基因是否与山羊肌内脂肪沉积有关,同时对基因在不同部位肌肉中的表达水平与IMF含量进行了关联分析。结果指出,山羊FTO的基因表达与不同部位肌肉组织IMF含量均存在相关,且与背最长肌中IMF含量相关达到显著水平,推测其主要参与山羊背最长肌的肌内脂肪沉积。本研究数据提示,FTO可以作为山羊IMF沉积的候选基因,根据软件预测的FTO可能相互作用的蛋白质来推测其作用机制可能是通过与MC4R、NPY和UCP1等与脂代谢相关蛋白的互作来实现的。研究指出,MC4R可作为肉牛肥育性状及IMF相关的候选基因[35-36],NPY的受体NPY2R多态性与BMI呈显著相关[37],UCP1基因的SNPs与人体脂沉积存在相关性[38]。并且S.Cauchi等2009年在肥胖中的研究指出FTO与MC4R基因的多态性对肥胖的影响具有联合效应[39],与本试验的预测结果相一致。但这几个相关蛋白是如何与FTO进行协同作用调控山羊IMF沉积的,其具体的作用机制则需要构建山羊FTO表达载体,转染到体外培养的肌内脂肪细胞,然后利用免疫共沉淀技术来做进一步阐明。
4 结 论
本研究克隆得到包含完整开放阅读框的山羊FTO基因序列,该蛋白是分子量为58.55ku的不稳定亲水性酸性非分泌蛋白,预测发现具有17个磷酸化位点,2个糖基化位点,具有FTO典型的催化结构域和C端结构域。高级结构由α-螺旋、β-折叠和无规则卷曲组成。FTOmRNA和蛋白广泛表达于各个组织中,其中mRNA水平在山羊的脂肪、脾和肺中存在高水平表达,在背最长肌中的表达量最低;FTO蛋白表达水平在背最长肌和脾中表达较高,脂肪组织中表达次之。不同发育阶段山羊不同部位肌肉组织FTO mRNA表达水平与相应的IMF含量呈不同程度的相关性。本试验为进一步研究FTO基因在山羊脂肪沉积中的调控作用提供重要的基础数据。
参考文献(References):
[1] SCOLLAN N,HOCQUETTE J F,NUERNBERG K,et al.Innovations in beef production systems that enhance the nutrional and health value of beef lipids and their relationship with meat quality[J].Meat Sci,2006,74(1):17-33.
[2] WANG Y H,BYRNE K A,REVERTER A,et al.Transcriptional profiling of skeletal muscle tissue from two breeds of cattle[J].Mamm Genome,2005,16(3):201-210.
[3] FRAYLING T M,TIMPSON N J,WEEDON M N,et al.A common variant in the FTO gene is associated with body mass index and predisposes to childhood and adult obesity[J].Science,2007,316(5826):889-894.
[4] ROBBENS S,ROUZÉP,COCK J M,et al.The FTO gene,implicated in human obesity,is found only in vertebrates and marine algae[J].J Mol Evol,2008,66(1):80-84.
[5] TUNG Y C,AYUSO E,SHAN X,et al.Hypothalamic-specific manipulation of Fto,the ortholog of the human obesity gene FTO,affects food intake in rats[J].PLoS One,2010,5(1):e8771.
[6] DINA C,MEYRE D,GALLINA S,et al.Variation in FTO contributes to childhood obesity and severe adult obesity[J].Nat Genet,2007,39(6):724-726.
[7] MERKESTEIN M,LABER S,MCMURRAY F,et al.FTO influences adipogenesis by regulating mitotic clonal expansion[J].Nat Commun,2015,6:6792.
[8] SCOTT L J,MOHLKE K L,BONNYCASTLE L L,et al.A genome-wide association study of type 2diabetes in Finns detects multiple susceptibility variants [J].Science,2007,316(5829):1341-1345.
[9] FAWWAD A,SIDDIQUI I A,ZEESHAN N F,et al.Association of SNP rs9939609in FTO gene with metabolic syndrome in type 2diabetic subjects,rectruited from a tertiary care unit of Karachi,Pakistan[J].Pak J Med Sci,2015,31(1):140-145.
[10] ZHOU D,LIU H,ZHOU M,et al.Common variant (rs9939609)in the FTO gene is associated with metabolic syndrome[J].Mol Biol Rep,2012,39(6):6555-6561.
[11] JIA X,NIE Q,LAMONT S J,et al.Variation in sequence and expression of the avian FTO,and association with glucose metabolism,body weight,fatness and body composition in chickens[J].Int J Obes (Lond),2012,36(8):1054-1061.
[12] FONTANESI L,SCOTTI E,BUTTAZZONI L,et al.The porcine fat mass and obesity associated(FTO)gene is associated with fat deposition in Italian Duroc pigs[J].Anim Genet,2009,40(1):90-93.
[13] ZHANG B,ZHANG Y,ZHANG L Z,et al.Allelic polymorphism detected in the bovine FTO gene[J].Mol Biotechnol,2011,49(3):257-262.
[14] WEI S J,ZAN L S,UJAN J A,et al.Novel polymorphism of the bovine fat mass and obesity-associated (FTO)gene are related to backfat thickness and longissimus muscle area in five Chinese native cattle breeds[J].AFR J Biotechnol,1022,10(5):2820-2824.
[15] ZHANG G W,GAO L,CHEN S Y,et al.Single nucleotide polymorphisms in the FTO gene and their association with growth and meat quality traits in rabbits[J].Gene,2013,527(2):553-557.
[16] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod[J].Methods,2001,25 (4):402-408.
[17] VAN DER HOEVEN F,SCHIMMANG T,VOLKMANN A,et al.Programmed cell death is affected in the novel mouse mutant Fused toed(Ft)[J].Development,1994,120(9):2601-2607.
[18] PETERS T,AUSMEIER K,RÜTHER U.Cloning of Fatso(Fto),a novel gene deleted by the Fused toes (Ft)mouse mutation[J].Mamm Genome,1999,10 (10):983-986.
[19] KIM J H,LEE J,OH B,et al.Prediction of phosphorylation sites using SVMs[J].Bioinformatics,2004,20(17):3179-3184.
[20] GUPTA R,BRUNAK S.Prediction of glycosylation across the human proteome and the correlation to protein function[J].Pac Symp Biocomput,2002:310-322.
[21] FREDRIKSSON R,HÄGGLUND M,OLSZEWSKI P K,et al.The obesity gene,FTO,is of ancient origin,up-regulated during food deprivation and expressed in neurons of feeding-related nuclei of the brain[J].Endocrinology,2008,149(5):2062-2071.
[22] GERKEN T,GIRARD C A,TUNG Y C,et al.The obesity-associated FTO gene encodes a 2-oxoglutarate-dependent nucleic acid demethylase[J].Science,2007,318(5855):1469-1472.
[23] STRATIGOPOULOS G,PADILLA S L,LEDUC C A,et al.Regulation of Fto/Ftm gene expression in mice and humans[J].Am J Physiol Regul Integr Comp Physiol,2008,294(4):1185-1196.
[24] QI L,KANG K,ZHANG C,et al.Fat mass-and obesity-associated(FTO)gene variant is associated with obesity:longitudinal analyses in two cohort studies and functional test[J].Diabetes,2008,57(11):3145-3151.
[25] WANG Y F,RAO K Q,YUAN L X,et al.Chicken FTO gene:Tissue-specific expression,brain distribution,breed difference and effect of fasting[J].Comp Biochem Physiol AMol Integr Physiol,2012,163(3-4):246-252.
[26] TIWARI A,KRZYSIK-WALKER S M,RAMACHANDRAN R.Cloning and characterization of chicken fat mass and obesity associated(Fto)gene:fasting affects Fto expression[J].Domest Anim Endocrinol,2012,42(1):1-10.
[27] MADSEN M B,BIRCK M M,FREDHOLM M,et al.Expression studies of the obesity candidate gene FTO in pig[J].Anim Biotechnol,2010,21(1):51-63.
[28] SÉBERT S P,HYATT M A,CHAN L L,et al.Influence of prenatal nutrition and obesity on tissue specific fat mass and obesity-associated(FTO)gene expression[J].Reproduction,2010,139(1):265-274.
[29] KLÖTING N,SCHLEINITZ D,RUSCHKE K,et al.Inverse relationship between obesity and FTO gene expression in visceral adipose tissue in humans[J].Diabetologia,2008,51(4):641-647.
[30] ZABENA C,GONZÁLEZ-SÁNCHEZ J L,MARTíNEZLARRAD M T,et al.The FTO obesity gene.Genotyping and gene expression analysis in morbidly obese patients[J].Obes Surg,2008,19(1):87-95.
[31] CHURCH C,LEE S,BAGG E A,et al.A mouse model for the metabolic effects of the human fat mass and obesity associated FTO gene[J].PLoS Genet,2009,5(8):E1000599.
[32] HU Z L,REECY J M.Animal QTLdb:beyond a repository.A public platform for QTL comparisons and integration with diverse types of structural genomic information[J].Mamm Genome,2007,18(1):1-4.
[33] FAN B,DU Z Q,ROTHSCHILD M F.The fat mass and obesity-associated(FTO)gene is associated with intramuscular fat content and growth rate in the pig [J].Anim Biotechnol,2009,20(2):58-70.
[34] REMPEL L A,CASAS E,SHACKELFORD S D,et al.Relationship of polymorphisms within metabolic genes and carcass traits in crossbred beef cattle[J].J Anim Sci,2012,90(4):1311-1316.
[35] WANG W,XUE W,JIN B,et al.Candidate gene ex-pression affects intramuscular fat content and fatty acid composition in pigs[J].J Appl Genet,2013,54 (1):113-118.
[36] 黄 萌,许尚忠,李俊雅,等.中国西门塔尔牛MC3R 和MC4R基因组织表达谱及其在脂肪组织中表达水平与背膘厚度的相关性研究[J].畜牧兽医学报,2011,42(4):489-494.HUANG M,XU S Z,LI J Y,et al.The tissues profile of MC3Rand MC4Rand the association of their expression in the adipose with backfat thickness in Chinese Simmental cattle[J].Acta Veterinaria et Zootechnica Sinica,2011,42(4):489-494.(in Chinese)
[37] HUNT S C,HASSTEDT S J,XIN Y,et al.Polymorphisms in the NPY2Rgene show significant associations with BMI that are additive to FTO,MC4R,and NPFFR2gene effects[J].Obesity(Silver Spring),2011,19(11):2241-2247.
[38] SHIN H D,KIM K S,CHA M H,et al.The effects of UCP-1polymorphisms on obesity phenotypes among Korean female subjects[J].Biochem Biophys Res Commun,2005,335(2):624-630.
[39] CAUCHI S,STUTZMANN F,CAVALCANTIPROENÇA C,et al.Combined effects of MC4Rand FTO common genetic variants on obesity in European general populations[J].J Mol Med(Berl),2009,87 (5):537-546.
(编辑 郭云雁)
Cloning and Expression Profiling of FTOGene of Goat
LIN Ya-qiu1#,LIAO Hong-hai1,2#,HE Qing-hua1,LI Qian1,2,WANG Yong1,2*
(1.College of Life Science and Technology,Southwest University for Nationalities,Chengdu610041,China;2.Key Laboratory of Sichuan Province for Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Exploitation,Chengdu610041,China)
Abstract:The aim of this study was to clarify the expression characteristics of FTOgene and investigate the correlation between FTOexpression and intramuscular fat(IMF)content in muscles.The FTOgene was cloned from Jianzhou Da’er goat by RT-PCR method.Quantitative Realtime PCR(qPCR)and Western blotting were used to measure the expression profiles of FTOgene in tissues,especially in various parts of muscle of goats at different developmental stages.The correlation analysis was performed between FTOgene and IMF content.The results showed that goat FTOgene was 1 518bp in CDS length,encoding 505amino acids.The FTO protein was predicted to be non-secretory and lacking cross-membrane domain.The mRNA level of FTO was higher in adipose,spleen and lung(P<0.01),while lowest in longissimus dorsi;However,the protein level of FTO was higher in longissimus dorsi and spleen than that in adipose(P<0.01).The mRNA level of FTOwas significantly higher in longissimus dorsi and biceps femoris of 24-month-old goats than that in 1to 3-month-old and 8to 10-month-old goats(P<0.05).ThemRNA level of FTOwas negatively correlated with IMF content of longissimus dorsi(P<0.05)but positively correlated with IMF content of biceps femoris and triceps brachii.In this study,we investigated a significant correlation between FTOexpression and IMF,which indicates that FTO may serve as a candidate gene for IMF.
Key words:goat;FTO;clone;tissue expression;intramuscular fat content
中图分类号:S827;S813.3
文献标志码:A
文章编号:0366-6964(2016)05-0888-11
doi:10.11843/j.issn.0366-6964.2016.05.005
收稿日期:2015-05-28
基金项目:四川省“十二五”畜禽育种攻关项目(2011NZ0099-36);四川省科技创新产业链示范工程重大项目(2014NZ0003);四川省教育厅项目(15ZA0385)
作者简介:林亚秋(1976-),女,内蒙古海拉尔人,博士,副教授,主要从事动物遗传育种研究,E-mail:linyq1999@163.com;廖红海(1988-),男,仡佬族,贵州正安人,硕士生,主要从事动物遗传育种与繁殖研究,E-mail:liaohonghaivip@163.com;林亚秋与廖红海为并列第一作者
*通信作者:王 永,博士,教授,博士生导师,主要从事动物遗传育种与繁殖研究,E-mail:wangyong010101@swun.cn
