单增李斯特菌膜裂解相关基因缺失突变株的构建及生物学特性鉴定
2016-07-11江玲丽高有领周向阳钱国英方维焕
江玲丽,高有领,周向阳,白 帆,方 春,钱国英*,方维焕
(1.宁波卫生职业技术学院,宁波 315100;2.浙江万里学院,宁波 315100;3.舟山出入境检验检疫局,舟山 316000;4.浙江大学动物预防医学研究所,杭州 310058)
单增李斯特菌膜裂解相关基因缺失突变株的构建及生物学特性鉴定
江玲丽1,高有领2,周向阳3,白帆4,方春4,钱国英2*,方维焕4
(1.宁波卫生职业技术学院,宁波 315100;2.浙江万里学院,宁波 315100;3.舟山出入境检验检疫局,舟山 316000;4.浙江大学动物预防医学研究所,杭州 310058)
摘要:拟探明单核细胞增多性李斯特菌(单增李斯特菌)分离株M7可能的低致病力机制。利用SOE-PCR及同源重组法构建M7膜裂解相关基因hly及plcB单缺失(M7-Δhly和M7-ΔplcB)及双缺失突变株(M7-Δhly/plcB),比较它们与亲本株的生物学特性差异。结果如下:PCR及反转录PCR表明突变株构建成功。突变株M7-Δhly和M7-Δhly/plcB因hly缺失致其溶血活性丧失。plcB缺失突变株M7-ΔplcB和M7-Δhly/plcB无可见溶脂活性。单缺失突变株M7-ΔplcB、M7-Δhly与M7具有相似的细胞黏附及增殖能力(P>0.05)。MOI为1 000时,双缺失突变株M7-Δhly/plcB对Caco-2细胞毒性最低(11.10%),M7-Δhly次之(23.53%)(P<0.05)。空斑试验表明菌株M7和M7-ΔplcB仅能在无庆大霉素培养基中形成空斑。hly及plcB缺失致单增李斯特菌对免疫抑制小鼠毒力降低。单增李斯特菌M7低致病力可能与hly及plcB的高水平表达有关,致细菌对宿主细胞毒性增强而从细胞内逸出,使其不能躲避宿主免疫系统而被清除。
关键词:单增李斯特菌;膜裂解相关基因;细胞毒性;生物学特性
单核细胞增多性李斯特菌(简称单增李斯特菌)为重要的食源性病原菌,可致胃肠炎、败血症、脑炎和脑膜炎,老人、儿童和免疫抑制人群最易感,孕妇感染后致流产。虽然发生率不高,但死亡率较高[1]。单增李斯特菌在自然界广泛存在,在土壤、水、废水、农场、植物表面及食品加工表面等环境中营腐生生活[1]。此外作为胞内菌,单增李斯特菌在巨噬细胞中具备强大的存活能力;能侵袭入非吞噬细胞(如肝细胞、上皮细胞、内皮细胞等)并能高效复制和增殖[2]。单增李斯特菌的细胞内感染过程主要包括:1)由内化素A和B(InlA和InlB)主导的黏附与侵袭;2) 由溶血素O(LLO)以及磷脂酶A和B(PLcA和PLcB)协同作用逃离吞噬体并逸入细胞质中;3)在肌动蛋白ActA和内化素C(InlC)的介导下实现细胞间的扩散。上述毒力因子主要由转录调控因子PrfA所调控[3-4]。
LLO由hly基因编码,为单增李斯特菌主要毒力因子,属于胆固醇依赖型膜穿孔蛋白家族(CDCs),通过插入它的蛋白疏水区到宿主细胞膜的磷脂双层,进而破坏宿主细胞吞噬体膜,为细菌逸入细胞质中增殖所必需[5]。在小鼠模型中,感染初期LLO能引发树突细胞及淋巴细胞的凋亡[6]。在变形虫等原生动物模型中,单增李斯特菌能抑制纤毛虫四膜虫生长并加速其胞囊形成,究其原因主要与LLO的消化性空泡裂解有关[7]。
此外,单增李斯特菌分泌的磷脂酶PLcA和PLcB参与吞噬体膜的裂解和细菌逃逸。PLcA和PLcB分别属于磷脂酰肌醇特异性磷脂酶(PI-PLC)和广谱磷脂酶(PC-PLC)。PC-PLC(编码基因plcB)主要以协同LLO的方式参与吞噬体膜的裂解,为单增李斯特菌、金黄色葡萄球菌、结核分枝杆菌、产气荚膜梭状芽孢杆菌、绿脓杆菌等胞内菌主要的毒力因子[8]。有研究表明,结核分枝杆菌主要通过磷脂酶对宿主细胞产生毒性,致宿主细胞坏死[8]。
在前期研究中,作者分离到单增李斯特菌M7,该菌株具有强溶血、溶脂活性,较高的细胞黏附及侵袭能力,但在小鼠模型及体外培养细胞空斑试验中毒力较弱[9-10]。因而是否可能因为该菌株的强溶血及溶脂活性致细菌对宿主细胞毒性增强,致宿主细胞裂解,因而细菌不能躲避宿主的免疫系统攻击而被清除,从而呈现低毒力?本研究旨在构建与吞噬体膜裂解相关基因hly与plcB单基因(全基因)缺失突变株(M7-Δhly、M7-ΔplcB)及双基因(全基因)缺失突变株M7-Δhly/plcB,通过研究突变株M7-Δhly、M7-ΔplcB、M7-Δhly/plcB的细胞毒性、细胞黏附率、细胞内增殖能力及对小鼠致病力等生物学特性,进而为阐明M7低致病力的可能机制奠定重要基础。
1材料与方法
1.1菌株,质粒,培养基,试剂和引物
大肠杆菌 DH5α及质粒pUC18、单增李斯特菌消毒奶分离株M7系本实验室保存。李斯特菌培养基TSB-Y和BHI购自北京陆桥技术有限责任公司。单增李斯特菌标准菌株EGD由丹麦哥本哈根大学Jakobsen教授惠赠,穿梭质粒pKSV7由美国康奈尔大学Wiedmann博士惠赠。T4多聚核苷酸激酶、DNA连接试剂盒、DNA Marker、限制性内切酶Hind Ⅲ和EcoRⅠ购自TaKaRa宝生物(大连)公司,dNTPs、SuperTaq购自上海申能博彩生物技术有限公司,PCR产物纯化试剂盒、UNIQ-10胶回收试剂盒购于AXYGEN公司,庆大霉素、TaqDNA聚合酶购自北京鼎国生物技术有限责任公司。中性红、Triton X-100购自美国Sigma公司,细胞培养基DMEM、RPMI 1640(不含酚红)购自美国Gibco公司,细胞毒性试剂盒CytoTox96购自美国Promega公司。本文中涉及的引物均由英潍捷基 (上海)贸易有限公司合成(表1)。
表1本试验所涉及的引物列表
Table 1Primers used in the current study

引物Primer序列(5'-3')Sequence(5'-3')扩增长度/bpProductlengthhly-ahly-bATAAGCTTTAATATCGATGTACCGTATTCCTGCTT(HindⅢ)aTTATTACTTTTAAAAGGGTTTCACTCTCCTTCTAC581hly-chly-dTTTTAAAAGTAATAAAAAATTAAGAATAAAACCGCTTCAGAATTCTCCATTTATGAAAGTGATTTTATTATC(EcoRⅠ)650hly-ID2CATGTAGTGGCCTCTGGAGCAAT3156or1566plcB-aplcB-bGGGAAGCTTCCAAAGCTAGCAGCACTTCC(HindⅢ)ATCACTCACCTCACTTTTTTCTTTCAT444plcB-cplcB-dAGTGAGGTGAGTGATCAATATTTAGGAATGCATTCCGCGAATTCCTAACAAACCGCACTATTACAATAG(EcoRⅠ)512plcB-ID2CACTCAATCTCCTTTGCATCGCTTA2053or1183
a下划线部分表示引入的酶切位点
aThe underlined sequences indicate the introduced restriction enzyme cutting site
1.2实验动物与细胞系
ICR小鼠购自浙江省中医药大学动物实验研究中心。L929细胞由浙江省医学科学院戴方韦女士惠赠,HeLa细胞由浙江大学动物科学学院孙红祥教授惠赠,Caco-2细胞系本实验室保存。
1.3突变株的构建
参照课题组已经建立的同源重组方法[11-12],构建hly全基因和plcB全基因单缺失突变株M7-Δhly、M7-ΔplcB及双基因缺失突变株M7-Δhly/plcB。首先在靶基因hly和plcB两端外侧分别设计两对引物(标记为引物a、b、c、d,并在引物a和d中分别引入HindⅢ和EcoR Ⅰ酶切位点)(表1)。利用基因切割和重叠延伸(SOE)PCR方法[13]扩增出hly-ad和plcB-ad靶基因片段,克隆于pUC18,构建成pUC-hly-ad和pUC-plcB-ad,经HindⅢ和EcoRⅠ酶切及PCR鉴定后,再利用pUC18和pKSV7质粒中相应的酶切位点,将目的片段亚克隆于穿梭质粒pKSV7,构建重组质粒pKSV7-hly-ad和pKSV7-plcB-ad。
将重组穿梭质粒pKSV7-hly-ad 和pKSV7-plcB-ad电转化入野生型M7菌株,通过温度和氯霉素抗性压力的双重筛选实现同源重组[11],将目的基因片段整合于M7基因组中,经PCR及RT-PCR鉴定,获得两个单基因缺失突变株M7-Δhly、M7-ΔplcB。此外,将重组穿梭质粒pKSV7-hly-ad电转入突变株M7-ΔplcB感受态细胞中,通过温度和氯霉素抗性压力实现同源重组,经PCR及RT-PCR鉴定,构建膜裂解相关基因hly和plcB双基因缺失的突变株M7-Δhly/plcB。
1.4溶脂活性试验
卵黄琼脂试验参照本实验室优化的方法进行[12],卵黄琼脂平板为BHI平板经高压灭菌冷却至55 ℃加入5%的卵黄悬液配制而成。将突变株M7-Δhly、M7-ΔplcB、M7-Δhly/plcB划线接种至卵黄琼脂平板,37 ℃培养48 h。
1.5溶血活性试验
按照T.Ono等建立的方法进行[14]。设PBS为阴性对照,阳性对照为终浓度0.2% 的Triton X-100。以各菌株在每个时间点的OD570 nm值与阴性对照OD570 nm的差值为纵坐标绘制图表,以比较各突变株及其亲本株的溶血活性。
此外,划线接种突变株M7-Δhly、M7-ΔplcB、M7-Δhly/plcB和亲本株M7到含5%绵羊血的BHI平板上,37 ℃培养24 h以观察其溶血现象。
1.6HeLa细胞黏附及细胞内增殖试验
按本实验室优化的方法[12,15]进行。突变株M7-Δhly、M7-ΔplcB和亲本株M7过夜培养物调整OD600 nm至0.12左右(约1×108cfu·mL-1),以1∶10与DMEM培养液混合,以每孔0.3 mL(12孔板)加入到融合度为80%左右的HeLa单层细胞中,在37 ℃、5%CO2感染1 h后加入100 μg·mL-1庆大霉素以杀灭细胞外细菌,PBS洗涤两次后,换用含10 μg·mL-1庆大霉素的DMEM培养液(2%胎牛血清)继续培养至12 h,用0.1% Triton-100和0.25%胰酶裂解细胞,细胞裂解液10倍梯度稀释后于BHI平板上进行细菌计数。黏附率计算公式:CFUrec/CFUadded×100(其中CFUrec表示细胞裂解后的细菌数,CFUadded代表加入孔内的实际细菌数)。细胞内增殖则用12 h的细胞裂解数与庆大霉素作用1 h后的细胞裂解数之间的对数差值表示。采用SPSS软件(IBM SPSS statistics 19)对突变株及亲本株的黏附和细胞内增殖进行统计学分析(P<0.05表明统计学差异显著)。
1.7细胞毒性试验
按照Y.R.Kim等[16]建立的方法进行。采用Cytotox 96®非放射性细胞毒性检测试剂盒,通过测定感染细胞培养上清液中的乳酸脱氢酶含量确定各菌株对Caco-2细胞的毒性。设置细菌与Caco-2细胞比例(MOI)分别为1 000、100、10,每个菌株包含3个重复,设标准菌株EGD为阳性对照。细胞毒性计算公式为细胞毒性=(OD试验孔-OD空白孔)/(OD阳性孔-OD空白孔)。采用SPSS软件(IBM SPSS statistics 19)进行统计学分析(P<0.05表明统计学差异显著)。
1.8L929细胞空斑试验
参照实验室优化的方法进行[12,17-18],调整各单增李斯特菌突变株及亲本株M7细菌浓度至1×108cfu·mL-1,以每孔5 μL加入至融合度为80%左右的L929单层细胞中,37 ℃、5% CO2感染1 h,经0.01 mol·L-1PBS (pH 7.4)洗涤3次后,覆盖3 mL含0.7%琼脂糖和含20 μg·mL-1庆大霉素的DMEM,同时设立不含庆大霉素处理组。待出现可见空斑(2~3 d)覆盖2 mL含0.7%琼脂糖和0.01%中性红的DMEM并拍照,以标准菌株EGD为阳性对照。
1.9小鼠毒力试验
参照本实验室方法[12]建立小鼠免疫抑制模型,比较突变株M7-Δhly、M7-ΔplcB、M7-Δhly/plcB和亲本株M7对ICR小鼠毒力的差异,以强毒参考菌株EGD为阳性对照。20~22 g ICR正常雌性小鼠腹腔注射角叉胶(200 mg·kg-1),24 h后收集各菌株过夜培养物,经PBS重悬调整浓度至109cfu·mL-1(OD600 nm值为1.2),10倍梯度稀释后进行平板计数以确定实际接种量。选取100~10-5稀释度腹腔接种小鼠,剂量为0.1 mL,每组接种6只小鼠,同时设PBS阴性对照组。连续观察10 d,每天记录小鼠死亡情况,改良寇氏法计算LD50(LD50= log-1[Xm-i(∑P-0.5)],其中Xm为最大剂量的对数值;i为相邻两组剂量对数值之差;P代表各组小鼠死亡率,用小数形式表示;∑P代表各组小鼠死亡率总和)。
2结果
2.1突变株构建与鉴定
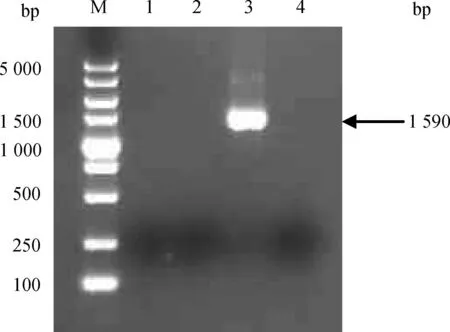
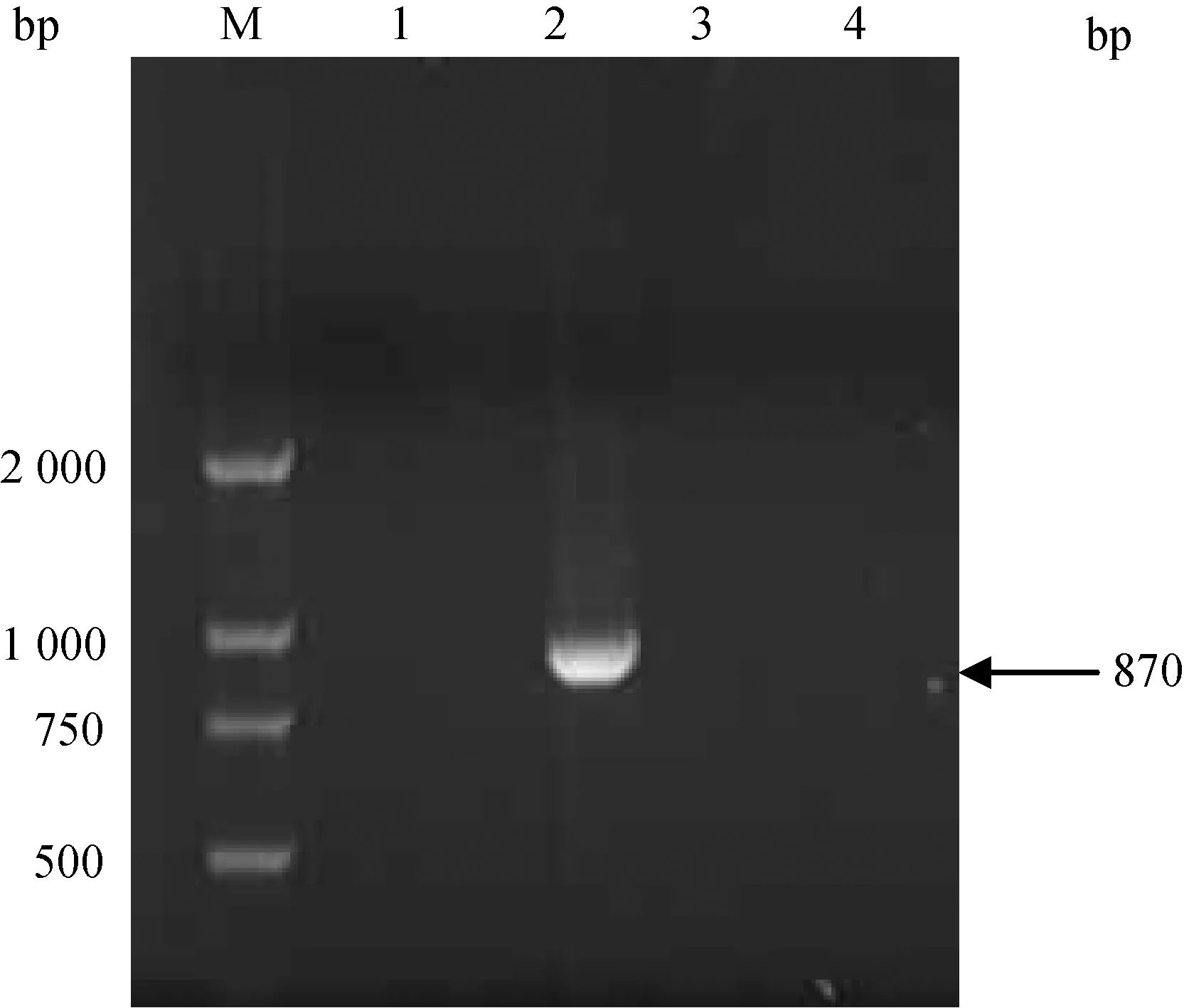
提取可疑重组菌的基因组DNA,于引物d外侧区域设计一条引物分别为hly-ID2(hly缺失突变株)和plcB-ID2(plcB缺失突变株)进行PCR鉴定。结果表明野生型菌株能获得3 156和2 053 bp条带(图1第3泳道,图2第3泳道),而M7-Δhly、M7-ΔplcB的扩增片段大小分别为1 566和1 183 bp条带(表1,图1第1泳道,图2第1泳道),表明突变株M7-Δhly、M7-ΔplcB已成功构建。双基因缺失突变株M7-Δhly/plcB的鉴定如前,以该菌株的基因组DNA为模板,以hly-a/hly-ID2及plcB-a/plcB-ID2为引物对,同时扩增hly和plcB引物 a和d外侧片段,结果表明该双基因缺失突变株M7-Δhly/plcB成功构建(图1、2,第2泳道)。对突变株M7-Δhly、M7-ΔplcB和M7-Δhly/plcB反转录结果表明野生型菌株M7能得到相应的hly(1 590 bp)或plcB(870 bp)目的片段(图3、4,第3泳道),而突变株M7-Δhly、M7-ΔplcB、M7-Δhly/plcB和阴性对照均无相应片段的扩增(图1、2,第1、2和4泳道),表明毒力基因hly或(和)plcB已成功缺失。

M.DL5000 DNA相对分子质量标准;1.单缺失突变株M7-Δhly的PCR扩增;2.双缺失突变株M7-Δhly/plcB的PCR扩增;3.亲本株M7的PCR扩增;4.阴性对照M.DL5000 DNA marker;1.PCR amplification from single mutant M7-Δhly;2.PCR amplification from double mutant M7-Δhly/plcB;3.PCR amplification from the wild type strain M7;4.Negative control图1 hly缺失突变株(M7-Δhly、M7-Δhly/plcB)的PCR鉴定Fig.1 PCR identification of L.monocytogenes mutants with hly full gene deletion
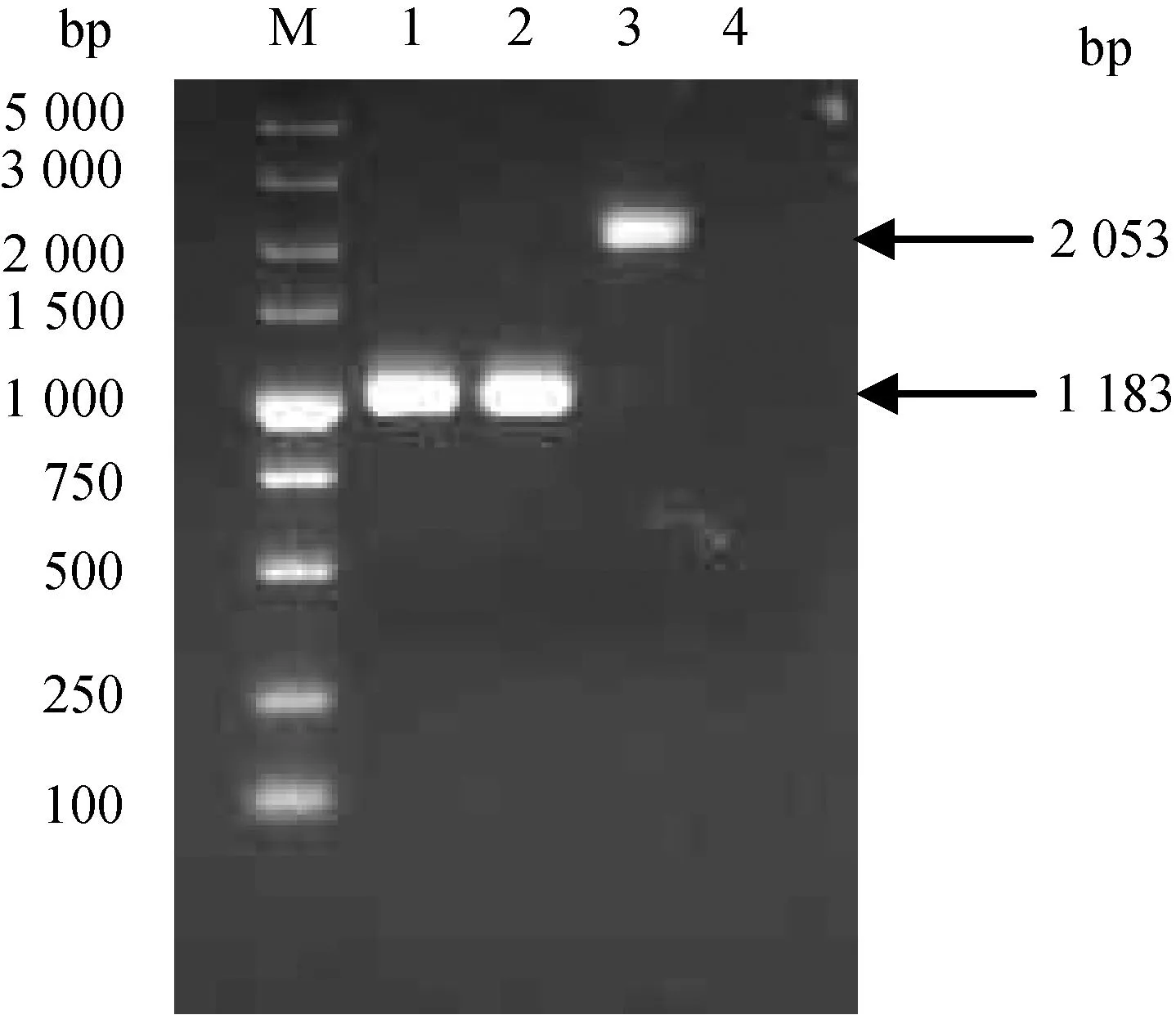
M.DL5000 DNA相对分子质量标准;1.单缺失突变株M7-ΔplcB的PCR扩增;2.双缺失突变株M7-Δhly/plcB的PCR扩增;3.亲本株M7的PCR扩增;4.阴性对照M.DL5000 DNA marker;1.PCR amplification from the single mutant M7-ΔplcB;2.PCR amplification from double mutant M7-Δhly/plcB;3.PCR amplification from the wild type strain M7;4.Negative control图2 plcB缺失突变株(M7-ΔplcB、M7-Δhly/plcB)的PCR鉴定Fig.2 PCR identification of L.monocytogenes mutants with plcB full gene deletion
M.DL5000 DNA相对分子质量标准;1.单缺失突变株M7-Δhly的RT-PCR扩增;2.双缺失突变株M7-Δhly/plcB的RT-PCR扩增;3.亲本株M7的RT-PCR扩增;4.阴性对照M.DL5000 DNA marker;1.RT-PCR amplification from single mutant M7-Δhly;2.RT-PCR amplification from double mutant M7-Δhly/plcB;3.RT-PCR amplification from the wild type strain M7;4.Negative control图3 hly缺失突变株(M7-Δhly、M7-Δhly/plcB)的RT-PCR鉴定Fig.3 RT-PCR identification of L.monocytogenes mutants with hly full gene deletion
M.DL2000 DNA相对分子质量标准;1.单缺失突变株M7-ΔplcB的RT-PCR扩增;2.双缺失突变株M7-Δhly/plcB的RT-PCR扩增;3.亲本株M7的RT-PCR扩增;4.阴性对照M.DL2000 DNA marker;1.RT-PCR amplification from single mutant M7-ΔplcB;2.RT-PCR amplification from double mutant M7-Δhly/plcB;3.RT-PCR amplification from the wild type strain M7;4.Negative control图4 plcB缺失突变株(M7-ΔplcB、M7-Δhly/plcB)的RT-PCR鉴定Fig.4 RT-PCR identification of L.monocytogenes mutants with plcB full gene deletion
2.2突变株的生物学特性
2.2.1溶脂溶血活性在5%卵黄琼脂平板中,plcB缺失突变株M7-ΔplcB、M7-Δhly/plcB无可见强溶脂活性,而突变株M7-Δhly及亲本菌株M7仍呈现强溶脂活性(图5)。此外,如图6所示,突变株M7-Δhly和M7-Δhly/plcB溶血活性消失,而亲本株M7与突变株M7-ΔplcB的溶血情况基本一致,在1 h左右达到最高值(图6)。在5%绵羊血琼脂平板中hly缺失突变株M7-Δhly和M7-Δhly/plcB无可见溶血圈(图7),而突变株M7-ΔplcB及其亲本菌株M7具有相似的溶血活性,具有明显β溶血环(图7),与前面的细菌、红细胞共培养结果一致。
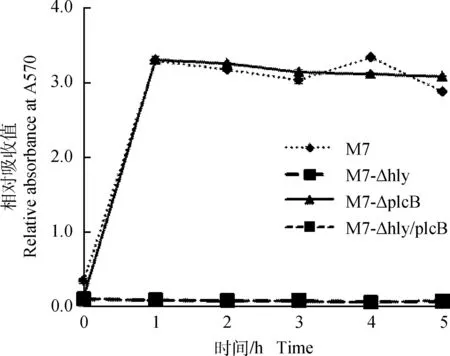
图6 突变株及其亲本菌株M7与红细胞共培养时的溶血活性Fig.6 Hemolytic activity of of L. monocytogenes mutants and their parent strain M7 incubated together with red blood cells
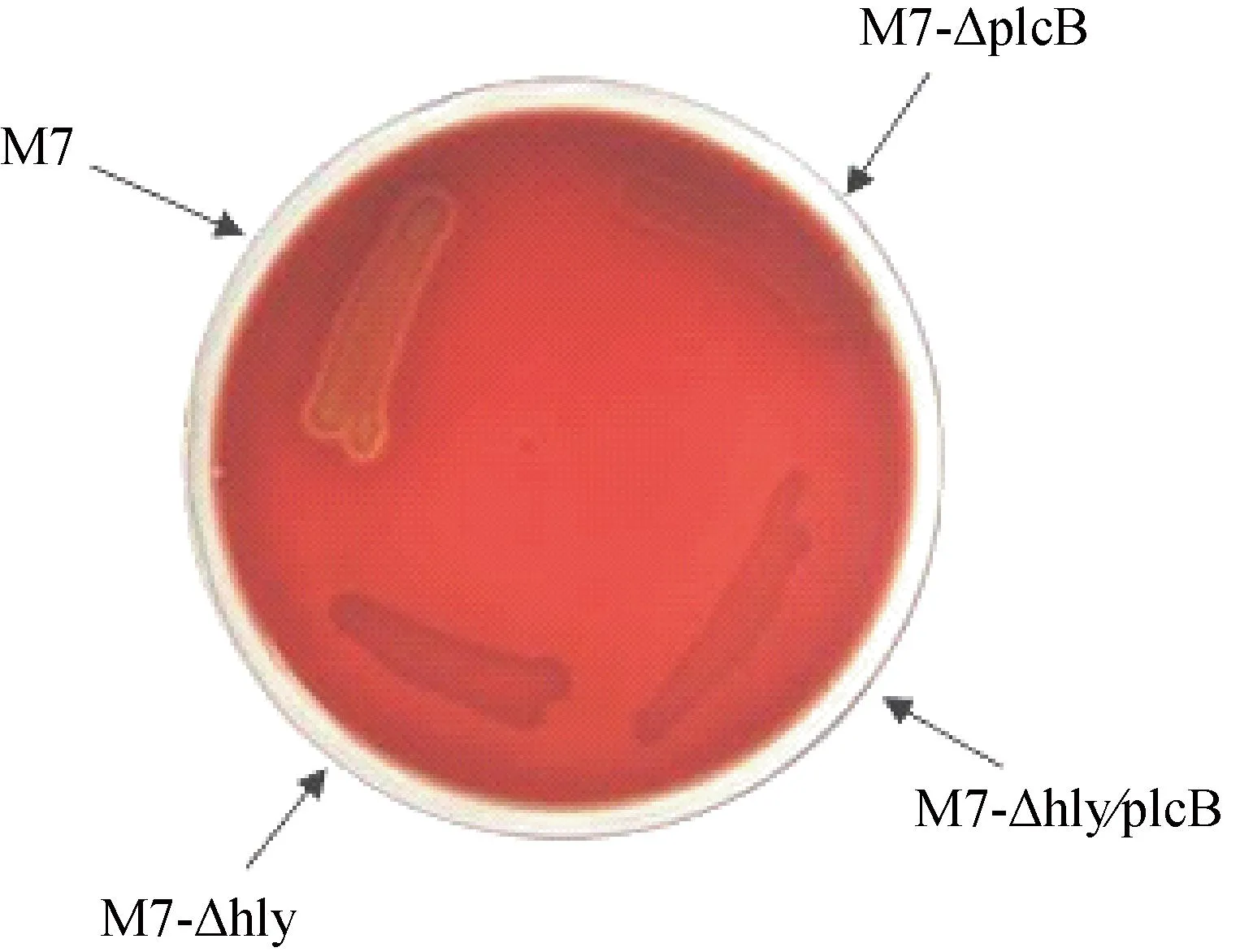
图7 突变株及其亲本菌株在5%绵羊血琼脂平板中的溶血活性Fig.7 Hemolytic activity of of L.monocytogenes mutants and their parent strain M7 on BHI agar plate with 5% sheep blood cells
2.2.2对HeLa细胞的黏附及细胞内增殖能力比较突变株M7-ΔplcB、M7-Δhly和其亲本菌株M7对HeLa的黏附率分别是17.91%、12.75%和15.78%,统计学差异不显著(P>0.05)(图8)。此外,在HeLa细胞内培养12 h,突变株M7-ΔplcB、M7-Δhly和其亲本菌株M7均有所增殖,分别增加1.86对数倍数、2.04对数倍数和1.97对数倍数,统计学差异不显著(P>0.05)(图9)。
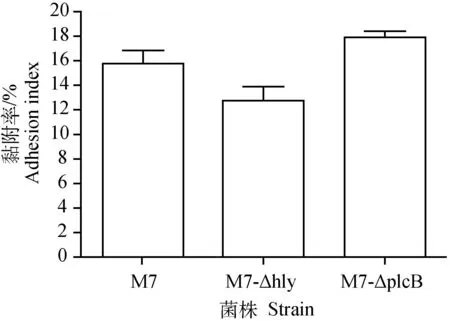
图8 突变株M7-Δhly、M7-ΔplcB及其亲本菌株M7对HeLa细胞的黏附率比较Fig.8 Adherence index of L.monocytogenes mutants and their parent strain M7 to HeLa cells

图9 突变株M7-Δhly、M7-ΔplcB及其亲本菌株M7在HeLa细胞中培养12 h的增殖力比较Fig.9 Intracellular growth of L. monocytogenes mutants and their parent strain M7 in HeLa cells after infection for 12 h
2.2.3体外培养细胞的细胞毒性比较在Caco-2细胞模型中,当MOI为10,各菌株对宿主细胞毒性较低(均小于20%)(表2),亲本株M7的细胞毒性显著高于M7-ΔplcB和M7-Δhly/plcB(P<0.05)。提高MOI至100,M7与M7-ΔplcB对宿主 Caco-2细胞毒性分别提高至38.20%和47.70%,显著高于参考菌株EGD(6.83%)、M7-Δhly(5.40%)和双缺失突变株M7-Δhly/plcB(6.10%)(P<0.05)。当提高MOI至1 000,M7与M7-ΔplcB对Caco-2细胞的毒性作用分别达到86.83%和83.17%,强毒株EGD为50.23%,M7-Δhly为23.53%,而双缺失突变株M7-Δhly/plcB细胞毒性最低,仅为11.10%,显著低于单缺失突变株(M7-Δhly和M7-ΔplcB)、亲本菌株M7及参考菌株EGD(P<0.05)。hly缺失突变株M7-Δhly的细胞毒性显著低于M7、M7-ΔplcB及参考菌株EGD(P<0.05)(表2)。

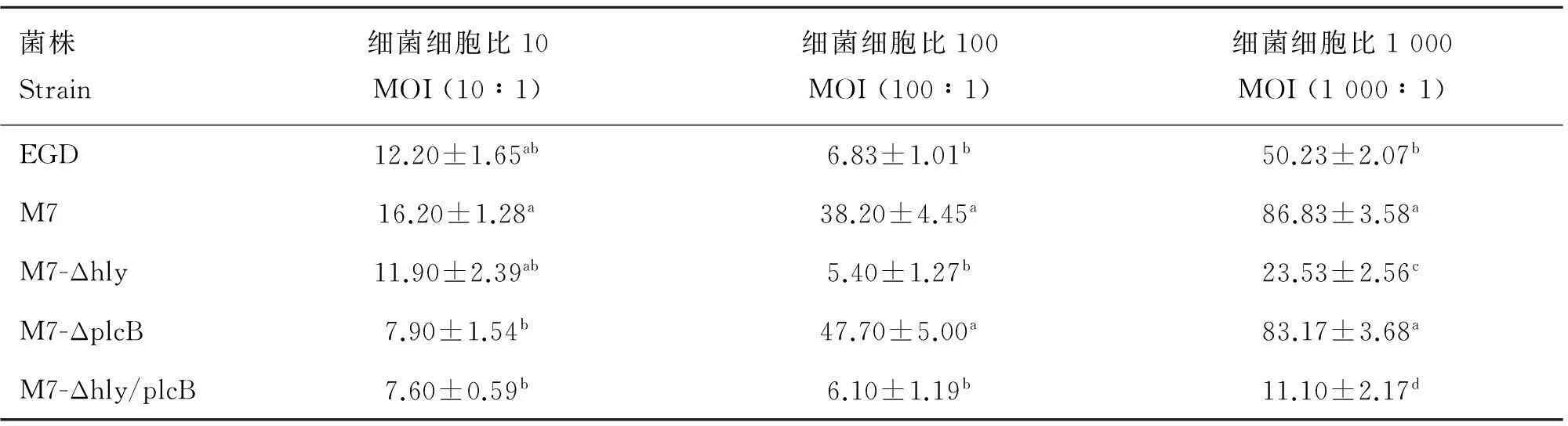
菌株Strain细菌细胞比10MOI(10∶1)细菌细胞比100MOI(100∶1)细菌细胞比1000MOI(1000∶1)EGD12.20±1.65ab6.83±1.01b50.23±2.07bM716.20±1.28a38.20±4.45a86.83±3.58aM7-Δhly11.90±2.39ab5.40±1.27b23.53±2.56cM7-ΔplcB7.90±1.54b47.70±5.00a83.17±3.68aM7-Δhly/plcB7.60±0.59b6.10±1.19b11.10±2.17d
不同小写字母表示差异显著(P<0.05),所标字母相同表示差异不显著(P>0.05)
Different letters indicate significant difference among different strains (P<0.05),same letters imply no significant difference among different strains (P>0.05)
2.2.4在L929细胞中的迁移能力比较在L929细胞中,hly缺失突变株M7-Δhly(图10B)和M7-Δhly/plcB(图10C)无任何可见空斑形成。而亲本菌株M7(图10D)及突变株M7-ΔplcB(图10E)在不含庆大霉素(G-)的培养基中能形成若干细小空斑。当培养基中含庆大霉素时,菌株M7和M7-ΔplcB无任何肉眼可见空斑。而参考强毒菌株EGD与培养基中的庆大霉素无关,均能形成许多清晰可见的空斑(图10A)。
2.2.5对小鼠致病力比较在角叉胶小鼠免疫抑制模型中,单基因缺失突变株M7-Δhly和M7-ΔplcB的LD50均大于107.95,双基因缺失突变株M7-Δhly/plcB的LD50大于108.01,而亲本株M7和强毒株EGD的LD50分别为107.46和100.95,如表3所示,以最高剂量108cfu·mL-1进行攻毒时仍观察不到小鼠死亡,其低致病能力可见一斑。
3讨论
单增李斯特菌主要经污染的食物摄入而引发感染,并完成环境腐生菌到致病菌的华丽转换[10]。然而并非所有单增李斯特菌均表现出相同致病能力,主要与其毒力因子,尤其是PrfA调控的毒力基因表达息息相关[4]。
表3本研究涉及的各突变株、亲本菌株M7及参考菌株EGD在小鼠中的LD50比较
Table 3Pathogenicity ofL.monocytogenesmutants,the parent strain M7 together with the reference strain EGD in terms of LD50in mouse model

菌株Strain半数致死量log10LD50EGD0.95M77.46M7-Δhly>7.95M7-ΔplcB>7.95M7-Δhly/plcB>8.01
溶血及溶脂试验表明突变株hly和plcB基因的缺失致其相关强溶血活性及高溶脂活性丧失(图5~7),但不影响细菌的黏附及细胞内增殖能力(图8~9)。虽然LLO与PC-PLC为裂解宿主细胞吞噬体膜所必需,有研究表明单增李斯特菌也可不依赖于LLO,通过肠道派伊尔结上的M细胞进入感染宿主细胞内[19-20]。而且在有些细胞系(如人上皮细胞中),PC-PLC能够在缺失LLO情况下介导初级吞噬体膜的裂解[21],因而突变株M7-Δhly、M7-ΔplcB呈现与其亲本菌株M7相似的黏附及细胞内增殖能力可能与上述原因有关。

图10 突变株M7-Δhly、M7-ΔplcB、M7-Δhly/plcB和其亲本菌株M7及参考菌株EGD在L929培养细胞中的空斑形成比较Fig.10 Plaque forming of L.monocytogenes mutants, the parent strain M7 together with the reference strain EGD
在细胞毒性试验中,当MOI为100及1 000时,亲本株M7的细胞毒性显著高于强毒参考菌株EGD、突变株M7-Δhly及M7-Δhly/plcB(P<0.05)(表2)。而hly缺失突变株M7-Δhly的细胞毒性显著弱于亲本株M7和M7-ΔplcB(P<0.05)。双突变株M7-Δhly/plcB的细胞毒性在MOI为10、100及1 000时均显著低于其亲本菌株M7(P<0.05)。细菌迁移试验中当培养基中不含有庆大霉素时,亲本株M7及M7-ΔplcB可形成若干细小空斑(图10D、E),而当培养基中含有庆大霉素时无任何可见空斑形成。上述结果表明M7的低致病力主要与其膜裂解相关基因hly及plcB的高效表达致宿主强细胞毒性有关,使细菌无法躲避宿主细胞免疫系统的杀伤作用最终被宿主清除。菌株M7-ΔplcB仍具有较强的细胞毒性,且在MOI 为100及1 000时显著高于EGD、突变株M7-Δhly和M7-Δhly/plcB(P<0.05),表明M7的强细胞毒性主要与高水平表达的LLO有关。
由hly编码的LLO蛋白为杆状晶体结构[22],对多种核化细胞(如Caco-2、HepG2等)具有裂解性[23],可诱发细胞凋亡。包含D1、D2、D3和D4 4个结构区域。其中D1包含25个氨基酸序列的信号肽序列及PEST区域。PEST区域为单增李斯特菌逃离吞噬体及建立细胞内感染所必需。有研究表明将该PEST区域缺失后,单增李斯特菌对宿主细胞毒性显著增强,致宿主细胞裂解,而细菌最终因无法躲避宿主杀伤作用而被清除[24]。J.A.Carrero等研究表明将LLO第491位及492位或仅第492位氨基酸从色氨酸突变为丙氨酸后,LLO的溶血活性及细胞毒性降低90%以上,但仍然保持其免疫原性[25]。本研究表明将hly全基因缺失后,单增李斯特菌对宿主细胞毒性显著减弱,溶血活性消除,对免疫抑制ICR小鼠毒力显著减弱(>107.95vs107.46),与本课题组前期研究成果及其他学者的结果一致[26-27]。
4结论
单增李斯特菌菌株M7低致病力的原因可能与其膜裂解相关基因hly及plcB高效表达有关,致其细胞毒性显著增强,从而对宿主整体的致病力明显降低。
参考文献(References):
[1]LECHOWICZ J,KRAWCZYK-BALSKA A.An update on the transport and metabolism of iron inListeriamonocytogenes: the role of proteins involved in pathogenicity[J].Biometals,2015,28(4):587-603.
[2]DESHAYES C,BIELECKA M K,CAIN R J,et al.Allosteric mutants show that PrfA activation is dispensable for vacuole escape but required for efficient spread andListeriasurvivalinvivo[J].MolMicrobiol,2012,85(3):461-477.
[4]VASANTHAKRISHNAN R B,DE LAS HERAS A,SCORTTI M,et al.PrfA regulation offsets the cost ofListeriavirulence outside the host[J].EnvironMicrobiol,2015,17(11):4566-4579.
[5]STACHOWIAK R,LYZNIAK M,BUDZISZEWSKA B K,et al.Cytotoxicity of bacterial metabolic products,including listeriolysin O on leukocyte targets[J].JBiomedBiotechnol,2012,2012:954375.
[7]PUSHKAREVA V I,ERMOLAEVA S A.Listeriamonocytogenesvirulence factor Listeriolysin O favors bacterial growth in co-culture with the ciliateTetrahymenapyriformis,causes protozoan encystment and promotes bacterial survival inside cysts[J].BMCMicrobiol,2010,10:26.
[9]CHEN J,XIA Y,CHENG C,et al.Genome sequence of the nonpathogenicListeriamonocytogenesserovar 4a strain M7[J].JBacteriol,2011,193(18):5019-5020.
[10]FANG C,CAO T,CHENG C,et al.Activation of PrfA results in overexpression of virulence factors but does not rescue the pathogenicity ofListeriamonocytogenesM7[J].JMedMicrobiol,2015,64(8):818-827.
[11]BAI F,CHEN J,CHEN Q,et al.A single substitution in 5′-untranslated region ofplcBis involved in enhanced broad-range phospholipase C activity inListeriamonocytogenesstrain H4[J].ActaBiochimBiophysSin(Shanghai),2011,43(4):275-283.
[12]江玲丽,陈健舜,李爱云,等.单核细胞增多性李斯特菌弱毒株的生物学特性鉴定[J].畜牧兽医学报,2014,45(2):274-280.
JIANG L L,CHEN J S,LI A Y,et al.Characterization ofListeriamonocytogenesstrains with low virulence[J].ActaVeterinariaetZootechnicaSinica,2014,45(2):274-280.(in Chinese)
[13]HECKMAN K L,PEASE L R.Gene splicing and mutagenesis by PCR-driven overlap extension[J].NatProtoc,2007,2(4):924-932.
[14]ONO T,PARK K S,UETA M,et al.Identification of proteins secreted viaVibrioparahaemolyticustype III secretion system 1[J].InfectImmun,2006,74(2):1032-1042.
[15]JIANG L L,XU J J,CHEN N,et al.Virulence phenotyping and molecular characterization of a low-pathogenicity isolate ofListeriamonocytogenesfrom cow’s milk[J].ActaBiochimBiophysSin(Shanghai),2006,38(4):262-270.
[16]KIM Y R,VAN’T OEVER R,LANDAYAN M,et al.Automated red blood cell differential analysis on a multi-angle light scatter/fluorescence hematology analyzer[J].CytometryBClinCytom,2003,56(1):43-54.
[17]FANG C,SHAN Y,CAO T,et al.Prevalence and virulence characterization ofListeriamonocytogenesin chilled pork in Zhejiang Province,China[J].FoodbornePathogDis,2015,doi:10.10899/fpd.2015.2023.
[18]JIANG L,CHEN J,XU J,et al.Virulence characterization and genotypic analyses ofListeriamonocytogenesisolates from food and processing environments in eastern China[J].IntJFoodMicrobiol,2008,121(1):53-59.
[19]JENSEN V B,HARTY J T,JONES B D.Interactions of the invasive pathogensSalmonellatyphimurium,Listeriamonocytogenes,andShigellaflexneriwith M cells and murine Peyer’s patches[J].InfectImmun,1998,66(8):3758-3766.
[20]CORR S,HILL C,GAHAN C G.Aninvitrocell-culture model demonstrates internalin-and hemolysin-independent translocation ofListeriamonocytogenesacross M cells[J].MicrobPathog,2006,41(6):241-250.
[21]BURRACK L S,HARPER J W,HIGGINS D E.Perturbation of vacuolar maturation promotes listeriolysin O independent vacuolar escape duringListeriamonocytogenesinfection of human cells[J].CellMicrobiol,2009,11(9):1382-1398.
[22]KÖSTER S,VAN PEE K,HUDEL M,et al.Crystal structure of listeriolysin O reveals molecular details of oligomerization and pore formation[J].NatCommun,2014,5:3690.
[24]DECATUR A L,PORTNOY D A.A PEST-like sequence in listeriolysin O essential forListeriamonocytogenespathogenicity[J].Science,2000,290(5493):992-995.[25]CARRERO J A,VIVANCO-CID H,UNANUE E R.Listeriolysin o is strongly immunogenic independently of its cytotoxic activity[J].PLoSOne,2012,7(3):e32310.
[26]GLOMSKI I J,DECATUR A L,PORTNOY D A.Listeriamonocytogenesmutants that fail to compartmentalize listerolysin O activity are cytotoxic,avirulent,and unable to evade host extracellular defenses[J].InfectImmun,2003,71(12):6754-6765.
[27]JIANG L L,SONG H H,CHEN X Y,et al.Characterization of a mutantListeriamonocytogenesstrain expressing green fluorescent protein[J].ActaBiochimBiophysSin(Shanghai),2005,37(1):19-24.
(编辑白永平)
Construction and Characterization of Mutant Strains fromListeriamonocytogeneswith Deletion of Vacuolar Lysis Related Genes
JIANG Ling-li1,GAO You-ling2,ZHOU Xiang-yang3,BAI Fan4,FANG Chun4,QIAN Guo-ying2*,FANG Wei-huan4
(1.NingboCollegeofHealthSciences,Ningbo315100,China;2.ZhejiangWanliUniversity,Ningbo315100,China;3.ZhoushanEntry-ExitInspectionandQuarantineBureau,Zhoushan316000,China;4.InstituteofPreventiveVeterinaryMedicine,ZhejiangUniversity,Hangzhou310058,China)
Abstract:We attempted to gain insights into the possible mechanism of oneListeriamonocytogenesstrain M7 with naturally low virulence.Splicing by overlap extension-PCR and homologous recombination were utilized to construct the mutant strains with full deletion of vacuolar lysis related geneshlyor (and)plcB.Subsequently,comparisons among mutants and their parent strain M7 together with the reference strain EGD were investigated in terms of hemolytic activity,phospholipase activity,adhesion and intracellular growth in HeLa cells,plaque forming assay in L929 cells,cytotoxicity against Caco-2 cells,as well as virulence to immunocompromised ICR mice.PCR amplification and reverse transcriptional PCR of the target genes indicated the successful construction of the mutants M7-Δhly,M7-ΔplcB and M7-Δhly/plcB.Furthermore,hemolytic and phospholipase activity were devoid in mutants M7-Δhly and M7-ΔplcB,respectively.Neither hemolytic nor phospholipase activity could be seen in the double mutant M7-Δhly/plcB.Besides,mutants M7-Δhly and M7-ΔplcB exhibited similar adhesiveness and intracellular growthinvitro(P>0.05).Cytotoxicity assay under multiplicity of infection (MOI) ratio 1 000 revealed that the double mutant M7-Δhly/plcB showed the lowest cytotoxic to the host Caco-2 cells with the ratio of 11.10%,followed by mutant M7-Δhly with the ratio of 23.53%.Significant difference could be found between the aforementioned two mutants and other test strains (P<0.05).Plaque forming assay pinpointed that mutant M7-ΔplcB together with its parent strain M7 could form plaques only in the medium without gentamycin.The full deletion ofhlyor (and)plcBresulted in even less pathogenicity in immunocompromised ICR mice.This study presents some clues as the low virulence of strain M7 probably result from the over-expression of geneshlyandplcB.Thereafter,the M7 strain might be exposed to the host immune responses due to its detrimentally stronger cytotoxicity.
Key words:Listeriamonocytogenes;vacuolar lysis related genes;cytotoxicity;biological characteristics
doi:10.11843/j.issn.0366-6964.2016.04.018
收稿日期:2015-10-10
基金项目:浙江省科技厅公益技术研究农业项目(2014C32047);2015年度留学人员科技活动项目择优资助经费项目;浙江万里学院省重中之重学科开放基金(KF2014007);宁波市自然科学基金(2015A610189);浙江检验检疫局重点科研项目(2014-ZKZ-017)
作者简介:江玲丽(1980-),女,浙江温岭人,研究员,博士,主要从事微生物与食品安全研究,Tel:0574-88126061,E-mail:jllgrace@163.com *通信作者:钱国英,教授,E-mail:qiangy@zwu.edu.cn
中图分类号:R378.99.4
文献标志码:A
文章编号:0366-6964(2016)04-0779-10
