神经肽Y对大鼠皮质神经元凋亡的调节作用研究
2016-07-04白玉娟李琦军周红艳张国亮
白玉娟,李琦军,周红艳,李 炎,张国亮
(河北省石家庄市第三医院,河北 石家庄 050011)
神经肽Y对大鼠皮质神经元凋亡的调节作用研究
白玉娟,李琦军,周红艳,李炎,张国亮
(河北省石家庄市第三医院,河北 石家庄 050011)

[摘要]目的探讨神经肽Y(NPY)对大鼠神经小胶质细胞生成白细胞介素-1β(IL-1β)的影响以及对神经元凋亡的调节作用。方法培养原代大鼠皮质小胶质细胞,分为5组,对照组以无血清培养基孵育,LPS组以含脂多糖(LPS)的无血清培养基孵育,NPY+LPS组先后予含NPY和LPS的无血清培养基孵育,NPY组以含NPY的无血清培养基孵育,BIBP3226+NPY+LPS组先后用含BIBP3226、NPY和 LPS的无血清培养基孵育。孵育6 h后,ELISA方法检测各组培养液中IL-1β蛋白含量,RT-PCR方法检测各组小胶质细胞中IL-1β mRNA表达水平。然后用各组培养液分别孵育原代培养的大鼠皮质神经元,采用Hoechst33258染色鉴定神经元凋亡情况。结果LPS组培养液中IL-1β蛋白含量及小胶质细胞中IL-1β mRNA表达水平均显著高于对照组(P均<0.05),神经元凋亡率明显高于对照组(P<0.05)。NPY+LPS组培养液中IL-1β蛋白含量和小胶质细胞中IL-1β mRNA表达水平均明显低于LPS组(P均<0.05),神经元凋亡率明显低于LPS组 (P<0.05)。BIBP3226+NPY+LPS组培养液中IL-1β蛋白含量及小胶质细胞中IL-1β mRNA表达水平明显高于NPY+LPS组(P均<0.05),神经元凋亡率显著高于NPY+LPS组(P<0.05)。结论NPY有可能通过其Y1受体降低过度激活的小胶质细胞免疫活性,抑制其生成IL-1β,从而减少大鼠皮质神经元凋亡。
[关键词]小胶质细胞;神经肽Y;IL-1β;神经元;凋亡
小胶质细胞(MG)是巨噬细胞的一种,广泛分布于中枢神经系统,与中枢神经系统的免疫反应密切相关。小胶质细胞还是大脑中产生炎症因子的主要细胞之一,当受到刺激后成活化状态,可释放白细胞介素-1β(IL-1β)、TNF-α等细胞因子以及其他一些生物活性物质,其中有些物质会导致神经元受损。神经肽Y(NPY)是一种多肽,在中枢神经系统广泛分布,对神经系统有保护作用,其作用机制需要进一步研究。本研究探讨了NPY对大鼠神经小胶质细胞生成IL-1β的影响以及对神经元凋亡的调节作用,现将结果报道如下。
1实验资料
1.1实验动物及试剂24 h内新生SD大鼠30只,清洁级,河北医科大学实验动物中心提供,动物生产许可证号:SCXK(冀)2013-1-03。主要试剂:小鼠单克隆抗体IBA-1,脂多糖(LPS,美国Sigma公司),FITC标记的山羊抗小鼠IgG(美国Proteintech公司),胎牛血清、DMEM/F12培养液(美国Gibco公司),BIBP3226(美国Tocris Bioscience公司),NPY(美国ENZO公司),ELISA试剂盒(中国Bio-Swamp公司)。
1.2混合胶质细胞培养及小胶质细胞的分离纯化参照Nakajima等[1]所述方法。24 h内新生SD大鼠无菌环境下开颅取脑,剥除脑膜及血管,取部分大脑皮质,剪碎后用0.125%胰蛋白酶37 ℃消化15 min,终止消化后反复吹打成悬液,1 000 r/min离心5 min后过滤,弃上清,在沉淀物中加入含10%胎牛血清和1 IU/mL青霉素、100 μg/mL链霉素的DMEM/F12培养基制成细胞悬液,接种于大培养瓶(75 cm2,250 mL)中,置于培养箱(37 ℃,5%CO2)中进行培养,第2天全量换液1次,以后每3 d更换1/2体积培养液。培养至第14天,看到细胞充分分层生长后, 置于37 ℃恒温摇床中180 r/min振摇2 h,收集细胞悬液,1 000 r/min离心5 min,去上清,用DMEM/F12全培养基吹打成细胞悬液,接种于底部预涂多聚赖氨酸的培养板,在培养箱内静置30 min后完全换液1次,去除少突胶质细胞,加入DMEM/F12完全培养基继续培养3~5 d,供实验用。
1.3原代神经元的培养大鼠大脑皮质神经元的分离培养按照Yang等[2]所述的方法。24 h内新生SD大鼠无菌环境下开颅取脑,冲洗干净后取双侧海马组织,仔细去除血管及脑膜,将海马组织剪碎后0.125%胰蛋白酶37 ℃消化15 min,终止消化后打成细胞悬液,过滤去除细胞团块,滤液接种于底部放置预涂多聚赖氨酸圆玻片的6孔培养板, 置于培养箱(37 ℃,5%CO2)中进行混合细胞培养。24 h后全量换成含2%B27、100 IU/mL青霉素和100 μg/mL链霉素的Neurobasal培养液,根据情况2~3 d换液1次,培养7~9 d,即可获得纯化的海马神经元。
1.4细胞形态学观察及纯度鉴定原代小胶质细胞接种于内置预涂多聚赖氨酸盖玻片的培养板,培养3 d后取出盖玻片,经PBS冲洗,4%多聚甲醛固定30 min,0.3%Triton×100破膜10 min,3%山羊血清封闭30 min,加IBA-1抗体(1∶200),4 ℃过夜;荧光二抗,37 ℃孵育1 h,Hoechst33258染色细胞核5 min,山羊血清封闭后除外,余各步骤之间用PBS冲洗3遍,封片后荧光显微镜观察原代小胶质细胞细胞形态。用WAP-2抗体免疫荧光染色鉴定神经元,步骤同小胶质细胞。阳性率计数方法:荧光显微镜下随机选取,计数5个高倍视野,计算原代小胶质细胞和神经元阳性细胞的百分率。
1.5小胶质细胞分组及处理方法以1×105mL-1的浓度将小胶质细胞种于预铺多聚赖氨酸的六孔板内,每孔3 mL,培养3 d后换新鲜无血清培养基培养孵育12 h,将各孔随机分为对照组、LPS组、NPY+LPS组、NPY组、BIBP3226+NPY+LPS组。对照组以无血清培养基孵育6 h,LPS组以含终浓度为100 ng/mL LPS的无血清培养基孵育6 h,NPY+LPS组先以含终浓度1 μmol/L NPY的无血清培养基孵育0.5 h,然后加入终浓度为100 ng/mL LPS继续孵育6 h,NPY组以含终浓度1 μmol/L NPY无血清培养基孵育6 h,BIBP3226+NPY+LPS组先用含终浓度1 μmol/L BIBP3226的无血清培养基孵育0.5 h,余步骤同NPY+LPS组。
1.6培养液中IL-1β蛋白含量的测定用ELISA法检测。将酶标板分为阳性对照孔、空白对照孔和待测样品孔,将不同浓度的标准品加入阳性对照孔,每孔50 μL,空白对照孔不加样品、酶标试剂及生物素标记的抗IL-1β抗体,待测样品孔中先加各组样品40 μL,然后再加生物素标记的抗IL-1β抗体10 μL。用封板膜封板后置37 ℃温育30 min。重复洗板5次,拍干。每孔加入酶标试剂50 μL,空白孔除外。温育30 min,洗板,加入显色剂,37 ℃避光显色15 min,每孔加终止液50 μL,终止反应。酶标仪检测,以空白对照孔调零,450 nm波长依序测量各孔的吸光度(OD值)。测定应在加终止液后15 min以内进行。以标准物的浓度为横坐标,OD值为纵坐标,在坐标纸上绘出标准曲线。根据样品的OD值由标准曲线查出相应的浓度。
1.7小胶质细胞中IL-1β mRNA表达水平的测定采用实时荧光定量PCR法检测上述各组小胶质细胞中IL-1β mRNA表达水平。小胶质细胞加入Trizol(1 mL/孔),吹打后移至去核酶的离心管中,静置5 min。每管加入0.2 mL氯仿,震荡15 s,静置5 min。12 000 r/min离心15 min,把上层无色液体移到新的离心管中。加入等体积的异丙醇,颠倒混匀。4 ℃ 12 000 r/min离心10 min,管底可见羽毛状白色沉淀物,完全弃去上清。加入1 mL 75%乙醇(DEPC水配置),洗涤沉淀。4 ℃ 7 500 r/min离心5 min,弃上清。静置晾干3~5 min,加入20~30 μL DEPC水充分溶解RNA。1%琼脂糖凝胶电泳证实RNA完整性较好,无污染。紫外分光光度计检测RNA浓度。引物由上海生工生物公司合成。IL-1β上游引物为5’-CTCCATGAGC TTTGTACAAGG-3’,IL-1β下游引物为5’-TGCTGATGTACCAGTTGGG-3’,扩展长度为245 bp。GAPDH上游引物为5’-TGAACGGGAAGCTCACTGG -3’,GAPDH下游引物为5’-GCTTCACCACCTTCTTGATGTC-3’,扩增长度为120 bp。实时PCR反应中反转录反应体系总RNA 8 μL,随机引物1 μL,2×ESReaction Mix 10 μL,RT/RI Enzyme Mix 1 μL,总体积20 μL。扩增体系:2×UltraSYBR Mixture(with ROX)10 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,cDNA 8 μL,总体积20 μL。RT-PCR反应程序参数:预变性95 ℃ 10 min;变性95 ℃ 15 s,退火58 ℃ 20 s,延伸72 ℃ 27 s,40个循环。用ABI 7300 Real-Time PCR System (Applied Biosystems, Foster City,CA,USA)检测并计算目的基因表达量与内参GAPDH比较的相对值(RQ值),用于统计分析。
1.8神经元凋亡和坏死的检测将LPS组、NPY+LPS组、NPY组、BIBP3226+NPY+LPS组原代小胶质细胞条件培养液分别与神经元培养液1∶1混合,将对照组培养液与神经元培养液1∶1混合后分为对照组、对照+LPS组、对照+NPY组,在对照+LPS组、对照+NPY组中分别加入终浓度50 ng/mL LPS和终浓度0.5 μmol/L NPY,每组5个样本。用各组混合培养液孵育纯化好的神经元细胞。12 h后取出盖玻片,行Hoechst 33258染色:①将取出的盖玻片用1×PBS洗3遍,冲洗要温柔,防止细胞脱落,将冲洗好的盖玻片放在干净的载玻片上。②加入预冷的纯丙酮固定30 min,然后用1×PBS洗3遍。③在避光条件下,加入Hochst染色,室温,染色5 min,用1×PBS洗3遍。④防淬灭水溶性封片剂封片。荧光显微镜下观察。
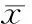
2结果
2.1大鼠大脑皮质小胶质细胞的形态学表现显微镜下观察小胶质细胞胞体小,胞体有细长突起(箭头),IBA-1染色阳性,见图1。

图1 小胶质细胞IBA-1染色表现(×400,25 μm)
2.2神经元形态学表现WAP-2免疫染色后的神经元,细胞被染成绿色,细胞核染色后成蓝色,神经元具有细长的轴突(箭头)和长的树突,见图2。经鉴定,纯度大于95%,满足实验需要。

图2 大鼠皮质神经元细胞MAP-2免疫荧光染色表现(×400,25 μm)
2.3培养液中IL-1β蛋白含量及各组细胞中IL-1β mRNA表达水平LPS组培养液中IL-1β蛋白含量及小胶质细胞中IL-1β mRNA表达水平均显著高于对照组(P均<0.05),NPY+LPS组培养液中IL-1β蛋白含量和小胶质细胞中IL-1β mRNA表达水平均明显低于LPS组及BIBP3226+NPY+LPS组(P均<0.05),NPY组培养液中IL-1β蛋白含量和小胶质细胞中IL-1β mRNA表达水平与对照组比较差异无统计学意义。见表1。

表1 各组培养液中IL-1β蛋白含量及细胞中IL-1β mRNA表达水平比较
注:①与对照组比较,P<0.05;②与LPS+NPY组比较,P<0.05。
2.4神经元凋亡和坏死情况LPS组神经元凋亡率为(67.74±11.88)%,LPS+NPY组为(13.35±1.13)%,NPY组为(1.63±0.33)%,BIBP3226+NPY+LPS组为(72.05±4.73)%,对照组为(0.97±0.39)%,对照+LPS组为(1.07±0.15)%,对照+NPY组为(2.01±0.32)%。LPS组神经元凋亡率明显高于对照组(P<0.05)。NPY+LPS组神经元凋亡率明显低于LPS组及BIBP3226+NPY+LPS组(P均<0.05)。与对照组相比,对照+LPS组和对照+NPY组神经元凋亡率没有明显变化(P均>0.05)。
3讨论
小胶质细胞与中枢神经系统的免疫反应密切相关。当中枢神经系统发生变化时,小胶质细胞呈激活状态,产生一系列变化,起到中枢神经系统感受器的作用[3]。例如有人使用海人酸诱发癫痫大发作,观察到癫痫传播区域分布的小胶质细胞很早就被激活[4],且小胶质细胞生物活性与癫痫的发作频率及持续时间有密切关系[5]。很多资料显示小胶质细胞激活还和中枢神经系统其他疾病有关[6-8]。LPS可以激活小胶质细胞,使之处于活化状态,分泌相关炎症因子。NPY对神经系统有保护作用,其与位于突触上的Y2受体相结合,减少细胞释放谷氨酸,减轻神经元的兴奋性损伤[9]。NPY Y1与细胞免疫反应密切相关,直接影响小胶质细胞细胞因子与多种抗体释放以及细胞迁移活动[10-12]。周江睿等[13]对RAW264.7细胞的研究结果说明,NPY可以抑制炎性因子TNF-α、IL-1β、IL-6 和前列腺素B2的释放,且能够促进炎症因子HMGB1的释放。Ferreira等[14]研究表明,NPY可以抑制LPS所致的小鼠小胶质细胞N9细胞株的激活,减少NO的生成;且给予NPY后,N9细胞的吞噬作用以及迁移能力明显下降,这种作用与NPY Y1受体有关[15-17]。
本实验采用LPS激活小胶质细胞,干预6 h后,小胶质细胞的免疫活性明显增强,小胶质细胞培养液中IL-1β含量明显高于对照组。给予NPY后,LPS对小胶质细胞的激活作用明显降低,小胶质细胞培养液中IL-1β蛋白量和小胶质细胞内的IL-1β水平也随之下降,阻断NPY Y1受体后,LPS作用完全消失,说明NPY Y1受体在NPY降低小胶质细胞的免疫活性,减少IL-1β产生的过程中起着关键作用,这与Ferreira等[14]研究N9细胞株的结果一致。笔者用各组小胶质细胞培养液去孵育原代培养的大鼠皮质神经元,Hoechst33258染色示 LPS组刺激后神经元凋亡率明显高于对照组,提前给予NPY能够明显抑制小胶质细胞的激活,其培养液孵育的神经元凋亡率明显降低,在加入BIBP3226阻断NPY Y1受体后,NPY的这种作用消失。与对照组相比,对照+LPS组和对照+NPY组神经元凋亡率没有明显变化,说明神经元凋亡的变化不是由LPS和NPY引起的,而是由激活后小胶质细胞的条件培养液中的活性物质导致,IL-1β可能在其中起着重要作用。本实验说明NPY在中枢神经系统中起着调节免疫功能的重要作用,它有可能通过对小胶质细胞的功能调节,进而减少神经元的凋亡,起到保护神经元的作用。
[参考文献]
[1]Nakajima K,Takemoto N,Kohsaka S. Retinoic acid enhances the secretion of plasminogen from cultured rat microglia[J]. FEBS Lett,1992,314(2):167-170
[2]Yang S,Zhou W,Zhang Y,et al. Effects of Liuwei Dihuang decoction on ion channels and synaptic transmission in cultured hippocampal neuron of rat[J]. J Ethnopharmacol,2006,106(2):166-172
[3]Kreutzberg GW. Microglia: a sensor for pathological events in the CNS[J]. Trends in Neurosciences,1996,19(8):312-318
[4]Zhu Y. Transforming growth factor-beta 1 increases bad phosphorylation and protects neurons against damage[J]. J Neurosci,2002,22(10):3898-3909
[5]Aronica E,Gorter JA,Redeker S,et al. Distribution, characterization and clinical significance of microglia in glioneuronal tumours from patients with chronic intractable epilepsy[J]. Neuropathol Appl Neurobiol,2005,31(3):280-291
[6]Hickman SE,Allison EK,ElKhoury J. Microglial dysfunction and defective beta-amyloid clearance pathways in aging Alzheimer's disease mice[J]. J Neurosci,2008,28(33):8354-8360
[7]Marinova-Mutafchieva L,Sadeghian M,Broom L,et al. Relationship between microglial activation and dopaminergic neuronal loss in the substantia nigra:a time course study in a 6-hydroxydopamine model of Parkinson's disease[J]. J Neurochem,2009,110(3):966-975
[8]Arranz AM,Gottlieb M,Pérez-Cerdá F,et al. Increased expression of glutamate transporters in subcortical white matter after transient focal cerebral ischemia[J]. Neurobiol Dis,2010,37(1):156-165
[10] Wheway J,Herzog H,Mackay F. NPY and receptors in immune and inflammatory diseases[J]. Curr Top Med Chem,2007,7(17):1743-1752
[11] Wheway J,Mackay CR,Newton RA,et al. A fundamental bimodal role for neuropeptide Y1 receptor in the immune system[J]. J Exp Med,2005,202(11):1527-1538
[12] Bedoui S,Miyake S,Lin Y,et al. Neuropeptide Y (NPY) suppresses experimental autoimmune encephalomyelitis: NPY1 receptor-specific inhibition of autoreactive Th1 responses in vivo[J]. J Immunol,2003,171(7):3451-3458
[13] 周江睿,蒋春雷. 神经肽Y对巨噬细胞炎症因子和小分子炎症介质的调节及机制研究[C]. 上海:第二军医大学,2012
[14] Ferreira R,Xapelli S,Santos T,et al. Neuropeptide Y modulation of interleukin-1β (IL-1β)-induced nitric oxide production in microglia[J]. J Biol Chem,2010,285(53):41921-41934
[15] Ferreira R,Santos T,Cortes L,et al. Neuropeptide Y inhibits interleukin-1 beta-induced microglia motility[J]. J Neurochem,2012,120(1):93-105
[16] Ferreira R,Santos T,Viegas M,et al. Neuropeptide Y inhibits interleukin-1b-induced phagocytosis by microglial cells[J]. J Neuroinflammation,2011,8(17):169
[17] Ferreira R,Xapelli S,Santos T,et al. Neuropeptide Y modulation of interleukin-1β (IL-1β)-induced nitric oxide production in microglia[J]. J Biol Chem,2010,285(53):41921-41934
Regulation of neuropeptide Y on the apotosis of cerebral cortical neurons in rats
BAI Yujuan, LI Qijun, ZHOU Hongyan, LI Yan, ZHANG Guoliang
(The Third Hospital of Shijiazhuang, Shijiazhuang 050011, Hebei, China)
Abstract:Objective It is to explore the effect of neuropeptide Y (NPY)on IL-1B produced by microgliacytes in rats and the regulation on the apotosis of neurons. Methods The rat primary microgliacytes were cultured and divided into 5 groups: control group, lipopolysaccharide (LPS) group, NPY+LPS group, NPY group, BIBP3226+NPY+LPS group, which were respectively cultured by serum-free medium (SFM), SFM+LPS, SFM+NPY+LPS, SFM+NPY, BIBP3226+NPY+LPS. After culture for 6h, the content of IL-1B in culture liquid in every group were detected by ELISA, the expression of IL-1B were detected by RT-PCR. The apotosis of neurons were evaluated by Hoechst32258 staining. Results The contents of IL-1B in culture liquid and the expression level of IL-1B mRNA in microgliacytes in LPS group and apotossi rate were significantly higher than that in control group (P<0.05), and these indexes in NPY+LPS group were significantly lower than those in LPS group (P<0.05), these indexes in BIBP3226+NPY+LPS group were also higher than those in NPY+LPS group (all P<0.05). Conclusion NPY can low down the over-activity of immunity of microgliacytes by its Y1 receptor, inhibit production of IL-1B, thus to decrease the apotosis of neurons in the rats.
Key words:microgliacytes; neuropeptide Y; IL-1B; neurons; apotosis
[作者简介]白玉娟,女,从事神经电测听工作。 [通信作者]李琦军,E-mail:13832121438@163.com
doi:10.3969/j.issn.1008-8849.2016.10.005
[中图分类号]R-33
[文献标识码]A
[文章编号]1008-8849(2016)10-1040-04
[收稿日期]2015-10-20
