多杀菌素C-9不同糖基衍生物的合成及杀虫活性分析
2016-07-02寇芸芸张晓琳
王 旭,陈 新,李 龙,寇芸芸,张晓琳
(1 武汉轻工大学 生物与制药工程学院,湖北 武汉 430023;2 国家粮食局科学研究院,北京 100037)
多杀菌素C-9不同糖基衍生物的合成及杀虫活性分析
王旭1,陈新1,李龙1,寇芸芸1,张晓琳2
(1 武汉轻工大学 生物与制药工程学院,湖北 武汉 430023;2 国家粮食局科学研究院,北京 100037)
[摘要]【目的】 寻找具有更高杀虫活性的新型多杀菌素衍生物。【方法】 以盐酸水解获得的多杀菌素C-9假糖苷配基为受体,以3种单糖(D-葡萄糖、D-半乳糖、L-鼠李糖)为供体,采用三氯乙酰亚胺法进行糖苷化反应得到C-9位不同糖基大环内酯类衍生物;用核磁共振谱(1H-NMR、13C-NMR),MS和IR对所合成衍生物进行表征,并分别测定所合成衍生物的杀虫活性。【结果】1H-NMR、13C-NMR、MS和IR谱图分析表明,新合成的3种多杀菌素衍生物分别为9-0-(β-D-吡喃葡萄糖)多杀菌素衍生物、9-0-(β-D-吡喃半乳糖)多杀菌素衍生物、9-0-(β-L-吡喃鼠李糖)多杀菌素衍生物;杀虫活性测定表明,3种新型多杀菌素衍生物在20 mg/L剂量下对锯谷盗、赤拟谷盗、米蛾等均表现出一定的杀虫活性,致死率为31%~59%。【结论】 新合成的多杀菌素衍生物均具有一定的杀虫活性,其构效关系还具有进一步研究的价值。
[关键词]多杀菌素;糖基衍生物;杀虫活性
多杀菌素是一种大环内酯类化合物杀虫剂[1-3],是土壤放线菌刺糖多孢菌[4-6]在培养介质中经有氧发酵所获得的次级代谢产物。多杀菌素能有效防治双翅目和缨翅目害虫,也能很好地防治鞘翅目和直翅目中某些大量取食叶片的害虫,其杀虫活性远远地超过了通常用于防治棉花害虫的多种有机磷、氨基甲酸酯类、环戊二烯类和其他杀虫剂,且毒力和杀虫活性与拟除虫菊酯类杀虫剂相当。由于多杀菌素兼有生物农药的安全性和化学农药的速效性[7-8],因而获得了美国“总统绿色化学品挑战奖”。相关领域在关注多杀菌素对有益昆虫高效选择性的同时,很少注意其独特的分子结构[9-11]。因目前多杀菌素生物合成繁杂,产率也因之受到一定影响,寻找高产、低毒、低残留的新型多杀菌素活性物质倍受关注。通过提高多杀菌素化合物的亲脂性和减小偶极矩,对其进行合理的化学修饰,是筛选多杀菌素类高活性化合物的一个重要途径。本研究在多杀菌素作用机理[12]分析的基础上,利用三氯乙酰亚胺法[13-15],保留多杀菌素母核结构及其氨基糖部位,对其C-9位的鼠李糖部位进行化学结构修饰,合成了3种新型多杀菌素衍生物,并对其衍生物构效关系和杀虫活性进行了分析,以期为更高活性的多杀菌素衍生物的合成和筛选提供参考。
1材料与方法
1.1试剂
D-葡萄糖、L-鼠李糖、D-半乳糖,上海国药集团;多杀菌素标准品(Spinosad),Dow AgroSciences;虫卵和酵母粉,武汉市疾病预防控制中心;甲醇、乙腈(色谱纯),上海国药集团;乙酸铵(分析纯)、石油醚、二氯甲烷、三氯甲烷、甲醇、乙酸乙酯,科密欧试剂有限公司;烯丙基溴、苯甲酰氯、DBU(1,8-二氮杂二环[5.4.4]十一碳-7-稀)、TMSOTF(三氟甲磺酸三甲基硅醇酯)、甲胺乙醇溶液(30%)、三氯乙腈、4,4-二甲基吡啶(DMAP)、DMF(氮氮二甲基甲酰胺),阿拉丁;Dowex-50WX8型阳离子交换树脂,陶氏化学;柱层析硅胶(111~166 μm)、薄层层析硅胶(10~40 μm),青岛海洋化工有限公司。
1.2仪器
紫外-可见分光光度仪,Perkin Elmer spectrophotomoter;79-1磁力加热搅拌器,金坛市医疗仪器厂;BUCHI旋转蒸发仪,瑞士BUCHI公司;高效液相色谱仪1260,安捷伦科技(中国)有限公司;分析天平,瑞士梅特勒托利多仪器;0.22 μm微滤膜,天津津腾试验设备有限公司。
1.3合成路线的设计
经查阅多杀菌素结构修饰的相关文献[13-15],葡萄糖等若要以β连接的方式形成糖苷键,受体上的3-H、5-H和供体上的1-H都处于直立键,3个靠近的H产生很大的位阻,连接苷元后分子量更大,骨架难以扭转以致反应的难度增加。因此以苯甲酰基保护的糖三氯乙酰亚胺酯作为糖基供体。多杀菌素局部酸水解[16]去除甲氧基化α-L-鼠李糖获得C-9假糖苷配基,与单糖经过三步反应合成糖基配体,即苯甲酰基三氯异胺酯进行糖苷化反应得到多杀菌素的糖苷化衍生物。糖基供体、受体的制备以及供体与受体的结合见图1~3,其中化合物1为全苯甲酰化的糖基,化合物2为选择性游离1-OH的糖基,化合物3为乙酰化的糖基,化合物4为游离C-9位羟基的多杀菌素糖基受体。
1.4多杀菌素的水解
1.4.1盐酸水解工艺的确定多杀菌素大环结构上的9-羟基连接的是一个甲氧基化的α-L-鼠李糖,通过酸性条件水解多杀菌素的糖苷键,游离出活性羟基,再在一定条件下将不同糖基与多杀菌素水解产物结合,即可得到不同结构的多杀菌素衍生物。
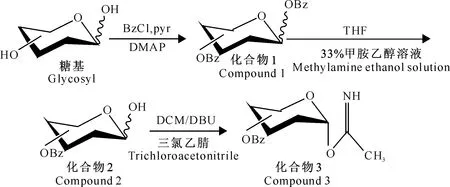
图 1 糖基供体的制备
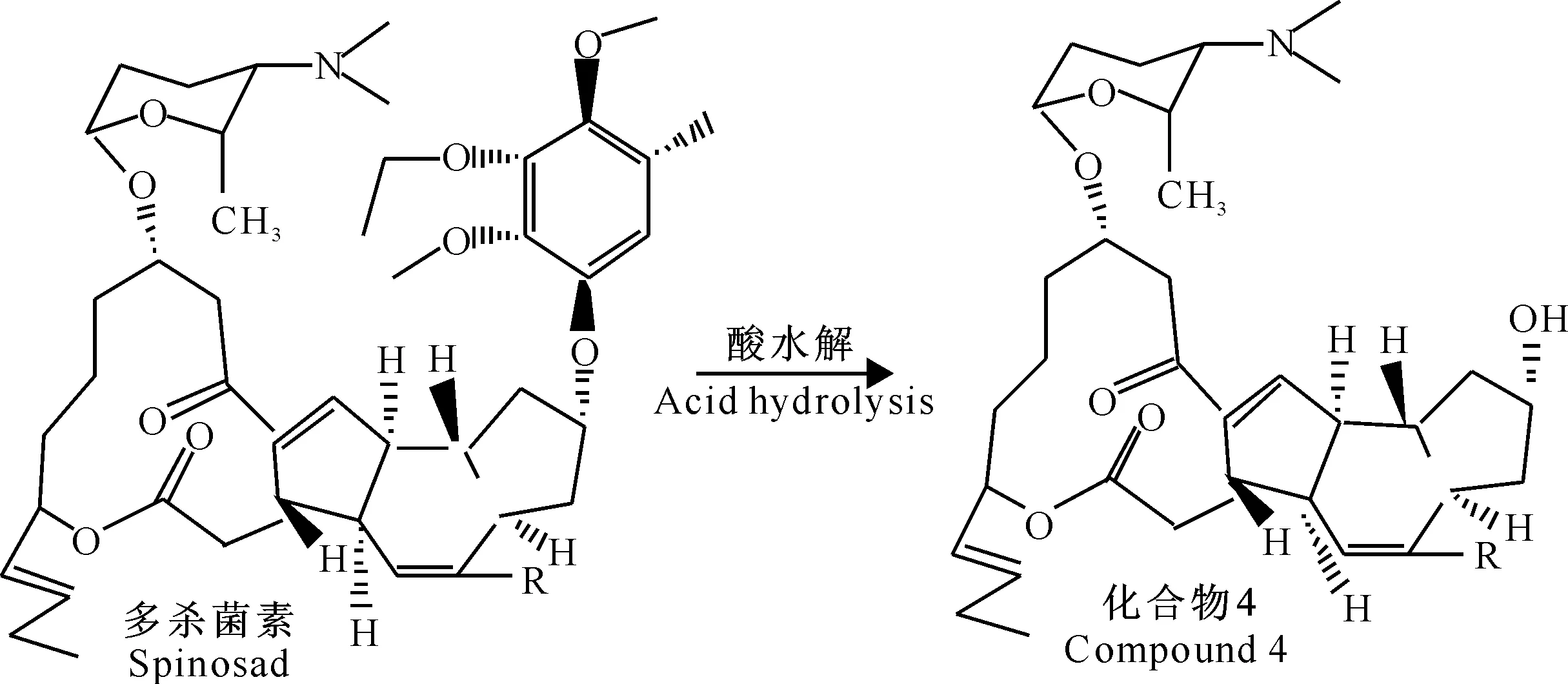
图 2 糖基受体的制备
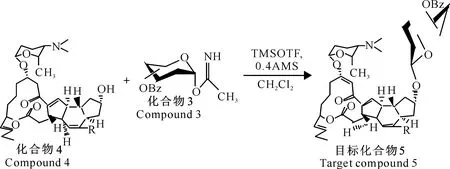
图 3 糖基供体与糖基受体的结合
基于糖苷键能够被三氟乙酸、硫酸、盐酸等催化水解,本研究选择盐酸作为试验水解用酸,并选取盐酸浓度(A)、水解时间(B)、水解温度(C)3个因素设计正交试验,以水解后得到的多杀菌素C-9假糖苷配基的产率作为评价指标,确定多杀菌素的最佳水解工艺。正交试验的因素及水平见表1。
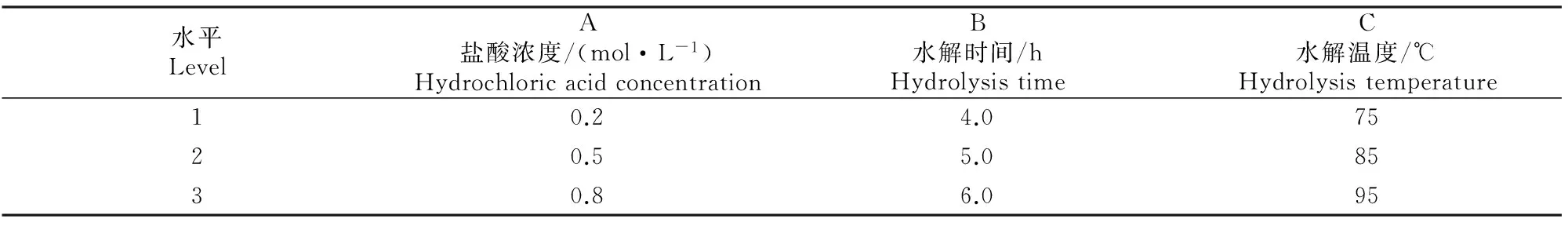
表 1 多杀菌素水解正交试验的因素及水平
1.4.2多杀菌素的水解称取多杀菌素2 g,用 1 000 mL浓度0.5 mol/L的盐酸溶解,在水浴温度为85 ℃的条件下反应5 h后,TLC监测至目标水解产物的量不再增加时,加入氨水调pH=7,终止反应。将反应液旋转蒸发浓缩至适量体积,用乙酸乙酯反复萃取。乙酸乙酯萃取部分旋转蒸发至干,产物经过硅胶柱层析分离纯化,流动相体系为石油醚-丙酮溶液(V(石油醚)∶V(丙酮)=5∶1),检测体系为石油醚-丙酮溶液(V(石油醚)∶V(丙酮)=3∶1),石油醚-丙酮溶液洗脱后收集水解产物洗脱液,旋转蒸发至干,经高效液相色谱和核磁波谱解析为去除甲氧基化α-L-鼠李糖的C-9假糖苷配基化合物4(1.76 g)。分别称取多杀菌素标准品及酸水解后产物各1 mg溶于2 mL甲醇溶液,将甲醇溶液滤过微孔滤膜后作为液相检测液。色谱条件:色谱柱为Agilent Eclipse XDB柱;流动相为甲醇-乙腈-水溶液(0.5 g/L 乙酸铵水溶液)(V(甲醇)∶V(乙腈)∶V(水)=45∶45∶10),流速1 mL/min;进样量20 μL。然后提取多杀菌素标准品及水解产物的液相图。
1.5多杀菌素葡萄糖基衍生物的合成
1.5.1苯甲酰化葡萄糖的制备称取D-葡萄糖18 g(0.1 mol)于反应瓶中,加入吡啶400 mL、DMAP 13.5 g(0.044 mol),室温搅拌后60 ℃水浴条件下加入35 mL(0.3 mol)苯甲酰氯,TLC监测反应进程,监测体系为石油醚-乙酸乙酯-HOAc溶液(V(石油醚)∶V(乙酸乙酯)∶V(HOAc)=3∶1∶0.2),室温搅拌24 h后反应结束。将反应液倒入水中,静止固化后倒去上清液,用稀盐酸反复洗涤固化后的产物至无吡啶味,再用水反复洗涤,干燥。柱层析分离,得全苯甲酰化葡萄糖白色固体化合物1a:67.29 g(0.096 mol)。
1.5.21-OH苯甲酰化葡萄糖的制备在300 mL THF(四氢呋喃)溶液中溶入全苯甲酰化葡萄糖30.12 g(0.043 mol),加入33%甲胺乙醇溶液31 mL (0.13 mol)后室温搅拌,TLC监测反应进程,监测体系为石油醚-乙酸乙酯溶液(V(石油醚)∶V(乙酸乙酯)=2∶1),5 h后反应结束,柱层析分离(柱层析用硅胶111~166 μm,过柱体系为石油醚-乙酸乙酯溶液(V(石油醚)∶V(乙酸乙酯)=3∶1),得1-OH苯甲酰化葡萄糖白色固体化合物2a:12.52 g(0.021 mol)。
1.5.3葡萄糖三氯异胺酯的合成无水二氯甲烷中溶入1-OH苯甲酰化葡萄糖7.56 g(0.013 mol),在无氧环境中加入三氯乙腈11.8 mL(0.117 mol),室温搅拌,TLC监测反应进程,监测体系为石油醚-乙酸乙酯溶液(V(石油醚)∶V(乙酸乙酯)=2∶1),28 h后反应结束,柱层析分离(柱层析用硅胶111~166 μm,过柱体系为石油醚-乙酸乙酯溶液((V(石油醚)∶V(乙酸乙酯)=5∶1)得到葡萄糖三氯异胺酯白色固体化合物3a:5.55 g(7.63 mol)。1H-NMR(CDCl3,400 MHZ)δ:8.64(s,1H),8.04(d,2H,J=7.4 Hz),7.95(dd,4H,J=8.3,3.1 Hz),7.87(d,2H,J=7.4 Hz),7.56~7.26(m,12H),6.28(t,1H,J=10.1 Hz),5.84(t,1H,J=9.8 Hz),4.64(d,2H,J=10.3 Hz),4.48(dd,1H,J=12.8,5.4 Hz),与参考文献[17]一致。
1.5.4多杀菌素C-9全苯甲酰化D-葡萄糖衍生物的合成称取2 000 mg(2.76 mmol)葡萄糖三氯异胺酯和880 mg(1.55 mmol)C-9假糖苷配基,溶入20 mL无水二氯甲烷中,室温下搅拌5 min后,在无氧条件下加入4A(分子筛孔径)分子筛约4.2 g。将反应管放入制备好的冰盐浴中继续搅拌,加入TMSOTF 57 μL(0.27 mmol),1 h后室温搅拌,TLC监测反应进程,监测体系为石油醚-乙酸乙酯溶液(V(石油醚)∶V(乙酸乙酯)=3∶1),18 h后反应结束,柱层析分离,得到多杀菌素C-9全苯甲酰化葡萄糖衍生物白色固体化合物5a:510 mg(0.40 mmol)。
1.6多杀菌素半乳糖基衍生物的合成
1.6.1苯甲酰化半乳糖的制备称取D-半乳糖16 g(0.089 mol)于反应瓶中,加入吡啶350 mL、DMAP 12.1 g(0.039 mol)。室温搅拌后冰浴条件下加入98 mL(0.84 mol)苯甲酰氯,TLC监测反应进程,监测体系为石油醚-乙酸乙酯-HOAc溶液(V(石油醚)∶V(乙酸乙酯)∶V(HOAc)=3∶1∶0.2),室温搅拌10 h后反应结束。然后同1.5.1节,得全苯甲酰化半乳糖白色固体化合物1b:60.29 g(0.08 mol)。
1.6.21-OH苯甲酰化半乳糖的制备在300 mL THF溶液中溶入全苯甲酰化半乳糖32.78 g(0.047 mol),加入33%甲胺乙醇溶液66 mL(0.28 mol)后室温搅拌,TLC监测反应进程,监测体系为石油醚-乙酸乙酯溶液(V(石油醚)∶V(乙酸乙酯)=2∶1),3 h后反应结束。柱层析分离,得到1-OH苯甲酰化半乳糖白色固体化合物2b:12.72 g(0.021 4 mol)。
1.6.3半乳糖三氯异胺酯的合成无水二氯甲烷中溶入1-OH苯甲酰化半乳糖8.56 g(0.014 4 mol),在无氧环境中加入三氯乙腈17.4 mL(0.139 mol)、DBU 1.8 mL(0.013 mol),室温搅拌,TLC监测反应进程,监测体系为石油醚-乙酸乙酯溶液(溶液(V(石油醚)∶V(乙酸乙酯)=2∶1),12 h后反应结束,柱层析分离,得到半乳糖三氯异胺酯产物——白色固体化合物3b:6.45 g(8.87 mol),与参考文献[17]一致。
1.6.4多杀菌素C-9 全苯甲酰化D-半乳糖衍生物的合成称取2 283.3 mg(3.137 mmol)半乳糖三氯异胺酯和574.4 mg(1.01 mmol)C-9假糖苷配基,溶入20 mL无水二氯甲烷中,室温下搅拌5 min,之后继续搅拌,加入TMSOTF 11 μL(0.06 mol),1 h后室温搅拌,TLC监测反应进程,监测体系为石油醚-乙酸乙酯溶液(V(石油醚)∶V(乙酸乙酯)=3∶1),16 h后反应结束,柱层析分离,得到多杀菌素全苯甲酰化半乳糖衍生物——白色固体化合物5b:1.005 g(0.786 mmol)。
1.7多杀菌素鼠李糖基衍生物的合成
1.7.1苯甲酰化鼠李糖的制备称取L-鼠李糖14 g(0.085 mol)于反应瓶中,加入吡啶230 mL、DMAP 10.5 g(0.034 mol)。室温搅拌后冰浴下加入98 mL(0.535 mol)苯甲酰氯,TLC监测反应进程,监测体系为石油醚-乙酸乙酯-HOAc溶液(V(石油醚)∶V(乙酸乙酯)∶V(HOAc)=4∶1∶0.2),室温下搅拌36 h后反应结束。然后同1.5.1节,得全苯甲酰化鼠李糖白色固体化合物1c:43.38 g(0.08 mol)。
1.7.21-OH苯甲酰化鼠李糖的制备在300 mL THF溶液中溶入全苯甲酰化鼠李糖35.46 g(0.535 mol),加入33%甲胺乙醇溶液114 mL(0.49 mol)后室温搅拌,TLC监测反应进程,监测体系为石油醚-乙酸乙酯溶液(V(石油醚)∶V(乙酸乙酯)=2∶1),1 h后反应结束。柱层析分离得1-OH苯甲酰化鼠李糖白色固体化合物2c:11.89 g(0.025 mol)。
1.7.3鼠李糖三氯异胺酯的合成无水二氯甲烷中溶入1-OH苯甲酰化鼠李糖7.31 g(0.015 4 mol),在无氧环境中加入三氯乙腈22 mL(0.215 mol)、DBU 2.2 mL(0.015 mol),室温搅拌,TLC监测反应进程,监测体系为石油醚-乙酸乙酯溶液(V(石油醚)∶V(乙酸乙酯)=2∶1),20 h后反应结束,柱层析分离,得鼠李糖三氯异胺酯白色固体化合物3c:5.96 g(0.009 8 mol),与参考文献[17]一致。
1.7.4多杀菌素C-9全苯甲酰化L-鼠李糖衍生物的合成称取1 680 g(1.47 mol)鼠李糖三氯异胺酯、280 mg (0.49 mmol) C-9假糖苷配基,溶入20 mL无水二氯甲烷中,室温搅拌5 min后在无氧环境中加入4A(分子筛孔径)分子筛约1.4 g。将反应管放入制备好的冰盐浴中继续搅拌,加入TMSOTF 9 μL (0.050 mmol),1 h后室温搅拌,TLC监测反应进程,监测体系为石油醚-乙酸乙酯溶液(V(石油醚)∶V(乙酸乙酯)=3∶1),12 h后反应结束,柱层析分离,得到多杀菌素C-9 L-鼠李糖衍生物白色固体化合物5c:198 g(0.172 mmol)。
1.8目标化合物杀虫活性的测定
以多杀菌素原料为对照品,采用96孔板法初步测定合成的新型多杀菌素衍生物对锯谷盗(Oryzae-philussurinamensis)、赤拟谷盗(Triboliumcastaneum(Herbst))、米蛾(Corcyracephalonica)等储粮虫害的摄食杀虫活性。将多杀菌素原料及合成的目标产物溶解在蒸馏水中(超声,温度<70 ℃),配制成质量浓度20 mg/L的药物溶液,幼虫卵在纯水恒温箱(35 ℃)中培养孵化8 h待用,期间用酵母粉提供营养。测试时每孔最佳幼虫个数为5只,每种成虫有1个孔,重复3次。将酵母粉喷洒样品后供试虫摄食,于室温光源下连续观察24 h,记录试虫的活动情况,并计算幼虫、成虫的死亡率。以拨动虫子不再活动作为虫子死亡的判断标准,死亡率为每个孔板中死亡虫子数除以每孔板的总虫数。连续7~10 d在相同温度及湿度等外因条件下进行重复试验。
2结果与分析
2.1多杀菌素最佳水解工艺的确定
多杀菌素最佳水解工艺的三因素三水平正交试验结果及方差分析结果见表2~3。
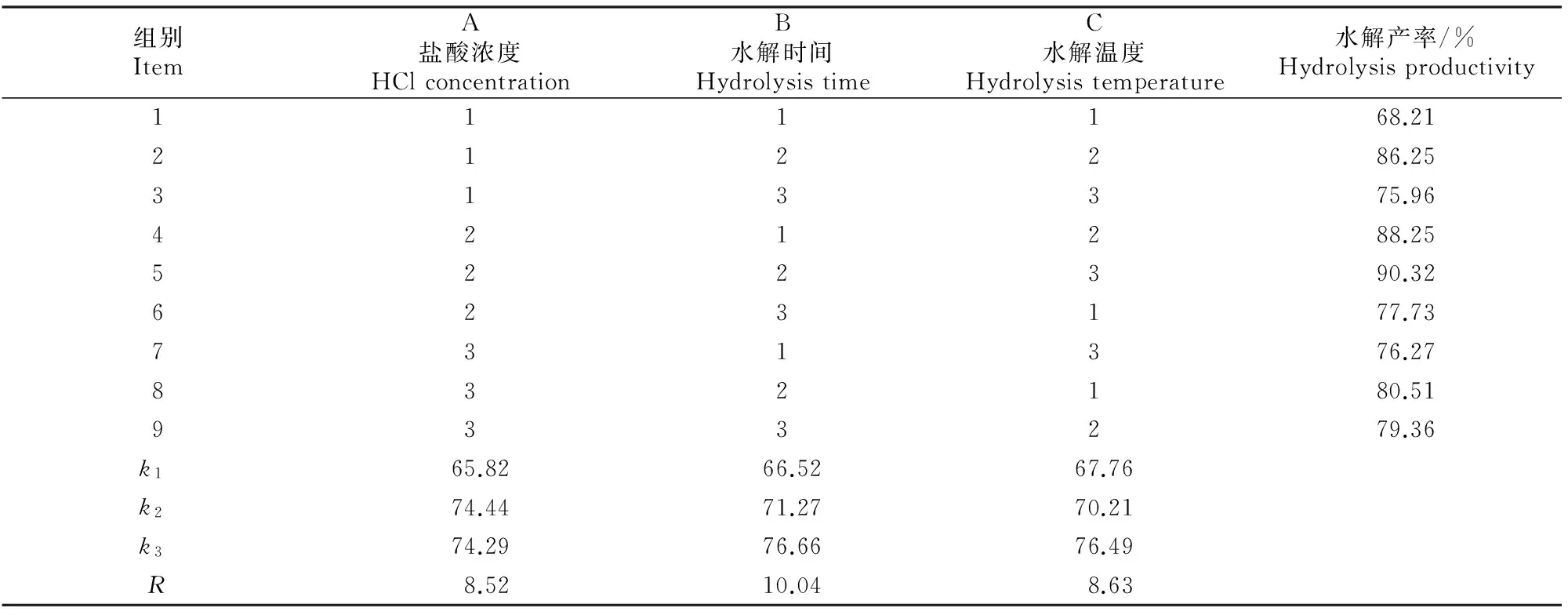
表 2 多杀菌素水解工艺的正交试验结果
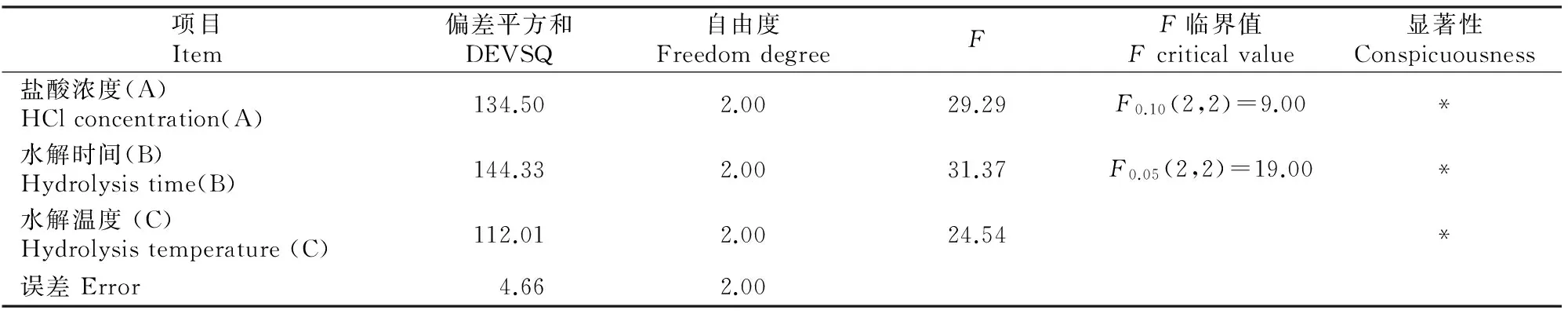
表 3 多杀菌素水解工艺正交试验结果的方差分析
从表2,3可知,多杀菌素水解工艺正交试验的3个因素对水解率的影响程度依次为B>C>A,3个因素、水平的最佳组合为A2B2C3,即盐酸水解的最佳工艺条件为:盐酸浓度为0.5 mol/L,水解时间为5.0 h,水解温度为95 ℃。
2.2多杀菌素标准品及水解产物的液相分析
多杀菌素标准品及水解产物的液相图如图4~5所示。
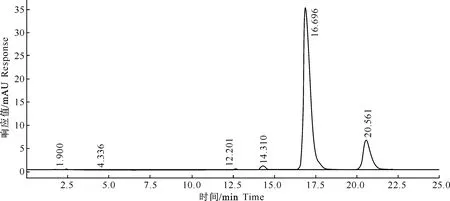
图 4 多杀菌素标准品的液相图
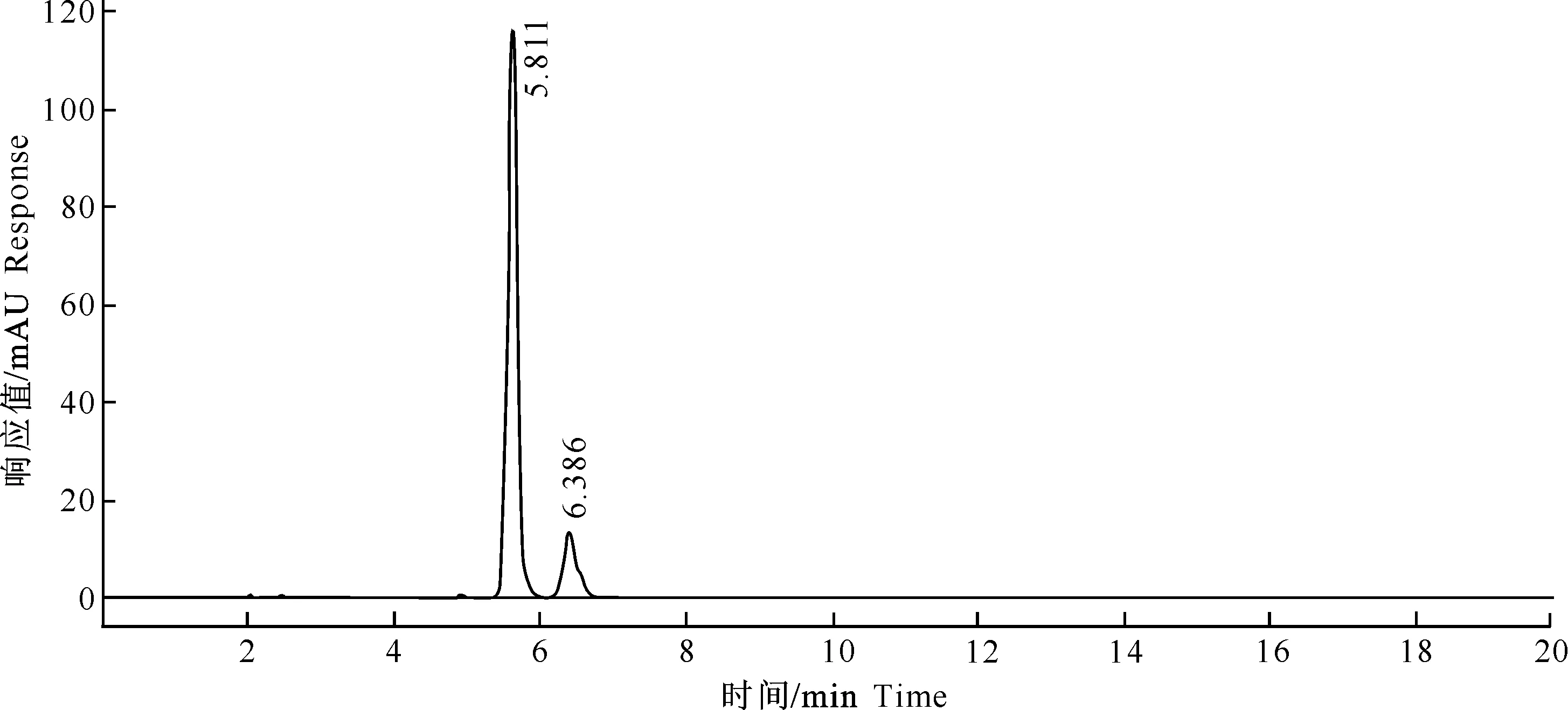
图 5 多杀菌素水解产物的液相图
比较图4和图5可以看出,图4中2个物质的出峰时间均明显晚于图5中2个物质的出峰时间,而多杀菌素水解后游离出羟基,极性变大,与之相对应其在HPLC中的出峰时间有所提前。因此,通过HPLC可初步判断多杀菌素已成功水解游离出羟基。
2.3多杀菌素衍生物的理化性质
化合物4和多杀菌素衍生物5a、5b、5c的相关理化性质和核磁共振数据、质谱和红外分析数据见表4和表5。
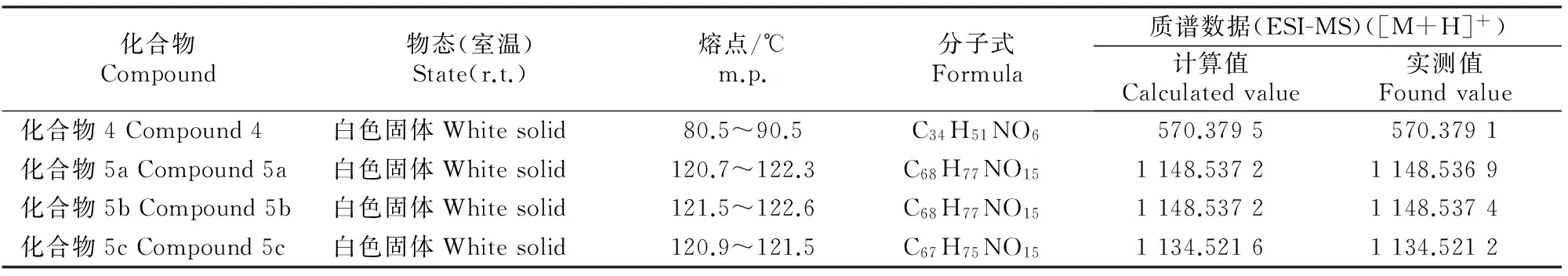
表 4 化合物4及化合物5a~5c的理化和质谱分析

表 5 化合物4及化合物5a~5c的核磁共振谱和红外光谱分析
由表4和表5可知,新合成的3种多杀菌素衍生物经核磁共振谱、质谱和IR表征为9-0-(β-D-吡喃葡萄糖)多杀菌素、9-0-(β-D-吡喃半乳糖)多杀菌素、9-0-(β-L-吡喃鼠李糖)多杀菌素,其结构如图6所示。本研究采用三氯乙酰亚胺法进行糖苷化反应,反应可在相对稳定的条件下进行,并通过反应条件的控制得到所需的立体构型,在酯化时采用的是碱性相对较强的DBU,同时选择反应活性较高的苯甲酰基保护的糖三氯乙酰亚胺酯作为糖基的供体,并与高效催化剂TMSOTF配合使用可使位阻较大的受体发生糖苷化反应,得到热力学比较稳定的α构型的产物,但当糖环2位带有邻基参与功能的保护基如酰基时,易形成β构型的糖苷键[16-17]。因为L-鼠李糖C2-OH位于a键上,所以以最难确定的L-吡喃鼠李糖为例进行分析,在CDCl3中,C-1’、C-2’、C-3’、C-41’、C-5’和C-6’分别为95.5,7.5,72.9,70.3,70.2,20.1 ppm(ppm为核磁中化学位移单位),与文献[16-17]一致,且与原料对比鼠李糖异头碳的质子信号为4.39(J=7.7 Hz),所以确定为9-0-(β-L-吡喃鼠李糖)多杀菌素,以此类推D-葡萄糖和D-半乳糖的C2-OH位于e键上,即可通过葡萄糖和半乳糖异头碳质子信号分别为4.89(J=8.2 Hz)、4.65(J=7.7 Hz)推断出其分别为9-0-(β-D-吡喃葡萄糖)多杀菌素和9-0-(β-D-吡喃半乳糖)多杀菌素。
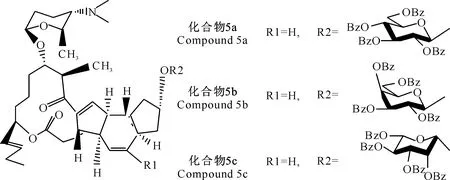
图 6 化合物5a~5c的结构式
2.4多杀菌素衍生物的杀虫活性
以多杀菌素原料为对照品,采用96孔板法测定新合成的多杀菌素衍生物对锯谷盗(Oryzaephilussurinamensis)、赤拟谷盗(TriboliumcastaneumHerbst)、米蛾(Corcyracephalonica)等储粮虫害的杀虫活性,结果如表6所示。
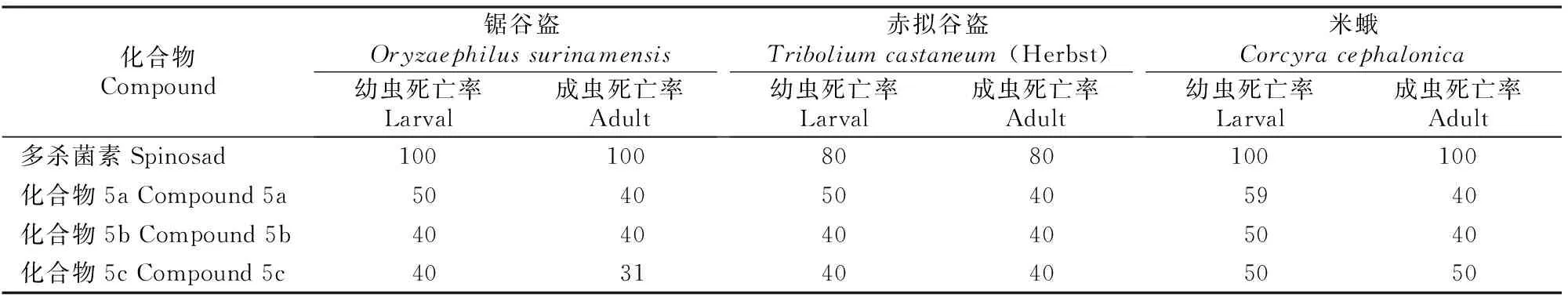
表 6 多杀菌素及衍生物的杀虫活性
由表6可以看出,合成的目标化合物在20 mg/L 剂量下对锯谷盗、赤拟谷盗和米蛾等害虫均表现出一定的摄食杀虫活性,死亡率为31%~59%,有效性可持续7~8 d,且对米蛾的杀虫活性高于锯谷盗和赤拟谷盗。
3结论与讨论
1)通过水解去除多杀菌素的甲氧基化α-L-鼠李糖获得多杀菌素的C-9假糖苷配基,多杀菌素的最佳水解工艺条件为:盐酸浓度0.5 mol/L,水解时间为5.0 h,水解温度为95 ℃。在此条件下多杀菌素的水解产率大、效率高、条件稳定,更有利于保证后期合成所需的糖苷键量。
2)以水解获得的多杀菌素C-9假糖苷配基为受体,以D-葡萄糖、D-半乳糖、L-鼠李糖 3种单糖为供体,采用三氯乙酰亚胺法进行糖苷化反应,经过五大反应步骤,即假糖苷的制备、糖的全苯甲酰化、游离羟基的选择、酯化、新糖苷键的形成,可以得到3种新型化合物,酯化和糖苷键形成时要严格控制无水无氧环境,糖苷键立体构型可控制。通过核磁共振谱1H-NMR、13C-NMR、MR和IR等分析,确认成功得到了具有杀虫活性的9-0-(β-D-吡喃葡萄糖)多杀菌素衍生物、9-0-(β-D-吡喃半乳糖)多杀菌素衍生物、9-0-(β-L-吡喃鼠李糖)多杀菌素衍生物。如果将酯化反应中的DBU换成弱无机碱K2CO3等,也可以提供以β构型为主的异构体。
3)采用96孔板法测定所获得的多杀菌素衍生物对储食害虫的摄食杀虫活性,表明其对锯谷盗、赤拟谷盗、米蛾等储粮虫害均具有一定的摄食毒杀活性,致死率为31%~59%。合成的多杀菌素衍生物的杀虫活性研究补充了多杀菌素在锯谷盗和赤拟谷盗中的杀虫谱,但其起效时间和与其他类型杀虫剂的毒力比较及其对虫害的熏蒸及趋避毒性等,均有待于进一步探究。尽管多杀菌素衍生物对锯谷盗和赤拟谷盗的杀虫活性稍差于成熟产品多杀菌素,但仍可对其衍生物做进一步的杀虫毒力研究,推测 C-9 糖基的变化对其杀虫活性的影响较小,还可以考虑单独将母环C-17或同时对C-9和C-17位的糖基进行修饰改造,对于其有关糖取代基更深一步的构效关系尚待进一步研究。
[参考文献]
[1]夏立秋,张友明,黄科学,等.多杀菌素研究进展 [C]//中国微生物学会.2009中国微生物学会学术年会论文集.北京:中国科学技术出版社,2011:16-17.
Xia L Q,Zhang Y M,Huang K X,et al.Research progression of spinosad [C]//Chinese Society for Microbiology.Chinese society of microbiology academic annual meeting of memoir in 1999.Beijing:China Science and Technology Press,2011:16-17.(in Chinese)
[2]王洁静,吕建华.多杀菌素在储粮害虫防治中的研究及应用进展 [J].粮食与饲料工业,2012,19(4):19-22.
Wang J J,Lü J H.Research progression and usedof spinosad in prevention and control of pests [J].Cereal & Feed Industry,2012,19(4):19-22.(in Chinese)
[3]梁权.引人注目的储粮害虫防治研究进展评述 [J].粮食储藏,2001(1):6-11.
Liang Q.Research progress of remarkable grain storage pest control are reviewed [J].Food Storage,2001(1):6-11.(in Chinese)
[4]Geber B,Emmerling A,Becker.Koenigs-knorr reaction of fusel alcohols with methyl (1-bromo-2,3,4-tri-O-acetyl-α-d-glucopyra spinosid)uronate leading to the protected alkyl glucuronides-crystal structures and high resolution ~1H and ~13CNMR data [J].Carbohydrate Research,2012,352:186-190.
[5]Munyololo M,Gammon D W,Mohrholz I.Extending the scope of the ferrierreaction:fragmentation-rearrangement reactions of selectivel substitute1,2-cyclopropanated glucose derivatives [J].Carbohydrate Research,2012,351(4):49-55.
[6]SparkstcT D.Spinosad a case study:an example from a nature products discovery programme [J].Pest Management Science,2000,56:696-702.
[7]蔡恒,王燕,万红贵,等.刺糖多孢菌生产多杀菌素的研究进展 [J].中国生物工程杂志,2011,31(2):124-129.
Cai H,Wang Y,Wan H G,et al.Research progress of Thorn sugar more bacteria produce sterilization [J].Journal of Chinese Bio-Technology,2011,31(2):124-129.(in Chinese)
[8]Lowe L B.Pesticidal spinosyn derivates:US,8048861 [P].2001-11-01.
[9]Peter B A,Creemer L C,Gary D,et al.Synthetic modification of Spinosyn compounds:US,6001981 [P].1999-12-14.
[10]聂果,王广成,张忠明,等.多杀菌素高效液相色谱分析 [J].农药科学与管理,2003,24(8):6-8.
Nie G,Wang G C,Zhang Z M,et al.High performance liquid chromatograph of spinosad [J].Pesticide Science and Admini-Stration,2003,24(8):6-8.(in Chinese)
[11]张苑,金志华,林建平,等.多杀菌素的高效液相色谱法测定 [J].农药,2003,42(10):27-28.
Zhang Y,Jin Z H,Lin J P,et al.Determination of spinosyns by high performance liquid [J].Pesticide,2003,42(10):27-28.(in Chinese)
[12]王彦华,王鸣华.多杀菌素的作用机理及其执药性的研究进展 [J].农业科学与管理,2006,25(11):12-15.
Wang Y H,Wang M H.Research progress of the mechanism and research progress of medicinal properties about spinosad [J].Pesticide Science and Administration,2006,25(11):12-15.(in Chinese)
[13]Breslin W J,Marty M S,Vedula U V,et al.Developmental toxicity of spinosad administered by gavage to CD rats and New Zealand white rabbits [J].Food & Chemical Toxicology,2001,38(12):1103-1112.
[14]李月,常城,杨克迁.多杀菌素生物合成途径及改造策略 [J].微生物学报,2011,51(11):1431-1439.
Li Y,Chang C,Yang K Q.The biosynthetic pathway and transformation strategy of spinosad [J].Acta Microbiologica Sinica,2011,51(11):1431-1439.(in Chinese)
[15]胡西洲.多杀菌素分离纯化的工艺研究 [D].武汉:华中农业大学,2005:76-80.
Hu X Z.The research aimed to study the separation and purification techniques of spinosad [D].Wuhan:Huazhong Agricultural University,2005:76-80.(in Chinese)
[16]Lawrence C,Herbert A.Conversion of Spinosyn A and Spinosyn D to their respective 9- and 17- Pseudoaglycones and their aglycones [J].The Journal of Antibiotics,1998,51(8):795-800.
[17]裴月湖,华会明,李占林.核磁共振谱法在糖苷键构型确定中的应用 [J].药学学报,2011,46(2):127-131.
Pei Y H,Hua H M,Li Z L.NMR in the application of the glycosidic bond [J].Acta Pharmaceutica Sinica,2011,46(2):127-131.(in Chinese)
Synthesis and insecticidal activity of different aglycones derivatives of spinosad C-9
WANG Xu1,CHEN Xin1,LI Long1,KOU Yun-yun1,ZHANG Xiao-lin2
(1SchoolofBiologyandPharmaceuticalEngineering,WuhanPolytechnicUniversity,Wuhan,Hubei430023,China;2AcademyofStateAdministrationofGrain,Beijing100037,China)
Abstract:【Objective】 The purpose of this study was to synthesize spinosad with better insecticidal activity.【Method】 Using C-9 aglycone as receptor and three monosaccharaides (D-gluclse,D-galactose,and L-rhamnose) as donor, different aglycones derivatives of spinosad C-9 were synthesized using trichloroacetimidate method.All compounds were confirmed by1H-NMR,13C-NMR,MS and IR and their insecticidal activities were determined. 【Result】 Spectra analysis with1H NMR,13C-NMR,MS and IR confirmed that the new synthesized three derivatives were 9-0 (β-D-pyran glucose),9-0-(β-D-pyran galactose),and 9-0-(β-L-pyran rat lee sugar).The new compounds exhibited intertidal activities against Oryzaephilus surinamensis,Tribolium castaneum (Herbst),Corcyra cephalonica at concentration of 20 mg/L,and the lethality was 31%-59%.【Conclusion】 The compounds synthesized in this study had good insecticidal activity and the structure activity relationship should be further studied.
Key words:spinosad;glycosyl derivatives;insecticidal activity
DOI:网络出版时间:2016-05-0314:0510.13207/j.cnki.jnwafu.2016.06.020
[收稿日期]2014-10-24
[基金项目]国家粮食公益性行业科研专项“储粮虫霉监测与生态控制技术研究”(201313002)
[作者简介]王旭(1987-),男,湖北随州人,硕士,主要从事药学研究。E-mail:wangxu54ep@126.com [通信作者]陈新(1978-),男,福建龙海人,副教授,博士,硕士生导师,主要从事药学研究。E-mail:chenxin_0001@126.com
[中图分类号]S482.2+8
[文献标志码]A
[文章编号]1671-9387(2016)06-0141-09
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160503.1405.040.html
