呼吸道合胞病毒疫苗增强性疾病小鼠模型的建立与评价
2016-06-29贾然陆路梁小珍孙志武谭令兵徐梦华苏犁云徐锦
贾然,陆路,梁小珍,孙志武,谭令兵,徐梦华,苏犁云,徐锦
1. 复旦大学附属儿科医院临床检验中心,上海 201102; 2. 复旦大学基础医学院教育部/卫生部医学分子病毒学重点实验室,上海 200032; 3. 中国科学院上海巴斯德研究所,上海 200031
·论著·
呼吸道合胞病毒疫苗增强性疾病小鼠模型的建立与评价
贾然1,陆路2,梁小珍3,孙志武2,谭令兵3,徐梦华1,苏犁云1,徐锦1
1. 复旦大学附属儿科医院临床检验中心,上海 201102; 2. 复旦大学基础医学院教育部/卫生部医学分子病毒学重点实验室,上海 200032; 3. 中国科学院上海巴斯德研究所,上海 200031
摘要:呼吸道合胞病毒(respiratory syncytial virus,RSV)是导致婴幼儿严重下呼吸道感染的最重要病原体,但该病毒的灭活疫苗可引起RSV疫苗增强性疾病(RSV vaccine-enhanced disease,RVED),因此至今仍未研制出安全、有效的疫苗。RVED的发生机制目前仍不清楚。使用能有效模拟RVED的动物模型是探索RVED发生机制的主要手段,而本研究的目的就是建立能稳定模拟RVED表现的小鼠模型。将BALB/c小鼠分成3组,即甲醛灭活RSV疫苗接种组(FV组)、活RSV接种组(VV组)和对照组(BV组),并模拟自然感染对其攻毒。通过小鼠体重监测、肺组织苏木精-伊红染色、荧光定量聚合酶链反应(polymerase chain reaction,PCR)、流式细胞术等,观察FV组小鼠感染RSV后的病毒载量、肺部炎症和T细胞免疫状态。结果显示,与VV组和BV组相比,FV组小鼠RSV攻毒后的体重占初始体重百分比显著降低,肺部炎症最明显,且仅FV组出现支气管和毛细血管周围有大量淋巴细胞浸润及嗜酸性粒细胞浸润。荧光定量PCR显示,FV组小鼠的肺部RSV载量最低。流式细胞术显示,攻毒4 d后FV组CD4+ T细胞数与其他两组相比显著增加,且CD4+ T细胞分泌的白细胞介素4(interleukin 4,IL-4)及IL-4/γ干扰素(interferon γ,IFN-γ)比值显著高于其他两组,而CD8+T细胞分泌的肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和IFN-γ低于VV组。结果提示,RVED小鼠呈现出Th2优势型免疫应答及CD8+ T细胞功能不足,模型初步建立成功,为RVED发生机制的探索和RSV疫苗的研发奠定了良好基础。
关键词:呼吸道合胞病毒;呼吸道合胞病毒疫苗增强性疾病;Th2优势型免疫应答
呼吸道合胞病毒(respiratory syncytial virus,RSV)属于副黏病毒科肺病毒属,是世界范围内导致婴幼儿严重下呼吸道感染的最重要病原体,每年由RSV感染导致的5岁以下婴幼儿死亡病例达20万例[1]。然而到目前为止,仍没有安全、有效的疫苗被批准用于婴幼儿RSV感染的预防。20世纪60年代,人们首次在婴幼儿中开展了甲醛灭活RSV疫苗(formalin-inactivated RSV vaccine,FIRSV)的临床试验,然而80%的受试者在自然感染RSV后出现了比初次感染时更严重的肺炎,甚至有两名受试儿童死亡,且死者肺部病理切片显示其肺部毛细血管及支气管周围有大量淋巴细胞及嗜酸性粒细胞浸润。因此,该疫苗的研制很快宣告失败[2-3]。这种由于接种灭活RSV疫苗而导致的病情比未接种疫苗者更严重的疾病称为呼吸道合胞病毒疫苗增强性疾病(RSV vaccine-enhanced disease,RVED)。
RVED的发生严重阻碍了RSV疫苗的研制,但其发生机制目前仍不清楚。早期对RVED机制的研究主要集中在体液免疫上,认为在FIRSV制作过程中抗原表位被甲醛破坏,因而不能激发机体产生有效的特异性中和抗体。但后来研究发现,这种由于接种灭活疫苗而导致的疫苗增强性疾病,在同属于副黏病毒科的麻疹病毒和偏肺病毒中也存在,而在流感病毒和副流感病毒中不存在[4],且RSV G蛋白疫苗也能诱导小鼠产生类似RVED的表现[5],表明甲醛并不是导致RVED发生的关键所在。因此,部分学者转而研究RVED形成的细胞免疫机制,发现RVED小鼠体内的Th2型细胞因子﹝白细胞介素4(interleukin 4,IL-4)、IL-5等﹞分泌明显升高,而Th1型细胞因子﹝γ干扰素(interferon γ,IFN-γ)等﹞则相对下降,即RVED小鼠体内存在一种特殊的Th2优势型免疫应答。研究者们认为这种异常T细胞应答所导致的细胞因子风暴与RVED小鼠感染后的免疫病理密切相关。但灭活的RSV疫苗如何导致异常T细胞免疫应答发生,目前还不清楚,这也是目前RVED发生机制研究领域中最需要回答的关键问题。
使用能有效模拟RVED表现的动物模型是探索RVED发生机制的主要手段,也是疫苗研发中的重要环节。目前,用于构建RVED动物模型的疫苗主要有灭活疫苗(如紫外线灭活疫苗和FIRSV[6])、亚单位疫苗(如RSV G蛋白疫苗[5])、重组疫苗(如表达RSV G蛋白的牛痘病毒疫苗[7])等。不同RSV疫苗导致RVED表现有所不同。例如,传统FIRSV可导致小鼠感染后出现体重下降、重度肺炎、肺部嗜酸性粒细胞浸润等表现;而RSV G蛋白疫苗导致的RVED小鼠体重下降程度较轻,主要表现为肺部炎症加重[5];RSV F蛋白疫苗可导致小鼠体重下降,但不会出现肺部嗜酸性粒细胞浸润[8]。不同的RSV疫苗通过何种机制诱导不同表现的RVED目前还不清楚。因此,构建RVED动物模型时,需根据研究目的来选择合适的RSV疫苗。本研究旨在构建有典型RVED表现的小鼠模型,使用传统的FIRSV接种小鼠,并对其感染RSV后的肺部炎症、T细胞免疫状态、肺部RSV载量等进行检测。
1材料与方法
1.1材料
RSV A2病毒株由复旦大学基础医学院教育部/卫生部医学分子病毒学重点实验室姜世勃教授实验室扩增保存。DMEM培养液和RPMI 1640培养液购自美国Gibco公司,铝佐剂购自美国Thermo Scientific公司,CD8、CD4、IL-4、IFN-γ、IL-17和肿瘤坏死因子α(tumor necrosis factor α, TNF-α)单克隆荧光标记抗体购自美国eBioscience公司,Fc block、高尔基复合体阻断剂和细胞内因子流式染色试剂盒购自美国BD公司,鼠抗RSV F蛋白单克隆抗体购自德国Leica公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记兔抗鼠免疫球蛋白多克隆抗体购自丹麦Dako公司,HRP显色底物4-氯-1-萘酚(4-chloro-1-naphthol,4CN)购自美国Bio-Rad公司,流式细胞仪购自美国BD公司,淋巴细胞刺激剂购自美国Biolegend公司,TRIzol提取剂购自美国Invitrogen公司,Prime ScriptTM反转录-聚合酶链反应(reverse transcriptase-polymerase chain reaction,RT-PCR)试剂盒和Premix Ex TaqTMReal-time RCR试剂盒购自日本TaKaRa公司,荧光定量PCR仪购自瑞士Roche公司。
1.2方法
1.2.1RSV培养及滴度检测本研究使用Hep-2细胞培养RSV。用滚瓶培养Hep-2细胞,待细胞铺满瓶壁80%~90%时,弃上清液,用无菌磷酸盐缓冲液(phosphate buffered saline,PBS)洗细胞1次,加入600 μL RSV液和40 mL含2%胎牛血清(fetal bovine serum,FBS)的DMEM培养液,吸附3 h后补加100 mL含2% FBS的DMEM培养液,5% CO2、37 ℃培养。观察并记录合胞体形成情况,4~5 d后待合胞体全部脱落,将病毒液冻融3次,2 000 r/min离心10 min,收集上清液即为病毒液。将病毒液分装,于-80 ℃保存。
RSV毒力检测采用免疫酶组织化学法。将Hep-2细胞接种入24孔板,待其长满孔底90%时,将50 μL待测RSV液加入450 μL含2% FBS的DMEM培养液中配成10-1倍病毒稀释液,依次稀释,配制10-2~10-6倍病毒稀释液,将10-2~10-6倍共5个密度的病毒稀释液按200 μL/孔加入24孔板中,每个密度做一个复孔。放入37 ℃培养箱吸附3 h,期间每隔30 min轻轻摇动一次,弃去病毒液,每孔加入500 μL含0.2%低温琼脂的DMEM培养液,5% CO2、37 ℃培养。4~5 d后待合胞体形成完全时,弃琼脂,加入甲醛室温固定5 h,用含1%牛血清蛋白(bovine serum albumin,BSA)的PBS封闭1 h,PBS洗2次,按1∶250比例加入鼠抗RSV F蛋白单克隆抗体,4 ℃温育过夜。次日将24孔板用PBS洗2次,按1∶250比例加入HRP标记兔抗鼠免疫球蛋白多克隆抗体,4 ℃温育2 h,PBS洗2次。每孔加入500 μL HRP显色液(溶液A:4 mL甲醇+12 mg 4CN;溶液B:20 mL PBS+12 μL H2O2。显色前将溶液A、B混匀,现用现配)进行显色,计数斑点并计算病毒毒力。
1.2.2FIRSV制备将RSV液200 mL加入T75培养瓶中,按1∶4 000比例加入50 μL甲醛,摇匀后用封口膜封口,放入37 ℃培养箱中温育,72 h后取出,50 000g离心1 h,底部白色沉淀即为甲醛灭活的RSV。弃上清液,用8 mL无血清DMEM培养液重悬沉淀,吹打均匀,逐滴加入800 μL铝佐剂,边加边摇,此时Al(OH)3终浓度为4 mg/mL,4 ℃震荡过夜。3 000 r/min离心30 min,弃上清液,用2 mL无血清DMEM培养液重悬沉淀,分装并做好标记,于4 ℃保存备用。
1.2.3实验动物及分组选取无特定病原体(specific pathogen free,SPF)级BALB/c小鼠,雌性,6~8周龄,体重(21.1±0.6)g,购自上海斯莱克实验动物有限公司。本研究获得复旦大学附属儿科医院实验动物伦理委员会批准。
设置FIRSV接种组(FV组)、活RSV接种组(VV组)和PBS对照组(BV组),每组10只小鼠。FV组处理方案见图1,采用肌内注射方式为小鼠接种FIRSV, 接种两次,单次疫苗接种量50 μL;VV组小鼠在第1天以50 μL RSV液经鼻感染小鼠;而BV组小鼠在第1天以50 μL无菌PBS滴鼻。第28天FV组、VV组与BV组以滴度为106pfu的RSV液经鼻感染小鼠(攻毒)。

图1RVED小鼠模型的FIRSV接种及攻毒方案
Fig.1Vaccination and challenge schedules for RVED murine model
1.2.4模型评价体重记录:攻毒后当天起每天定时为每只小鼠称重,并观察其生活习性及饮食情况。
流式细胞术检测小鼠免疫应答状态:攻毒后第4天处死小鼠,无菌取脾,剪碎,加入1 mL含10% FBS的RPMI 1640培养液,用200目尼龙网研磨过滤,2 000 r/min离心;用预冷的红细胞裂解液重悬,冰上放置3 min,2 000 r/min离心,弃上清液;用含10% FBS的RPMI 1640培养液重悬细胞,计数并将细胞密度调整到2×106/mL;在每1 mL细胞悬液中加入2 μL淋巴细胞刺激剂,37 ℃培养箱放置1 h,然后每6 mL细胞悬液中加入4 μL高尔基复合体阻断剂,37 ℃培养箱中继续放置2 h,2 000 r/min离心,PBS洗2次;加入200倍稀释的Fc block,并将细胞转移入标记好的96孔板中,冰上放置30 min,离心, PBS洗2次;将荧光标记的抗CD4、CD8单克隆抗体加入Staining Buffer中,混匀后加入相应孔中,避光4 ℃温育20 min, PBS洗2次。按BD公司细胞内细胞因子流式染色试剂盒说明书进行操作,染色结束后每孔用100 μL 4%多聚甲醛将细胞重悬,并转移至流式管中,用流式细胞仪进行检测。
定量RT-PCR检测肺部RSV RNA含量:攻毒后第4天无菌取肺,称重并研磨,用TRIzol法抽提肺部总RNA,根据每只小鼠肺部重量按比例重悬总RNA。反转录使用随机引物,程序为37 ℃ 30 min,85 ℃ 5 s。荧光定量PCR扩增条带为RSV F蛋白,正向引物序列为CAARTCAAYATTGAG-ATAGAATCTAGAA,反向引物序列为GCTAT-ACAYARTATTATCATCCCACA,探针序列为FAM-C T C C A G A A T A Y A G G C A T G A T T C T C C-BHQ。荧光定量PCR程序为:95 ℃15 min预变性;95 ℃10 s→60 ℃1 min(荧光检测),45个循环。
肺部组织病理学检查:攻毒后第4天无菌取肺,于4%多聚甲醛中固定24 h,石蜡包埋、切片,进行苏木精-伊红(hematoxylin-eosin,HE)染色。光镜下观察并记录各组肺部病理学改变,400×高倍视野下计数支气管和毛细血管周围炎症细胞层数及是否有嗜酸性粒细胞浸润。
1.3统计学方法
2结果
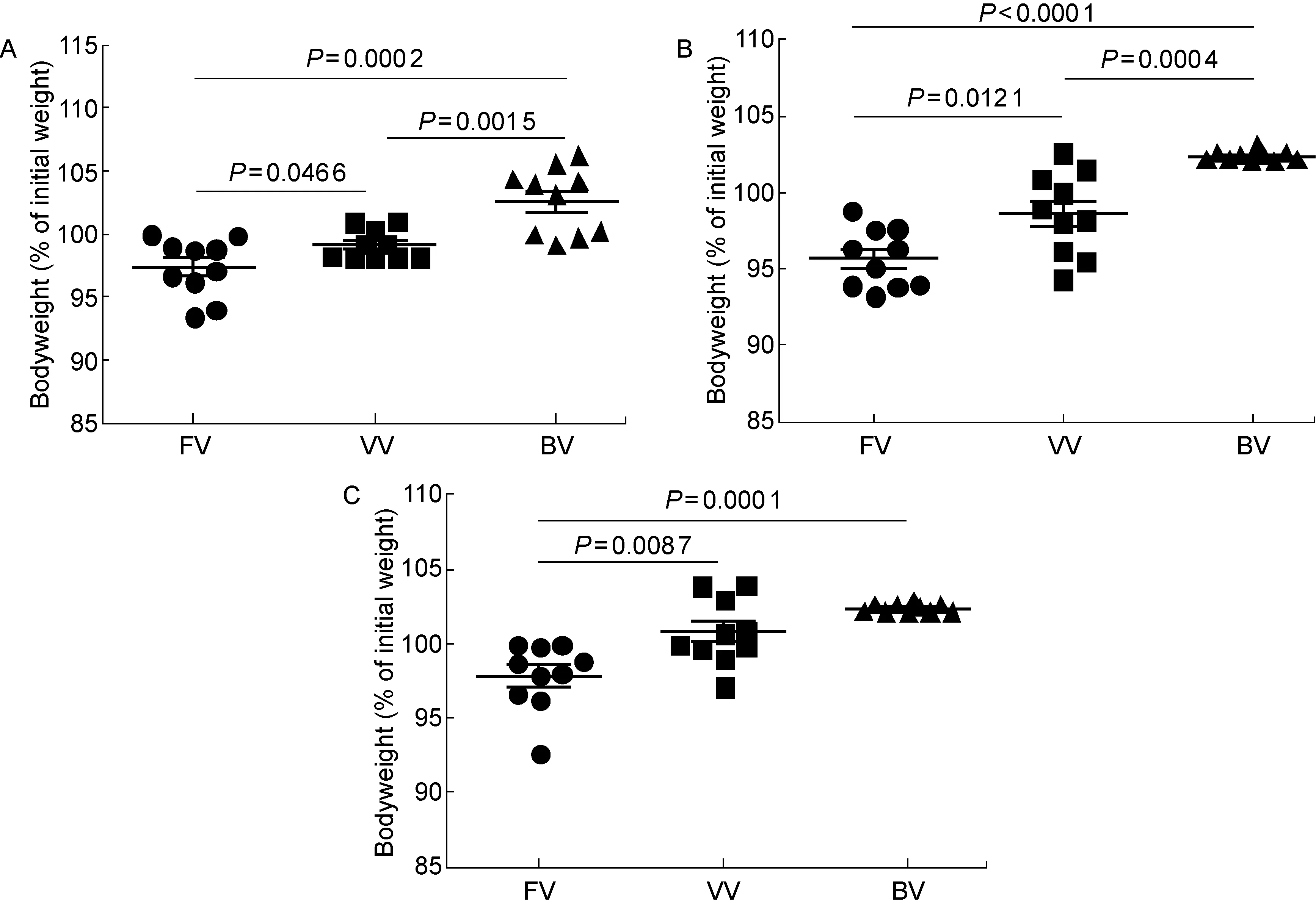
2.1小鼠攻毒后的体重变化
FV组、VV组和BV组的小鼠体重占初始体重的百分比:攻毒后第1天分别为(97.40±2.32)%、(99.06±1.09)%和(102.56±2.63)%,第2天分别为(95.68±1.98)%、(98.64±2.73)%和(102.32±0.34)%,第3天分别为(97.84±2.61)%、(100.73±2.27)%和(102.33±0.30)%。单因素方差分析显示,FV组、VV组和BV组小鼠在攻毒后第1、2、3天的体重占初始体重的百分比差异有统计学意义(F分别为15.15、29.76和15.57,均P<0.000 1)。攻毒后第1和第2天,FV组小鼠体重百分比均低于VV组(P<0.05)和BV组(P<0.001)。第3天,FV组小鼠体重虽稍有回升,但仍明显低于VV组(P<0.05)和BV组(P<0.001)。VV组在攻毒后第1和第2天的体重百分比均明显低于BV组(P<0.05),但第3天VV组与BV组小鼠的体重百分比差异无统计学意义(P>0.05)(图2)。
2.2肺部病理结果
如图3所示,FV组小鼠在攻毒后第4天肺部即可见明显炎症,支气管和毛细血管周围出现大量淋巴细胞浸润,支气管腔内有大量混杂的中性粒细胞的炎性分泌物,炎症区可见明显的嗜酸性粒细胞浸润。而VV组和BV组炎症程度均轻于FV组,支气管和毛细血管周围可见少量淋巴细胞浸润,未见嗜酸性粒细胞浸润。
如图4所示,高倍镜下计数各组小鼠支气管和毛细血管周围淋巴细胞平均层数发现,FV组、VV组和BV组小鼠毛细血管及支气管周围淋巴细胞平均层数分别为(25.8±8.37)、(6.00±2.38)和(8.25±3.52)层。单因素方差分析显示,3组小鼠的淋巴细胞层数差异有统计学意义(F=16.34,P=0.000 7)。其中FV组淋巴细胞层数显著高于VV组和BV组(均P<0.05),而BV组与VV组差异无统计学意义(P>0.05)。
A: Day 1 after challenge. B: Day 2 after challenge. C: Day 3 after challenge.
图2FV组、VV组和BV组小鼠在攻毒后3 d内的体重百分比
Fig.2The bodyweight changes of mice from groups FV, VV and BV within 3 d after challenge

HE staining of lung tissues of mice collected 4 d after challenge from FV group (A), VV group (C), BV group (E) at an original magnification of 100×, and 400× magnification of the selected areas was shown in B, D and F. Eosinophils dispersed in the inflammatory area of panel B are indicated by arrow.
图3FV组、VV组和BV组小鼠在攻毒后第4天的肺组织病理
Fig.3Pulmonary pathology of mice from groups FV, VV and BV on day 4 after challenge
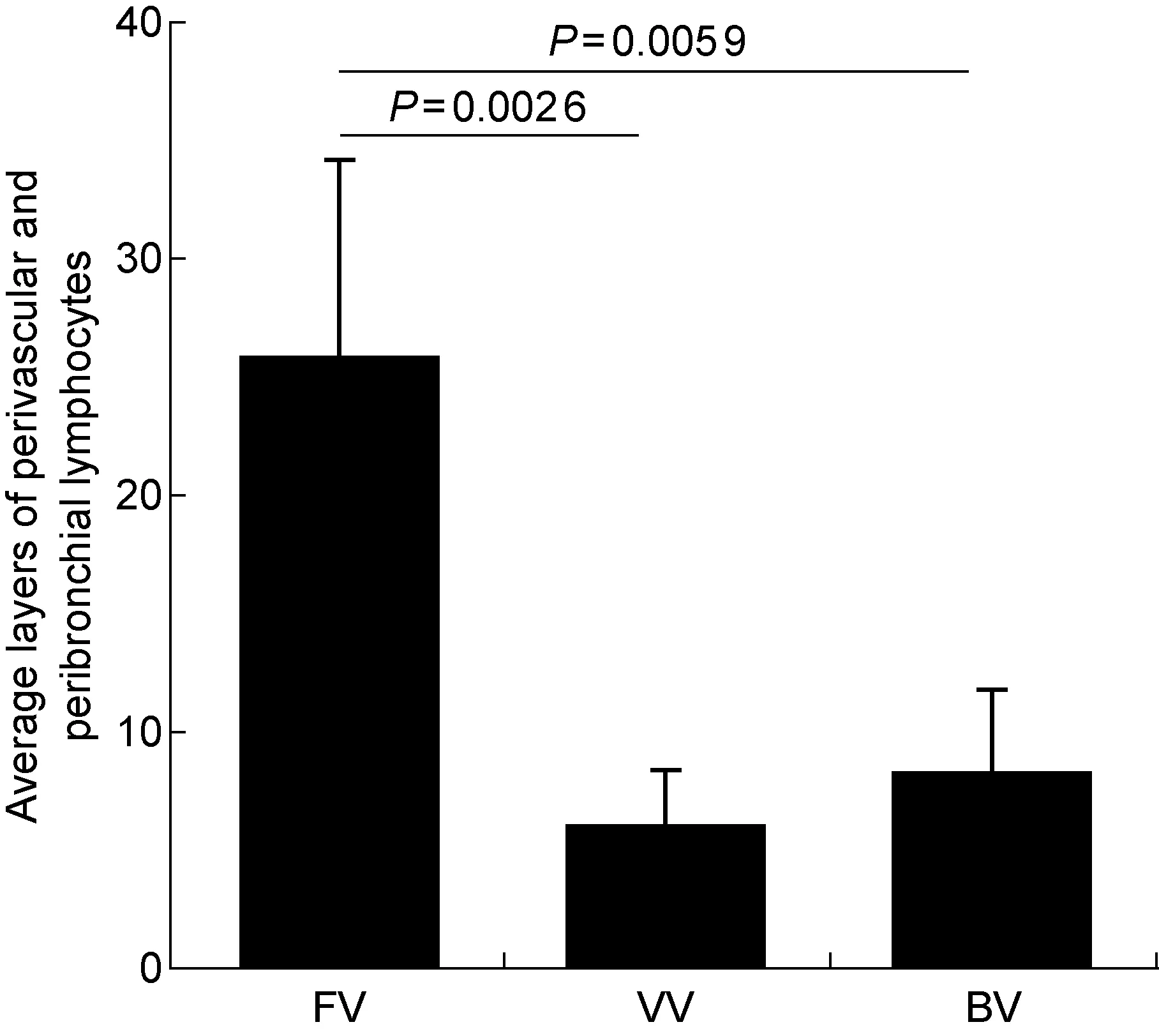
图4FV组、VV组和BV组小鼠肺支气管周围和血管周围淋巴细胞层数
Fig.4Average layers of perivascular and peribronchial lymphocytes in lungs of mice from groups FV, VV and BV
2.3流式细胞术检测结果
图5所示为攻毒后第4天通过流式细胞术测得的小鼠T细胞免疫状况。单因素方差分析显示,3组小鼠的CD4+T细胞数差异有统计学意义(F=9.86,P=0.005 4)。其中FV组CD4+T细胞数显著高于VV组和BV组(均P<0.05),而BV组与VV组差异无统计学意义(P>0.05)。3组之间CD8+T细胞数无统计学差异(F=1.02,P=0.396 1)。
方差分析显示,3组小鼠CD4+T细胞分泌的IL-4差异有统计学意义(F=7.47,P=0.010 4)。其中FV组CD4+T细胞分泌的IL-4显著高于VV组和BV组(均P<0.05);但3组之间CD4+T细胞分泌的IFN-γ和IL-17差异无统计学意义(F分别为0.51和0.20,均P>0.05)。
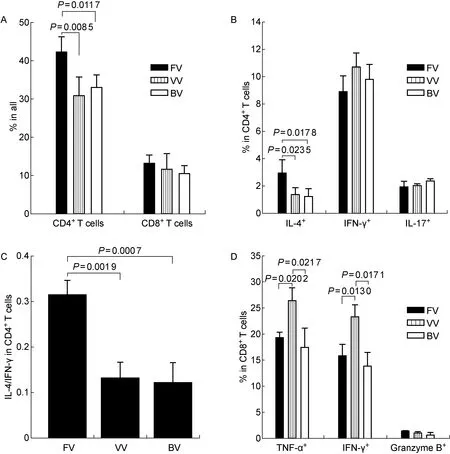
A: The percentage of CD4+T cells and CD8+T cells in splenocytes. B: The secretions of IL-4, IFN-γ and IL-17 in CD4+T cells measured by intracellular cytokine staining. C: The IL-4 to IFN-γ ratio in CD4+T cells according to the data from panel B. D: The secretions of TNF-α, IFN-γ and granzyme B in CD8+T cells.
图5FV组、VV组和BV组小鼠T细胞免疫应答状态
Fig.5The immune response of T lymphocytes in mice from groups FV, VV and BV
单因素方差分析显示,3组之间小鼠CD4+T细胞中IL-4/IFN-γ比值有显著性差异(F=20.95,P=0.000 3)。其中FV组IL-4/IFN-γ比值显著高于VV组(P<0.05)和BV组(P<0.001),而BV组与VV组无统计学差异(P>0.05)。
方差分析显示,3组之间小鼠CD8+T细胞分泌的TNF-α有统计学差异(F=8.52,P=0.013 3)。其中FV组和BV组的TNF-α分泌均显著低于VV组(均P<0.05),而FV组与BV组差异无统计学意义(P>0.05)。此外,3组之间小鼠IFN-γ分泌有统计学差异(F=11.59,P=0.008 7),其中FV组和BV组IFN-γ分泌显著低于VV组(均P<0.05),而FV组与BV组差异无统计学意义(P>0.05)。3组小鼠CD8+T细胞颗粒酶B(granzyme B)分泌水平均较低,且无统计学差异(F=0.29,P=0.757 7)。
2.4小鼠肺RSV含量检测
攻毒后第4天采用定量RT-PCR检测小鼠肺部RSV RNA含量,3组之间小鼠肺部RSV RNA含量差异有统计学意义(F=84.79,P=0.007 3)。其中FV组小鼠RSV含量显著低于VV组和BV组(均P<0.05),且BV组RSV含量显著高于VV组(P<0.001)(图6)。
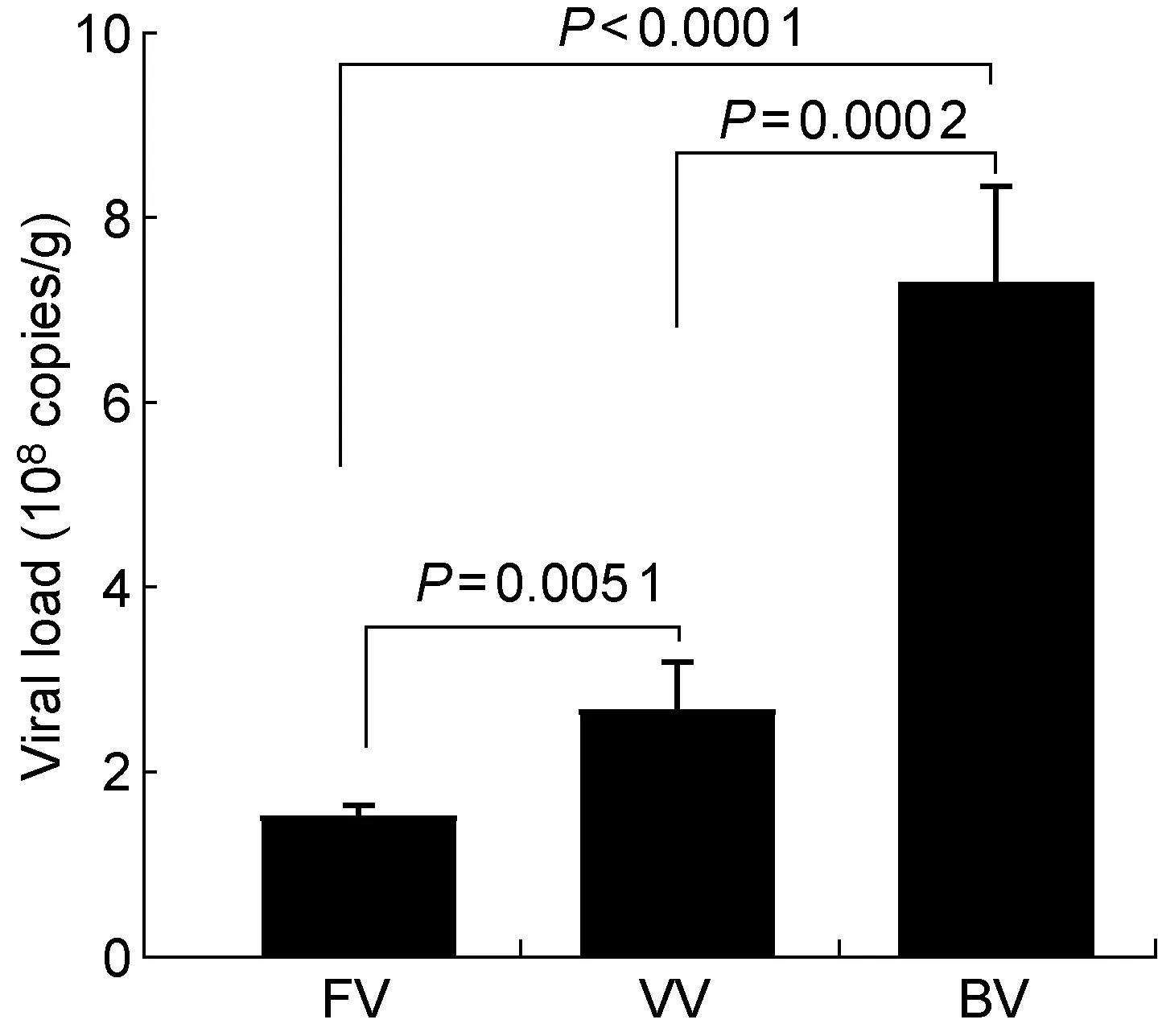
图6FV组、VV组和BV组小鼠肺部RSV RNA含量
Fig.6RSV RNA loads in lungs of mice from groups FV, VV and BV
3讨论
RVED的发生严重阻碍了RSV疫苗的研制,也导致RSV感染的预防工作在婴幼儿中难以开展。因此,重现RVED表现并探索其发生机制对RSV疫苗的研制具有重要意义。本研究中,与其他两组相比,FV组小鼠感染RSV后体重下降最明显,且肺部支气管和毛细血管周围有大量淋巴细胞浸润,炎症细胞层数显著多于另外两组,表明接种FIRSV的小鼠在感染RSV后,其全身病情和肺部炎症均比未免疫者更严重;且FV组小鼠的一个独特表现是,肺部有明显的嗜酸性粒细胞浸润。接种FIRSV后不幸死于RSV感染的两名儿童肺部也有类似病理表现[3],人类RVED的主要病理表现在小鼠体内得到了验证,表明本研究所构建的RVED小鼠模型能较好地模拟人类RVED的表现。
Th0细胞可在不同细胞因子和抗原的刺激下分化为Th1、Th2、Th17等。Th1细胞主要分泌IFN-γ等,Th17细胞主要分泌IL-17,Th2细胞则主要分泌IL-4、IL-5、IL-13等。其中IL-5是重要的嗜酸性粒细胞调节因子,可影响骨髓内嗜酸性粒细胞的分化;IL-4可通过JAK/STAT3途径诱导呼吸道重塑,促进肺部炎症形成,还可抑制Th0向Th1和Th17细胞分化[9]。本研究中,与其他两组相比,FV组攻毒后小鼠CD4+T细胞数显著升高,且CD4+T细胞分泌的IL-4和IL-4/IFN-γ比值显著高于VV组和BV组,表现出明显的Th2优势型免疫应答,与其他研究认为RVED小鼠存在Th2优势型免疫应答的特点一致[4,6]。本研究显示,CD4+T细胞中IFN-γ和IL-17无明显差异,进一步表明RVED小鼠的炎症及嗜酸性粒细胞浸润主要由Th2细胞介导,而Th1和Th17细胞可能由于被增强的Th2型应答所抑制,在炎症发生中并不扮演主要角色。
CD8+T细胞可特异性杀伤靶细胞,称为细胞毒性T细胞或杀伤性T细胞。CD8+T细胞可通过穿孔素、颗粒酶B、TNF-α等途径直接杀伤靶细胞,也可通过分泌IFN-γ活化巨噬细胞而间接杀伤靶细胞。其中杀伤作用最快的是穿孔素和颗粒酶B,TNF-α次之,IFN-γ最慢[10]。本研究通过流式细胞术发现,FV组和BV组小鼠CD8+T细胞分泌的TNF-α和IFN-γ比VV组显著下降,但3组之间颗粒酶B的水平均很低,无显著差异,表明RVED小鼠CD8+T细胞存在功能不足,且此杀伤功能的下降是通过TNF-α和IFN-γ途径实现的。有研究显示,RSV攻击RVED小鼠24 h就有颗粒酶B激活,认为颗粒酶B的激活可能发生在RSV攻毒后的早期[11];而在RSV攻毒后4 d,即RSV攻毒后期,可能因消耗而检出水平较低,且无显著差异。有研究发现,能充分激活CD8+T细胞应答的疫苗,可使小鼠表现出Th1优势型应答且嗜酸性粒细胞数明显减少,提示CD8+T细胞在Th2细胞的分化和激活中有重要抑制作用[12]。因此,导致RVED的效应细胞主要是CD4+T细胞,不是CD8+T细胞[4],且CD8+T细胞功能不足也促进了Th2优势型免疫应答和RVED的发生。
嗜酸性粒细胞作为支气管哮喘等疾病的主要效应细胞,可合成和分泌大量细胞毒素及促炎性介质,包括活性氧簇、嗜酸性粒细胞阳性蛋白等。当嗜酸性粒细胞活化或坏死时,这些物质被释放,引起一系列的组织损伤,如上皮细胞缺损、气道高反应性、组织炎症等[13]。因此,猜测RVED小鼠感染后形成的肺部病变可能与嗜酸性粒细胞有关。关于嗜酸性粒细胞性炎症的产生与Th2型免疫应答之间的关系,已有不少研究。Srikiatkhachorn等发现,CD8+T细胞可抑制嗜酸性粒细胞的成熟和募集[12]。Castilow等发现,Th2型细胞因子IL-4、IL-5和IL-13缺失能显著减少肺部嗜酸性粒细胞聚集的数量[14],表明嗜酸性粒细胞浸润是由于FV组小鼠感染RSV后触发Th2型细胞因子过度分泌所致。还有研究显示,嗜酸性粒细胞缺失小鼠在感染RSV后,肺部RSV含量显著升高,因此认为嗜酸性粒细胞可促进肺部RSV清除[15-16]。本研究中,FV组小鼠在感染RSV后有明显的嗜酸性粒细胞浸润,可能是由于明显增多的Th2型细胞因子IL-4导致小鼠肺部嗜酸性粒细胞大量浸润,而后者不仅是RVED的重要病理表现,也可能是FV组小鼠肺部RSV含量最低的重要原因。
近年来,有研究发现RVED小鼠中树突细胞(dendritic cell,DC)成熟度较低;而在接种疫苗的同时联合使用Toll样受体(Toll-like receptor,TLR)激动剂,则可有效激活DC并产生有保护性的Th1型免疫应答。因此,该研究认为灭活疫苗对DC表面的TLR激活不足,导致DC不能有效发挥抗原呈递作用,从而产生了不平衡的T细胞应答[6]。DC是体内功能最强的抗原呈递细胞,依赖TLR识别入侵的微生物而激活,从而激发天然免疫,将抗原呈递给CD4+和CD8+T细胞。通过调控CD4+和CD8+T细胞的分化、成熟,TLR能以DC为桥梁调节T细胞免疫应答。另外,由于TLR广泛表达于T细胞,有研究发现其激活可直接促进CD4+和CD8+T细胞的增殖、存活及相应细胞因子产生,并在病原特异性T细胞免疫记忆形成过程中有重要作用[17]。因此,TLR的激活不足可能是RVED形成的重要原因。其是通过DC间接影响还是通过T细胞直接影响获得性T细胞应答,是今后依赖此模型继续研究的方向。
目前,国内关于构建RVED动物模型的研究极少,更缺乏对其机制的研究。而国外对RVED的研究侧重于与免疫相关的发病机制。例如,Delgado等主要通过检测RSV特异性IgG的功能来探讨RVED形成与DC成熟度之间的关系,并采用酶联免疫斑点法(enzyme-linked immunospot assay,ELISPOT)检测肺部淋巴结IL-4和IFN-γ的分泌[6];李宏勇用实时荧光定量PCR检测RVED小鼠肺组织IL-4和IL-5等细胞因子的mRNA含量[18]。上述方法虽可检测细胞因子分泌水平,但不能区分CD4+T细胞与CD8+T细胞,因此不能准确观察Th1/Th2偏倚及CD8+T细胞功能。Johnson等观察并分析了RVED小鼠外周血和支气管肺泡灌洗液中的嗜酸性粒细胞数,用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)对肺组织匀浆上清液中的IL-4和IFN-γ总体水平进行检测,但未做CD8+T细胞功能检测[19],因此不能全面展现RVED小鼠的不平衡T细胞应答。本研究不仅检测了RVED小鼠的攻毒后体重变化、肺部炎症、肺部RSV载量等,还通过流式细胞术在细胞水平对CD4+和CD8+T细胞分泌的细胞因子进行了检测,明确显示Th2偏倚及CD8+T细胞功能不足。因此,与其他研究相比,本研究较为全面地呈现了RVED小鼠的肺部病理表现和异常T细胞免疫应答,为后期进一步探索其发生机制奠定了基础。
综上所述,本研究成功构建了RVED小鼠模型,再现了RVED小鼠的Th2优势型免疫应答及肺部嗜酸性粒细胞性炎症,为RVED发病机制研究和RSV疫苗研制提供了重要手段。
参考文献
[1]Taylor G, Thom M, Capone S, Pierantoni A, Guzman E, Herbert R, Scarselli E, Napolitano F, Giuliani A, Folgori A, Colloca S, Cortese R, Nicosia A, Vitelli A. Efficacy of a virus-vectored vaccine against human and bovine respiratory syncytial virus infections [J/OL]. Sci Transl Med, 2015. http://stm.sciencemag.org/content/7/300/300ra127.full.
[2]Anderson LJ. Respiratory syncytial virus vaccine development [J]. Semin Immunol, 2013, 25(2): 160-171.
[3]Kim HW, Canchola JG, Brandt CD, Pyles G, Chanock RM, Jensen K, Parrott RH. Respiratory syncytial virus disease in infants despite prior administration of antigenic inactivated vaccine [J]. Am J Epidemiol, 1969, 89(4): 422-434.
[4]Waris ME, Tsou C, Erdman DD, Zaki SR, Anderson LJ. Respiratory synctial virus infection in BALB/c mice previously immunized with formalin-inactivated virus induces enhanced pulmonary inflammatory response with a predominant Th2-like cytokine pattern [J]. J Virol, 1996, 70(5): 2852-2860.
[5]Li C, Zhou X, Zhong Y, Li C, Dong A, He Z, Zhang S, Wang B. A recombinant G protein plus cyclosporine A-based respiratory syncytial virus vaccine elicits humoral and regulatory T cell responses against infection without vaccine-enhanced disease [J]. J Immunol, 2016, 196(4): 1721-1731.
[6]Delgado MF, Coviello S, Monsalvo AC, Melendi GA, Hernandez JZ, Batalle JP, Diaz L, Trento A, Chang HY, Mitzner W, Ravetch J, Melero JA, Irusta PM, Polack FP. Lack of antibody affinity maturation due to poor Toll stimulation led to enhanced RSV disease [J]. Nat Med, 2009, 15(1): 34-41.
[7]Castilow EM, Legge KL, Varga SM. Cutting edge: Eosinophils do not contribute to respiratory syncytial virus vaccine-enhanced disease [J]. J Immunol, 2008, 181(10): 6692-6696.
[8]Castilow EM, Varga SM. Overcoming T cell-mediated immunopathology to achieve safe RSV vaccination [J]. Future Virol, 2008, 3(5): 445-454.
[9]Olson MR, Varga SM. Pulmonary immunity and immunopathology: lessons from respiratory syncytial virus [J]. Expert Rev Vaccines, 2008, 7(8): 1239-1255.
[10]Pinto RA, Arredondo SM, Bono MR, Gaggero AA, Díaz PV. T helper 1/T helper 2 cytokine imbalance in respiratory syncytial virus infection is associated with increased endogenous plasma cortisol [J]. Pediatrics, 2006, 117(5): e878-e886.
[11]Bar-Haim E, Erez N, Malloy AM, Graham BS, Ruckwardt TJ. CD8+TCR transgenic strains expressing public versus private TCR targeting the respiratory syncytial virus KdM282-90epitope demonstrate similar functional profiles [J]. PLoS One, 2014, 9(6): e99249.
[12]Srikiatkhachorn A, Braciale TJ. Virus-specific CD8+T lymphocytes downregulate T helper cell type 2 cytokine secretion and pulmonary eosinophilia during experimental murine respiratory syncytial virus infection [J]. J Exp Med, 1997, 186(3): 421-432.
[13]Sneeboer MM, Fens N, van de Pol MA, Majoor CJ, Meijers JC, Kamphuisen PW, Lutter R, Sterk PJ, Bel EH. Loss of asthma control and activation of coagulation and fibrinolysis [J]. Clin Exp Allergy, 2015, 46(3): 422-427.
[14]Castilow EM, Meyerholz DK, Varga SM. IL-13 is required for eosinophil entry into the lung during respiratory syncytial virus vaccine-enhanced disease [J]. J Immunol, 2008, 180(4): 2376-2384.
[15]Zhou W, Hashimoto K, Moore ML, Elias JA, Zhu Z, Durbin J, Colasurdo G, Rutigliano JA, Chiappetta CL, Goleniewska K, O′Neal JF, Graham BS, Peebles RS Jr. IL-13 is associated with reduced illness and replication in primary respiratory syncytial virus infection in the mouse [J]. Microbes Infect, 2006, 8(14-15): 2880-2889.
[16]Phipps S, Lam CE, Mahalingam S, Newhouse M, Ramirez R, Rosenberg HF, Foster PS, Matthaei KI. Eosinophils contribute to innate antiviral immunity and promote clearance of respiratory syncytial virus [J]. Blood, 2007, 110(5): 1578-1586.
[17]Zuo AJ, Liang DC, Shao H, Born WK, Sun DM. In vivo priming of IL-17+uveitogenic T cells is enhanced by Toll ligand receptor (TLR)2 and TLR4 agonists via gamma delta T cell activation [J]. Mol Immunol, 2012, 50(3): 125-133.
[18]李宏勇.Notch信号抑制剂和TLR配体联合作为佐剂对呼吸道合胞病毒疫苗增强性免疫病理的调节作用[D].石家庄:河北医科大学,2015.
[19]Johnson TR, Rao S, Seder RA, Chen M, Graham BS. TLR9 agonist, but not TLR7/8, functions as an adjuvant to diminish FI-RSV vaccine-enhanced disease, while either agonist used as therapy during primary RSV infection increases disease severity [J]. Vaccine, 2009, 27(23): 3045-3052.
Establishment and analysis of a murine model for respiratory syncytial virus vaccine-enhanced disease
JIA Ran1, LU Lu2, LIANG Xiaozhen3, SUN Zhiwu2, TAN Lingbing3, XU Menghua1, SU Liyun1, XU Jin1
1. Department of Clinical Laboratory, Children’s Hospital of Fudan University, Shanghai 201102, China; 2. Key Laboratory of Medical Molecular Virology of Ministries of Education and Health, School of Basic Medical Sciences, Fudan University, Shanghai 200032, China; 3. Institut Pasteur of Shanghai, Chinese Academy of Sciences, Shanghai 200032, China
Abstract:Respiratory syncytial virus (RSV) is the most important pathogen responsible for children’s severe lower respiratory tract infection worldwide. As inactivated RSV vaccine could lead to RSV vaccine-enhanced disease (RVED),no safe RSV vaccine has been permitted in clinical use yet, and the mechanism of RVED is still unclear. The aim of the present study is to establish a murine model that can steadily mimic the performance of RVED. A total of 30 BALB/c mice were divided into three groups and vaccinated with formalin-inactivated RSV (FV group), live RSV (VV group) or sterilized phosphate buffered saline (PBS) (BV group), respectively. Four weeks later, all the mice were challenged with live RSV intranasally. The bodyweight of the tested animals was measured on the day of viral challenge and the following 3 days. T cell immune response, lung RSV load and pulmonary pathology were detected by flow cytometry, quantitative reverse transcriptase-polymerase chain reaction (RT-qPCR) and lung hematoxylin-eosin (HE) staining respectively. Compared with the VV group and the BV group, the bodyweight of the mice in the FV group showed the largest weight loss after challenge. Severe pneumonia with extensive lymphocytic and eosinophilic infiltration could be seen in the FV group only. Lung RSV load in the FV group was the lowest. The number of CD4+ T cells in the FV group was higher than those in the other two groups, while the number of CD8+ T cells showed no significant difference among the three groups. The secretion of interleukin 4 (IL-4) in CD4+ T cells and IL-4/interferon γ (IFN-γ) ratio in the FV group were much higher than those in the other two groups, while the secretions of tumor necrosis factor α (TNF-α) and IFN-γ in the FV group were much lower than those in the VV group. In conclusion, a murine model of RVED has been established successfully, showing an unbalanced Th2-biased immune response and impaired CD8+ T cell function. The model could be used to help the study of RVED and development of protective and safe RSV vaccines.
Key words:Respiratory syncytial virus; Respiratory syncytial virus vaccine-enhanced disease; Th2-biased immune response
基金项目:国家自然科学基金(81273204)
通信作者:徐锦
Corresponding author. XU Jin, E-mail: jinxu_125@163.com
(收稿日期:2016-02-26)
