Ti-6Al-7Nb喷砂酸蚀处理后对大鼠成骨细胞的影响
2016-06-28孙鸿婉李志刚张静莹
孙鸿婉,李志刚,张静莹
Ti-6Al-7Nb喷砂酸蚀处理后对大鼠成骨细胞的影响
孙鸿婉1,李志刚1,张静莹2
摘要:目的研究纯钛(Ti)、Ti-6Al-7Nb表面经喷砂酸蚀(SLA)处理后大鼠成骨细胞的生物相容性。方法实验分为Ti机械打磨组(S1组)、Ti喷砂酸蚀组(SLA1组)、Ti-6Al-7Nb机械打磨组(S2组)以及Ti-6Al-7Nb喷砂酸蚀组(SLA2组)。用显微镜观察4组样品的表面形貌,使用接触角测量仪分析SLA1、SLA2组样品表面亲水性,并将2组样品放入模拟体液(SBF)中,7、14、21 d后分别用扫描电镜(SEM)、X线衍射仪(XRD)观察样品表面沉积物的形貌、物相,将从大鼠颅盖骨中提取的成骨细胞接种于4组样品上,用倒置显微镜观察大鼠成骨细胞形态,用MTT比色法测量大鼠成骨细胞增殖情况。结果显微镜下SLA1、SLA2组较S1、S2组样品表面拥有更多孔洞,接触角测量仪分析得出SLA1、SLA2组样品表面为亲水性结构,且SLA2组接触角小于SLA1组;SEM显示在14 d时SLA2组样品表面最先观察到覆盖的羟基磷灰石涂层,21 d时2组样品表面都观察到羟基磷灰石涂层。MTT实验结果经统计学分析得出成骨细胞在SLA1、SLA2组样品表面增殖能力强于S1、S2组,且在SLA2组样品表面的增殖能力强于SLA1组(P<0.05)。结论喷砂酸蚀处理的Ti-6Al-7Nb拥有良好的生物相容性,有利于促进种植体与骨组织的结合。
关键词:喷砂酸蚀;模拟体液;成骨细胞;机械打磨;钛;Ti-6Al-7Nb
随着口腔医学的快速发展,种植技术被越来越多地应用于口腔修复中。目前钛(Ti)及Ti-6Al-4V因其良好的机械性能,成为广泛使用的种植材料[1]。然而,Ti在组织液中会发生腐蚀,种植体周围会出现含Ti的黑色颗粒沉积[2]。Ti-6Al-4V合金在人体中会释放含有钒(V)的有毒元素,因此寻找新型钛种植体材料成为研究目标。Ti-6Al-7Nb合金用铌(Nb)代替V,减少了毒性元素的释放,此外该合金还具有良好的机械性能。同时,骨内种植材料的表面形态、亲水性等也是影响种植体-骨结合及临床疗效的关键因素[3]。我国主要使用喷砂酸蚀(SLA)的方法处理Ti及钛合金表面,喷砂酸蚀是种植体制作常用的一种方法[4],能提高钛合金表面的粗糙度,进而提高种植体-骨组织的骨结合率,提高种植的早期稳定性。本实验旨在观察Ti-6Al-7Nb经喷砂酸蚀处理后,其表面形貌、亲水性对大鼠成骨细胞生物相容性的影响。
1 材料与方法
1.1材料
1.1.1仪器与试剂喷砂设备(JY-80D吸入式干燥砂机),喷砂介质(Al2O3、SiO2、Fe2O3),X线衍射仪(XRD,9430-060-03002),超高分辨率场发射扫描电镜(SEM,NOVA Nano⁃SEM450),倒置荧光显微镜(XSP-63XDV),接触角测量仪(OCA20),SBF模拟体液[5],胰酶(BIBCO美国),低速离心机(TDL-50D)。
1.1.2样品的制备选取纯Ti、Ti-6Al-7Nb两种样品,直径14 mm,厚1 mm。两种钛片先后用800、1 500、2 000目SiC砂纸进行机械打磨,将打磨过的钛片放入丙酮中超声清洗30 min,蒸馏水冲洗干燥。Ti、Ti-6Al-7Nb分别取一半在0.2 MPa压强下喷砂30 s,将喷砂后的Ti、Ti-6Al-7Nb放入配置好的酸蚀液中酸蚀80 s,蒸馏水冲洗干燥。将样品分为如下4组:Ti机械打磨组(S1组)、Ti喷砂酸蚀组(SLA1组)、Ti-6Al-7Nb机械打磨组(S2组)以及Ti-6Al-7Nb喷砂酸蚀组(SLA2组)。
1.1.3实验动物新生24 h内雄性SD大鼠10只,为一级普通动物,不计体质量,购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2012-001。
1.2方法
1.2.1样品表面形貌观察4组样品各取3个在40倍显微镜下观察其表面形貌。
1.2.2样品表面接触角测定将SLA后的Ti和Ti-6Al-7Nb各取4个放入接触角测试仪中,观察样品表面的接触角大小。1.2.3样品表面的Ca、P沉积将SLA1、SLA2组样品分别放入6孔板中,每孔加入10 mL模拟体液,放入37.5℃恒温箱中,每2 d更换1次模拟体液,在7、14、21 d时从2组样品中各取3个,去离子水清洗,40℃烘干。用SEM观察样品表面Ca、P沉积情况。
1.2.4样品表面物相分析将SLA1、SLA2组样品浸泡在10 mL的模拟体液中,分别在7、14、21 d时取出2组样品放入XRD测试仪中,测试角度θ为20°~60°,分析表面物相。
1.2.5大鼠成骨细胞的原代培养无菌条件下取出新生鼠的颅盖骨,用PBS冲洗,培养皿中加入PBS,刮除骨膜和结缔组织,用手术剪刀将颅盖骨剪碎,移至离心管中,1 000 r/min离心5 min,去上清液,加入0.25%胰蛋白酶,37℃恒温消化20 min,吸出消化液,加入完全培养基,吹打骨片,将细胞悬液接种于培养瓶中,置37℃,5%CO2恒温孵育箱中培养。
1.2.6大鼠成骨细胞形态观察在24孔细胞培养板中分别放入4组钛片,将接种于钛片表面的细胞用0.25%的胰酶消化下来进行细胞计数,调整密度为1×105cells/mL,吹打均匀后接种到每个钛片表面,每个钛片上接种细胞密度为1×104cells/mL,4 h后每孔添加1 mL完全培养基,48 h后2.5%戊二醛置于4℃固定,4 h后弃戊二醛用50%、70%、90%、100%乙醇梯度脱水,每个梯度进行2次,每次30 min,送检前喷金,于倒置显微镜下观察细胞的伸展情况。
1.2.7大鼠成骨细胞增殖情况测定将消化下来的细胞调整密度至1×105cells/mL,将细胞悬液接种到4组样品表面,每个样品表面接种细胞为1×104cells/mL,每个样本设3个平行孔。4 h后每孔补加1 mL完全培养基,37℃下孵育1、3、5 d。然后于相应时间点上弃去原培养基后每个钛片表面加550 μL MTT(50 μL,5 mg/L MTT加500 μL无血清培养基),37℃,5%CO2浓度条件下孵育4 h,去除无血清培养基,每孔加400 μL DMSO,移液枪吹打均匀后将溶解液转移至96孔板中,最后于酶标仪下测定570 nm下的吸光度(A)值。
1.3统计学方法使用SPSS 16.0软件进行分析,计量数据用x ±s表示,组间比较用方差分析,组间多重比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1样品表面形貌显微镜下可见S1、S2组样品表面光亮,具有砂纸打磨的机械划痕,SLA1、SLA2组样品表面出现明显孔洞结构,大小不等,SLA1、SLA2组较S1、S2组样品表面粗糙,有利于增加种植体接触面积,见图1。

Fig. 1 The surface morphology of samples under low multiple microscope(×40)图1低倍数显微镜下样品表面形貌(×40)
2.2样品表面的接触角分析SLA1、SLA2组样品表面的接触角情况,见图2。2组样品表面接触角均小于90°,为亲水性,这种性能更接近于骨小梁结构。在实验范围内大多数测量显示Ti-6Al-7Nb的接触角小于Ti,具有更好的表面张力。

Fig. 2 The surface contact angle of SLA1 and SLA2 groups图2 SLA1、SLA2组样品表面接触角
2.3样品表面Ca、P沉积量和元素分析SEM下观察,SLA1、SLA2组样品在模拟体液中浸泡7 d后表面无Ca、P沉积物,仍为多孔结构;浸泡14 d后SLA1组样品表面仍无Ca、P沉积,而SLA2组样品表面可见Ca、P沉积并形成沉积基团;浸泡21 d后2组样品上均有Ca、P沉积形成沉积基团,见图3~5。对浸泡21 d的2组样品进行能谱分析,Ti表面主要是Ti、O、Ca、P、C、Na、Cl,Ca/P=1.933;Ti-6Al-7Nb表面主要是Ti、Al、Nb、O、Ca、P、C、Na、Cl,Ca/P= 1.64,见图6。

Fig.3 SEM micrographs of SLA1 and SLA2 groups after beingsoaked in SBFfor 7 d(×3 000)图3 SLA1、SLA2组样品在SBF中浸泡7 d后的SEM形貌(×3 000)

Fig.4 SEMmicrographs of SLA1and SLA2groups afterbeingsoakedin SBFfor 14 d图4 SLA1、SLA2组样品在SBF中浸泡14 d后SEM观察

Fig.5 SEM micrographs of SLA1 and SLA2 groups after beingsoaked in SBFfor 21 d(×2 000)图5 SLA1、SLA2组样品在SBF中浸泡21 d后SEM观察(×2 000)
2.4样品表面XRD成分分析在SBF中浸泡7 d
后SLA1、SLA2组样品表面只有明显的Ti衍射峰,
14 d后观察到SLA1组样品表面有Ti和TiO衍射峰,而SLA2组样品除了以上两种以外还有微弱的羟基磷灰石(HA)和锐钛矿衍射峰,至21 d SLA2组样品中检测到HA和TiO明显增多,此外又出现了微弱的金红石和CaTiO3,见图7。
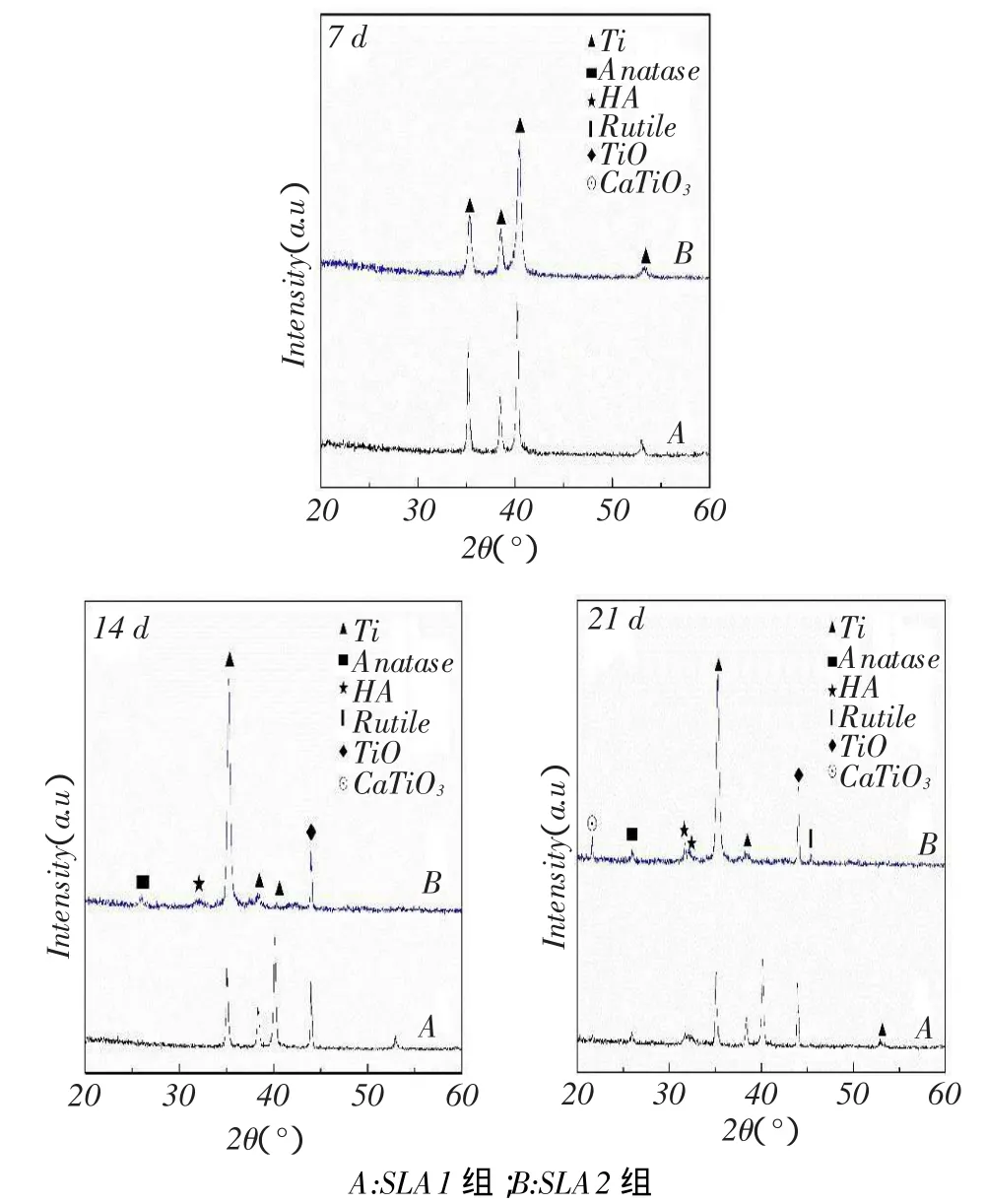
Fig.7 X-ray diffraction (XRD)phase analysis of SLA1 and SLA2 groups after beingsoaked in SBFfor 7 d, 14 d and 21 d图7 SLA1、SLA2组样品在模拟体液浸泡7、14、21 d后的XRD物相分析
2.5大鼠成骨细胞的鉴定倒置显微镜下观察到大鼠成骨细胞为长短不一、细长的纺锤型和梭形等,细胞核明显,核仁清晰可见,见图8。
2.6大鼠成骨细胞黏附情况大鼠成骨细胞均能黏附于4组钛片上,在S1、S2组钛片上只有轻微的附着,在SLA1、SLA2组可以发现成骨细胞的伪足深入到孔洞中,大鼠成骨细胞牢固地附着于钛片表面,其中SLA2组成骨细胞黏附形态又好于SLA1组,见图9。2.7大鼠成骨细胞增殖情况成骨细胞接种于4组样品表面,1、3、5 d后,随着时间的增长样品表面的细胞逐渐增多,1 d时S1和SLA1之间细胞增殖量无差别(P=0.168),SLA2组细胞增殖量多于S2组、SLA1组(P<0.05);3、5 d时SLA1组细胞增殖量多于S1组,SLA2组细胞增殖量多于S2组、SLA1组(P<0.05),见表1。

Tab.1 Comparison of osteoblast proliferation in sample surface for different time points between four groups表1不同时间4组成骨细胞在样品表面增殖情况比较(n=6,A,x ±s)
3 讨论
目前口腔医学主要使用的种植体材料为Ti、Ti-6Al-4V,Ti和Ti-6Al-4V的弹性模量高于人体骨组织,在口腔行使咀嚼功能时易发生断裂[6],Ti-6Al-4V植入人体后易释放毒性元素V。本实验采用Ti-6Al-7Nb合金代替Ti-6Al-4V合金,减少毒性元素V的释放,不仅提高了种植体材料的生物相容性,同时还拥有与人体相似的弹性模量。
为了达到种植体-骨结合的目的,对种植体表面进行处理已成为当今研究的热点。近年来研究表明喷砂酸蚀处理后,种植体和成骨细胞之间接触面积的增加可以改变表型表达,并允许更多的成骨细胞分化[7-8]。本实验得出,与机械打磨的样品比较,喷砂酸蚀处理后的样品表面具有大小不等的一级孔洞和二级孔洞,增加了样品表面的粗糙度,有利于提高种植体的生物活性。
种植体植入人体颌骨中,两者之间充满液体成分,种植体与液体、液体与颌骨之间形成的接触角越小润湿越好,越有利于种植体-骨之间的结合。本实验研究表明喷砂酸蚀处理的Ti-6Al-7Nb与Ti相比接触角小,说明Ti-6Al-7Nb湿润性好,有利于提高种植体与骨的接触面积。并且Conserva等[9]研究证明成骨细胞生长在粗糙和亲水性的钛片表面具有更强的分化能力。
此外,本实验发现喷砂酸蚀处理的Ti-6Al-7Nb放入模拟体液21 d后表面拥有大量Ca、P沉积,可诱导形成羟基磷灰石涂层。HA涂层可以加快种植体与骨结合的速度,能诱导骨组织长入孔隙中,与新形成的骨组织呈交叉结构,在短时间内形成牢固的骨结合[10]。MTT结果显示,喷砂酸蚀处理的Ti-6Al-7Nb比其他3组样品更能促进大鼠成骨细胞的增殖,使更多的成骨细胞和细胞突起嵌入钛片孔洞中,说明喷砂酸蚀处理的Ti-6Al-7Nb拥有良好的生物相容性。上述结果显示,Ti-6Al-7Nb经喷砂酸蚀处理后对种植体-骨结合和表面生物相容性均有很大提高。
(图6,8,9见插页)
参考文献
[1] Sumitsawan S, Cho J, Sattler ML, et al. Plasma surface modified TiO2nanoparticles: improved photocatalytic oxidation of gaseous m-xylene[J]. Environ Sci Technol, 2011, 45(16):6970-6977. doi: 10. 1021/es2012963.
[2] Zhang SY, Hu KJ, Mo JZ, et al. Effects of HF and anodic oxidation treated Ti-6Al-7Nb alloy on rat bone marrow mesenchymal stem cells[J]. Chinese Journal of Conservative Dentistry, 2013, 23 (5): 310-314. [张述寅,胡开进,莫静珍,等. TI-6AL-7Nb合金表面经HF酸蚀+阳极氧化处理后对骨髓间充质干细胞特性影响的研究[J].牙体牙髓牙周病学杂志, 2013, 23(5):310-314]. doi: 10.15956/j.cnki.chin.j.conserv.dent.2013.05.007.
[3] Padial-Molina M, Galindo-Moreno P, Fernandez-Barbero JE, et al. Role of wettability and nanoroughness on interactions between os⁃teoblast and modified silicon surface[J]. Acta Biomater, 2011, 7(2): 771-778. doi: 10.1016/j.actbio.2010.08.024.
[4] Park JH, Olivares-Navarrete R, Baier RE, et al. Effect of cleaning and sterilization on titanium implant surface properties and cellular response[J]. Acta Biomater, 2012, 8(5): 1966-1975. doi: 10.1016/j. actbio.2011.11.026.
[5] Zhang JY, Liang WB, Wang WQ, et al. Deposition of Ca and P en⁃hanced on the surface of Ti6Al7Nb by SLA[J]. Journal of Functional Materials, 2015, 46(4):04123-04127. [张静莹,梁文波,王伟强,等.喷砂酸蚀处理促进Ti6Al7Nb表面钙磷沉积[J].功能材料, 2015, 46 (4):04123-04127]. doi:10.3969/j.issn.1001-9731.2015.04.024.
[6] Sahu N, Lakshmi N, Azhagarasan NS, et al. Comparison of the effect of implant abutment surface modifications on retention of implantsupported restoration with a polymer based cement[J]. J Clin Diagn Res, 2014, 8(1):239-242.doi: 10.7860/JCDR/2014/7877.3931.
[7] Galli C, Macaluso GM, Elezi E, et al. The effects of Er: YAG laser treatment on titanium surface profile and osteoblastic cell activity: an in vitro study [J]. Periodontol, 2011, 82(8):1169-1177. doi: 10. 1902/jop.2010.100428.
[8] Cei S, Legitimo A, Barachini S, et al. Effect of laser micromachining of titanium on viability and responsiveness of osteoblast-like cells [J]. Implant Dent, 2011, 20(4):285-291. doi: 10.1097/ID.0b013e3 1821bfa9f.
[9] Conserva E, Menini M, Ravera G, et al. The role of surface implant treatments on the biological behavior of SaOS- 2 osteoblast- like cells. An in vitro comparative study[J]. Clin Oral Implants Res, 2013, 24(8):880-889. doi: 10.1111/j.1600-0501.2011.02397.x.
[10] Jiao Y. Surface treatment and microstructure of biomedical titanium⁃Alloy[D]. Dalian: Dalian University of Technology, 2013. [焦岩.生物医用钛合金表面处理及其微结构[D].大连:大连理工大学, 2013].
(2015-08-20收稿2015-10-23修回)
(本文编辑李国琪)
The effects of sanding acid etch treatment of Ti-6Al-7Nb surface on rat osteoblasts
SUN Hongwan1, LI Zhigang1, ZHANG Jingying2
1 The Second Affiliated Hospital of Liaoning Medical University, Jinzhou 121000, China;
2 School of Medicine, Dalian University
Corresponding Author E-mail: ZGLi700103@163.com
Abstract:Objective To investigate the biocompatibility of pure titanium (Ti) and Ti-6Al-7Nb surface treated by sanding acid etch (SLA) on rat osteoblasts. Methods Experiments were divided into four groups, Ti mechanical grinding group (S1 group), Ti sand-blastingacid group (SLA1 group), Ti-6Al-7Nb mechanical grindinggroup (S2 group)and Ti-6Al-7Nb sand-blasting acid group (SLA2 group). The surface topography of samples was examined by microscope. The contact angle measurement instrument was used to analyse surface hydrophily of SLA1 and SLA2 groups. The surface sediment mor⁃phology and phase were observed by scanningelectron microscopy (SEM)and X-ray diffraction (XRD)in two groups after be⁃ing soaked into simulated body fluid (SBF) for 7 d,14 d and 21 d. Osteoblasts extracted from rats were seeded on titanium sheets, and the osteoblast cells on different titanium surfaces were observed by inverted microscope. MTT colorimetric meth⁃od was used to measure the proliferation of osteoblasts. Results Compared with S1 and S2 groups, there were more holes on sample surface of SLA1 and SLA2 groups. The sample surface was hydrophilic structure in SLA1 and SLA2 groups. The con⁃tact angle was smaller in SLA2 group than that of SLA1 group. The hydroxyapatite coating was firstly observed in SLA2 group at 14 d. The hydroxyapatite coating was found in samples of two groups after 21 d. The proliferative ability of osteo⁃blasts was stronger in SLA1 and SLA2 groups than that of S1 and S2 groups. And the proliferative ability of osteoblasts was stronger in sample surface of SLA2 group than that of SLA1 group (P<0.05). Conclusion Ti-6Al-7Nb by SLA has good biological compatibility, which is helpful to promote the combination of implant and bone tissue.
Key words:sandblastingetching; simulated body fluid; osteoblast; mechanical grinding; titanium; Ti-6Al-7Nb
中图分类号:R783.1
文献标志码:A
DOI:10.11958/20150084
基金项目:国家自然科学基金青年基金(81500890);大连市科技计划资助项目(2013E11SF057)
作者单位:1辽宁医学院附属第二医院口腔修复科(邮编121000);2大连大学医学部
作者简介:孙鸿婉(1990),女,研究生在读,主要从事口腔修复、种植研究
通讯作者E-mail:ZGLi700103@163.com
