川芎嗪对脂多糖诱导的内皮细胞损伤的保护作用
2016-06-18杨锡兰赵士弟陈前芬
杨锡兰,李 言,王 盼,赵士弟,陈前芬
川芎嗪对脂多糖诱导的内皮细胞损伤的保护作用
杨锡兰,李言,王盼,赵士弟,陈前芬
[摘要]目的:探讨川芎嗪(tetramethylpyrazine,TMP)对脂多糖(lipopolysaccharide,LPS)诱导的人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)RhoA、Rho相关卷曲螺旋形成蛋白激酶2(Rho associated coiled coil forming protein kinase,ROCK2)、肌球蛋白轻链(myosin light chain,MLC)磷酸化及细胞骨架连接蛋白(ezrin-radxin-moesin,ERM)磷酸化水平的影响。方法:以体外培养的HUVEC为实验对象,分为对照组、LPS组和TMP组(0.5、1.0、1.5 mg/mL),荧光定量PCR测定内皮细胞RhoA、ROCK2和信使RNA(p-Ezr mRNA)的表达,Western blot法测定内皮细胞RhoA、ROCK2、p-MLC和p-ERM蛋白水平的表达。结果:与对照组比较,LPS组RhoA、ROCK2、p-MLC和p-ERM蛋白及RhoA、ROCK2和p-Ezr mRNA表达均显著升高(P<0.01);与LPS组比较,TMP 3组RhoA蛋白表达与mRNA表达差异均无统计学意义(P>0.05),ROCK2、p-MLC和p-ERM蛋白及ROCK2、p-Ezr mRNA表达均降低(P<0.05~P<0.01),且TMP 3组之间ROCK2、p-MLC和p-ERM的分子表达差异均有统计学意义(P<0.05~P<0.01)。结论:TMP对LPS诱导的HUVEC损伤的保护作用可能是通过抑制Rho/ROCK信号通路中ROCK2、p-MLC和p-ERM的表达,以减弱LPS对内皮细胞骨架的损伤。
[关键词]内皮,血管;川芎嗪;脂多糖;细胞骨架;Rho/ROCK通路
内毒素与脓毒血症的发生、发展密切相关,血管内皮通透性增高和大分子物质渗出是其重要的病理生理过程,主要由炎症介质和细胞骨架改变共同介导。肌动蛋白细胞骨架已被认为是细胞外信号启动和调控细胞内信号时的首要靶蛋白,是调节内皮细胞通透性的重要机制[1]。研究[2]证实,Rho/Rho相关卷曲螺旋形成蛋白激酶(ROCK)信号通路是介导细胞骨架重构的重要信号通路。多种因子和介质可作用于Rho/ROCK信号通路使Rho活化,Rho激活ROCK,进一步使磷酸化的肌球蛋白轻链(myosin light chain,MLC)和细胞骨架连接蛋白(ezrin-radxin-moesin,ERM)水平升高,肌球蛋白交联增加,微丝骨架收缩增强,从而使血管内皮细胞收缩,通透性增加。川芎嗪(tetramethylpyrazine,TMP)是中药川芎的主要活性成分,在临床上被广泛应用于心脑血管疾病的治疗[3-4]。有研究[5]表明,TMP能减轻内皮细胞损伤,修复内皮细胞屏障功能。本实验拟建立脂多糖(lipopolysaccharide,LPS)诱导人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)损伤模型,从分子水平探讨Rho/ROCK信号通路是否参与LPS引起的内皮细胞损伤,探讨TMP对内皮细胞损伤的保护作用以及TMP干预Rho/ROCK信号通路的具体分子学机制。
1材料与方法
1.1主要材料、试剂及药品健康足月剖宫产新生儿脐带,标本取自蚌埠医学院第一附属医院产科(均征得产妇同意);ECM培养基(Sciencell公司);胶原酶Ⅰ型、β-actin抗体、辣根酶标记山羊抗小鼠IgG(Biosharp公司);胰酶(碧云天生物技术研究所);LPS(0111美国Sigma公司);TMP(中国食品药品检定研究院标准品);Ⅷ因子相关抗原兔抗人抗体、SABC免疫组织化学染色试剂盒、DAB显色试剂盒、辣根过氧化物酶标记山羊抗兔IgG(武汉博士德生物工程有限公司);RhoA抗体(Santa Cruz biotechnology);兔抗人ROCK2抗体、p-MLC抗体、p-ERM抗体(Cell Signaling公司);逆转录第一链cDNA合成试剂盒(Thermo公司);Super Real荧光定量预混试剂(Tiangen公司)。
1.2原代人脐静脉内皮细胞培养、传代无菌条件下,取新生儿脐带(>20 cm),剪去损伤部分,用37 ℃预热的PBS冲洗3次。注入预热的0.1% 胶原酶约15 mL,置37 ℃培养箱中孵育10 min,充分消化脐静脉内皮。收集消化液,然后注入含5%胎牛血清的ECM培养基冲洗管腔,将消化液与冲洗液一并收集于离心管,1 000 r/min离心10 min,弃上清。加入3 mL完全培养液,用吹打管吹打均匀,按1×106个接种于25 cm2培养瓶,置于5% CO2、37 ℃培养箱中培养。待3~5 d,细胞生长成单层细胞,达到70%~80%融合后,弃去培养瓶中的培养液,然后加入0.25%胰蛋白酶消化、传代培养,经Ⅷ因子抗体免疫组织化学鉴定为血管内皮细胞后,将2~3代用于实验。
1.3分组与处理实验分组(n=6):(1)对照组不加特殊处理因素;(2)LPS组:只加LPS(0.1 μg/mL);(3)TMP组:Ⅰ组(0.5 mg/mL TMP+0.1 μg/mL LPS),Ⅱ组(1.0 mg/mL TMP+0.1 μg/mL LPS),Ⅲ组(1.5 mg/mL TMP+0.1 μg/mL LPS)。实验处理:LPS组和TMP组分别加入药物处理24 h(对照组加等体积的培养基)。处理时间结束后分别提取细胞总RNA和总蛋白。
1.4检测指标和方法
1.4.1荧光定量PCR检测内皮细胞RhoA、ROCK2、信使RNA(p-Ezr mRNA)的表达Trizol法提取细胞总RNA,按照逆转录合成说明书合成cDNA,Real-Time PCR反应操作按Super Real荧光定量预混试剂盒说明书进行,每份标本均检测3次。反应体系:20 μL;反应条件:预变性95 ℃ 15 min →变性95 ℃ 10 s,退火52~60 ℃(RhoA、57 ℃;ROCK、53 ℃;p-Ezr、59 ℃),延伸72 ℃ 30 s(收集荧光信号),循环40次→溶解曲线分析。引物序列:RhoA上游5′-TGG ATG GAA AGC AGG TAG AGT-3′,下游5′-GTT GGG ACA GAA ATG CTT GAC-3′;ROCK2上游5′-TGA CAT TGG ACA GTA AAG ACA GTG-3′,下游5′-AGT GTT GTT TCG TAC AGG CAA T-3′;p-Ezr上游5′-TGC ACA AGT CTG GGT ACC TCA-3′,下游5′-CAT TTC CAG GTC CTG AGC AAT-3′;内参GAPDH上游5′-CAG CCT CAA GAT CAT CAG CA-3′,下游5′-TGT GGT CAT GAG TCC TTC CA-3′。采用2-△△CT法对结果进行相对定量分析。得到的RQ值进行统计分析。平行实验重复3次。
1.4.2Western blot法测定内皮细胞RhoA、ROCK2、p-MLC、p-ERM蛋白表达用胰酶消化下细胞,与旧培养基一并收集至于离心管内,加入RIPA裂解液+PMSF重悬5×106个细胞,置于冰上裂解30 min,不时弹动管壁使充分裂解。裂解后4 ℃,12 000 r/min离心15 min。样品采用BCA法测定上清蛋白浓度。加上样缓冲液煮沸变性后,取38 μg蛋白样品于SDS-PAGE电泳后转移到PVDF膜上,用5%BSA室温封闭2 h,然后一抗4 ℃孵育过夜,TBST洗3次,每次10 min;然后二抗孵育2 h,TBST洗3次后显影,BIO-RAD凝胶成像系统照相、拍照。用quantity one进行积分光密度(integral optical density,IOD)值分析,与β-actin蛋白积分光密度值之比作为蛋白相对表达量。平行实验重复3次。
1.5统计学方法采用方差分析和q检验。
2结果
2.1内皮细胞的鉴定细胞长至70%~80%融合时,倒置显微镜观察显示融合的内皮细胞为多角形或短梭形,呈典型的鹅卵石样或铺路石样紧密排列,无重叠生长现象;内皮细胞爬片后,第Ⅷ因子相关抗原免疫细胞化学法检测培养的正常内皮细胞,阳性结果为胞质内出现大量红棕色颗粒积聚、浓染(见图1 )。
2.2各组内皮细胞RhoA、ROCK2、p-Ezr mRNA的表达比较扩增曲线和溶解曲线提示产物纯度高;LPS组与对照组比较,RhoA、ROCK2和p-Ezr mRNA表达均显著升高(P<0.01),与LPS组比较,TMP各组RhoA mRNA表达差异均无统计学意义(P>0.05),而ROCK2和p-Ezr mRNA表达均呈明显的剂量依赖性下降(P<0.01);TMP Ⅱ组和TMP Ⅲ组ROCK2和p-Ezr mRNA的表达均低于TMP Ⅰ组(P<0.05~P<0.01)(见图2、表1)。
2.3内皮细胞RhoA、ROCK2、p-MLC、p-ERM蛋白表达比较与对照组比较,LPS组RhoA、ROCK2、p-MLC和p-ERM蛋白表达均显著上调(P<0.01);
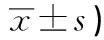
q检验:与对照组比较#P<0.05,##P<0.01;与LPS组比较 **P<0.01;与TMPⅠ组比较△P<0.05,△△P<0.01
TMP组与LPS组比较,RhoA蛋白表达差异均无统计学意义(P>0.05),而ROCK2、p-MLC和p-ERM蛋白的表达均显著下调(P<0.05~P<0.01),且TMP 3组之间呈剂量依赖性下降(P<0.05~P<0.01)(见图3、表2)。
3讨论
血管内皮屏障功能障碍是脓毒血症的病理基础。革兰阴性细菌细胞壁成分LPS可能通过影响内皮屏障的功能参与了脓毒血症的早期发病环节[6]。当内皮细胞骨架受到血管紧张素Ⅱ和白细胞介素-1等[7]的作用,细胞内纤维状网架结构产生变化,进而引起内皮细胞收缩,内皮屏障功能受损[8]。Rho/ROCK信号通路在调节肌动蛋白骨架的聚合状态方面扮演重要角色。有研究[9]表明,抑制Rho/ROCK信号通路能取得较显著的内皮保护作用。激活状态的Rho蛋白与细胞膜相结合,进一步激活ROCK2,活化的ROCK2 能使肌球蛋白轻链磷酸酶(myosin light chain phosphatase,MLCP)失活,也可直接作用于MLC和ERM家族,使二者磷酸化水平增高。p-MLC的高表达能诱使肌动-肌球蛋白交联增加,从而导致了肌动蛋白微丝骨架的聚合[10];而p-ERM能进一步诱导细胞周边应力纤维的形成,二者共同作用最终导致内皮通透性增加。本实验将LPS作为诱导剂,检测到LPS组与对照组比较,RhoA、ROCK2和p-Ezr mRNA的表达和RhoA、ROCK2、p-MLC和p-ERM蛋白表达均显著升高(P<0.01),说明Rho/ROCK通路可能参与了LPS诱导内皮细胞损伤过程,LPS作用于Rho/ROCK信号通路且上调了RhoA、ROCK2、p-MLC和p-ERM的表达,造模成功。
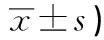
q检验:与对照组比较##P<0.01;与LPS组比较 *P<0.05,**P<0.01;与TMPⅠ组比较△P<0.05,△△P<0.01;与TMPⅡ组比较 ++P<0.01
TMP是从伞形科植物川芎中提取的一种酰胺类生物碱,化学结构为2,3,5,6-四甲基吡嗪。有研究[11]提示TMP具有抑制机体过度炎症反应,改善微循环和抗凝血等作用。TMP在抗动脉粥样硬化中能保护受损的内皮细胞[12]。近年有报道[13]TMP对LPS诱导的内皮细胞损伤也有保护作用,但对于内皮细胞上其他受体及信号转导系统的研究均较少涉及。本实验建立LPS诱导的HUVEC损伤模型,从Rho/ROCK通路入手,探讨TMP对内皮细胞的保护作用。TMP组和LPS组相比,RhoA蛋白表达与mRNA表达差异均无统计学意义,可能是由于RhoA处于信号通路的上游,其表达较少受作用于下游的药物影响,而TMP组整体升高的趋势可能只是单一受LPS的影响所致;ROCK2、p-MLC和p-ERM蛋白及ROCK2和p-Ezr mRNA表达均明显降低(P<0.01),提示TMP保护内皮细胞的分子机制可能与抑制ROCK2、p-MLC和p-ERM的表达有关,且TMP能剂量依赖性地减弱由LPS诱导的ROCK2、p-MLC和p-ERM激活。
综上所述,Rho/ROCK通路可能参与了LPS引起的内皮细胞损伤的病理过程,TMP可能通过降低Rho/ROCK通路信号分子的表达,对受损的内皮细胞起到保护作用。TMP的保护作用可为临床实验提供基础,但其在LPS诱导的内皮细胞损伤和细胞骨架蛋白重构中其他信号通路的作用尚不完全清楚,仍需要进一步研究。
[参考文献]
[1]ETIENNE-MANNE VILLE S,HALL A.RhoGTPases in cell biology[J].Nature,2002,420(6 916):629.
[2]TAKAI Y,SASAKI T,MATOZAKI T.Small GTP-binding proteins[J].Physiol Rev,2001,81(1):153.
[3]XU H,SHI DZ,GUAN CY,etal.Clinical application and pharmacologic action of tetramethylpyrazine[J].Chin J Integr Med,2003,23(5):376.
[4]ZHAO L,WEI MJ,HE M,etal.The effects of tetramethylpyrazine on learning and memory abilities of mice with Alzheimer disease and its possible mechanism[J].Chin Pharmacol Bull,2008,24(8):1088.
[5]姚义安,张抒扬.内皮细胞与动脉粥样硬化[J].中华内科杂志,2008,47(1):63.
[6]SUZUKI K,NEMOTO K,NINOMIYA N,etal.Fasudil,a Rho-kinase inhibitor,attenuates lipopolysaccharide-induced vascular hyperpermeability and colonicmuscle relaxation in guinea pigs[J].J Surg Res,2012,178(1):352.
[7]WETTSCHURECK N,OFFERMANNS S.Rho/Rho-kinase mediated signaling in physiology and pathophysiology[J].J Mol Med,2002,80(10):629.
[8]王高频,杨雪佳,王继红,等.盐酸法舒地尔对血管紧张素Ⅱ诱导的人脐静脉内皮细胞骨架损伤的保护作用[J].中国动脉硬化杂志,2010,18(10):795.
[9]国伟,孟建中,陈宇.Rho/Rho激酶信号通路与血管内皮通透性的研究[J].生物医学工程研究,2009,28(2):154.
[10]LOIRAND G,GURIN P,PACAUD P.Rho kinases incardiovascular physiology and pathophysiology[J].Circ Res,2006,98:322.
[11]郑红,徐庆连,韩之勋,等.中药川芎嗪对烫伤豚鼠肾脏保护作用的实验研究[J].安徽医科大学学报,2005,40(1):13.
[12]CUI L,WANG SX,LIU XY.The effective mechanism of tetramethylpyrazine in anti-atherosclerosis[J].Med Recap,2008,14(22):3491.
[13]李文明,刘洪涛,李秀英,等.川芎嗪对脂多糖诱导的血管内皮细胞损伤的影响[J].中国药理学通报,2009,25(11):1516.
(本文编辑刘畅)
Protective effect of tetramethylpyrazine on the injury endothelial cell induced by lipopolysaccharide
YANG Xi-lan,LI Yan,WANG Pan,ZHAO Shi-di,CHEN Qian-fen
(DepartmentofPathophysiology,BengbuMedicalCollege,BengbuAnhui233030,China)
[Abstract]Objective:To explore the effects of tetramethylpyrazine(TMP) on the levels of RhoA,Rho associated coiled coil forming protein kinase 2(ROCK2),myosin light chain(MLC) phosphorylation and ezrin-radxin-moesin(ERM) phosphorylation in the injury of human umbilical vein endothelial cells(HUVECs) induced by lipopolysaccharide(LPS).Methods:The HUVECs were cultured in vitro,and divided into the control group,LPS group and TMP groups(0.5,1.0,1.5 mg/mL).The mRNA levels of RhoA,ROCK2 and p-EZR in endothelial cells were detected by real-time fluorescence quantitative PCR,and the protein levels of RhoA,ROCK2,p-MLC and p-ERM were examined using western blotting.Results:Compared with the control group,the protein levels of RhoA,ROCK2,p-MLC and p-ERM,and the mRNA levels of RhoA,ROCK2 and p-Ezr in LPS group significantly increased(P<0.01).The differences of the protein and mRNA levels of RhoA between LPS group and 3 TMP groups were not statistically significant(P>0.05).Compared with the LPS group,the protein levels of ROCK2,p-MLC and p-ERM,and the mRNA levels of ROCK2 and p-Ezr decreased significantly in 3 TMP groups(P<0.01).The differences of the expression of ROCK2,p-MLC and p-ERM within 3 TMP groups were statistically significant(P<0.05 to P<0.01).Conclusions:TMP may protect the HUVECs against LPS-induced injury by inhibiting the expressions of ROCK2,p-MLC and p-ERM in Rho/ROCK signaling pathways,and reducing the injury of LPS on endothelial cell skeleton.
[Key words]endothelial,vascular;tetramethylpyrazine;eipopolysaccharide;cytoskeleton;Rho/ROCK pathway
[文章编号]1000-2200(2016)03-0284-04·基础医学·
[收稿日期]2015-01-31
[基金项目]国家自然科学基金项目(81202833);安徽省自然科学基金项目(1308085MH140);蚌埠医学院研究生科研创新计划项目(Byycx1306)
[作者简介]杨锡兰(1988-),女,硕士研究生.[通信作者] 陈前芬,硕士研究生导师,副教授.E-mail:cqf14621@126.com
[中图法分类号]R 322.12;R 284.1
[文献标志码]A
DOI:10.13898/j.cnki.issn.1000-2200.2016.03.002
[作者单位] 蚌埠医学院 病理生理学教研室,安徽 蚌埠 233030
