脉冲超声及电磁场对大鼠骨髓间充质干细胞体外成软骨分化过程中细胞外基质溢出的影响
2016-06-15张智唐娜王珏赵志河谭理军口腔疾病研究国家重点实验室华西口腔医院正畸科四川大学成都6004四川省人民医院口腔科成都6007
张智 唐娜 王珏 赵志河 谭理军.口腔疾病研究国家重点实验室 华西口腔医院正畸科(四川大学),成都 6004;.四川省人民医院口腔科,成都 6007
脉冲超声及电磁场对大鼠骨髓间充质干细胞体外成软骨分化过程中细胞外基质溢出的影响
张智1唐娜2王珏1赵志河1谭理军1
1.口腔疾病研究国家重点实验室 华西口腔医院正畸科(四川大学),成都 610041;2.四川省人民医院口腔科,成都 610072
[摘要]目的研究脉冲超声以及脉冲电磁场对大鼠骨髓间充质干细胞微球体外成软骨分化中细胞外基质向培养基中溢出的影响。方法将干细胞微球在成软骨培养基中进行培养,分为无刺激组(N组)、脉冲超声(100、150、200 mW·cm-2)刺激组和脉冲电磁场(1、2、5 mT)刺激组。2周后采用酶联免疫吸附测定法检测培养液中Ⅱ型胶原和糖胺聚糖的质量浓度。结果脉冲超声刺激组细胞外基质分泌较N组增多(P<0.05),但3个刺激组间的差异无统计学意义(P>0.05);脉冲电磁场组对Ⅱ型胶原分泌无明显影响(P>0.05),1 mT组对糖胺聚糖的分泌无明显影响(P>0.05),2 mT和5 mT组糖胺聚糖的分泌减少(P<0.05)。结论在促进干细胞成软骨分化的过程中,特定参数的脉冲电磁场可能起到防止增多的细胞外基质向组织外扩散溢出的作用。
[关键词]脉冲超声; 脉冲电磁场; 成软骨分化; 细胞外基质
Supported by: National Natural Science Foundation of China (30900287, 81030034, 30900286).Correspondence: Tan Lijun, E-mail: orthotan@vip.163.com.
干细胞的成软骨分化过程与物理刺激紧密相关。脉冲超声(pulsed ultrasound,PUS)和脉冲电磁场(pulsed electromagnetic fields,PEMF)作为非侵入性的物理刺激,具有极佳的应用前景[1-3]。El-Bialy 等[4]提取新西兰兔股骨中的骨髓间充质干细胞,扩增后接种到胶原蛋白支架中,4周后,PUS刺激组番红-O染色增强。Schumann等[5]使用成软骨培养基体外成软骨诱导人的骨髓间充质干细胞微球,并在前7 d对实验组施加PUS刺激,结果发现,每日40 min的PUS刺激组成软骨相关基因的表达除了在最初7 d降低外,之后都明显增加。Esposito等[6]在体外通过成软骨诱导结合Wharton’s胶的人脐带血来源间充质干细胞,发现PEMF明显缩短成软骨分化的时间,表明PEMF具有早期诱导脐带血来源间充质干细胞成软骨分化的潜力。Chen等[7]将人脂肪源性干细胞接种于羟磷灰石和胶原蛋白支架进行成软骨诱导,使用PEMF刺激1周,结果发现,每日8 h的PEMF刺激可以使SRY基因相关高迁移率组家族-9、Ⅱ型胶原蛋白和蛋白聚糖基因的表达增加,促进ADSCs的成软骨分化。由此可见,现有的多数体外研究均已证实PUS和PEMF可以促进干细胞成软骨分化过程中软骨特征性细胞外基质合成。然而,在体外研究中细胞外基质合成后,除了存在于培养体内部,一部分还会被分泌到培养基中,以往的实验研究都忽略了这一重要组成部分。研究这部分细胞外基质,可以探讨PUS和PEMF是否有助于软骨样细胞外基质储存于培养体中。基于这种设想,本实验以经典的无支架细胞微球为成软骨研究模型[8],采用临床常用的PUS和PEMF参数设置,通过酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)研究PUS及PEMF对大鼠骨髓间充质干细胞体外成软骨分化,细胞外基质Ⅱ型胶原和糖胺聚糖(glycosaminoglycan,GAG)分泌的影响。
1 材料和方法
1.1实验动物
1月龄雄性SD大鼠,由四川大学实验动物中心提供。本实验中对实验动物的处置符合动物伦理学要求。
1.2细胞微球培养
脱颈处死大鼠,将股骨及胫骨骨髓组织悬液接种于细胞培养瓶中,置于37 ℃,5%CO2孵箱中培养,24 h后半换液弃去不贴壁的细胞,2 d全换液,之后每隔2~3 d换液,待原代细胞(P0)贴壁融合达80%~90%后,以1∶2的比例传代培养。使用流式细胞仪检测P3细胞表面抗原标志物CD34、CD29、CD44 及CD45表达。使用P3细胞进行实验,每个15 mL无菌离心管移入约5×105个细胞,1 000 r·min-1离心5 min,细胞沉淀后,加入成软骨诱导液,于37 ℃、5%CO2孵箱中静置培养24 h,细胞沉淀聚集成球状。
1.3PUS干预
将细胞微球培养2 d后转移至6孔细胞培养板培养,每个孔加入2.5 mL成软骨诱导培养基,10个细胞微球,随机分为无刺激组(N组)和刺激组(US组)。US组按刺激强度分为100、150、200 mW·cm-2共3组(分别为US1、US2、US3组),设置参数为:占空比20%,工作频率1 mHz,重复频率1 kHz,15 min·d-1。N组每天处理方式相同,但是不开电源。
1.4PEMF干预
将细胞微球培养2 d后转移至24孔细胞培养板培养,每孔加1 mL成软骨诱导培养基及4个细胞微球,设无刺激组(N组)和刺激组(PS组)。PS组按强度分为5、2和1 mT共3组(分别为PS1、PS2、PS3组),调制频率为750 Hz,载波频率为75 Hz,3 h·d-1。N组每天处理方式相同,但不开电源。
1.5ELISA检测
培养2周后收集各组培养液,编号后置于-20 ℃冰箱保存备用。检测时先通过离心提取上清液,然后进行ELISA反应。按照预实验结果,样本可直接用于GAG的检测,稀释100倍后可用于Ⅱ型胶原蛋白的检测。反应终止后30 min内置于酶标仪450 nm下读取光密度(optical density,OD)值,根据标准品的浓度和OD值绘制标准曲线。在曲线上根据样本OD值查找出样本中该物质的浓度,由此检测各组细胞分泌Ⅱ型胶原和GAG的含量。
1.6统计学分析
应用SPSS 17.0统计软件进行分析,对结果进行t检验、单因素方差分析,两两比较采用SNK检验,检验水准为双侧α=0.05。
2 结果
2.1细胞形态学观察及细胞表型鉴定
原代培养72 h后,贴壁细胞数量明显增多,多数梭形细胞聚集成团,呈现克隆样生长的特点。培养5 d时,细胞相互融合,成片生长。经过2次传代后,P2代细胞均为成纤维细胞样细胞,长梭形并带有多个细胞质突起,保持克隆样生长的特点,生长迅速,2~3 d即可以相互融合成片,局部成漩涡样。原代培养的P3代大鼠骨髓间充质干细胞表面抗原表达情况如下:CD34表达阴性(0.2%),CD45表达阴性(0.0%),CD29表达阳性(99.7%),CD44表达阳性(52.5%)。
2.2PUS干预对软骨基质分泌的影响
培养2周后收集的培养基内含细胞微球最近3 d的代谢产物,经ELISA检测,结果显示:US组和N组Ⅱ型胶原质量浓度的总体均数为116.309 μg·mL-1,远高于GAG(2.483 μg·mL-1),差异有统计学意义(P<0.05)(图1)。
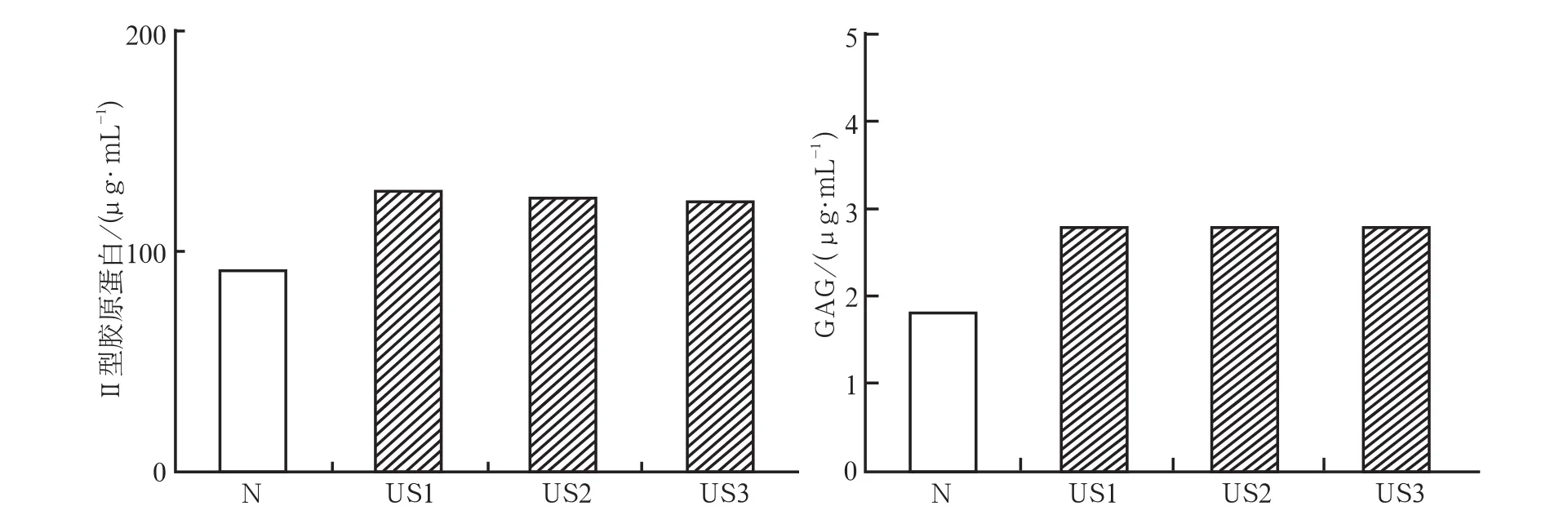
图1 PUS对干细胞微球成软骨诱导2周时上清液中细胞外基质质量浓度的影响Fig 1 The effect of PUS on the content of extracellular matrix in the medium after 2 week
2.2.1PUS干预对Ⅱ型胶原分泌的影响PUS干预下,N、US1、US2、US3组分泌Ⅱ型胶原的质量分数分别为93.331、127.968、122.636、121.303 μg·mL-1(图1)。经单因素方差分析,4组质量分数的差异有统计学意义(P<0.05);进一步行SNK检验,US1、US2、US3组间的差异无统计学意义,但3个组与N组间的差异均有统计学意义(P<0.05)。
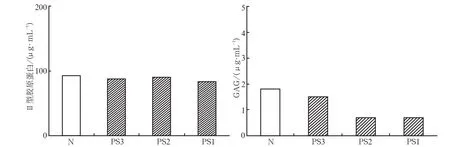
图2 PEMF对干细胞微球成软骨诱导2周时上清液中细胞外基质含量的影响Fig 2 The effect of PEMF on the content of extracellular matrix in the medium after 2 weeks
2.2.2PUS干预对GAG分泌的影响在PUS干预下,N、US1、US2、US3组分泌GAG的质量分数分别为1.782、2.772、2.739、2.640 μg·mL-1(图1)。经单因素方差分析,4组质量分数的差异有统计学意义(P<0.05);进一步行SNK检验,US1、US2、US3组间的差异无统计学意义,但3个组与N组间的差异均有统计学意义(P<0.05)。
2.3PEMF干预对软骨基质分泌的影响
培养2周时细胞培养上清液中,PS组和N组的Ⅱ型胶原蛋白质量浓度总体均数为88.743 μg·mL-1,远高于GAG(1.155 μg·mL-1,P<0.05)(图2)。
2.3.1PEMF干预对Ⅱ型胶原分泌的影响PEMF干预下,N、PS3、PS2、PS1组分泌Ⅱ型胶原的质量分数分别为92.334、87.763、90.935、83.940 μg·mL-1(图2)。经单因素方差分析,4组质量分数均值的差异无统计学意义(P>0.05),提示PEMF对Ⅱ型胶原分泌无明显影响。
2.3.2PEMF干预对GAG分泌的影响PEMF干预下,N、PS3、PS2、PS1组分泌GAG的质量浓度分别为1.785、1.470、0.700、0.666 μg·mL-1(图2)。经单因素方差分析,4组质量分数的差异有统计学意义(P<0.01);进一步行SNK检验,N组和PS3组中任一组GAG质量浓度与PS2和PS1组的任一组均有差异,且差异有统计学意义(P<0.05)。
3 讨论
由软骨细胞分泌的细胞外基质的主要成分为Ⅱ型胶原和GAG。细胞外基质沉积在细胞周围,为软骨细胞提供三维网状结构,有利于关节软骨细胞表型的稳定[9]。Ⅱ型胶原和GAG表达的程度代表稳定分化的软骨细胞的功能活跃情况。其中,Ⅱ型胶原是透明软骨的特征性细胞外基质[10],是软骨细胞的特异性标志之一;GAG的代谢与软骨细胞的功能状态有密切关系。物理刺激可直接或间接影响干细胞成软骨过程中Ⅱ型胶原合成及GAG合成及释放[4-7],因此定性定量研究干细胞成软骨分化过程中软骨细胞外基质的Ⅱ型胶原和GAG的变化情况,是研究物理刺激对干细胞成软骨分化影响的重要途径之一。研究[8]证实,物理刺激在干细胞成软骨分化过程中可以促进成软骨培养体内细胞外基质的合成。物理刺激是否有利于合成的细胞外基质储存在培养体内,防止溢出到培养基中尚缺乏科学的证明。
本研究发现,PUS促进了成软骨分化的干细胞微球向培养基中溢出Ⅱ型胶原和GAG。本研究还对不同强度PUS的促进效果进行了比较,结果发现,100、150、200 mW·cm-2这3种强度的PUS相互之间的刺激作用无明显差异,尚不能认为PUS的强度会影响细胞外基质向培养基中溢出。本课题组在前期研究[11]中发现,100、150和200 mW·cm-2的超声均可使培养体内部番红-O染色增强,促进Ⅱ型胶原蛋白的表达,尤其是在150、200 mW·cm-2的刺激下,Ⅱ型胶原蛋白的表达明显高于100 mW·cm-2。由此可见,在本研究设置下,PUS可以促进干细胞成软骨培养体系内软骨相关细胞的细胞外基质合成和溢出增多,但是溢出增多的比例低于其合成增加的比例,尤其是在150和200 mW·cm-2的超声刺激下。
1、2、5 mT PEMF刺激对干细胞微球向培养基中合成分泌Ⅱ型胶原无显著影响,2、5 mT组降低了干细胞微球向培养基中分泌GAG。本课题组在前期研究[12]中发现,只有5 mT的PEMF可使培养体内GAG表达降低,1、2 mT的PEMF对GAG的表达无明显影响,同时PEMF对培养体内Ⅱ型胶原的表达也无明显影响。结合本研究结果可见,PEMF在促进干细胞成软骨分化并合成细胞外基质的同时,2 mT 的PEMF刺激可能参与阻止其向培养基中溢出。
本研究发现,PUS可以促进成软骨分化干细胞微球向培养基中分泌Ⅱ型胶原和GAG,其促进作用强于PEMF,并且与PUS强度无关。PEMF在促进干细胞成软骨分化的过程中,其机制可能不仅仅局限于促进软骨样细胞外基质的合成,还可能参与了防止增多的细胞外基质向组织外溢出的作用,从而更有效地促进细胞微球等培养体成软骨分化;但其具体机制还有待进一步的研究证实。
[参考文献]
[1]Wuschech H, von Hehn U, Mikus E, et al.Effects of PEMF on patients with osteoarthritis: results of a prospective, placebocontrolled, double-blind study[J].Bioelectromagnetics, 2015, 36(8):576-585.
[2]Zeng C, Li H, Yang T, et al.Effectiveness of continuous and pulsed ultrasound for the management of knee osteoarthritis: a systematic review and network meta-analysis[J].Osteoarthr Cartil, 2014, 22(8):1090-1099.
[3]吴鹏, 宋锦璘, 冯格, 等.低强度脉冲超声波对Beagle犬牙槽骨缺损的修复效应[J].华西口腔医学杂志, 2010, 28(5): 522-525.Wu P, Song JL, Feng G, et al.Repairing effects of low-intensity pulsed ultrasound on alveolar bone defects in Beagle dogs[J].West Chin J Stomtol, 2010, 28(5):522-525.
[4]El-Bialy T, Uludag H, Jomha N, et al.In vivo ultrasoundassisted tissue-engineered mandibular condyle: a pilot study in rabbits[J].Tissue Eng Part C Methods, 2010, 16(6):1315-1323.
[5]Schumann D, Kujat R, Zellner J, et al.Treatment of human mesenchymal stem cells with pulsed low intensity ultrasound enhances the chondrogenic phenotype in vitro[J].Biorheology, 2006, 43(3/4):431-443.
[6]Esposito M, Lucariello A, Costanzo C, et al.Differentiation of human umbilical cord-derived mesenchymal stem cells, WJ-MSCs, into chondrogenic cells in the presence of pulsed electromagnetic fields[J].In Vivo, 2013, 27(4):495-500.
[7]Chen CH, Lin YS, Fu YC, et al.Electromagnetic fields enhance chondrogenesis of human adipose-derived stem cells in a chondrogenic microenvironment in vitro[J].J Appl Physiol, 2013, 114(5):647-655.
[8]Lau TT, Lee LQ, Vo BN, et al.Inducing ossification in an engineered 3D scaffold-free living cartilage template[J].Biomaterials, 2012, 33(33):8406-8417.
[9]邓迎生, 唐昊, 王秋根.低强度脉冲式超声促软骨修复及其基因表达研究进展[J].国际骨科学杂志, 2009, 30(1): 10-14.Deng YS, Tang H, Wang QG.Advances in the study of low intensity pulsed ultrasound for cartilage repair and gene expression[J].Int J Orthop, 2009, 30(1):10-14
[10]Poole AR, Kojima T, Yasuda T, et al.Composition and structure of articular cartilage: a template for tissue repair[J].Clin Orthop Relat Res, 2001(391 Suppl):S26-S33.
[11]Wang J, Tang N, Xiao Q, et al.The potential application of pulsed ultrasound on bone defect repair via developmental engineering: an in vitro study[J].Artif Organs, 2015.doi: 10.1111/aor.12578.
[12]Wang J, Tang N, Xiao Q, et al.Pulsed electromagnetic field may accelerate in vitro endochondral ossification[J].Bioelectromagnetics, 2015, 36(1):35-44.
(本文编辑吴爱华)
·口腔微生物学专栏·
Effects of pulsed ultrasound and pulsed electromagnetic field on the extracellular matrix secretion of rat bone marrow mesenchymal stem cell pellets in chondrogenesis
Zhang Zhi1, Tang Na2, Wang Jue1, Zhao Zhihe1, Tan Lijun1.(1.State Key Laboratory of Oral Diseases, Dept.of Orthodontics, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China;2.Dept.of Stomatology, People’s Hospital, Sichuan Province, Chengdu 610072, China)
[Key words]pulsed ultrasound;pulsed electromagnetic field;chondrogenesis;extracellular matrix
[Abstract]Objective To study the effects of pulsed ultrasound (PUS) and pulsed electromagnetic fields (PEMF) on the secretion of extracellular matrix from a culture complex during in vitro chondrogenesis.MethodsAll the rat bone marrow mesenchymal stem cell pellets were cultured in achondrogenic medium.Different intensities of PUS (100, 150, and 200 mW·cm-2) and PEMF (1, 2, and 5 mT) were applied to the cell pellets for 2 weeks.Group N was cultured without PUS and PEMF stimulation as control.The culture medium was collected after 2 weeks of culture.Enzyme-linked immunosorbent assay (ELISA) was used to detect the type of collagen and glycosaminoglycan (GAG) in the culture medium.ResultsPUS increased the secreting-type collagen and GAG from cell pellets compared with group N (P<0.05), whereas there was no difference in different intensities (P>0.05).PEMF had no significant effect on the secretion of the type of collagen (P>0.05).A PEMF of 1 mT had no significant effect on the secretion of GAG (P>0.05).A PEMF 2 and 5 mT decreased the secretion of GAG (P<0.05).ConclusionTo prevent the secretary of extracellular matrix may play a role in chondrogenic effect of PEMF.
[中图分类号]R 783.5
[文献标志码]A [doi]10.7518/hxkq.2016.03.015
[收稿日期]2015-12-16; [修回日期]2016-02-01
[基金项目]国家自然科学基金(30900287,81030034,30900286)
[作者简介]张智,硕士,E-mail:263687654@qq.com
[通信作者]谭理军,副教授,博士,E-mail:orthotan@vip.163.com
