生物钟基因Per1对人口腔鳞状细胞癌细胞增殖、凋亡、细胞周期和体内成瘤的影响及机理
2016-06-15付小娟杨凯李晗雪赵钦陈丹重庆医科大学附属第一医院口腔颌面外科重庆400016
付小娟 杨凯 李晗雪 赵钦 陈丹重庆医科大学附属第一医院口腔颌面外科,重庆 400016
生物钟基因Per1对人口腔鳞状细胞癌细胞增殖、凋亡、细胞周期和体内成瘤的影响及机理
付小娟杨凯李晗雪赵钦陈丹
重庆医科大学附属第一医院口腔颌面外科,重庆 400016
[摘要]目的探讨生物钟基因Per1对细胞周期相关基因的调控作用,以及对人口腔鳞状细胞癌细胞SCC15增殖、凋亡、细胞周期和体内成瘤的影响。方法构建3组针对Per1 RNA的短发夹RNA(shRNA)慢病毒重组质粒,转染SCC15细胞,用蛋白质印迹法(Western blot)及实时荧光定量PCR(qRT-PCR)检测筛选RNA干扰作用最强组为实验组,对照组(Control-shRNA)为对任何基因均无干扰效应的shRNA序列的质粒,空白组为未做任何处理的SCC15细胞。用qRT-PCR检测各组细胞中细胞周期相关基因Per1、p53、Cyclin D1、Cyclin E、Cyclin A2、Cyclin B1、CDK1、CDK2、CDK4、CDK6、p16、p21、Wee1、cdc25、E2F、Rb1 mRNA的表达;用流式细胞仪检测各组细胞增殖、凋亡和细胞周期分布;将实验组和空白组细胞分别接种于裸鼠背部皮下,观察成瘤情况。结果成功构建了3组Per1-shRNA慢病毒质粒,通过qRT-PCR和Western blot证明Per1-shRNA-Ⅰ组沉默效果最佳,作为实验组。Per1-shRNA-Ⅰ组中Cyclin D1、Cyclin E、Cyclin B1、CDK1和Wee1 mRNA的表达水平高于Control-shRNA组和SCC15组(P<0.05),p53、Cyclin A2、p16、p21和cdc25 mRNA的表达水平降低(P<0.05);Control-shRNA组和SCC15组中各基因mRNA的表达水平无差异(P>0.05)。CDK2、CDK4、CDK6、E2F和Rb1 mRNA的表达水平在3组中均无统计学差异(P>0.05)。Per1-shRNA-Ⅰ组中细胞增殖指数高于Control-shRNA组和SCC15组(P<0.05),凋亡指数降低(P<0.05),S期的细胞数降低(P<0.05),G2/M期的细胞数增加(P<0.05)。Control-shRNA组和SCC15组细胞的增殖指数和凋亡指数无统计学差异(P>0.05)。Per1-shRNA-Ⅰ组细胞体内成瘤能力显著增强(P<0.05)。结论生物钟基因Perl是重要的抑癌基因,Perl能调控下游众多的细胞周期基因,其表达变化影响细胞周期进程、增殖和凋亡的平衡失调及体内成瘤能力,对Per1深入研究有可能进一步明确癌症的发生发展机制,为癌症的治疗提供新的有效分子靶点。
[关键词]生物钟;Per1;细胞周期;基因;口腔癌
Correspondence: Yang Kai, E-mail: cqfyyk@aliyun.com.
生物体内的许多生命活动,如激素分泌、细胞增殖等,均表现出近24 h的周期波动,称为昼夜节律[1-3]。昼夜节律是生物适应外界环境长期进化的结果,是生命活动的基本特征之一。昼夜节律的产生由细胞内生物钟基因呈昼夜节律性表达所导致[1-4]。目前人们已发现14个生物钟基因:Per1、Per2、Per3、Cryl、Cry2、Clock、Bmal1、TIM、CK1ε、NPAS2,REV-ERBs、Dec1、Dec2、RORs[1,3-4],这些生物钟基因通过周期性表达产生的昼夜节律使复杂的生命活动相互协调有序。Per1是重要的生物钟基因,具有维持昼夜节律稳定和调控昼夜节律周期的作用[5-6]。研究表明:Per1不仅与生物体昼夜节律有关,而且还能调控下游许多重要的细胞周期蛋白[7],Per1的异常表达与癌症的发生发展密切相关[7-9]。
细胞周期紊乱是肿瘤发生的主要原因[4,10]。正常细胞周期的运行依赖于细胞周期蛋白(Cyclins)、细胞周期蛋白依赖性激酶(cyclin dependent kinases,CDKs)和细胞周期蛋白依赖性激酶抑制因子(cyclin dependent kinase inhibitors,CKIs)组成的细胞周期分子网络调控系统[4,10-11]。Cyclins包括Cyclin A-Y,其中起主要作用的有Cyclin A2、B1、D1、E;CDKs包括CDK1-CDK16,起重要作用的有CDK1、2、4、6;CKIs包括Ink4家族和Cip/Kip家族,其中起重要作用的主要有Ink4家族中p16和Cip/Kip家族中p21[10-11]。在Cyclins-CDKs-CKIs网络系统中,CDKs是调控细胞周期的核心,Cyclins和CKIs分别对CDKs具有正向调控作用和负向调控作用[10-11]。
研究表明:生物钟基因Per1在多种癌症中表达降低[8-9],Per1能调控下游许多重要的细胞周期蛋白[7],从而导致细胞周期进程和细胞增殖水平改变,与癌症发生发展密切相关[4,7,10]。在Cyclins-CDKs-CKIs网络系统中,人们的研究主要集中在Per1对细胞周期蛋白的调控,如Cyclin B1、Cyclin D1、Cyclin E和Wee1等[7],但关于Per1对CDKs和CKIs中分子的调控还了解甚少。为了进一步探讨Per1基因与癌症发生的关系以及昼夜节律与细胞周期两大周期活动之间的相互作用,本研究通过对人口腔鳞状细胞癌细胞内的Per1基因沉默,检测Per1沉默后细胞的细胞周期、增殖、凋亡和体内成瘤能力的改变,并全面检测Cyclins-CDKs-CKIs网络系统中各重要分子的改变情况,以阐明Per1与癌症发生的机制。
1 材料和方法
1.1细胞和主要试剂
人口腔鳞状细胞癌SCC15细胞(重庆医科大学生命科学院),慢病毒表达载体PLKO.1(Sigma公司,美国),质粒提取试剂盒(Invitrogen公司,美国),逆转录试剂盒(TaKaRa公司,日本);逆转录聚合酶链反应(reverse transcription polymerase chainreaction,RT-PCR)试剂盒(Bio-Rad公司,美国),BCA蛋白浓度测定试剂盒、鼠抗人甘油醛-3-磷酸脱氢酶( glyceraldehyde-3-phosphate dehydrogenase,GAPDH),单克隆抗体(上海碧云天生物技术有限公司),兔抗人Per1单克隆抗体(Genetex公司,美国),辣根酶标记山羊抗兔IgG抗体(北京中杉金桥生物技术有限公司),低温冷冻离心机(Z223-MK-Z,HERMLE公司,德国),荧光定量PCR仪(C1000TMThermal Cycler,Bio-Rad公司,美国),核酸蛋白分析仪(UV-GeneQuant,安玛西亚公司,瑞典),流式细胞仪(FACSVantage SE,BD公司,美国)。
1.2Per1短发夹RNA(Per1-short hairpin RNA,Per1-shRNA)慢病毒干扰质粒载体构建和鉴定
根据Genbank数据库中人的Per1 mRNA序列(GeneID: NM_002616),遵循RNA干扰序列设计原则[12],选择Per1 RNA干扰靶序列后进行BLAST基因组同源性分析(www.ncbi.nlm.nih.gov/BLAST/),确定3个干扰作用位点为本实验Per1基因的靶序列,用软件BLOCK-iT™ RNAi Designer(Invitrogen公司,美国)设计3条Per1 RNA干扰序列和1条对照序列,Per1-Ⅰ:3’-CAGCACCACTAAGCGTAAATG-5’;Per1-Ⅱ:3’-CCAGCACCACTAAGCGTAAAT-5’;Per1-Ⅲ:3’-CCATGGACATGTCCACCTATA-5’;对照序列:3’-CCTAAGGTTAAGTCGCCCTCG-5’。通过Genbank数据库验证该对照序列对任何基因均无干扰效应。在DNA连接酶的作用下将各条序列5’末端添加CCGG序列,3’末端添加TTTTTG序列,各条序列的正义链与反义链之间用Loop环(CTCGAG)连接,然后在5’和3’末端用DNA连接酶分别连接含限制性内切酶Age Ⅰ和EcoR Ⅰ酶切位点的黏性末端。将上述合成的shRNA行PCR扩增,用限制性内切酶Age Ⅰ和EcoR Ⅰ对慢病毒载体PLKO.1进行双酶切,得到的产物经琼脂糖电泳分离、割胶回收和纯化,然后与shRNA片段在DNA连接酶作用下连接形成Per1-shRNA-PLKO.1。将连接产物转化感受态大肠杆菌DH5α后涂布于含氨基核苷类抗生素的LB固体培养基上抗性培养,将形成的单克隆菌落接种于LB培养液中,37 ℃摇菌过夜,离心(8 000 r·min-1,3 min)后收集细菌并裂解细胞,提取质粒DNA,然后用Age Ⅰ和EcoR Ⅰ行双酶切后用Chromas软件(Technelysium公司,澳大利亚)测序鉴定。
1.3Per1-shRNA慢病毒质粒包装及转染SCC15细胞
取对数生长期的293T细胞,以2×106个·mL-1的细胞数接种于直径为10 cm的培养皿中,放于37 ℃、5% CO2饱和湿度的培养箱中培养,在细胞生长饱和度达到70%~80%时,加入各质粒DNA溶液10 μg和20 μL Lipofectamine 2000脂质体进行共转染,48 h后收集293T细胞上清液,离心10 min(4 ℃,4 000 r·min-1)后用直径0.45 μm的滤器过滤上清液,即获得慢病毒包装的Per1-shRNA重组质粒病毒液。取对数生长期的SCC15细胞,接种于6孔板中,加入4 mL血清新鲜培养基、10 μL Polybrene和1 mL重组质粒病毒液,混匀培养24 h,再向各孔中加入嘌呤霉素(终浓度2.0 μg·mL-1)进行传代筛选。实验分为5组:Per1-shRNA-Ⅰ组、Per1-shRNA-Ⅱ组和Per1-shRNA-Ⅲ组分别为转染Per1-shRNA-Ⅰ、Per1-shRNA-Ⅱ和Per1-shRNA-Ⅲ质粒病毒的SCC15细胞,对照组(ControlshRNA)为转染Control-shRNA质粒(对照质粒,即只含对任何基因均无干扰效应的shRNA序列的质粒)的SCC15细胞,SCC15组为未作任何处理的SCC15细胞(空白对照)。
1.4蛋白质印迹法(Western blot)检测
收集各组细胞,用RIPA裂解液提取总蛋白,用BCA蛋白浓度测定试剂盒测定蛋白质浓度。将提取蛋白与其1/4体积的蛋白上样缓冲液混合后变性5 min (100 ℃)。取50 μg蛋白上样,在10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)100 V电压下电泳,所得电泳产物转移至PVDF膜上,用5%脱脂奶粉封闭1 h后加入一抗兔抗人Per1多克隆抗体(1︰200)和鼠抗人GAPDH单克隆抗体(1︰3 000)过夜,用TBST(Tris Buffered Saline with Tween-20)液洗膜3次,每次10 min,然后加入二抗为辣根酶标记山羊抗兔IgG抗体(1︰1 000),37 ℃孵育1 h。用TBST液洗膜3遍后,电化学发光(electrochemiluminescence,ECL)显影。最后用Quantity One软件(Bio-Rad公司,美国)分析条带灰度值,计算 PER1和内参GAPDH条带灰度值比值。以上实验重复3次。
1.5实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)检测
按Trizol说明书分别提取各组细胞的总RNA,将总RNA溶解于焦碳酸二乙酯(diethylpyrocarbonate,DEPC)处理的双蒸水中,用紫外分光光度仪测定RNA浓度和纯度。用逆转录试剂盒将RNA反转录为cDNA,按试剂盒说明进行操作,反应体系为10 μL,反应条件:37 ℃,15 min,85 ℃ 5 s,4 ℃ 4 min。用Primer Premier 5.0软件设计并合成目的基因Per1、p53、Cyclin D1、Cyclin E、Cyclin A2、Cyclin B1、CDK1、CDK2、CDK4、CDK6、p16、p21、Wee1、cdc25、E2F、Rb1和内参基因GAPDH的引物序列(表1)。用荧光定量PCR仪进行PCR扩增,反应体系为10 μL:Premix Ex TapTM5 μL,上下游引物各0.5 μL,50 ng·μL-1cDNA模板1 μL,灭菌双蒸水3 μL补足体积至10 μL。扩增参数为:95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火延伸30 s,扩增40个循环。每次qRT-PCR反应都设有以相同体积的灭菌双蒸水取代cDNA作为空白对照,每个样本设3个复孔,检测重复3次。用Pfaffl法[13]计算各基因mRNA的表达。

表1 各基因qRT-PCR引物序列Tab 1 The primers for qRT-PCR of the genes
1.6流式细胞仪检测
根据Per1 mRNA和蛋白检测结果,筛选RNA干扰作用最强的Per1-shRNA-Ⅰ组作为实验组。取对数生长期的Per1-shRNA-Ⅰ、Control-shRNA和SCC15组细胞,用0.25%胰蛋白酶消化后吹打成单细胞悬液,调整各组细胞浓度为1×106个·mL-1,分别取1 mL各组细胞悬液离心(1 000 r·min-1,4 ℃)5 min,去掉上清液,PBS液洗涤细胞2次。
细胞周期分布和细胞增殖检测:在各组细胞中加入0.5 mL70%乙醇(-20 ℃预冷)固定,4 ℃冰箱过夜,离心(1 000 r·min-1,4 ℃)5 min,用PBS液洗涤细胞2遍,加入碘化丙啶染色液1 mL,4 ℃避光30 min后用流式细胞仪检测细胞周期分布,并计算细胞增殖指数(proliferation index,PI),PI=(S+ G2/M)/(G0/G1+S+G2/M)×100%。
细胞凋亡检测:在各组细胞中加入200 μL膜联蛋白(Annexin)Ⅴ-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)染色液,4 ℃避光孵育15 min,再加入碘化丙啶染色液1 mL混匀,5 min后用流式细胞仪检测细胞凋亡。细胞凋亡指数(apoptosis index,AI)=(凋亡细胞数/所测细胞总数)×100%。实验重复3次。
1.7体内成瘤实验
无特定病原体(specific pathogen free,SPF)级别BALB/c nu/nu品系雌性裸鼠10只,4~6周龄,体重18~22 g(重庆医科大学实验动物研究所)。随机分为Per1-shRNA-Ⅰ组(实验组)和SCC15组(空白组),每组5只。采用0.25%胰酶分别消化对数生长期的Per1-shRNA-Ⅰ和SCC15细胞,冷冻低速离心(4 ℃,1 000 r·min-1)5 min后,用PBS液调整细胞浓度为5×106个·mL-1的单细胞悬液。将0.2 mL Per1-shRNA-Ⅰ和SCC15细胞悬液分别注入实验组和空白组裸鼠的右背部皮下。3周明显成瘤后,用颈椎脱位法处死裸鼠,取出肿瘤,用电子天平(A250型,Denver公司,美国)称重量,用游标卡尺测量肿瘤的最大长径(a)和最小短径(b),按公式计算肿瘤体积(V):V=0.5×a×b2。然后将肿瘤用4%多聚甲醛固定,常规石蜡包埋,切片,常规苏木素-伊红(hematoxylin-eosin,HE)染色后在200倍光学显微镜下观察。所有实验操作程序均经过重庆医科大学实验动物研究所实验动物使用管理委员会批准。
1.8统计学分析
采用SPSS 17.0软件对3组及以上实验数据进行单因素方差分析,组间两两比较采用 LSD-t检验;对体内成瘤2组实验数据进行t检验。P<0.05为有统计学差异。
2 结果
2.1Per1-shRNA载体构建及鉴定
测序鉴定表明,3条Per1-shRNA-Ⅰ~Ⅲ重组质粒DNA测序与设计的干扰靶序列片段一致(图1),表明3条Per1-shRNA(Ⅰ~Ⅲ)-PLKO.1重组慢病毒载体构建成功。
图1 Per1-shRNA重组质粒测序图谱Fig 1 The sequencing atlas of Per1-shRNA recombinant plasmids
2.2Per1基因沉默后SCC15细胞中Per1 mRNA和蛋白的表达
Per1-shRNA-Ⅰ~Ⅲ、Control-shRNA和SCC15组细胞中Per1 mRNA的表达分别为1.00±0.00、1.45± 0.34、1.50±0.23、2.11±0.31、2.20±0.34,Per1蛋白的灰度值比值分别为1.05±0.21、1.50±0.15、1.63± 0.11、2.18±0.24、2.21±0.33(图2)。Per1-shRNA-Ⅰ组细胞中Per1 mRNA和蛋白的表达均低于其他组(P<0.05),表明Per1-shRNA-Ⅰ组的Per1沉默效果最佳,作为实验组。
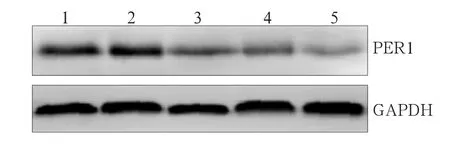
图2 Western blot检测各组Per1蛋白表达水平Fig 2 Per1 protein levels of each group analyzed by Western blot
2.3Per1沉默后SCC15细胞内细胞周期相关基因mRNA的表达
qRT-PCR检测结果见表2。Per1-shRNA-Ⅰ组中Cyclin D1、Cyclin E、Cyclin B1、CDK1和Wee1 mRNA的表达水平高于Control-shRNA组和SCC15组(P<0.05),p53、Cyclin A2、p16、p21和cdc25 mRNA的表达水平降低(P<0.05);Control-shRNA组和SCC15组中各基因mRNA的表达水平无差异(P>0.05)。CDK2、CDK4、CDK6、E2F和Rb1 mRNA的表达水平在3组中均无统计学差异(P>0.05)。
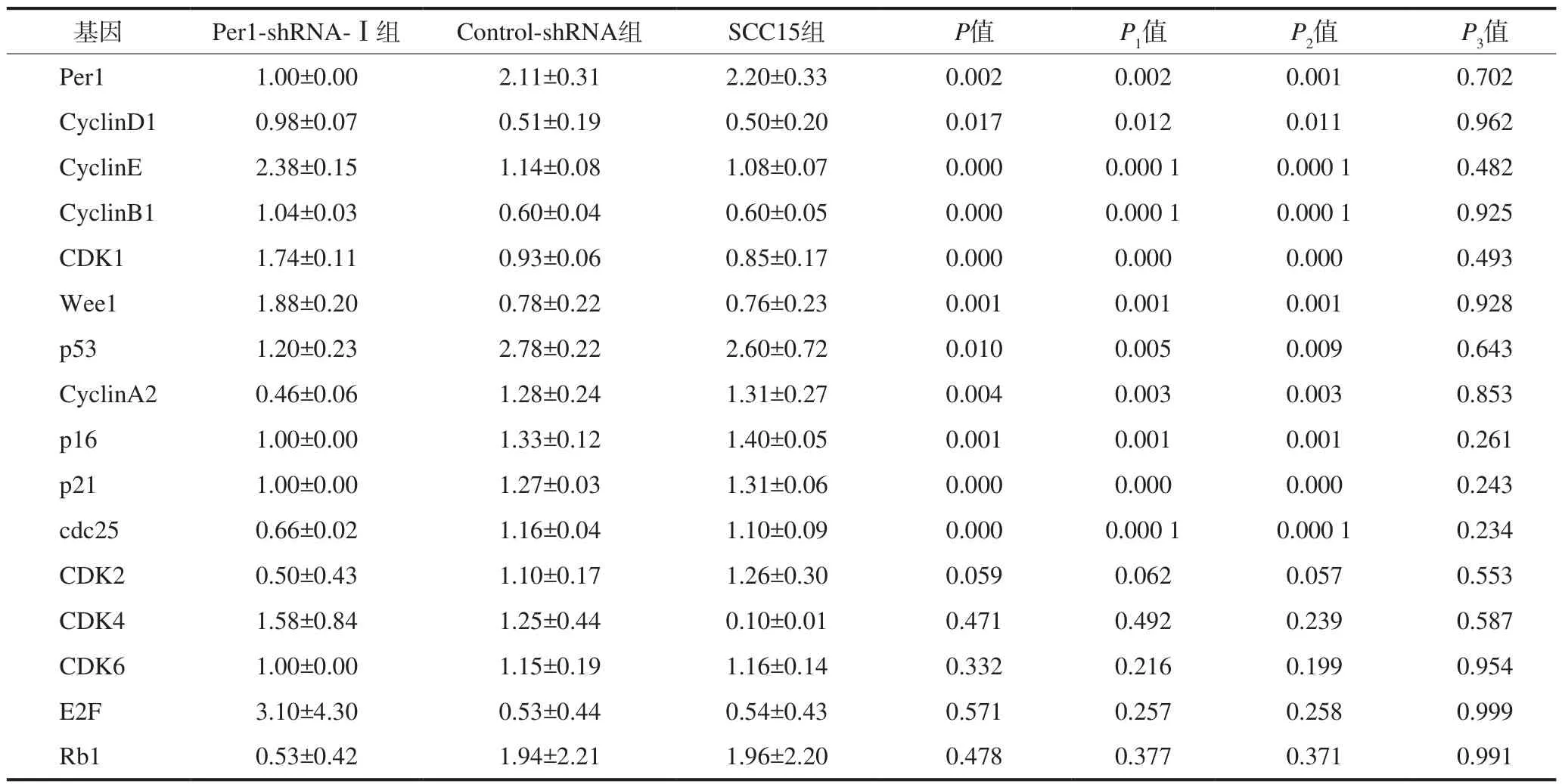
表2 Per1-shRNA-Ⅰ、Control-shRNA和SCC15组中细胞周期相关基因mRNA的表达Tab 2 The mRNA expressions of cell cycle related genes in Per1-shRNA-Ⅰ, Control-shRNA, and SCC15 groups
2.4Per1基因沉默后SCC15细胞的细胞周期分布、增殖、凋亡的变化
流式细胞仪检测结果见表3。Per1-shRNA-Ⅰ组中细胞增殖指数高于Control-shRNA组和SCC15组(P<0.05),凋亡指数降低(P<0.05),S期细胞数降低(P<0.05),G2/M期细胞数增加(P<0.05)。Control-shRNA组和SCC15组细胞的增殖指数、凋亡指数和细胞周期分布无统计学差异(P>0.05)。
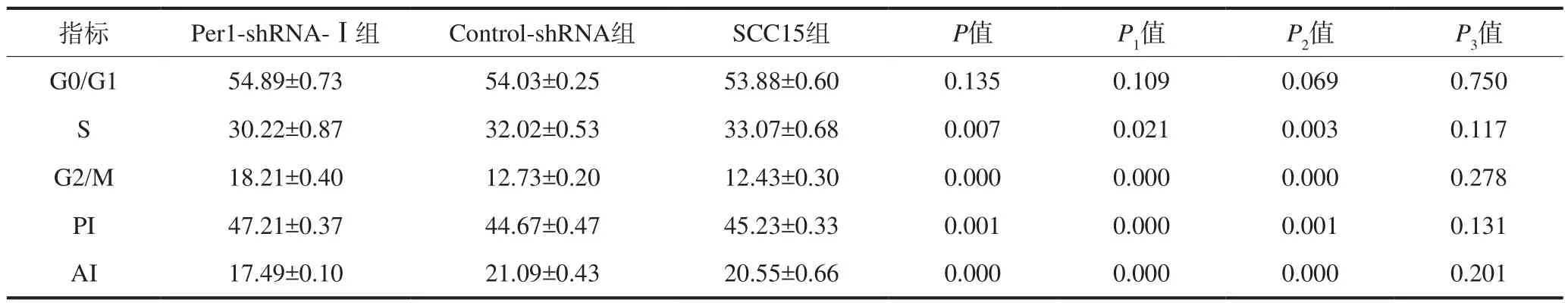
表3 Per1-shRNA-Ⅰ、Control-shRNA和SCC15组中细胞周期分布、细胞增殖、细胞凋亡Tab3 The cell cycle distribution, cell proliferation, and apoptosis in Per1-shRNA-Ⅰ, Control-shRNA, and SCC15 groups
2.5体内成瘤
体内成瘤结果见图3:Per1-shRNA-Ⅰ组和SCC15组肿瘤的体积分别为(0.25±0.09)cm³和(0.08± 0.02)cm³,质量分别为(0.50±0.16)g和(0.18± 0.04)g,均具有统计学差异(P<0.05)。表明Per1-shRNA-Ⅰ组细胞体内成瘤能力显著增强(P<0.05)。
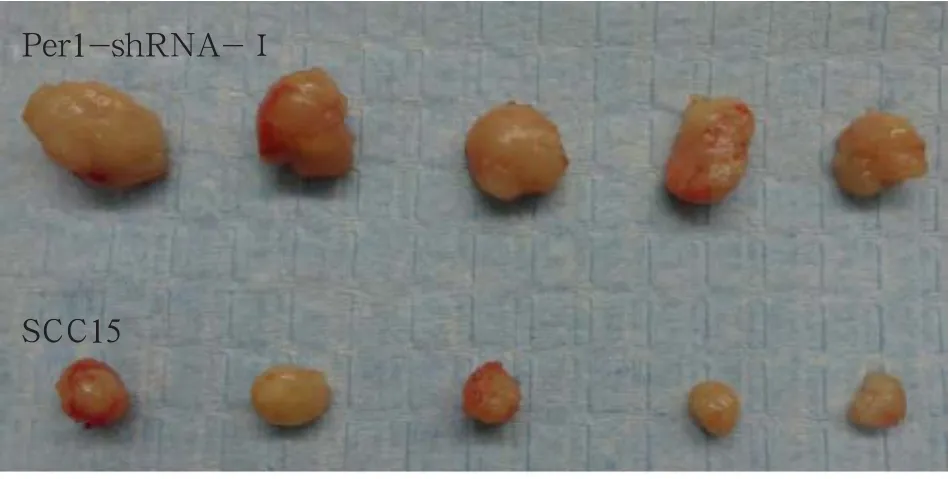
图3 Per1-shRNA-Ⅰ和SCC15组细胞的体内成瘤能力Fig 3 The tumorigenic ability in vivo of Per1-shRNA-Ⅰand SCC15 group cells
3 讨论
细胞周期紊乱导致细胞增殖和凋亡的平衡改变,这是肿瘤发生的主要原因[4,10]。正常细胞在Cyclins-CDKs-CKIs细胞周期分子网络系统的精确调控下按严格的时间顺序沿着G1-S-G2-M时相运转[4,10,14]。在Cyclins-CDKs-CKIs网络中,CDKs是调控细胞周期的核心,在细胞周期的不同时相,不同的Cyclins与不同的CDKs结合形成Cyclins/CDKs复合物,激活CDKs的功能,促进细胞由一个细胞周期时相向另一个细胞周期时相有序转换,而不同的CKIs可通过与相应的CDKs或Cyclins/CDKs复合物结合,抑制CDKs的活性,从而抑制细胞周期时相转换[10-11]。如果正性调节因子Cyclins和负性调节因子CKIs的协同调控作用发生异常,细胞增殖和凋亡的平衡就会发生改变,最终导致肿瘤的发生。
研究[7-8]证明:Per1异常表达与肿瘤的发生发展密切相关,其机理是Per1能调控下游许多重要细胞周期蛋白。Yang等[7]报道,下调Per1基因表达导致小鼠乳腺癌细胞中Cyclin D1和Cyclin E的表达水平增高,细胞增殖及生长能力增加;过表达Per1导致结肠癌细胞HCT116中Cyclin B1和Wee1的表达水平降低,从而诱导细胞凋亡,抑制细胞增殖;Cao等[8]也发现,过表达Per1基因能抑制前列腺癌细胞增殖和促进细胞凋亡。但在Cyclins-CDKs-CKIs细胞周期分子网络系统中,Per1对CDKs和CKIs这两方面的调控作用目前还了解甚少。
G1期的启动是启动细胞周期运行的关键,Cyclin D1与CDK4或CDK6结合,激活CDK4或CDK6的活性,启动G1期,然后Cyclin E与CDK2结合,激活CDK2的活性,使细胞从G1期向S期过渡[10,14],同时CKIs中属于Ink4家族的p16能与Cyclin D1竞争与CDK4 或CDK6结合,特异性抑制CDK4或CDK6活性,而CKIs中属于Cip/Kip家族的p21具有广泛激酶抑制活性,能抑制各种Cyclins-CDKs复合物的活性,因而在G1期对CyclinE/CDK2复合体活性有抑制作用,从而阻滞细胞周期进程[10-11,15]。本研究显示:SCC15细胞中沉默Per1基因后,虽然CDK2、CDK4和CDK6的表达水平无显著改变,但Cyclin D1和Cyclin E表达显著增高,激活了CDK2、CDK4或CDK6的活性,同时p16和p21表达显著降低,对CDK2、CDK4和CDK6活性的抑制能力减弱,从而增强了细胞G1期的启动能力,促进细胞由G1期向S期加速过渡,促进细胞增殖。本研究也证明:Per1基因沉默后,SCC15细胞体内成瘤能力增强。
在细胞周期的S期,Cyclin A2与CDK2结合激活CDK2,Cyclin A2/CDK2复合物驱动细胞延续S期,并促进细胞从S期向G2期转化[10,14]。本研究显示:沉默Per1基因后,SCC15细胞中CDK2表达无明显改变,但Cyclin A2表达显著降低,同时抑制Cyclin A2/ CDK2复合物活性的p21表达也显著降低,导致Cyclin A2/CDK2复合物对细胞S期的延续作用减弱,因而S期进程缩短,从而导致S期细胞数降低。
在G2期,Cyclin B1与CDK1结合激活CDK1,CDK1/Cyclin B1复合体驱动细胞从G2期向M期转化。cdc25能增强CDK1的活性,促进G2期向M期的转化进程[10,14],Weel能抑制CDK1的活性,导致M期延迟或将细胞周期阻滞在G2/M期[10]。本研究显示:沉默Per1基因后,SCC15细胞中CDK1、Cyclin B1和Wee1表达显著增高,而p21和cdc25表达显著降低,提示沉默Per1基因后,Cyclins-CDKs-CKIs网络调控系统中的三方面均发生了改变。同时本研究结果还显示,细胞在G2/M期数量增多,证明Wee1对Cyclin B1/CDK1复合体的负性调控作用占有优势。
在Cyclins-CDKs-CKIs网络调控的细胞周期运行中,p53是G1/S细胞周期检查点的重要因子。在G1/S细胞周期检查点,有DNA损伤的细胞通过激活p53使细胞周期停滞进行DNA修复,不能修复者诱导其凋亡[10]。本研究结果显示:沉默Per1基因后SCC15细胞中p53表达降低,导致细胞对损伤DNA的修复能力减弱和诱导细胞凋亡能力下降,增加了受损DNA未经修复的细胞进入S期,使细胞基因组的完整性和稳定性受到影响,促进细胞恶性转化。本研究也证明:Per1基因沉默后,SCC15细胞增殖指数显著增高,凋亡指数显著下降,并且体内成瘤能力增强。
本研究证明:生物钟基因Per1是重要的抑癌基因。Per1沉默后,SCC15癌细胞中CDK2、CDK4、CDK6、E2F和Rb1 mRNA表达水平无显著改变,但Cyclin D1、Cyclin E、Cyclin B1、CDK1和Wee1 mRNA的表达水平显著增高,而p53、Cyclin A2、p16、p21和cdc25 mRNA的表达水平显著降低,最终导致细胞增殖水平增高,凋亡水平下降,细胞周期进程改变,细胞体内成瘤能力增强。本研究从转录水平证明了生物钟基因Per1对Cyclins-CDKs-CKIs细胞周期分子网络中的三方面及细胞周期G1/S检查点均有重要的调控作用。在此基础上对Per1的深入研究有可能进一步明确昼夜节律与细胞周期两大周期活动之间的相互作用以及与癌变发生的关系,为癌症的治疗提供新的有效分子靶点。
[参考文献]
[1]Kelleher FC, Rao A, Maguire A.Circadian molecular clocks and cancer[J].Cancer Lett, 2014, 342(1):9-18.
[2]Eismann EA, Lush E, Sephton SE.Circadian effects in cancerrelevant psychoneuroendocrine and immune pathways[J].Psychoneuroendocrinology, 2010, 35(7):963-976.
[3]Zieker D, Jenne I, Koenigsrainer I, et al.Circadian expression of clock- and tumor suppressor genes in human oral mucosa[J].Cell Physiol Biochem, 2010, 26(2):155-166.
[4]Borgs L, Beukelaers P, Vandenbosch R, et al.Cell circadian cycle: new role for mammalian core clock genes[J].Cell Cycle, 2009, 8(6):832-837.
[5]Zheng B, Albrecht U, Kaasik K, et al.Nonredundant roles of the mPer1 and mPer2 genes in the mammalian circadian clock[J].Cell, 2001, 105(5):683-694.
[6]Bae K, Jin X, Maywood ES, et al.Differential functions of mPer1, mPer2, and mPer3 in the SCN circadian clock[J].Neuron, 2001, 30(2):525-536.
[7]Yang X, Wood PA, Ansell CM, et al.The circadian clock gene Per1 suppresses cancer cell proliferation and tumor growth at specific times of day[J].Chronobiol Int, 2009, 26(7):1323-1339.
[8]Cao Q, Gery S, Dashti A, et al.A role for the clock gene per1 in prostate cancer[J].Cancer Res, 2009, 69(19):7619-7625.
[9]Cadenas C, van de Sandt L, Edlund K, et al.Loss of circadian clock gene expression is associated with tumor progression in breast cancer[J].Cell Cycle, 2014, 13(20):3282-3291.
[10]Soták M, Sumová A, Pácha J.Cross-talk between the circadian clock and the cell cycle in cancer[J].Ann Med, 2014, 46(4):221-232.
[11]Lim S, Kaldis P.Cdks, cyclins and CKIs: roles beyond cell cycle regulation[J].Development, 2013, 140(15):3079-3093.
[12]Wilson RC, Doudna JA.Molecular mechanisms of RNA interference[J].Annu Rev Biophys, 2013, 42:217-239.
[13]Pfaffl MW.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Res, 2001, 29(9):e45.
[14]Hochegger H, Takeda S, Hunt T.Cyclin-dependent kinases and cell-cycle transitions: does one fit all[J].Nat Rev Mol Cell Biol, 2008, 9(11):910-916.
[15]Williams RT, Barnhill LM, Kuo HH, et al.Chimeras of p14ARF and p16: functional hybrids with the ability to arrest growth[J].PLoS ONE, 2014, 9(2):e88219.
(本文编辑李彩)
·临床研究·
Effects and mechanism of the circadian clock gene Per1 on the proliferation, apoptosis, cycle, and tumorigenicity in vivo of human oral squamous cell carcinoma
Fu Xiaojuan, Yang Kai, Li Hanxue, Zhao Qin, Chen Dan.(Dept.of Oral and Maxillofacial Surgery, The First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China)
[Key words]circadian clock;Per1;cell cycle;gene;oral carcinoma
[Abstract]Objective To determine the regulatory effects of the circadian clock gene Per1 on cell cycle-related genes and its influence on the proliferation, apoptosis, cycle, and tumorigenicity in vivo of human oral squamous cell carcinoma SCC15 cells.MethodsThree groups of the short hairpin RNA (shRNA) of lentivirus recombinant plasmids were designed against the RNA of Per1 and then transfected to the SCC15 cells.The optimum interference group was screened through Western blot and quantitative real-time PCR (qRT-PCR) and assigned as the experimental group.The transfected lentivirus plasmid without an interference effect on any gene was set as the control group (Control-shRNA).Untreated SCC15 cells were set as the blank group.The mRNA expressions of cell cycle-related genes, namely, Per1, p53, Cyclin D1, Cyclin E, Cyclin A2, Cyclin B1, CDK1, CDK2, CDK4, CDK6, p16, p21, Wee1, cdc25, E2F, and Rb1, in each group were detectedthrough qRT-PCR.The cell proliferation, apoptosis, and cell cycle distribution in each group were evaluated through flow cytometry.The cells of the experimental group andthe blank group were subcutaneously inoculated in nude mice to observe tumorigenesis.ResultsThree groups of Per1-shRNA lentivirus plasmids were constructed successfully.Among the groups, the Per1-shRNA-Ⅰgroup exhibited the highest interference effect, as indicated by qRT-PCR and Western blot analysis.As such, this group was set as the experimental group.The mRNA expression levels of CyclinD1, CyclinE, CyclinB1, CDK1, and Wee1 gene in the Per1-shRNA-Ⅰgroup were significantly higher than those in the Control-shRNA group and the SCC15 group (P<0.05).By contrast, the mRNA expression levels of p53, Cyclin A2, p16, p21, and cdc25 in the Per1-shRNA-Ⅰgroup were significantly lower than those in the Control-shRNA group and the SCC15 group (P<0.05).The mRNA expression levels of each gene between the Control-shRNA group and the SCC15 group did not significantly differ (P>0.05).The mRNA expression levels of CDK2, CDK4, CDK6, E2F, and Rb1 did not significantly differed in the three groups (P>0.05).The proliferation index of the Per1-shRNA-Ⅰgroup was significantly higher than those of the Control-shRNA group and the SCC15 group (P<0.05).The apoptosis index of the Per1-shRNA-Ⅰgroup was significantly lower than those of the Control-shRNA group and the SCC15 group (P<0.05).The number of S-phase cells in the Per1-shRNA-Ⅰgroup was significantly lower than those of S-phase cells in the Control-shRNA group and the SCC15 group (P<0.05).The number of G2/M-phase cells in the Per1-shRNA-Ⅰgroup was significantly higher than those of G2/M-phase cells in the Control-shRNA group and the SCC15 group (P<0.05).Conversely, the proliferation index, apoptotic index, and cell cycle distribution of the cells in the Control-shRNA group did not significantly differ from those of the SCC15 group (P>0.05).The tumorigenic ability in vivo was significantly enhanced in the Per1-shRNA-Ⅰgroup (P<0.05).ConclusionPer1 is an important tumor suppressor gene.Perl can regulate a large number of downstream cell cycle-related genes.The alteration of its expression can affect cell cycle progression, proliferation, apoptosis imbalance, and tumorigenic ability in vivo.Further studies on Per1 may elucidate cancer development and provide novel effective molecular targets for cancer treatment.
[中图分类号]R 739.8
[文献标志码]A [doi]10.7518/hxkq.2016.03.008
[收稿日期]2015-10-16; [修回日期]2016-02-28
[作者简介]付小娟,硕士,E-mail:466133758@qq.com
[通信作者]杨凯,教授,博士,E-mail:cqfyyk@aliyun.com
