体外持续传代引起小鼠透明软骨细胞表型和细胞外基质平衡变化的研究
2016-06-15蔡林奕孔祥丽谢静口腔疾病研究国家重点实验室华西口腔医院四川大学成都610041
蔡林奕 孔祥丽 谢静口腔疾病研究国家重点实验室 华西口腔医院(四川大学),成都 610041
体外持续传代引起小鼠透明软骨细胞表型和细胞外基质平衡变化的研究
蔡林奕孔祥丽谢静
口腔疾病研究国家重点实验室 华西口腔医院(四川大学),成都 610041
[摘要]目的研究体外持续传代对透明软骨细胞形态表型、分化特性及细胞外基质(ECM)平衡状态的影响。方法酶消化法分离培养小鼠透明软骨细胞,连续传代至第5代。采用苏木精-伊红染色观察软骨细胞的形态改变,采用半定量聚合酶链式反应分析软骨细胞特异性基因、常规基因、基质金属蛋白酶家族(MMPs)和基质金属蛋白酶组织抑制剂家族(TIMPs)mRNA水平的变化,采用明胶酶谱分析鉴定软骨细胞明胶酶活性的改变。结果随着传代次数增加,软骨细胞形态由圆形或多边形变为长梭形,其特异性基因的表达量明显下降(P<0.05),至第5代已基本丧失。相比而言,常规基因的下调并不明显。MMPs和TIMPs均有下调(P<0.05),仅MMP-1和TIMP-1改变的差异无统计学意义(P>0.05);MMPs/TIMPs比值随传代发生紊乱。在蛋白质水平,随传代次数增加,明胶酶的活性下降,P4和P5代细胞下调显著(P<0.05)。结论软骨细胞在体外培养过程中,其特异性表型特征会随传代次数增加而逐渐丧失,软骨细胞发生反分化而表现出纤维化趋势。同时,ECM的平衡状态被打破,合成与分解代谢紊乱。在利用软骨细胞进行相关疾病的研究或软骨组织工程学实验时,应选用前3代的软骨细胞。
[关键词]体外传代; 透明软骨细胞; 细胞表型; 细胞外基质; 组织工程
Supported by: Funding of State Key Laboratory of Oral Diseases (Sichuan University) (SKLOD201527);The Youth Start-up Fund of Sichuan University (2015SCU11013);The National Undergraduate Training Programs for Innovation and Entrepreneurship ofSichuan University (201610610374).Correspondence: Xie Jing, E-mail: Xiejing2012@scu.edu.cn.
关节软骨的修复是骨科临床治疗的难题。生理情况下,成熟软骨细胞处于相对静止的状态,增殖与合成软骨特异性细胞外基质(extracellular matrix,
ECM)的能力极其有限,故较小的创伤就会造成严重的软骨损伤和变性,导致关节功能障碍[1]。
组织工程为修复损伤和疾病组织提供新的治疗方案,但在软骨再生方面,组织工程的应用还存在较大的局限性[2]。例如,软骨下骨的微创手术常并发关节软骨的纤维性修复[3];自体软骨细胞移植会在新生关节软骨中出现一定比例的纤维软骨,且纤维化程度随时间增加而增加[4]。软骨细胞在体外培养过程中会发生反分化,表现出成纤维细胞的形态和特征,继而导致软骨纤维化,限制了软骨组织工程的广泛应用。由此可见,软骨细胞在组织工程领域的应用价值取决于其表型和分化特性,有必要探索体外连续传代培养对软骨细胞表型的影响。
关节软骨的病变常伴随软骨ECM稳态的失衡。软骨基质主要由Ⅱ型胶原和蛋白多糖构成。细胞外基质的合成、分泌和降解受软骨细胞调控,ECM的稳态也是软骨细胞发挥生理功能的关键。基质金属蛋白酶家族(metalloproteinases,MMPs)和MMPs组织抑制剂家族(tissue inhibitors of MMPs,TIMPs)是参与软骨ECM代谢的重要酶类。在软骨组织中,MMP-1、MMP-2、MMP-3、MMP-9、MMP-10、MMP-13和MMP-14是参与软骨内骨化的主要MMPs成员[5]。TIMPs是MMPs的生理性抑制剂[6]。正常情况下MMPs和TIMPs的表达量保持相对稳定,共同调控ECM的代谢平衡;在各种损伤因子的作用下,MMPs 和TIMPs的比例改变,造成软骨结构和功能异常。
本实验通过研究透明软骨细胞在体外传代扩增过程中形态的改变,特异性基因和常规基因的mRNA水平的变化以及MMPs和TIMPs基因/蛋白水平的改变,揭示连续传代对软骨细胞表型和ECM平衡的影响,为建立性状稳定的软骨细胞库提供理论基础。
1 材料和方法
1.1主要仪器和试剂
苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒、BCA试剂盒(上海碧云天生物技术有限公司),
RNA抽提试剂盒(Qiagen公司,美国),cDNA合成试剂盒、聚合酶链式反应(polymerase chain reaction, PCR)试剂盒、DNAseⅠ(Mbi公司,美国)。IX70型倒置显微镜(Olympus公司,日本),光密度计、PCR仪(Bio-Rad公司,美国),Bio-Tek ELx800酶标仪(Bio-Tek公司,美国)。
1.2实验动物
本实验所需动物的获得符合伦理原则,且处理流程经过伦理委员会的审查和批准。
1.3细胞培养
本研究在Gosset等[7]报道过的两种分离培养原代软骨细胞的方法上进行了改进,从1 d龄小鼠的膝关节分离透明软骨细胞(此时的膝关节软骨未发生钙化,均为透明软骨)。处死小鼠后灭菌并剥去膝关节上皮,用眼科剪收集后肢膝关节(图1)。将膝关节剪碎,再用0.25%的胰酶消化30 min。随后移除上清液,用0.5%的Ⅱ型胶原酶消化3 h。在处理后的软骨细胞悬浮液中加入等体积含10%胎牛血清(fetal bovine serum,FBS)、1%青霉素-链霉素的DMEM培养基。将混合溶液1 000 r·min-1离心5 min后,去除上清液,在离心管中加入含10%FBS的DMEM培养基,使软骨细胞再次悬浮。将悬浮的软骨细胞接种到培养瓶中,放入5%CO2、37 ℃孵箱中培养。将分离的软骨细胞标记为原代(P0代),待细胞长满汇合后开始传代,传代第1次称为P1代,本实验共传代5次。

图1 分离新生小鼠的关节软骨细胞Fig 1 Separation of articular chondrocytes from neonatal mice
1.4检测方法
1.4.1HE染色使用HE染色试剂盒进行染色。软骨细胞贴壁后用4%多聚甲醛溶液固定1 h,随后清洗,按照试剂盒说明书操作,干燥后中性树脂封片,倒置显微镜采集图像。
1.4.2半定量PCR 将软骨细胞接种于六孔板,弃去含10%FBS的DMEM培养基,用含2%FBS的DMEM培养基培养12 h,再换成含1%FBS的DMEM培养基,即刻开始计时,12 h后开始提取软骨细胞RNA。RNA纯化并定量后,使用cDNA合成试剂盒得到cDNA。使用PCR试剂盒在PCR仪上进行半定量PCR,以磷酸甘油醛脱氢酶(phosphoglyceraldehyde dehydroge nase,GAPDH)和β-actin为内参,检测软骨细胞特异性基因蛋白聚糖、骨形态发生蛋白-2(bone morphogenetic protein-2,BMP-2)和Ⅱ型胶原,同时检测软骨细胞常规基因纤连蛋白1和Ⅰ、Ⅲ型胶原,以及MMP-1、MMP-2、MMP-3、MMP-9、TIMP-1、TIMP-2、TIMP-3、TIMP-4 mRNA的表达。各基因的引物序列见表1。

表1 半定量PCR的引物序列Tab 1 Primers sequences for semi-quantitative PCR
经半定量PCR扩增得到的产物在Tris硼酸-乙二胺四乙酸缓冲液中电泳,使用溴化乙锭染色并显色,采用Quantity One 4.6.3软件分析光密度(optical density,OD)值。
1.4.3明胶酶谱实验0.05%明胶酶谱用于检测培养基中软骨细胞分泌的MMP-2和MMP-9的活性。酶谱实验所检测的软骨细胞为P0~P5代,所选时间点为12、24、48、72 h和1周。
通过BCA试剂盒测出蛋白质的浓度,加入相同质量的蛋白样品,并混入等量蛋白分离缓冲液,在10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)中分离,凝胶中聚合有0.05%明胶。电泳结束后,在2.5%Triton X-100中清洗凝胶3次,每次0.5 h。清洗后的凝胶在蛋白水解缓冲液中室温孵育12~16 h,随后在2.5%Triton X-100溶液中漂洗,在考马斯亮蓝染液中震荡染色1 h。当考马斯亮蓝的蓝色背景中出现清晰的白色条带时即开始对凝胶脱色。光密度计扫描条带,Quantity One 4.6.3软件定量分析。
1.5统计学方法
采用SPSS 19.0进行统计学分析,多组间比较采用单因素方差分析,两两比较采用LSD法,检验水准为双侧α=0.05。
2 结果
2.1随着传代次数的增加,软骨细胞的形态发生反分化
关节软骨细胞的HE染色结果见图2。由图2可见,P0—P3代软骨细胞形态多为圆形或多边形,而P4和P5代软骨细胞发生反分化,其形态表现为成纤维样的长梭形。
2.2随着传代次数增加,软骨细胞特异性基因的表达量下调,而常规基因的变化并不显著
半定量PCR表明,软骨细胞特异性基因Ⅱ型胶原和蛋白聚糖在P0代细胞高表达,其表达量随传代次数增加而下降(图3上)。P1、P2、P3、P4、P5代细胞Ⅱ型胶原的mRNA表达量分别为P0代细胞的87%、90%、67%、20%和3%,蛋白聚糖表达量分别是P0代细胞的60%、30%、23%、18%和10%; BMP-2也随着传代次数增加表现出一定的下调趋势(图3下)。软骨细胞内常规基因Ⅰ型和Ⅲ型胶原的表达量在软骨细胞传代过程中表现出一定的下调(图4),但其下调程度不如Ⅱ型胶原显著,纤连蛋白1在传代过程中的表达量并无明显变化。

图2 关节软骨细胞形态变化 HEFig 2 Morphological change of the articular chondrocytes HE
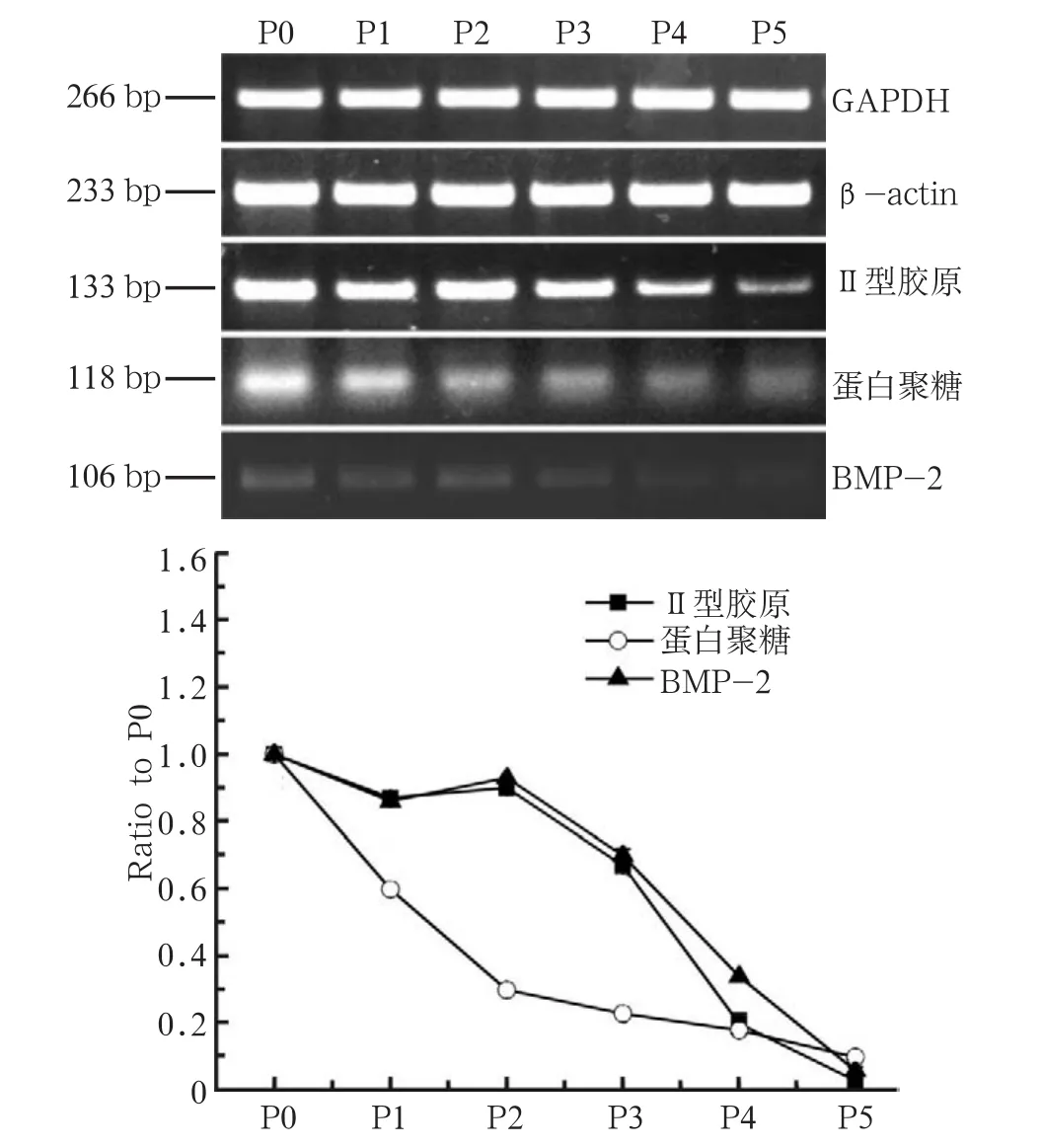
图3 软骨细胞特异性基因表达量的变化Fig 3 Expressions of specific marker genes in chondrocytes
2.3随传代次数增加,MMPs和TIMPs基因的表达量下降,MMPs与TIMPs比值失衡
MMPs和TIMPs的半定量PCR结果见图5、6。随传代次数的增加,MMPs表达量下降,其中MMP-2、MMP-3和MMP-9有明显下调(P<0.05);TIMPs表达量也有类似改变,以TIMP-2、TIMP-3和TIMP-4的变化较为显著(P<0.05)。MMP-1/TIMP-4、MMP-3/TIMP-4随传代次数增加而明显增加,而MMP-2/ TIMP-2、MMP-9/TIMP-1、MMP-3/TIMP-1则在传代中明显下调,说明P2代开始发生ECM稳态的紊乱。与P0代相比,P5代细胞MMP-1/TIMP-4、MMP-3/ TIMP-4分别增加了(9.03±0.20)和(3.15±0.19)倍,MMP-2/TIMP-2、MMP-9/TIMP-1、MMP-3/TIMP-1分别下降为P0代的8.70%、14.95%和69.93%。

图4 软骨细胞内常规基因表达量的变化Fig 4 Expressions of routine genes in chondrocytes
2.4明胶酶的活性随传代次数增加而下降,P4和P5代细胞蛋白活性的增加无明显时间依赖性
明胶酶谱实验结果表明,P0—P3代细胞MMP-2 和MMP-9活性的增强有明显时间依赖性,而P4、P5代细胞MMP-2和MMP-9活性随时间延长变化不明显(图7)。随传代次数增加,MMP-2和MMP-9的活性下降(图7、图8上)。当所选培养时间点为1周时,P4和P5代细胞MMP-2和MMP-9的活性明显下调(图8上),与P0代细胞相比,P4和P5代细胞MMP-2活性分别下降为P0代的19.34%和12.00%(图8下)。

图5 软骨细胞中MMPs、TIMPs基因的电泳结果Fig 5 The gene expressions of MMPs and TIMPs after continuous passaging in each generation of chondrocytes

图6 体外连续传代对软骨细胞中MMPs、TIMPs基因表达量及二者间比值的影响Fig 6 The influences of in vitro continuous passaging on the gene expressions of MMPs and TIMPs, and the gene ratios of MMPs/TIMPs in chondrocytes

图7 软骨细胞连续传代后MMP-2和MMP-9活性随时间的变化Fig 7 Activities of MMP-2 and MMP-9 are time-dependent in chon- drocytes after continuous passaging

图8 所选时间点为1周时,软骨细胞中MMP-2和MMP-9的活性Fig 8 Activities of MMP-2 and MMP-9 in each generation of chon- drocytes after 1 week culture
3 讨论
本研究通过分析连续传代时透明软骨细胞形态的改变、特异性基因和常规基因的表达变化,以及细胞外基质平衡的改变,试图为软骨损伤相关疾病和软骨组织工程的研究奠定理论基础。本研究结果显示:1)透明软骨细胞会随传代发生反分化,细胞形态表现出成纤维细胞的形态特征;2)在基因水平,随着传代次数增加,软骨细胞特异性基因的表达量显著下调,而常规基因的表达量未有明显变化;3)透明软骨细胞在传代过程中,MMPs和TIMPs mRNA的表达量均下降,MMP-2和MMP-9在蛋白水平也有一致的表现,ECM的稳态失衡。故在利用软骨细胞进行相关疾病的研究或软骨组织工程学实验时,应选用前3代的软骨细胞。
软骨组织是高度特异性的组织,主要由软骨细胞和软骨基质构成。软骨细胞是软骨组织中唯一的一种细胞。软骨基质约占软骨总重量的90%,而软骨细胞只占软骨组织的很小一部分。致密的软骨基质是软骨发挥负重,缓冲压力,吸收震动,减小摩擦等生理功能的结构基础。与大多数组织不同,软骨组织内无血管、淋巴管和神经,营养物质经软骨基质渗透进入软骨细胞。这种组织学结构使软骨细胞在损伤因子的作用下,无法有效启动机体固有的防御性修复应答。故软骨一旦损伤,很难自发修复,甚至会导致进一步的软骨磨损,进而引发骨关节炎[7]。软骨ECM的有机成分主要为胶原和蛋白多糖。关节软骨中的胶原主要包括Ⅱ、Ⅸ、Ⅺ型胶原,其中Ⅱ型胶原占软骨胶原总量的80%~85%[8]。Ⅱ型胶原的高表达是软骨细胞的特征性表型,也是软骨具有一定抗拉强度和承重能力的分子学基础。另外,在结缔组织中高表达的Ⅰ、Ⅲ型胶原在软骨组织中的表达量极低。普遍的观点认为,正常关节软骨细胞不合成Ⅰ、Ⅲ型胶原,这两种胶原均为软骨细胞的非典型基因产物,是去分化软骨细胞的表型。软骨组织中Ⅲ型胶原含量相对增加可能改变Ⅱ型胶原的正常结构,减弱胶原纤维的强度,导致软骨生物力学特性的损害[9]。在本实验中,蛋白聚糖和Ⅱ型胶原的表达量可在传代过程中明显下调,而Ⅰ、Ⅲ型胶原虽然也表现出下调趋势,但下降幅度显著小于Ⅱ型胶原。另外,随着传代次数增加,纤连蛋白1表达量并无明显变化。由此可见,体外传代会使软骨ECM的化学组成发生改变,Ⅰ、Ⅲ型胶原和纤连蛋白1相对增加,Ⅱ型胶原和蛋白聚糖相对下降。ECM是维持组织形态结构和细胞生理功能的关键调控因素,各组成成分共同构成一个统一的整体,共同调节细胞的黏附和迁移,增殖和分化等生命活动。大量研究[10-12]表明,当提供的体外培养环境越接近体内环境时,软骨细胞反分化程度延迟越多。由此可见,ECM各成分比例的改变是软骨细胞在体外连续传代时不能维持其细胞特异性的可能原因之一。随着传代次数增加,ECM与软骨细胞相互作用,使细胞骨架组成及排列发生变化,逐渐反分化为成纤维样的长梭形。
MMPs是一类胞外基质金属蛋白酶,以酶原的形式被分泌,其激活依赖于Zn2+。MMPs可通过降解软骨ECM的各种有机成分参与软骨骨转换。TIMPs是一组能够抑制MMPs活性的蛋白酶家族[13]。TIMPs的不同成员可针对不同的MMPs发挥其特异性抑制作用。TIMP-1主要作用于MMP-1、MMP-3、MMP-9 和MMP-13。TIMP-2与TIMP-1相似,但对MMP-2有明显的抑制作用。TIMP-3通过与ECM结合而发挥作用;TIMP-4能抑制数个MMPs的活化,特别是与骨关节炎进程中软骨降解相关的家族成员[14]。MMPs 和TIMPs在软骨ECM代谢中的作用已逐渐引起关注,其在骨关节炎发病中的作用已被证实[15]。本研究发现,连续传代能使MMPs和TIMPs的多个成员表现出明显下调,而MMPs/TIMPs的比值与P0代细胞相比发生显著改变。由此可以认为,软骨细胞体外传代扩增会导致ECM代谢紊乱,MMPs/TIMPs的比值改变或许也是ECM各组成成分比例改变的直接作用因素。
本实验还存在一些不足:软骨细胞取自新生小鼠,并不能真正代表体内的病理性软骨细胞;采用的体外培养环境是一个二维环境,其生物化学和生物力学特性与细胞真实所处的三维环境存在较大的差异。另外,本实验未对软骨细胞加以各种生长因子的刺激,也未应用适宜的生物支架材料,这一方面的内容不可忽视。
[参考文献]
[1]Newman AP.Articular cartilage repair[J].Am J Sports Med, 1998, 26(2):309-324.
[2]Huey DJ, Hu JC, Athanasiou KA.Unlike bone, cartilage regeneration remains elusive[J].Science, 2012, 338(6109): 917-921.
[3]Marlovits S, Hombauer M, Truppe M, et al.Changes in the ratio of type-Ⅰand type-Ⅱcollagen expression during monolayer culture of human chondrocytes[J].J Bone Joint Surg Br, 2004, 86(2):286-295.
[4]Roberts S, Menage J, Sandell LJ, et al.Immunohistochemical study of collagen typesⅠandⅡand procollagenⅡA in human cartilage repair tissue following autologous chondrocyte implantation[J].Knee, 2009, 16(5):398-404.
[5]Malemud CJ.Matrix metalloproteinases: role in skeletal development and growth plate disorders[J].Front Biosci, 2006, 11:1702-1715.
[6]Visse R, Nagase H.Matrix metalloproteinases and tissue inhibitors of metalloproteinases: structure, function, and biochemistry[J].Circ Res, 2003, 92(8):827-839.
[7]Zhang L, Hu J, Athanasiou KA.The role of tissue engineering in articular cartilage repair and regeneration[J].Crit Rev Biomed Eng, 2009, 37(1/2):1-57.
[8]Cremer MA, Rosloniec EF, Kang AH.The cartilage collagens: a review of their structure, organization, and role in the pathogenesis of experimental arthritis in animals and in human rheumatic disease[J].J Mol Med, 1998, 76(3/4):275-288.
[9]Young RD, Lawrence PA, Duance VC, et al.Immunolocalization of collagen typesⅡand Ⅲ in single fibrils of human articular cartilage[J].J Histochem Cytochem, 2000, 48(3): 423-432.
[10]Hoshiba T, Yamada T, Lu H, et al.Maintenance of cartilaginous gene expression on extracellular matrix derived from serially passaged chondrocytes during in vitro chondrocyteexpansion[J].J Biomed Mater Res A, 2012, 100(3):694-702.
[11]Kino-Oka M, Yashiki S, Ota Y, et al.Subculture of chondrocytes on a collagen typeⅠ-coated substrate with suppressed cellular dedifferentiation[J].Tissue Eng, 2005, 11(3/4):597-608.
[12]Darling EM, Athanasiou KA.Retaining zonal chondrocyte phenotype by means of novel growth environments[J].Tissue Eng, 2005, 11(3/4):395-403.
[13] Xie J, Fu N, Cai LY, et al.The effects of interleukin-1β in modulating osteoclast-conditioned medium’s influence on gelatinases in chondrocytes through mitogen-activated protein kinases[J].Int J Oral Sci, 2015, 7(4):220-231.
[14]Carmeli E, Moas M, Reznick AZ, et al.Matrix metalloproteinases and skeletal muscle: a brief review[J].Muscle Nerve, 2004, 29(2):191-197.
[15]Yang CC, Lin CY, Wang HS, et al.Matrix metalloproteases and tissue inhibitors of metalloproteinases in medial plica and pannus-like tissue contribute to knee osteoarthritis progression[J].PLoS ONE, 2013, 8(11):e79662.
(本文采编王晴)
Effects of in vitro continuous passaging on the phenotype of mouse hyaline chondrocytes and the balance of the extra-cellular matrix
Cai Linyi, Kong Xiangli, Xie Jing.(State Key Laboratory of Oral Diseases, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China)
[Key words]in vitro passaging;hyaline chondrocyte;cell phenotype;extracellular matrix;tissue engineering
[Abstract]Objective This study aimed to investigate the effects of in vitro continuous passaging on the morphological phenotype and differentiation characteristics of mouse hyaline chondrocytes, as well as on the balance of the extracellular matrix (ECM).Methods Enzymatic digestion was conducted to isolate mouse hyaline chondrocytes, which expanded over five passages in vitro.Hematoxylin-eosin stain was used to show the changes in chondrocyte morphology.Semi-quantitative polymerase chain reaction was performed to analyze the mRNA changes in the marker genes, routine genes, matrix metalloproteinases (MMPs), and tissue inhibitors of MMPs (TIMPs) in chondrocytes.Zymography was carried out to elucidate changes in gelatinase activities.ResultsAfter continuous expansion in vitro, the morphology of round or polygonal chondrocytes changed to elongated and spindled shape.The expression of marker genes significantly decreased (P<0.05), and it was almost negatively expressed by P5 chondrocytes.By contrast, the down regulation of routine genes was insignificant.The gene expression levels of MMPs and TIMPs both decreased (P<0.05), but the change in MMP-1 and TIMP-1 was not statistically significant (P>0.05).Meanwhile, the ratio of MMPs/TIMPs was altered.At the protein level, the activities ofgelatinases decreased after passaging, especially for P4 and P5 chondrocytes (P<0.05).Conclusion Serially passaged chondrocytes dedifferentiated and lost specific phenotypic characteristics during in vitro expansion culture.Simultaneously, the anabolism and catabolism of the cartilage ECM became uncontrollable and led to the imbalance of ECM homeostasis.When hyaline chondrocytes are applied in research on relevant diseases or cartilage tissue engineering, P0–P2 chondrocytes should be used.
[中图分类号]Q 813
[文献标志码]A [doi]10.7518/hxkq.2016.03.007
[收稿日期]2015-10-25; [修回日期]2016-01-29
[基金项目]口腔疾病研究国家重点实验室(四川大学)自主研究课题(SKLOD201527);四川大学青年教师科研启动基金(2015SCU-11013);四川大学大学生创新创业训练计划(201610610374)
[作者简介]蔡林奕,学士,E-mail:865685467@qq.com
[通信作者]谢静,讲师,博士,E-mail:Xiejing2012@scu.edu.cn
