外源IAA和GA3对杨树应拉木形成的影响
2016-06-15陈海燕刘盛全
刘 凯,余 敏,陈海燕,赵 磊,刘盛全
(安徽农业大学 林学与园林学院,安徽 合肥 230036)
外源IAA和GA3对杨树应拉木形成的影响
刘凯,余敏,陈海燕,赵磊,刘盛全
(安徽农业大学 林学与园林学院,安徽 合肥 230036)
[摘要]【目的】 探索外源激素吲哚乙酸(IAA)和赤霉素(GA3)对杨树应拉木形成的影响,揭示杨树应拉木的形成机理。【方法】 以人工倾斜45°的当年生中林46杨枝条为试材,连续施加不同含量的IAA(0.01,0.10和1.00 mg/g)和GA3(0.10,1.00和10.00 mg/g)对枝条生长进行调控,分别观测不同处理下枝条的生长量、角度、偏心率、纤维形态、组织比量和胶质纤维比率,分析这2种外源激素对杨树应拉木形成的影响。【结果】 施加1.00 mg/g外源IAA抑制了纤维细胞的生长及胶质纤维和导管的形成,不仅枝条角度变大,而且枝条生长受到限制;施加1.00和 10.00 mg/g外源GA3可促进纤维细胞、胶质纤维的形成和枝条的生长,使枝条偏心率显著增大,且高含量GA3的作用效果更明显;0.01 mg/g IAA和0.10 mg/g GA3对枝条的作用效果基本一致,均促进了枝条横向疏导组织的形成,使其偏心率明显减小,但对倾斜枝条应拉木形成的作用并不明显。【结论】 IAA和GA3均能够影响杨树应拉木的形成,高含量的IAA明显抑制应拉木的形成,而高含量的GA3可明显促进应拉木的形成。
[关键词]杨树;应拉木;吲哚乙酸;赤霉酸
杨树是重要的速生商品材,其木材被广泛用于造纸、人造板和家具等行业。但杨木自身的一些缺陷限制了其利用范围和价值,应拉木便是其中之一。应拉木是木本双子叶植物在外力作用下产生的一种具有胶质纤维的特殊木材组织,它使倾斜树木的茎枝上侧增粗并出现一定程度的偏心。应拉木的存在使木材具有较大的生长应力和轴向干缩性,并最终导致了杨树木材制材时的夹锯、干燥时的变形、旋切单板时的表面起毛、造纸时的纸张力学性能降低等问题[1-3]。目前,对于应拉木形成的原因有许多不同的学说,其中以激素分布学说和生长应力学说较有影响力[4]。近年来,人们围绕着激素分布学说开展了大量的研究工作,该学说指出,应拉木是树干倾斜时,树干的内源激素由于重力的作用在上、下两个部位分布不均衡,从而引起树干上方细胞分裂速度加快、生长轮变宽和细胞结构特化而产生的。
研究表明,生长素和赤霉素对木本植物形成层的活动起促进作用[5-9]。在木本被子植物的应拉木形成中,茎上、下侧生长素的含量差可以诱导应拉木纤维细胞的分化[10]。Lepp等[11]和Lachaud[12]发现,弯曲或水平放置的柳树和山毛榉在形成应拉木时,生长素从应拉区移向对应区,另外倾斜的阔叶材树干上侧的生长素含量要比下侧低。通过采用生长抑制剂、生长素及其类似物进行大量的应拉木诱导试验,结果印证了在应拉木形成的上侧区域生长素含量降低这一假设[13-15]。但 Wareing等[16]对杨树和柳树以及 Hellgren 等[17]对杨树和松树枝条上下侧内源生长素的测定结果表明,枝条上、下侧內源生长素分布没有差异;Moyle等[18]发现,杨树在形成应拉木前后,生长素含量没有变化;前人在倾斜的七叶树枝条上侧施加植物生长调节剂[19]或生长抑制剂[9],对应拉木的形成进行研究,结果表明各处理均抑制了应拉木的形成。在木本植物中,赤霉素是一种形成层生长所必需的植物激素[20]。研究发现,内源和外源赤霉素都可能与茎的增粗有关[5,7-8,21-22]。施加赤霉素可以诱导垂枝樱桃的下垂枝条出现向上弯曲生长,并在枝条上侧形成应拉木[23-24]。此外,施加赤霉素的合成抑制物唏效唑则会抑制水平放置水曲柳的木材形成和向上回复生长,但与赤霉素同时施加则此效应变弱[25-27]。
综上可知,目前关于植物内源激素、外源生长调节剂对树木宏观生长和微观构造影响的研究较多,其对枝条角度和树木形成的调控是其中的研究热点,虽然国外已有不少学者开展了生长素和赤霉素调控应拉木形成的研究,但研究内容较为分散且结果存在差异,而国内相关研究起步较晚且少有开展。为了进一步探究生长素与赤霉素对杨树应拉木形成的影响及调控机理,本研究以中林46杨为试材,在杨树速生期(6-8月份,此时形成层细胞较为活跃,对外源激素刺激较为敏感)内,对倾斜45°的枝条连续施加不同含量的生长素和赤霉素来调控枝条的生长,分别观测枝条的生长量、角度、偏心率、纤维形态特征、组织比量、胶质纤维比率,并分析相应变化的差异,以期揭示这2种激素对杨树应拉木形成的影响,并为木材定向培育和材质改良提供科学依据。
1材料与方法
1.1试材的选取和预处理
试验地位于安徽农业大学农萃园内,从3棵长势良好且相近的6年生中林46杨上,选取48枝生长相对均一的当年生倾斜枝条作为试材,测量枝条长度和枝条中点处径粗,然后均分成8组并编号。在所选枝条中点及其上、下10 cm处做标记,将这段作为枝条角度观测段,然后用绳子调整枝条使其观测段与垂直方向的夹角(记作α)为45°。
1.2激素涂抹物的配制与施加
参照Aloni[21]的方法,将吲哚乙酸(IAA)和赤霉素(GA3)标品(Sigma,德国)分别与羊毛脂(光复精细化工研究所,中国)均匀混合,配制成一定含量的激素涂抹物。选择枝条生长顶端以下第4个节间的1 cm长茎段为激素施加位点,第1次施加激素时,用手术刀轻轻刮去枝条激素施加位点处茎段上侧的表皮(之后不再进行此操作),然后均匀施以对应的激素涂抹物,覆上一层封口膜后,再用锡箔纸包裹。2013-06-17进行第1次激素施加试验,此后每周同一时间重复施加激素1次,连续施加7次,于2013-07-29终止激素施加试验。每次施加激素前先测量枝条角度α,再分别施加相应激素,第8周试验结束时分别增测一次枝长、径粗和角度。试验分组及激素施加情况如表1所示。

表 1 外源IAA和GA3影响杨树应拉木形成试验分组及激素施加情况
1.3试样的采集与处理
在距激素施加位点上、下两端各1,3,6 cm处将枝条分割,并分别获取2 cm和3 cm 长的茎段,然后将2 cm长的茎段迅速放入FAA(V(福尔马林)∶V(冰醋酸)∶V(体积分数50%乙醇)=1∶1∶18)中固定,用于切片制作;3 cm长的茎段用于纤维形态特征观察;再由枝条初始中点处截取1 cm 长的茎段,用于枝条偏心率的测量。将所有试样分装并编号后,统一带回实验室。用于制备切片的茎段用水热法软化后,经轮转式切片机(KD1508A,中国)获取15 μm厚的横切面,用番红-固绿染色、中性树脂胶固封。用于纤维特征观察的茎段,经剥皮、气干并切分成细火柴杆状后,采用冰醋酸-双氧水(体积比为1∶1)离析,试验中每组均获取3个平行样。
1.4测量方法
枝条角度为枝条中点上下标记的两点所确定的直线与垂直方向的夹角,试验时用数显角度测量尺(Exploit,中国)进行测量,每枝条测量3次。使用高清体视数码显微镜(KEYENCE,日本)测量茎段髓心到木质部上侧边缘的最大偏心距(A)及其对应的长度(B),计算枝条偏心率(E):E=[(A-B)/(A+B)]×100%。使用显微成像系统(Nikon Eclipse E100,日本)测量纤维长度、宽度和壁厚。采用网格法测定木材组织比量,并在倾斜枝条上侧产生最大偏心距处获取相应的木质部图像。在ImageJ 1.43[28](National Institutes of Health,美国)软件中打开上述图像,在测得木质部产生最大偏心距处作一条线段,再以线段的中点为中心选取长1 mm、宽0.5 mm 的矩形区域,通过处理,分别获取选定区域中胶质纤维细胞壁所占面积比和细胞壁所占面积比,并计算出胶质纤维细胞壁占细胞壁的面积百分比,即胶质纤维比率。
1.5数据处理
采用SPSS 17.0 和DPS 7.55 软件对原始数据进行方差齐性检验后再进行分析,不同处理间差异显著性采用LSD 检验。
2结果与分析
2.1IAA和GA3对杨树枝条生长量的影响
由表2可知,与对照组CA和CB相比,Ia处理枝条长度和径粗的增长率变化不大,而Ib和Ic处理枝条长度和径粗的增长率均明显减小,其中Ic处理枝条长度和径粗的增长率分别比CA低8.35%和7.91%。GA3处理后,枝条长度和径粗均明显增大,且随着GA3含量的升高,枝条的生长量也随之增大,与CA相比,Gc处理枝长和径粗的增长率分别增加了68.01%和36.84%。据此可知,高含量的IAA抑制枝条的生长,而高含量的GA3则可促进枝条的生长。

表 2 不同含量IAA和GA3处理前后倾斜枝条生长量的变化
2.2IAA和GA3对杨树枝条角度的影响
如图1所示,试验期间CA与CB处理枝条角度均无明显差异;所有处理组的枝条最终角度均较初始角度大;试验开始后2~4周,枝条角度的变幅较大。由图1-A可知,Ia处理枝条角度变化趋势与对照组相似,枝条最终角度与对照组之间差异较小;而Ib处理枝条角度快速增大,增幅明显;Ic处理对枝条角度变化的影响不大,枝条角度变幅小且最终角度与对照组无明显差异;IAA处理后,枝条最终角度表现为Ib>Ia>Ic>CA>CB。图1-B显示,GA3处理枝条角度快速增大,且随着GA3含量的升高,枝条角度的变化也更加明显;GA3处理后,枝条最终角度表现为Gc>Gb>CA>CB>Ga。结果表明,IAA含量越高,枝条角度变化越小,其抑制枝条回复生长的作用越强; GA3含量越高,枝条角度变化越大,其促进枝条回复生长的作用越强。
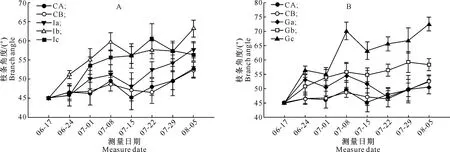
图 1不同含量IAA(A)和GA3(B)处理下杨树枝条角度随时间的变化
Fig.1Changes of branch angle of poplar over time under treatments of IAA and GA3with different contents
2.3IAA和GA3对杨树枝条偏心率的影响
由图2可以看出,施加外源激素后,所有枝条均出现不同程度的偏心,而且偏心率随施加激素含量的升高而增大;Ia、Ga处理枝条的偏心率极显著小于对照组(P<0.01),Ib、Ic处理对枝条偏心率的影响不明显,Gb、Gc处理枝条的偏心率极显著大于对照组(P<0.01)。结合图1可知,IAA处理枝条角度变化小,偏心率也小;GA3处理枝条角度变化大,其偏心率也明显变大。

图 2不同含量IAA和GA3处理
对杨树倾斜枝条偏心率的影响
与CA相比, **表示差异极显著(P<0.01)
Fig.2Effects of treatments of IAA and GA3with different
contents on the eccentricity of inclined poplar branch
Compared with CA, ** indicates significant difference (P<0.01) 2.4IAA和GA3对杨树枝条纤维形态特征的影响
激素施加位点上部枝条的纤维形态特征分析结果(表3)显示,对照组CA与CB间无显著差异;与对照相比,Ia和Ib处理对纤维形态特征的影响不显著,但Ic处理的纤维长度和宽度极显著小于其他处理组(P<0.01)。与CA相比,Ga处理对杨树枝条纤维形态影响不显著;Gb处理的纤维长度、宽度均变小,且与CA差异极显著(P<0.01),而纤维壁厚虽减小但与CA差异不显著;Gc处理对纤维形态特征的影响较大,纤维长度、宽度较CA极显著减小(P<0.01),但壁厚极显著增大(P<0.01)。
由激素施加位点下部枝条的纤维形态特征分析结果(表3)可知,对照组CA与CB间无显著差异;与CA相比,Ia处理对纤维宽度无显著影响,但使纤维长度显著减小(P<0.05),纤维壁厚显著增大(P<0.05);Ib处理对纤维形态特征的影响均不显著;Ic处理的纤维宽度和壁厚显著增大(P<0.05),而纤维长度极显著减小(P<0.01)。与对照CA处理相比,Ga处理对纤维宽度无显著影响,但使纤维长度显著减小(P<0.05),纤维壁厚显著增大(P<0.05);Gb处理的纤维宽度显著减小(P<0.05),而纤维长度和壁厚的变化不显著;Gc处理对杨树枝条纤维宽度和壁厚影响不显著,但使纤维长度显著减小(P<0.05)。综合可知,高含量IAA可抑制枝条纤维细胞的生长,尤其是伸长生长,导致枝条伸长生长受到抑制;高含量GA3作用后,枝条伸长生长加快,可以推测纤维细胞形成加速,致使纤维长度变短(表2和表3)。

表 3 不同含量IAA和GA3施加位点上、下部杨树枝条试样的纤维形态特征
注:同列数据后标不同小写字母表示差异显著(P<0.05),标不同大写字母表示差异极显著(P<0.01)。下同。
Note:Different lowercase letters in each column indicate significant differences (P<0.05) while different capital letters indicate extremely significant difference (P<0.01). The same below.
2.5IAA和GA3对杨树枝条组织比量的影响
对IAA、GA3施加位点上部枝条的分析结果(图3)表明,CA与CB对照组间组织比量无显著差异;与CA对照组相比,经不同含量IAA、GA3处理后,导管比量均下降,木射线比量均上升。与CA相比,IAA对纤维比量作用不明显;Ia和Ic处理均使导管比量极显著降低(P<0.01),木射线比量极显著升高(P<0.01)。Ga、Gb和Gc处理的导管比量均极显著小于CA(P<0.01);GA3含量越高,纤维比量越大,木射线比量越小,Gb和Gc处理均使纤维比量极显著大于CA。
施加IAA、GA3位点下部枝条的测量结果(图3)表明,IAA处理对纤维比量没有显著影响;Ia、Ic处理的枝条导管比量极显著低于CA(P<0.01),Ib处理的导管比量显著高于CA(P<0.05);Ia、Ib处理的木射线比量与CA差异不显著,而Ic处理木射线比量极显著高于CA(P<0.01)。Ga和Gb处理对枝条组织比量无显著影响;而Gc处理则使纤维比量极显著高于CA(P<0.01),导管和木射线比量均极显著低于CA(P<0.01)。

图 3不同含量的IAA和GA3对杨树倾斜枝条组织比量的影响
与CA相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)
Fig.3Effects of treatments of IAA and GA3with different contents on tissue proportion of inclined poplar branch
Compared with CA,* indicates significant difference (P<0.05),and ** indicates extremely significant difference (P<0.01)
2.6IAA和GA3对杨树倾斜枝条胶质纤维比率的影响
施加IAA、GA3位点上部杨树枝条胶质纤维比率分析结果(表4)表明,CA与CB对照组之间的胶质纤维比率无显著差异。与CA相比,Ia处理对胶质纤维比率无显著影响,Ib和Ic处理胶质纤维比率分别下降了19.8%和23.1%,差异极显著(P<0.01);Ga处理对胶质纤维比率的影响也不明显,而Gb和Gc处理使胶质纤维比率分别极显著提高了11.4%和23.4%(P<0.01)。
施加IAA、GA3位点下部枝条胶质纤维比率分析结果(表4)显示,CA与CB对照组之间的胶质纤维比率无显著差异。与CA相比,Ia处理对胶质纤维比率无显著影响,Ib处理胶质纤维比率极显著下降了10%(P<0.01),Ic处理胶质纤维比率显著下降了6%(P<0.05);Ga处理对胶质纤维比率的影响不明显,Gb处理胶质纤维比率显著提高了6.9%(P<0.05),Gc处理胶质纤维比率极显著提高了25.8%(P<0.01)。据此可知,高含量IAA抑制了胶质纤维的形成,而高含量GA3促进了胶质纤维的产生。

表 4 不同含量IAA和GA3处理后施加位点上、下部杨树枝条的胶质纤维比率
3讨论与结论
激素假说指出,主枝顶端产生的生长素向下运输(极性运输),会抑制侧枝的生长[29],而当树干受伤时,生长素的极性运输就会被中断,引起生长素沿水平方向扩散[30]。顶芽是产生IAA最主要的部位,当施加高含量IAA时,激素施加位点上方生长素运输受阻,使生长素含量增高,产生抑制作用,这是本研究0.10和1.00 mg/g IAA使杨树枝长和径粗增长率变小,尤其高含量IAA显著抑制了枝条纤维细胞伸长生长的原因。有研究表明,在水平放置的美国红枫幼苗上侧,沿轴向施加IAA、NAA或2,4-D会抑制幼苗的向上弯曲生长[31]。同样,本研究中IAA处理使枝条角度变大,向上弯曲生长受到抑制。异速生长会引起枝条弯曲,偏心率增大,而0.10和1.00 mg/g IAA处理后,枝条偏心率与对照组无显著差异,这可能与枝条生长受到抑制有关。Jourez等[32]研究发现,幼龄杨树应拉木的导管频率降低,木射线的数目增多。IAA处理对枝条纤维比量无显著影响;0.01 mg/g IAA处理使枝条导管比量下降,木射线比量升高,对枝条生长、纤维形态特征和胶质纤维比率的作用不显著,却导致枝条偏心率明显减小,这表明低含量IAA能够促进枝条横向疏导组织的形成,利于其横向生长,且对应拉木的形成作用不显著;0.10 mg/g IAA处理对枝条组织比量作用不明显,但胶质纤维比率显著降低,由此可以推知0.10 mg/g IAA对枝条应拉木的形成有抑制作用;1.00 mg/g IAA处理后,木射线比量显著升高,而导管比量和胶质纤维比率明显下降,表明枝条应拉木的形成受到抑制,这与前人的研究结果[31]一致。
GA3合成增加能够促进枝条的生长,尤其是伸长生长[33]。GA3在植物体内的运输无极性,且能够促进IAA的运输,使施加位点上方建立新的激素平衡体系,促进茎的伸长增长,所以当施加的GA3含量越高时,其对枝条生长的促进作用越明显。本研究中,1.00和10.00 mg/g GA3使杨树枝长和径粗增长率变大,但10 mg/g GA3使纤维长度明显变短,这是因为GA3能够促进纤维产量的增加[33],高含量GA3会促进纤维细胞的分化,大量新形成的厚壁纤维细胞引起了纤维长度和宽度减小。GA3能够诱导垂枝樱桃枝条从髓心附近便开始形成应拉木,并抑制枝条的下垂,表明枝条生长初期便产生了较大的轴向生长拉力,而正是由于连续拉力的存在,使枝条向上弯曲[34-35]。在本研究中,1.00和10.00 mg/g GA3处理后,杨树枝条与竖直方向的最终夹角均变大,这可能是因为木本植物有特定的成枝模式,在顶端优势的作用下,侧枝往往比主枝小,而且与竖直方向有较大的夹角[36]。此外,对比本试验和Nugroho等[37]的研究结果发现,生长顶端回复生长比基部快且明显,GA3处理使枝条产生较大增量,在重力影响下使枝条出现向地生长。偏心是应拉木的典型特征之一。本研究中,0.10 mg/g GA3处理使杨树枝条偏心率极显著下降且导管比率明显下降、木射线比率显著升高,而对枝条纤维形态特征、胶质纤维比率作用不显著,说明低含量GA3对应拉木的形成作用不显著,这与低含量IAA的作用结果相似。Wardrop[38]曾指出,因生长速率的增加而使木材偏心率变大,则应拉木的纤维会变短。本研究1.00和10.00 mg/g GA3则均使枝条偏心率极显著增大、枝条生长加速并使胶质纤维比率提高,而纤维长度减小。此外,本研究发现较高含量GA3处理后,纤维比量显著升高,尤其高含量GA3使施加位点上部枝条纤维壁厚明显增加,表明较高含量GA3会促进枝条应拉木的形成,这与前人的研究结果[34-35]一致。
有研究表明,IAA和GA3是调控应拉木形成和胶质纤维产量必不可少的物质[9,37]。本研究发现,1.00 mg/g IAA使纤维长和直径、导管比率和胶质纤维比率显著变小,说明高含量的IAA抑制了纤维细胞的生长及胶质纤维和导管的形成,进而使枝条向地弯曲并限制了枝条的生长。而10.00 mg/g GA3使杨树枝条长度、偏心率、纤维比率和胶质纤维比率均显著增大,表明高含量GA3促进了纤维细胞、胶质纤维的形成和枝条的生长。因此,IAA和GA3都能够影响杨树应拉木的形成,高含量的IAA明显抑制了应拉木的形成,而高含量的GA3则明显促进应拉木的形成。
[参考文献]
[1]Vazquez-Cooz I,Meyer R W.Cutting forces for tension and normal wood of maple [J].Forest Poducts Journal,2006,56(4):26-34.
[2]Dadswell H E,Wardrop A B.The structure and properties of tension wood [J].Holzforschung,1955,9(4):97-104.
[3]Parham R A,Robinson K W,Isebrands J G.Effects of tension wood on kraft paper from a short-rotation hardwood (Populous“TristisNo.1”) [J].Wood Science and Technology,1977,11(4):291-303.
[4]Timell T E.Compression wood in gymnosperms [M].Berlin Heidelberg:Springer-Verlag,1986.
[5]Little C H A,Savidge R A.The role of plant growth regulators in forest tree cambial growth [J].Plant Growth Regulation,1987,6(1/2):137-169.
[6]Pharis R P,Little C H A.Hormonal control of radial and longitudinal growth in the tree stem [M].San Diego:Academic Press,1995.
[7]Aloni R.Wood formation in deciduous hardwood trees [M].New York:John Wiley & Sons,1991.
[8]Wang Q,Little C H A,Odén P C.Effect of laterally applied gibberellin A4/7 on cambial growth and the level of indole-3-acetic acid in Pinus sylvestris shoots [J].Physiologia Plantarum,1995,95(2):187-194.
[9]Du S,Uno H,Yamamoto F.Roles of auxin and gibberellin in gravity-induced tension wood formation in Aesculus turbinata seedlings [J].IAWA Journal,2004,25(3):337-347.
[10]江莎,中村辉子,山本福寿.赤霉素对水平放置水曲柳幼苗的负向重性和木材形成的影响 [J].云南植物研究,2003,25(3):336-346.
Jiang S,Nakamura T,Yamamoto F.Effects of applied gibberellins on negative gravitropism and wood formation in horizontally-positionedFraxinusmandshuricaseedlings [J].Acta Botanica Yunnanica,2003,25(3):336-346.(in Chinese)
[11]Lepp N W,Peel A J.Distribution of growth regulators and sugars by the tangential and radial transport systems of stem segments of willow [J].Planta,1971,99(4):275-282.
[12]Lachaud S.Xylogénèse chez les Dicotylédones arborescentes:Ⅴ.Formation du bois de tension et transport de l’acide indole acétique tritié chez le Hêtre [J].Canadian Journal of Botany,1987,65(6):1253-1258.
[13]Cronshaw J,Morey P R.Developmental changes in the secondary xylem of Acer rubrum induced by gibberellic acid,various auxins and 2,3,5-tri-iodobenzoic acid [J].Protoplasma,1968,65(3):315-326.
[14]Casperson G.Über endogene faktoren der reaktionsholzbildu-ng [J].Planta,1965,64(3):225-240.
[15]Casperson G.Wirkung von Wuchs-und Hemmstoffen auf die Kambiumtätigkeit und Reaktionsholzbildung [J].Physiologia Plantarum,1968,21(6):1312-1321.
[16]Wareing P F,Hanney C E A,Digby J.The role of endogenous hormones in cambial activity and xylem differentiation [M].New York:Academic Press,1964.
[17]Hellgren J M,Olofsson K,Sundberg B.Patterns of auxin distribution during gravitational induction of reaction wood in popular and pine [J].Plant Physiology,2004,135(1):212-220.
[18]Moyle R,Schrader J,Stenberg A,et al.Environmental and auxin regulation of wood formation involves members of theAux/IAAgene family in hybrid aspen [J].The Plant Journal,2002,31(6):675-685.
[19]Phelps J E,McGinnes E A,Pieniazek J,et al.A scanning electron microscope study of the structure of normal,tension and morphactin IT 3456 induced wood inAesculushippocastanum[J].Bull Acad Polon Sci,1975,23:495-497.
[20]Du S,Yamamoto F.An overview of the biology of reaction wood formation [J].Journal of Integrative Plant Biology,2007,49(2):131-143.
[21]Aloni R.Role of auxin and gibberellin in differentiation of primary phloem fibres [J].Plant Physiology,1979,63(4):609-614.
[22]Aloni R.Differentiation of vascular tissues [J].Annual Review of Plant Physiology,1987,38(1):179-204.
[23]Nakamura T,Saotome M,Ishiguro Y,et al.The effects of GA3on weeping of growing shoots of the Japanese cherry,Prunusspachiana[J].Plant and Cell Physiology,1994,35(3):523-527.
[24]Nakamura T,Saotome M,Tanaka H.Weeping habit and gibberellin inPrunus[J].Plant Bioregulators in Horticulture,1994,394:273-280.
[25]Jiang S,Furukawa I,Yamamoto F,et al.Efects of applied gibberellins and uniconazole-P on gravitropism and xylem formation in horizontally-positionedFraxinusmandshuricaseedlings [J].Journal of Wood Science,1998,44:385-391.
[26]Jiang S,Yamamoto F,Honnma T,et al.Regulation by uniconazole-P and gibberellins of morphological and anatomical responses ofFraxinusmandshuricaseedlings to gravity [J].IAWA Journal,1998,19(3):311-320.
[27]Jiang S,Li Y F,Chen X H,et al.Control of negative gravitropism and tension wood formation by gibberellic acid and indole acetic acid inFraxinusmandshuricaRupr.var.japonica Maxim seedlings [J].Journal of Integrative Plant Biology,2006,48(2):161-168.
[28]Hiraiwa T,Toyoizumi T,Ishiguri F,et al.Characteristics of Trochodendron aralioides tension wood formed at different inclination angles [J].IAWA Journal,2013,34(3):273-284.
[29]Thimann K V.Hormone action in the whole life of plants [M].Anherst,Massachusetts,USA:University of Massachusetts Press,1977.
[30]沈惠娟.植物激素与木材形成 [J].林业科学,1996,32(2):165-170.
Shen H J.Plant hormone and wood formation [J].Scientia Silvae Sinicae,1996,32(2):165-170.(in Chinese)
[31]Cronshaw J,Morey P R.The effect of plant growth substances on the development of tension wood in horizontally inclined stems ofAcerrubrumseedlings [J].Protoplasma,1968,65(4):379-391.
[32]Jourez B,Riboux A,Leclercq A.Anatomical characteristics of tension wood and opposite wood in young inclined stems of poplar(PopuluseuramericanaCV ‘ghoy’) [J].IAWA Journal,2001,22(2):133-157.
[33]Eriksson M E,Israelsson M,Olsson O,et al.Increased gibberellin biosynthesis in transgenic trees promotes growth,biomass production and xylem fiber length [J].Nature Biotechnology,2000,18(7):784-788.
[34]Baba K,Adachi K,Take T,et al.Induction of tension wood in GA3-treated branches of the weeping type of Japanese cherry,Prunusspachiana[J].Plant Cell Physiology,1995,36(6):983-988.
[35]Yoshida M,Nakamura T,Yamamoto H,et al.Negative gravitropism and growth stress in GA3-treated branches ofPrunusspachianaKitamura f.spachianacv.Plenarosea[J].Journal of Wood Science,1999,45(5):368-372.
[36]Wilson B F.Apical control of branch growth and angle in woody plant [J].American Journal Botany,2000,87(5):601-607.
[37]Nugroho W D,Yamagishi Y,Nakaba S,et al.Gibberellin is required for the formation of tension wood and stem gravitropism inAcaciamangiumseedlings [J].Annals of Botany,2012,110:887-895.
[38]Wardrop A B.The nature of reaction wood:Ⅴ.The distribution and formation of tension wood in some species ofEucalyptus[J].Australian Journal of Botany,1956,4(2):152-166.
Effects of exogenous IAA and GA3on tension wood formation of poplar
LIU Kai,YU Min,CHEN Hai-yan,ZHAO Lei,LIU Sheng-quan
(SchoolofForestryandLandscapeArchitecture,AnhuiAgriculturalUniversity,Hefei,Anhui230036,China)
Abstract:【Objective】 The effect of exogenous indole-3-acid (IAA) and gibberellic acid (GA3) on tension wood formation of poplar was explored to reveal the tension wood formation mechanism. 【Method】 The current branches artificially inclined at angle of 45°of poplar Zhonglin-46 were selected and IAA and GA3 with different contents were continuously applied to regulate the growth of branches.The differences and changes in growth,angle,eccentricity,fiber morphology,tissue proportion,and gelatinous fiber ratio of poplar branch were observed and analyzed for unveiling the effects of these two exogenous hormones on tension wood formation of poplar.【Result】 The growth of fiber cells and formation of gelatinous fibers and vessels were inhibited by applying exogenous IAA with content of 1.00 mg/g.Branch angles were also increased and the growth of shoots was limited.The formation of fiber cells,gelatinous fibers and growth of branches were promoted by applying GA3 with the content of 1.00 and 10.00 mg/g,and the branch eccentricities also increased significantly.The higher the content of GA3,the more significant the effect was.The effects of low contents of IAA (0.01 mg/g) and GA3 (0.10 mg/g) on the branches were similar.They both contributed to the formation of lateral leading organization of the branches so that their eccentricities were significantly reduced.However,the effect on tension wood formation of the sloping branches was not significant.【Conclusion】 The formation of tension wood of poplar was significantly inhibited by IAA with high content,while it was significantly promoted by GA3 with high content.
Key words:poplar;tension wood;indole-3-acetic acid;gibberellic acid
DOI:网络出版时间:2016-02-0209:3710.13207/j.cnki.jnwafu.2016.03.018
[收稿日期]2014-08-05
[基金项目]国家自然科学基金面上项目(31270598)
[作者简介]刘凯(1988-),男,安徽亳州人,硕士,主要从事外源激素对应力木形成的调控机理研究。E-mail:liukai16881@163.com[通信作者]刘盛全(1967-),男,安徽合肥人,教授,博士,博士生导师,主要从事木材科学与技术研究。E-mail:liusq@ahau.edu.cn
[中图分类号]S781
[文献标志码]A
[文章编号]1671-9387(2016)03-0125-08
