湖南洞庭湖区12株H9N2亚型AIV全基因序列的进化分析
2016-06-15黄建龙王昌建张朝阳何世成朱春霞汪洪冰邓国华刘道新
黄建龙,谭 丹,,王昌建,张朝阳,何世成,朱春霞,汪洪冰,邓国华,刘道新
(1 湖南省动物疫病预防控制中心, 湖南 长沙 410014;2 中国农业科学院 哈尔滨兽医研究所农业部动物流感重点开放实验室/兽医生物技术国家重点实验室,黑龙江 哈尔滨150001)
湖南洞庭湖区12株H9N2亚型AIV全基因序列的进化分析
黄建龙1,谭丹1,2,王昌建1,张朝阳1,何世成1,朱春霞1,汪洪冰1,邓国华2,刘道新1
(1 湖南省动物疫病预防控制中心, 湖南 长沙 410014;2 中国农业科学院 哈尔滨兽医研究所农业部动物流感重点开放实验室/兽医生物技术国家重点实验室,黑龙江 哈尔滨150001)
[摘要]【目的】 从分子生物学角度了解H9N2亚型禽流感病毒在湖南省洞庭湖区的变异特点和进化规律。【方法】 对近年来洞庭湖区分离的12株H9N2亚型禽流感毒株的全基因进行分段克隆测序,应用Mega 5软件包对病毒基因进行多序列比对和进化树的绘制与分析。【结果】 12株H9N2亚型禽流感毒株HA裂解位点均没有多个连续的碱性氨基酸插入,属于低致病性病毒。12株H9N2亚型禽流感病毒HA、NA基因进化比较同步,均处于DK/HK/Y280/97分支,而6个内部基因(M、PB2、PB1、PA、NA、NS)与高致病性禽流感H5亚型毒株呈现不同程度重组现象,且与H7N9亚型毒株基因的核苷酸同源性很高,很有可能为其提供内部基因。【结论】 湖南省洞庭湖地区H9亚型禽流感病毒的遗传演化较为复杂,存在广泛的基因重组现象。
[关键词]H9N2亚型禽流感;遗传进化; 洞庭湖区;湖南省
禽流感病毒(Avian influenza virus,AIV)为负链单股RNA病毒,由8个基因片段组成,按照片段长度由大到小依次为PB2、PB1、PA、HA、NP、NA、M、NS基因。AIV感染的宿主范围、组织亲嗜性、致病力与HA的受体特异性、NA的唾液酸酶活性等密切相关,其内部基因某些特殊性位点的突变对AIV宿主范围、毒力及耐药性等也有一定的影响。有研究认为,我国H9亚型AIV多数带有易于结合哺乳动物受体的突变[1-2],有专家预测H9N2亚型AIV基因相对频繁的变异,使其可能成为毒力较强的毒株,成为下次流感大流行的亚型[3]。
自从1994年陈伯伦等[4]首次在中国从临床病鸡体内分离到H9N2亚型禽流感毒株以来,H9N2亚型禽流感在我国的流行和传播呈上升趋势,对养殖业造成了很大的危害[5-10]。禽流感病毒基因的频繁变异给禽流感的防控带来非常大的难度,本研究对近年来从湖南省洞庭湖区活禽市场及鸭场的正常监测样品中分离的12株H9N2亚型禽流感毒株进行全基因遗传进化分析,旨在从分子生物学角度了解H9N2亚型AIV在湖南省洞庭湖区的变异特点和进化规律,为该地区H9N2亚型禽流感的防控提供理论依据,从而有效预防和控制禽流感,保护人体健康和公共卫生安全。
1材料与方法
1.1材料
1.1.1主要试剂TaqDNA聚合酶、dNTPs和分子量Marker均购自宝生物工程(大连)有限公司,反转录酶、LS TRIzol RNA 提取试剂购自Invitrogen公司,胶回收试剂盒购自OMEGA生物工程公司,BigDye Terminator测序试剂盒3.1version 购自ABI公司。
1.1.2主要仪器包括台式离心机(Beckman X-22R)、高速离心机(Eppendorf 5242)、PCR仪(TaKaRa TP600)、可见分光光度计(NanoDrop ND-1000)、紫外投射仪(GL-3120)、凝胶成像系统(GBOXHR)和测序仪(ABI 3500XL)。
1.1.3毒株12株H9N2亚型AIV均分离自湖南省洞庭湖区活禽市场及鸭场的正常监测样品,由哈尔滨兽医研究所国家禽流感参考实验室分离保存,经HA-HI和RT-PCR试验鉴定为H9N2亚型AIV,具体毒株名称见表1。

表 1 湖南洞庭湖区H9N2亚型禽流感病毒分离株
1.1. 4鸡胚9~11日龄SPF鸡胚购自哈尔滨兽医研究所动物实验动物中心。
1.2AIV的增殖
将供试AIV按104~109稀释梯度接种10日龄SPF鸡胚,48 h后取有血凝价(HA-HI试验)且病毒稀释度最高的鸡胚尿囊液作为下一次纯化种毒,如此纯化3次后,以最适合的稀释度接种9~11日龄SPF鸡胚,48 h后收取鸡胚尿囊液,经过HA-HI试验验证及无菌检测后分装,-70 ℃保存备用。
1.3AIV各基因片段的扩增
采用RT-PCR方法扩增12株湖南洞庭湖区H9N2亚型禽流感病毒分离株的PB2、PB1、PA、HA、NP、NA、M、NS基因片段。反转录引物序列为:5′-AGCAAAAGCAGG-3′, 所有扩增引物根据GenBank中H9N2亚型AIV基因片段序列,选择同源性最高的区域,由国家禽流感参考实验室设计。引物由博士生物公司合成。
1.4AIV基因组序列的测定
紫外透射仪测定PCR产物的浓度并按测序要求计算所需DNA量, PCR反应结束后加入2.0 μL终止液。测序反应产物在终止反应后加入体积分数95%冰乙醇60 μL,混匀,于-20 ℃放置 15 min后, 4 ℃下12 000 r/min离心20 min,小心弃去上清液,加70 μL体积分数70%冰乙醇, 4 ℃下 12 000 r/min离心10 min洗脱残留的盐,之后再重复操作一次,将沉淀倒于纸上于室温下晾干,加入15 μL甲酰胺,使DNA沉淀充分溶解,最后全部加入测序板内,并进行高温变性,采用测序仪进行测序。
1.5AIV各基因序列的获得及基因同源性和进化树分析
采用DNAStar软件中Seqman程序对AIV各个基因片段的原始序列进行拼接,采用MegAlign程序对各个基因片段进行核苷酸以及氨基酸的同源性比较;应用Mega 5软件包对AIV各个基因进行多序列比对和进化树的绘制。
2结果与分析
2.1AIVHA基因编码氨基酸序列及遗传进化分析
在洞庭湖区分离的12株H9N2亚型AIV的HA全长为1 683 bp,编码560个氨基酸,分为HA1和HA2片段。由表2可知,除毒株CK/HuN/591/11HA基因的裂解位点为PARSSR/GLF外,其余毒株的HA基因的裂解位点为PSRSSR/GLF,均无多个连续的碱性氨基酸插入。氨基酸序列分析表明,HA1上共有6个糖基化位点,分别是29(NST)、141(NVS)、218(NRT)、299(NTT)、305(NVS)、313(NCS),HA2上有2个潜在的糖基化位点,分别是492(NGT)、551(NGS),其中CK/HuN/591/11毒株313(NCS)位点发生了氨基酸的突变为313(NCP),导致该潜在的糖基化位点缺失,有5株毒株增加了一个糖基化位点218(NRT)。12株AIV受体结合位点均有2个位点发生突变,分别是198位点由V突变为A,234位点由Q突变为L(表2)。
12株AIV的HA基因核苷酸同源性在87.8%~99.9%。有研究学者将H9亚型毒株划为3个群系,分别是CK/BJ/1/94(DK/HK/Y280/97)、CK/HK/G9/97、QA/HK/G1/97。本研究的12株AIV均属于DK/HK/Y280/97分支,与其核苷酸同源性在91.3%~92.0%,处于该分支的还有浙江、安徽、广东及广西分离的H9N2亚型AIV(图1)。从进化树可以看出,分离的H9亚型AIV进化比较同步,说明属于DK/HK/Y280/97分支的禽流感病毒一直在我国南方地区流行。
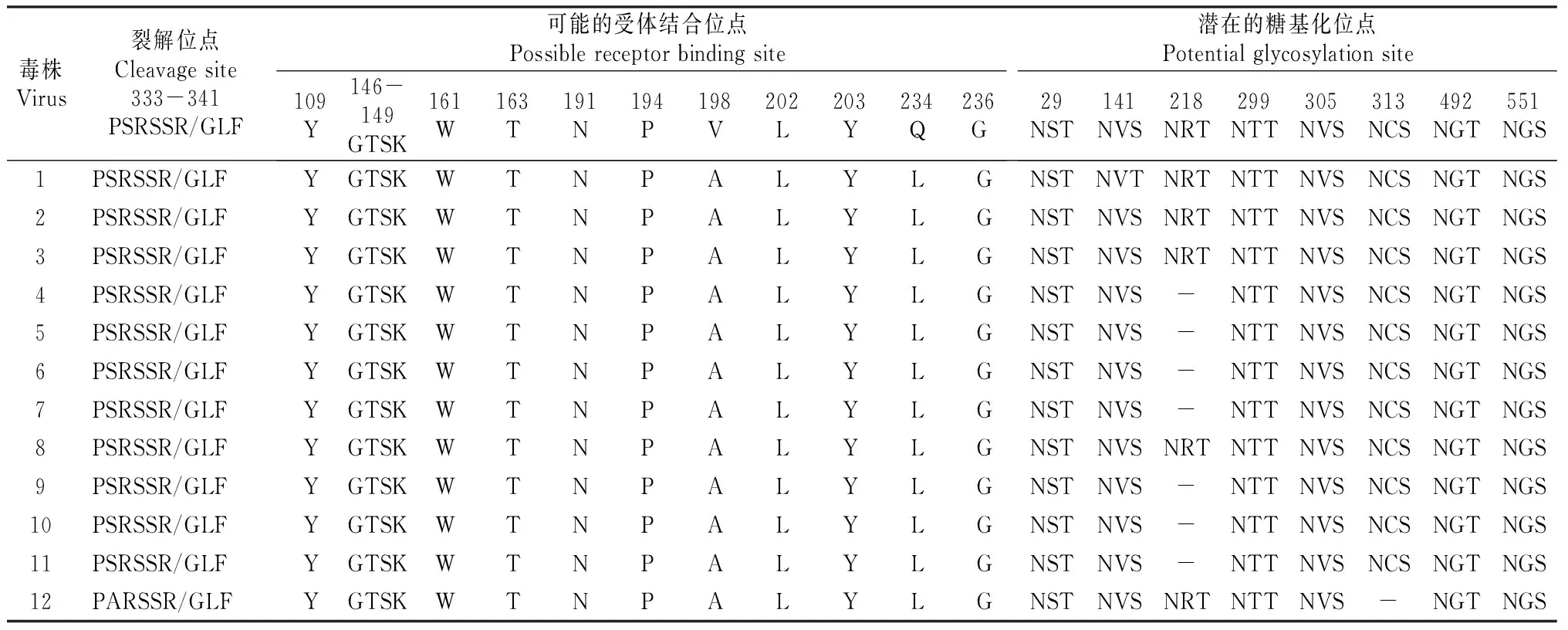
表 2 湖南洞庭湖区H9N2亚型禽流感病毒HA基因特征位点氨基酸序列分析
备注:毒株1~12的名称同表1,“-”表示缺失。下表同。
Note:The strain names from 1 to 12 corresponded to Table 1,“-” indicates missing.The same below.
2.2AIVNA基因编码氨基酸序列及遗传进化分析
由表3可知,对供试的12株H9N2亚型禽流感病毒NA基因进行氨基酸序列分析发现,所有的H9N2亚型毒株NA蛋白颈部均有63-65位的缺失,对应其潜在糖基化位点61(NIT)消失,具体的糖基化位点及可能的HB受体结合位点存在一定突变。

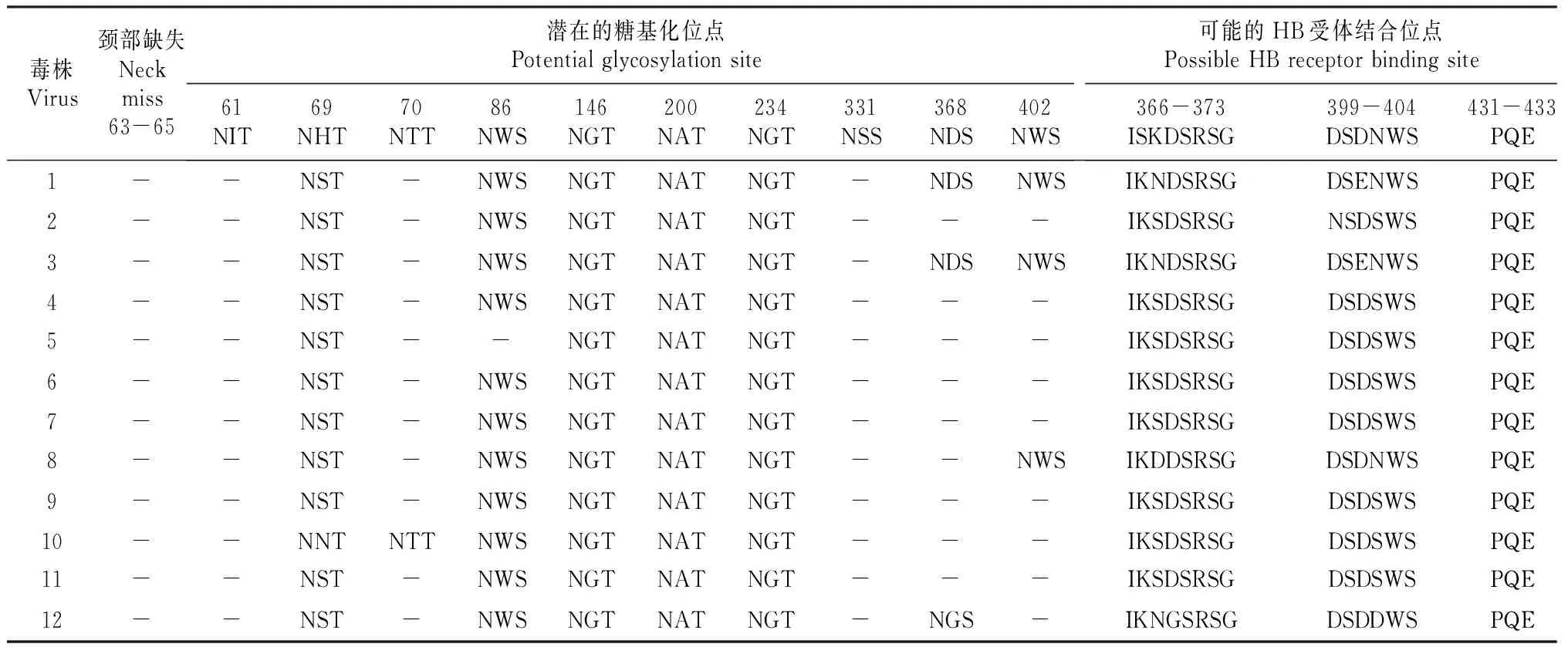
图 1 湖南洞庭湖区H9N2亚型禽流感病毒的HA基因进化树
本研究还发现,供试的12株病毒NA基因核苷酸同源性在92.7%~99.9%,与近期在浙江、广东、山东等地分离到的H9N2亚型AIV毒株集中于同一分支上,属于DK/HK/Y280/97(图2)。
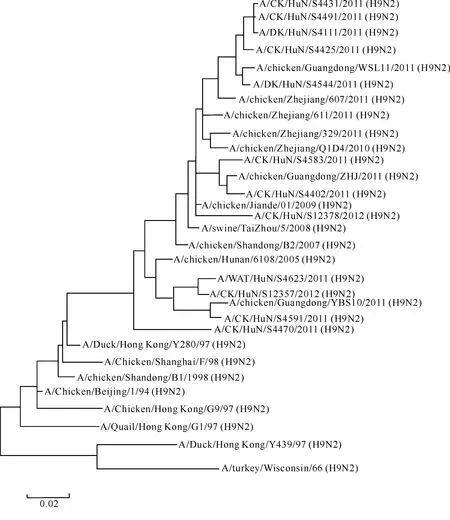
图 2湖南洞庭湖区H9N2亚型禽流感病毒的NA基因进化树
Fig.2Phylogenetic tree of H9N2 subtype AIVNAgene from Dongting Lake region,Hunan
2.3AIV内部基因序列特殊氨基酸位点分析及遗传进化分析
2.3.1M基因本研究中,12株H9N2亚型禽流感病毒的M基因均包含2个阅读框架(M1 和M2),在M2基因编码的氨基酸中,与病毒抗药性相关的氨基酸位点27(V)、30(A)及 31(S)有些发生了突变。对M基因的遗传进化分析结果(图3)显示,有些H5、H7亚型毒株与供试的H9N2亚型毒株处在同一分支中,说明H5、H7、H9亚型毒株之间可能存在M基因的交换。
从图3可以看出,M基因进化树可以分为2大分支,第1分支中有同期在湖南家禽中分离的H5N1亚型毒株及2013年在上海、江苏、杭州等沿海地区分离的H7N9亚型毒株,分离的10株H9N2亚型毒株处于该分支,与其他毒株的核苷酸同源性为97.7%~99.1%,说明它们之间可能存在着基因的重组;第2分支仅有3株毒株,其中同时从环境中分离的H9N2、H5N1毒株之间核苷酸同源性为98.9%,可能它们来源于共同的祖先。
2.3.2PB2 基因序列分析表明,供试12株AIVPB2基因核苷酸同源性在97.2%~99.9%,氨基酸同源性在97.6%~99.9%。 从进化树(图4)可以看出,不同亚型毒株的PB2基因分别处于不同的小分支,但它们的核苷酸同源性比较高,同时可以看出分离的这些H9N2亚型毒株较引起人感染的H7亚型禽流感毒株PB2基因进化更原始些,这也证实了致人发病的H7N9亚型禽流感毒株的PB2基因均由H9亚型毒株提供。
2.3.3PB1基因序列分析表明,供试12株AIVPB1 基因毒株核苷酸同源性在95.3%~100%,氨基酸同源性在97.8%~100%。从图5可以看出,在各分支中分散有H9N2、H5N1、H7亚型毒株,说明H5、H9、H7亚型毒株之间发生了PB1基因的重组。

图 3湖南洞庭湖区H9N2亚型禽流感病毒的M基因进化树
Fig.3Phylogenetic tree of H9N2 subtype AIVMgene from Dongting Lake region,Hunan
2.3.4PA基因序列分析表明,供试12株AIVPA基因核苷酸同源性在95.7%~100%,氨基酸同源性在95.8%~100%。从图6可以看出,在供试12株H9N2亚型AIV毒株中,有2株H5N1亚型毒株散在于其中,说明可能H9亚型毒株为H5N1亚型毒株提供了PA基因。
2.3.5NP基因12株AIV毒株NP基因核苷酸同源性在95.7%~100%,氨基酸同源性在95.8%~99.9%。由图7可知,有H5N1、H7N9亚型毒株与供试的毒株处于同一分支,表明H5N1、H7N9亚型毒株的NP基因可能是由H9亚型毒株提供的。
2.3.6NS基因12株AIV毒株NS基因核苷酸同源性在95.7%~100%,氨基酸同源性在95.8%~99.9%。由图8可知,分离的H5N1、H7N9亚型毒株与H9亚型毒株处于同一分支,说明这些毒株之间发生了NS基因的交换或重组。
3讨论
HA是病毒毒力和宿主特异性的主要决定因素[11],大多数高致病力毒株的HA在其裂解位点附近有多个碱性氨基酸插入,在无类胰蛋白酶的情况下就能发生裂解,造成感染禽全身系统衰竭,导致死亡。分离的12株H9N2亚型毒株中,除毒株CK/HuN/591/11HA基因的裂解位点为PARSSR/GLF,其余毒株HA的裂解位点为PSRSSR/GLF,均没有多个连续的碱性氨基酸插入,属于低致病性病毒。有研究表明,HA基因226位及228位受体结合位点决定宿主特异性的关键性位点[12-13],如第226位氨基酸残基为Gln,则具有SAa-2,3Gal受体结合特异性;若为Leu,则具有SAa-2,6Gal受体结合特异性;如果第226位氨基酸残基为Met,则同时具有对SAa-2,3Gal和SAa-2,6Gal的结合能力。本研究中,12株AIV毒株受体结合位点中的234位点由Q突变为L,说明其易于结合哺乳动物,这与桑晓宇等[2]的研究结果相似。所有12株H9N2亚型毒株M2基因编码的氨基酸位点中的31位由S替换为N,产生了抗金刚烷胺类药物的耐药性,可能是这些毒株长期在自然界进化过程中,在家禽体内长期受到药物的刺激而产生了耐药性。
本研究分离的12株H9N2亚型毒株进化比较同步,处于 DK/HK/Y280/97分支,与现有我国南方地区流行的毒株相一致[14]。从本研究供试的AIV 6个内部基因进化树可以看出,供试毒株与H5、H9亚型毒株处于同一分支,它们之间可能存在着基因的重组,尤其是此次流行的人感染H7N9亚型禽流感毒株内部基因与本研究分离的H9亚型毒株核苷酸同源性很高;同时研究结果也证明,引起H7N9亚型禽流感感染人的毒株内部基因全来自于H9亚型毒株[15],因此应该加强对H9亚型禽流感的监测,关注H9亚型的遗传进化情况。
总之,湖南省H9亚型禽流感病毒的遗传演化较为复杂,存在广泛的基因重排现象,必须提高对其危害性的认识,在防控工作上对其要有足够的重视,才能有效地防止禽流感疫情的发生。

图 4 湖南洞庭湖区H9N2亚型禽流感病毒的PB2基因进化树
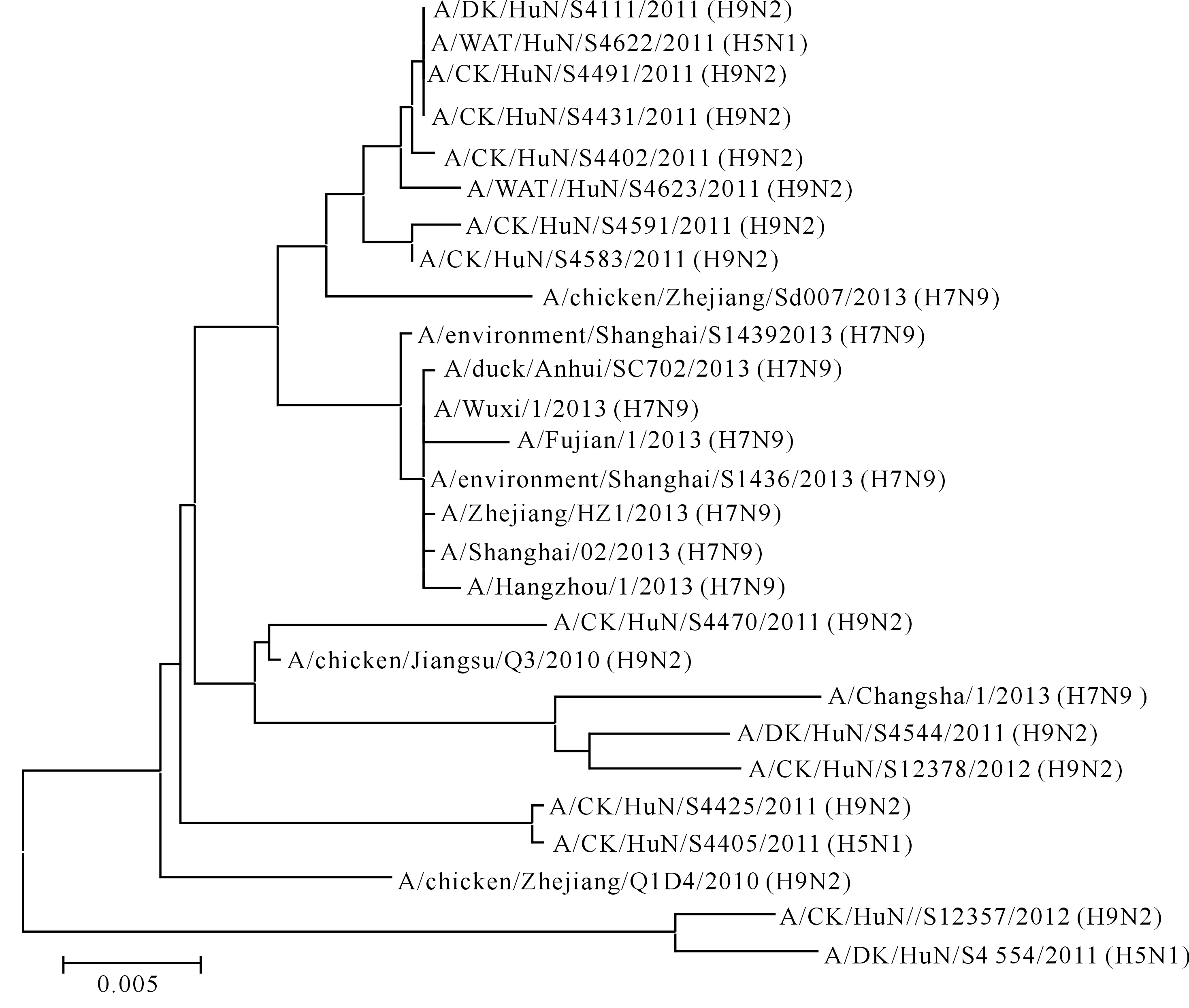
图 5 湖南洞庭湖区H9N2亚型禽流感病毒的PB1基因进化树

图 6湖南洞庭湖区H9N2亚型禽流感病毒的PA基因进化树
Fig.6Phylogenetic tree of H9N2 subtype AIVPAgene from Dongting Lake region,Hunan

图 7 湖南洞庭湖区H9N2亚型禽流感病毒的NP基因进化树

图 8湖南洞庭湖区 H9N2亚型禽流感病毒的NS基因进化树
Fig.8Phylogenetic tree of H9N2 subtype AIVNSgene from Dongting Lake region,Hunan
[参考文献]
[1]朱雯迎,许传田,胡北侠,等.2009年山东H9N2亚型禽流感M基因的分子进化分析及对哺乳动物致病性的研究 [J].中国农学通报,2011,27(3):337-341.
Zhu W Y,Xu C T,Hu B X,et al.Evolution analysis of the matrix protein genes of H9N2 chicken influenza viruses isolated in Shandong in 2009 and the pathgenicity to mammal [J].Chinese Agricultural Science Bulletin,2011,27(3):337-341.(in Chinese)
[2]桑晓宇,高玉伟,李林,等.5株H9N2亚型禽流感病毒血凝素蛋白分子特征分析和豚鼠间传播能力的评估 [J].中国预防兽医学报,2012,34(2):92-95.
Sang X Y,Gao Y W,Li L,et al.Hemagglutinin protein molecular characterization of 5 H9N2 influenza and evaluation transmissibility in guinea pigs [J].Chinese Journal of Preventive Veterinary Medicine,2012,34(2):92-95.(in Chinese)
[3]徐克敏,李康生.H9可能是人类下次流感大流行的亚型 [J].国外医学:微生物学分册,2003(2):7-9.
Xu K M,Li K S.H9 maybe the next human influenza pandemic subtypes [J].Foreign Medicine:Microbiology Section,2003(2):7-9.(in Chinese)
[4]陈伯伦,张泽纪,陈伟斌.禽流感研究:Ⅰ.鸡A型禽流感病毒的分离与血清学初步鉴定 [J].中国兽医杂志,1994,22(10):3-5.
Chen B L,Zhang Z J,Chen W B,et al.Avian influenza research:Ⅰ.The chicken avian influenza A virus isolation and serological preliminary identification [J].Chinese Journal of Veterinary Medicine,1994,22(10):3-5.(in Chinese)
[5]Choi Y K,Ozaki H,Webby R J,et al.Continuing evolution of H9N2 influenza viruses in Southeastern China [J].J Virol,2004,78(16):8609-8614.
[6]张泉鹏,李作生,鲍晓伟,等.云南省不同宿主H9N2感染调查和NA分子进化分析 [J].中国兽医学报,2011,31(6):828-834.
Zhang Q P,Li Z S,Bao X W,et al.Analysis of infection and NA molecular evolution of avian H9N2 in different hosts in Yunnan Provionce [J].Chinese Journal of Veterinary Science,2011,31(6):828-834.(in Chinese)
[7]周锦萍,刘健,李凯航,等.上海地区活禽批发市场H9亚型禽流感病毒调查 [J].中国动物传染病学报,2010,18(3):56-61.
Zhou J P,Liu J,Li K H,et al.Survey of H9 subtype avian influenza virus in live poultry markets of Shanghai [J].Chinese Journal of Animal Infectious Disease,2010,18(3):56-61.(in Chinese)
[8]李清竹,曹明慧,姜新.辽宁省低致病性禽流感(H9)亚型带毒情况调查研究 [J].现代畜牧兽医,2012(6):31-32.
Li Q Z,Cao M H,Jiang X,et al.Survey of H9 subtype low pathogenic avian influenza in Liaoning Province [J].Modern Journal of Animal Husbandry and Veterinary Medicine,2012(6):31-32.(in Chinese)
[9]岳旭龙,陈礼朋,李双亮,等.2010-2011年河南省部分地区H9亚型禽流感、新城疫和鸡传染性支气管炎的流行病学调查 [J].中国农学通报,2012,28(8):72-76.
Yue X L,Chen L P,Li S L,et al.Epidemiological investigations of H9 subtype avian influenza,newcastle disease and infection bronchitis in some regions of Henan Province during 2010 and 2011 [J].Chinese Agricultural Science Bulletin,2012,28(8):72-76.(in Chinese)
[10]彭宜,张伟,薛峰,等.2006-2008年对华东地区家禽不同HA亚型低致病性禽流感的病原学监测 [J].中国人兽共患病学报,2009,25(2):119-121.
Peng Y,Zhang W,Xue F,et al.Etiological examination on the low pathogenicity avian influenza viruses with different HA subtypes from poultry isolated in eastern China from 2006 to 2008 [J].Chinese Journal of Zoonoses,2009,25(2):119-121.(in Chinese)
[11]贾红玲,苏艳,吴润,等.禽流感病毒血凝素保守氨基酸对其受体结合位点的影响 [J].中国预防兽医学报,2008,30(7):500-504.
Jia H L,Su Y,Wu R,et al.The influence of the conservative amino acide of hemagglutinin to the receptor binding site of avian influenza virus [J].Chinese Journal of Preventive Veterinary Medicine,2008,30(7):500-504.(in Chinese)
[12]Suzuki Y.Receptor sialylsugar chains as determinants of host range of influenza viruses [J].Nihon Rinsho,2000,58(11):2206-2210.
[13]Stevens J,Blixt O,Tumpey T M,et al.Structure and receptor specificity of the hemagglutinin from an H5N1 influenza virus [J].Science,2006,312(5772):404-410.
[14]尚飞雪,刘朔,蒋文明,等.近年来中国H9亚型禽流感分离株谱系分析 [J].中国动物检疫,2012,29(4):51-53.
Shang F X,Liu S,Jiang W M,et al.Phylogenetic analysis of H9 subtype avian influenza viruses isolated from China in recent years [J].China Animal Health Inspection,2012,29(4):51-53.(in Chinese)
[15]陈寅,茅海燕,李榛,等.浙江省人感染H7N9禽流感病毒的基因组序列分析 [J].中华流行病学杂志,2013,34(6):604-608.
Chen Y,Mao H Y,Li Z,et al.Genomic sequences of human infection of avian-origin influenza A (H7N9) virus in Zhejiang Province [J].Chinese Journal of Epidemiology,2013,34(6):604-608.(in Chinese)
Genetic evolution analysis of twelve H9N2 subtype avian influenza virus in Dongting Lake,Hunan
HUANG Jian-long1,TAN Dan1,2,WANG Chang-jian1,ZHANG Chao-yang1,HE Shi-cheng1,ZHU Chun-xia1, WANG Hong-bing1,DENG Guo-hua2,LIU Dao-xin1
(1HunanProvincialAnimalDiseasePreventionandControlCenter,Changsha,Hunan410014,China;2AnimalInfluenzaLaboratoryoftheMinistryofAgricultural,StateKeyLaboratoryofVeterinaryBiotechnology,HarbinVeterinaryResearchInstitute,ChineseAcademyofAgriculturalSciences,Harbin,Heilongjiang150001,China)
Abstract:【Objective】 The study explored the genetic variation characteristics and evolution of H9N2 subtype avian influenza virus isolated from Dongting Lake area from the perspective of molecular biology.【Method】 Twelve strains of H9N2 subtype avian influenza virus were isolated from Dongting Lake area,and the gene fragments were amplified,sequenced and analyzed using Mega 5.【Result】 All the twelve strains of H9N2 subtype avian influenza virus belonged to low pathogenic avian influenza virus,because their cracking sites did not have inset of continuous alkaline amino acids.The HA and NA gene evolution of the twelve strains of H9N2 subtype avian influenza virus were synchronous in DK/HK/Y280/97 branch.Six internal genes (M,PB2,PB1,PA,NA,and NS)showed different degrees of recombination with H5 highly pathogenic avian influenza virus,and the homology were high with H7N9.【Conclusion】 The genetic evolution of H9 subtype avian influenza virus was complex and gene rearrangements existed in Dongting Lake region.
Key words:H9N2 subtype avian influenza virus;genetic evolution;Dongting Lake area;Hunan province
DOI:网络出版时间:2016-02-0209:3710.13207/j.cnki.jnwafu.2016.03.001
[收稿日期]2014-06-30
[基金项目]国家“973”计划项目(2011CB505001)
[作者简介]黄建龙(1982-),男,浙江龙游人,兽医师,硕士,主要从事动物疫病预防控制研究。E-mail:to_huangjianlong@126.com[通信作者]邓国华(1971-),男,湖南望城人,研究员,博士研究生,主要从事禽流感病毒分子生物学研究。E-mail:dgh1971 @163.com
[中图分类号]S851.3;Q78
[文献标志码]A
[文章编号]1671-9387(2016)03-0001-10
