无溶剂法在有机锌与醛(酮)不对称加成反应中的应用
2016-06-12杨翠凤林双政徐泽刚卫天琪李秉擘
杨翠凤, 刘 文, 林双政, 徐泽刚, 陈 涛, 卫天琪, 李秉擘
(1. 氟氮化工资源高效开发与利用国家重点实验室,陕西 西安 710065;2. 西安近代化学研究所,陕西 西安 710065; 3. 西安建筑科技大学 理学院,陕西 西安 710065)
·综合评述·
无溶剂法在有机锌与醛(酮)不对称加成反应中的应用
杨翠凤1,2, 刘文3*, 林双政1,2, 徐泽刚1,2, 陈涛1,2, 卫天琪1,2, 李秉擘1,2
(1. 氟氮化工资源高效开发与利用国家重点实验室,陕西 西安710065;2. 西安近代化学研究所,陕西 西安710065; 3. 西安建筑科技大学 理学院,陕西 西安710065)
摘要:综述了无溶剂法在有机锌与醛酮不对称加成反应中的应用。重点阐述了该方法在制备手性二级醇和手性三级醇中的应用。并对其未来发展进行了展望。参考文献30篇。
关键词:无溶剂法; 有机锌; 醛(酮)不对称加成; 应用; 综述
随着化学工业发展,合成理论和方法均有了突破性进展。化学工作者不仅可以合成天然产物,还能设计并合成复杂的非天然物质。但由于合成方法的复杂性和对环境的污染性,很多方法难以得到工业化应用,无法实现其应有价值。发展高效、简单、环境友好的合成方法成为化学家努力的方向。溶剂在有机反应中有十分重要的作用,如加快反应速率,决定反应能否进行。但溶剂在反应后往往很难回收利用,一般只能作废弃物处理,这不仅浪费资源,而且对生态环境和人类健康有极大危害。因此,发展无溶剂合成法对经济发展和环境保护均有十分重要的意义。
手性大分子,如蛋白质、糖类等,是生命活动的基础生物大分子。仅依靠从天然产物中获取手性化合物已不能满足社会发展需求,研究与开发不对称合成技术的重要性日益显著。不对称催化可从源头减少无用异构体的产生,提高有效异构体产率。此外,采用不对称催化技术,还可以缩短手性产品的合成路线,减少“碳足迹”,符合绿色化学的原则。
烷基化金属试剂与醛(酮)的不对称加成反应是合成手性仲(叔)醇的重要方法之一。金属有机试剂(如Grignard试剂)是构建C—C的重要方法,但活性太强,反应条件苛刻等缺点限制了其应用。近年来,有机锌试剂因具有反应活性高,反应过程易操作等优点而受到研究人员的热切关注,但其在无溶剂条件下的研究较少。
综上可见,在无溶剂条件下进行有机锌与醛(酮)的不对称加成反应,对提高原子利用率,减少环境污染,提高手性产物收率均有积极意义。
1有机锌与醛的不对称加成反应
二级醇的合成方法主要有:(1)酮还原,(2)烷基化金属试剂与醛加成。其中,方法(2)可以在构建C—C的同时,产生一个手性碳,对手性合成具有较大意义。目前,已有多种催化剂可用于该反应,且立体选择性较高[1-9],但适用于无溶剂反应的催化剂较少。Soai等[10-11]在研究烷基化锌试剂与醛的不对称反应(Scheme 1)时发现:在有溶剂时,有机锌用量由10 mol%减少至3.4%,收率>93%,立体选择性>85%。当反应在无溶剂条件下进行时,虽然反应温度降低(-28 ℃),反应时间延长(6 h),但收率(99%)和立体选择性(87%)较高。
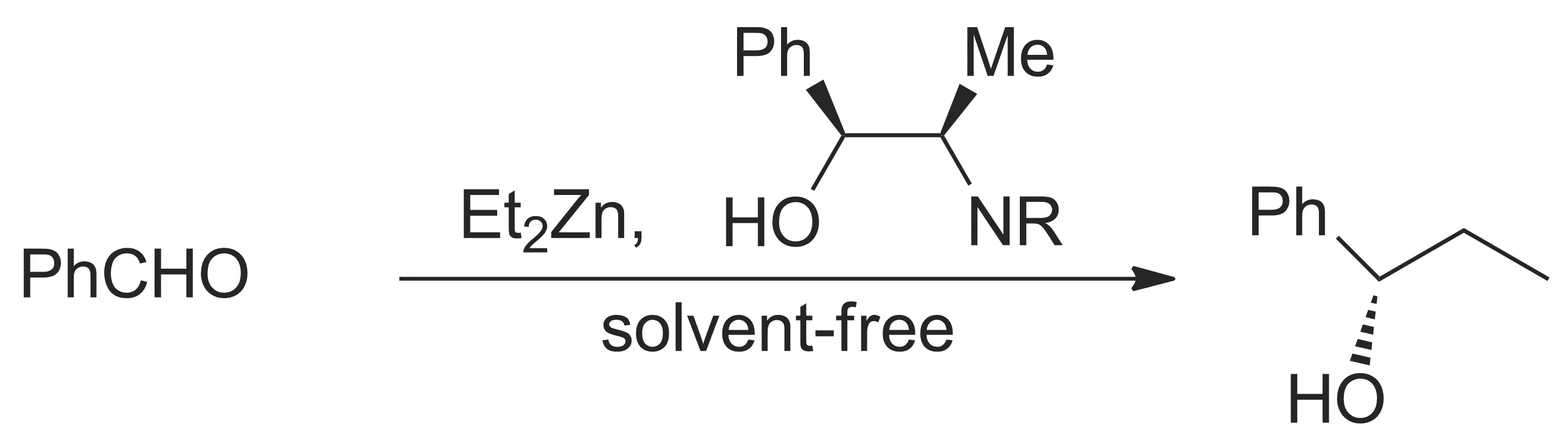
Scheme 1
此外,该报道还研究了底物对反应的影响。结果表明:无论是芳香醛还是脂肪醛,在无溶剂条件下,均能以较高的产率(>80%)和立体选择性(>84%)制得相应产物。
同有机锌试剂和醛的加成反应相比,酮加成反应相对比较困难[12-23]。Walsh等[24-25]开发了一种新型的催化剂体系[配体L*(Chart 1)与Ti(Oi-Pr)4的配合物(1)],在己烷和甲苯溶剂中可以催化有机锌与酮的不对称加成反应(Scheme 2)。结果表明:反应需在己烷和甲苯的混合溶剂中进行,L*用量需2 mol%~10 mol%,产物才能有较高的对映选择性。因此,Walsh等还推测,减少溶剂的量可能可以促进反应进行,减少催化剂用量,减少副产物产生和缩短反应时间。
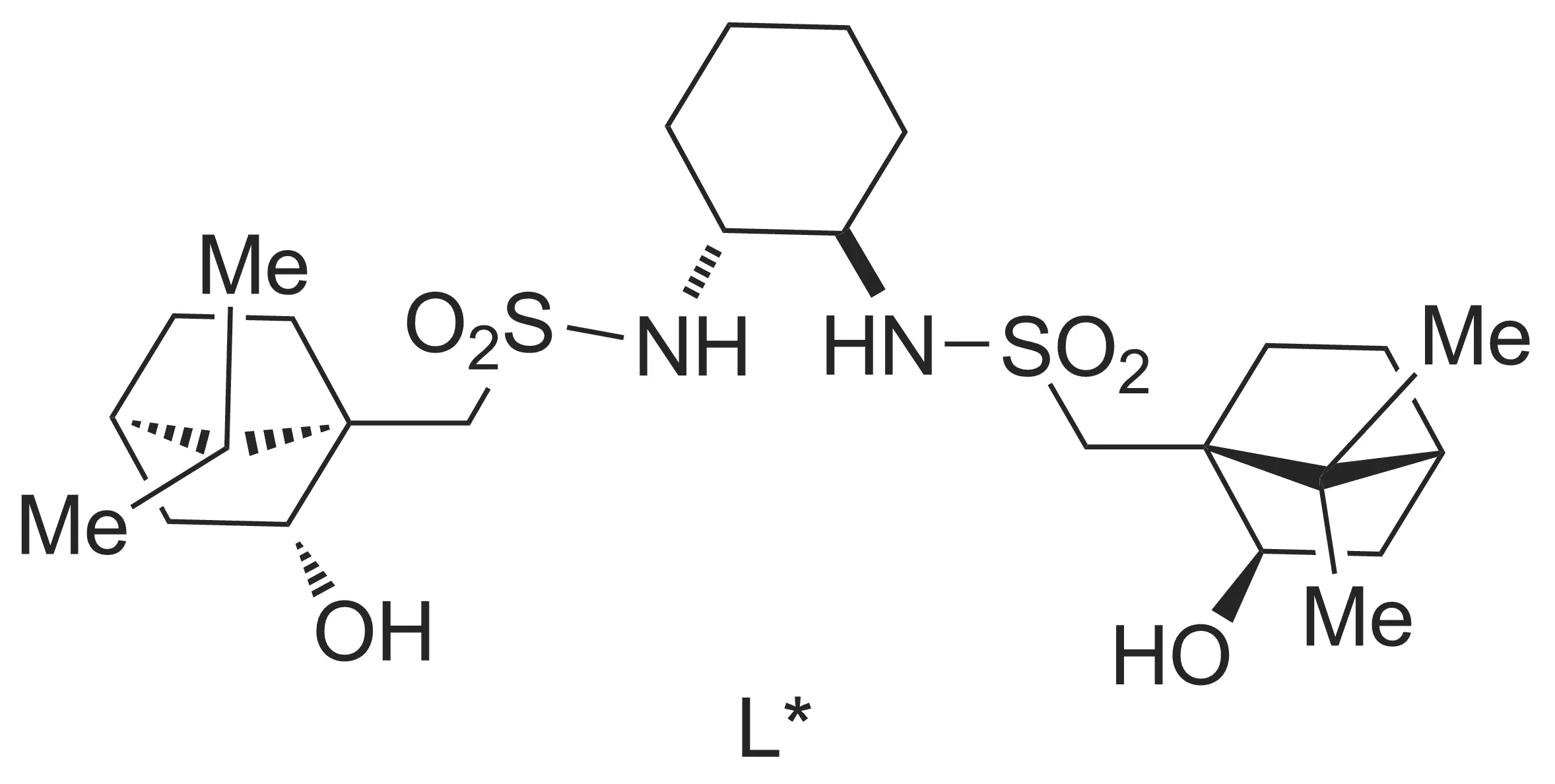
Chart 1
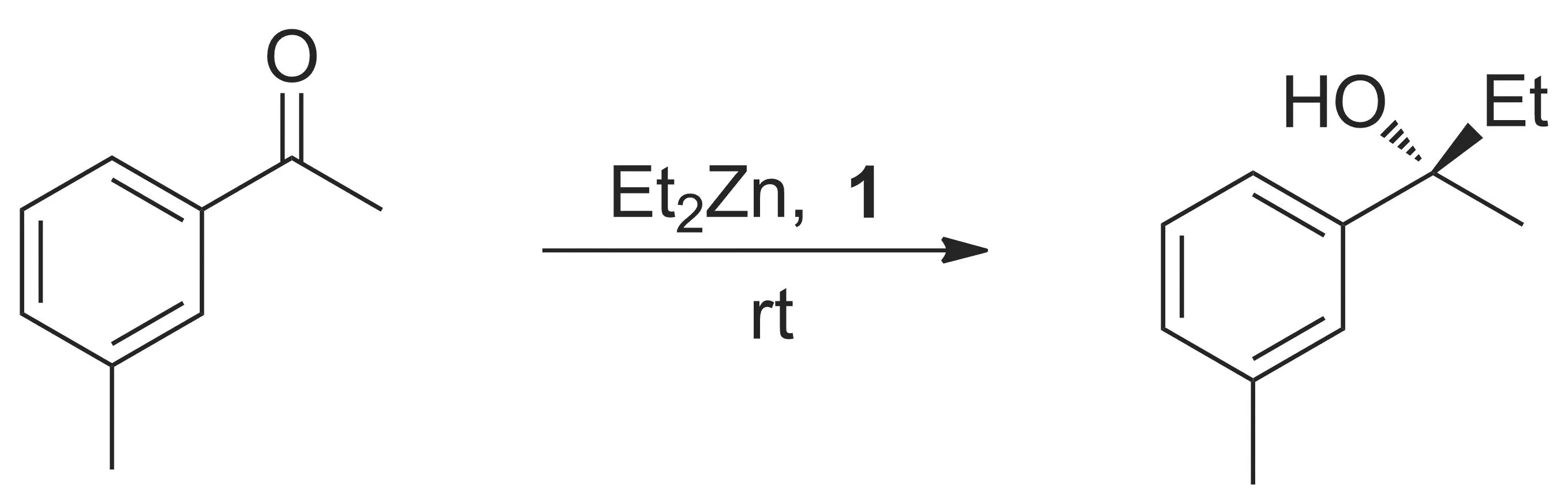
Scheme 2
在此基础上,Jeon等[17,23-24]研究了二乙基锌和3-甲基苯乙酮在1催化下的无溶剂反应条件。结果表明:以tol-hex为溶剂,反应时间为24 h,收率78%,ee值>99%。无溶剂条件下,反应仅需4 h,收率79%,ee值99%。此外,L*用量对产物也有较大影响。当L*用量为0.5 mol%时,反应时间为20 h,收率80%,ee值98%。当L*用量为0.25 mol%时,反应时间为21 h,收率明显下降(62%),ee值变化不大(97%)。当L*用量减少至0.1 mol%时,反应时间延长至24 h,收率降低至58%,ee值96%。因此,无溶剂条件下,减少L*用量,产物收率和ee值依然较高。
Jeon等还研究了底物对该反应的影响。结果表明:无溶剂条件下,收率和ee值更依赖底物种类。如二乙基锌与对甲氧基苯乙酮的不对称加成反应在溶剂中反应需反应111 h,收率85%,ee值92%。在无溶剂条件下,反应仅需12 h即可完成,但产率和ee值均降低(50%和81%);加入甲苯(2 eq.),反应可在15 h内完成,收率72%,ee值89%。类似的,二乙基锌与苯戊酮反应,在无溶剂条件下,反应时间由102 h缩短至24 h,收率基本不变(78%),ee值由88%降低至80%。
Kitamura等[26]研究了甲基锌试剂与酮的不对称加成反应。结果表明:无溶剂反应结果优于在溶剂中反应结果。如苯丙酮,在溶剂中反应,L*用量需2 mol%,反应时间为45 h;在无溶剂条件下,配体用量降低至1 mol%,反应时间缩短至15 h,收率85%,ee值92%; L*用量减少至0.25 mol%,虽然反应时间延长(60 h),但收率和ee值均较高(85%, 80%)。此外,甲基锌与酮的加成反应速率较乙基锌慢,如苯戊酮与二乙基锌反应,反应时间为24 h,与甲基锌反应,反应时间为43 h。然而,甲基锌与部分环烯酮(如2,4,4-三甲基环己烯酮)的反应收率和ee值均高于乙基锌,且L*用量较少。
Knochel等[27]研究了其他有机锌与酮的无溶剂不对称加成反应。结果表明:无溶剂条件下,L*用量为1 mol%时,Zn[(CH2)4OTBS]2与3′-甲基苯乙酮反应,收率(68%)和ee值(79%)均低于有溶剂反应(收率89%,ee值98%);加入甲苯(2 eq.)可以提高ee值(97%)。以溴取代烷基锌与3′-甲基苯乙酮反应,结果类似。
Jeon等[17]对该反应进行了底物范围扩展,结果表明:L*用量为0.5 mol%,苯丙酮与有机锌反应48 h,收率和ee值分别为90%和92%, 1回收率高达84%。
Kazuaki等[28]合成了一种脯氨酸衍生的膦酰胺手性催化剂(2a和2b, Chart 2)。结果表明,2a对乙(苯)基锌和酮的不对称加成反应有很好的催化作用(Scheme 3)。2b对甲基锌和醛的不对称烷基化反应催化效果较好。如甲基锌和苯甲醛在0.5 mol%~1.0 mol% 2b催化下,收率和ee值均>80%。 2a和2b在无溶剂条件下的催化效果优于溶剂(正己烷)条件。该方法实现了无溶剂条件下甲(乙)基锌和苯基锌等商业化程度较高的有机锌与醛酮的不对称加成,被认为是最有可能用于工业化的醛酮不对称烷基化方法。
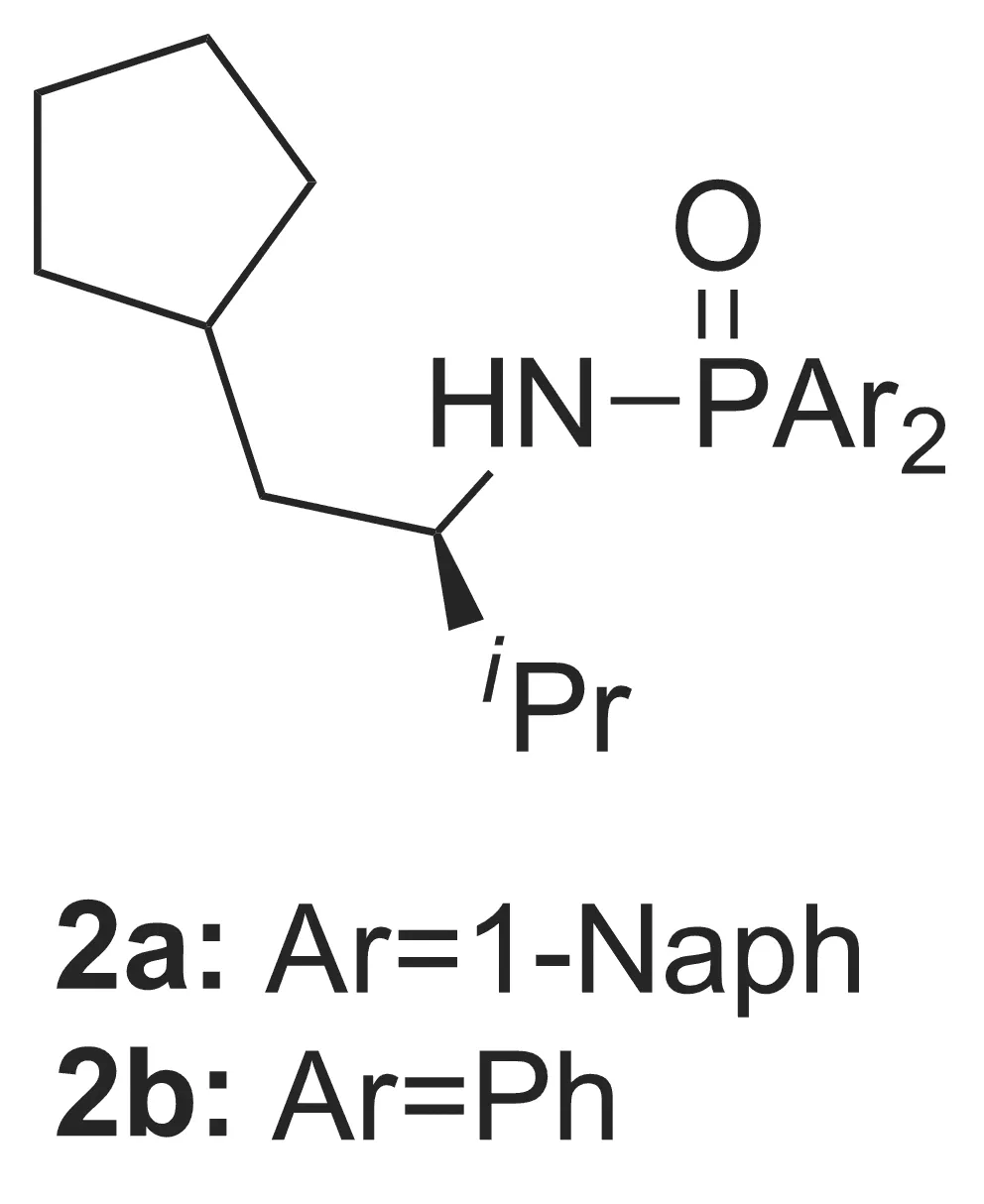
Chart 2
为活化苯基锌,Bolm等[29-30]加入乙基锌(2 eq.)参与反应。该方法对苯基锌与芳基酮、环酮、α,β-不饱和酮及杂原子脂肪酮均有较好效果(Scheme 4)。与Kazuaki等研究结果类似,无溶剂法在反应速率、收率和ee值等方面均较溶剂法有较大优势。
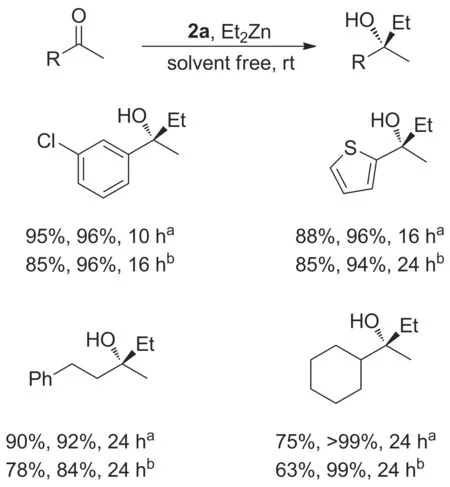
Scheme 3
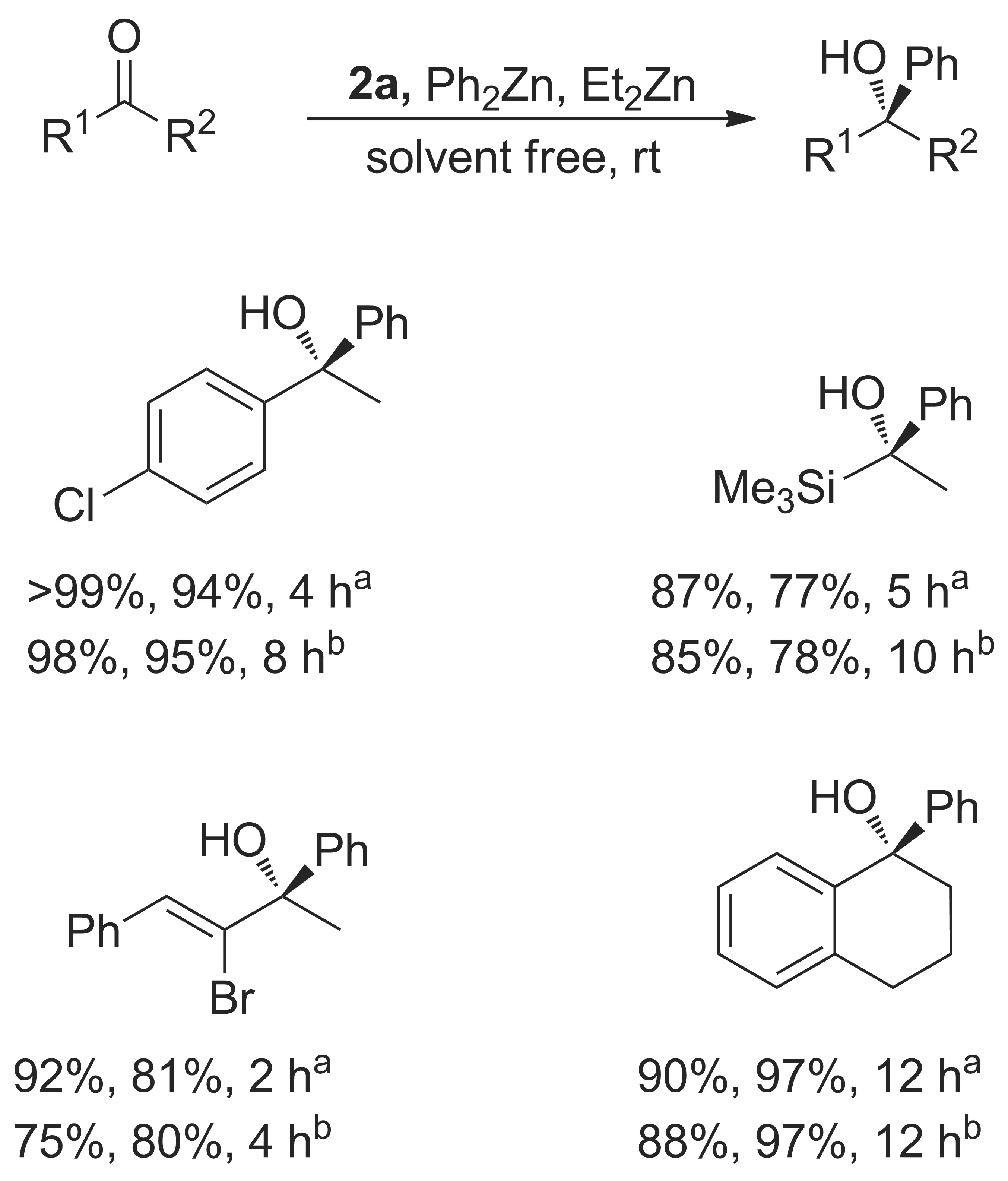
Scheme 4
无溶剂法在有机锌与醛(酮)的不对称加成反应中有一定的发展,但反应底物类型有限,复杂酮类底物的反应尚未有较大突破。这些研究均有待继续深入。
参考文献
[1]Knochel P, Singer R D. Preparation and reactions of polyfunctional organozinc reagents in organic synthesis[J].Chem Rev,1993,93(6):2117-2188.
[2]Duthaler R O, Hafner A. Fluorotitanium compounds:Novel catalysts for the addition of nucleophiles to aldehydes[J].Angew Chem Int Ed,1997,36(1):43-45.
[3]Walsh P J, Titanium-atalyzed enantioselective additions of alkyl groups to aldehydes:Mechanistic studies and new concepts in asymmetric catalysis[J].Acc Chem Res,2003,36(10):739-749.
[4]Pu L,Yu H B. Catalytic asymmetric organozinc additions to carbonyl compounds[J].Chem Rev,2001,101(3):757-824.
[5]Noyori R, Suga S, Oka H,etal. Self and nonself recognition of chiral catalysts:The origin of nonlinear effects in the amino-alcohol catalyzed asymmetric addition of diorganozincs to aldehydes[J].Chem Rec,2001,1(2):85-100.
[6]Lu G, Li Y M, Li X S,etal. Synthesis and application of new chiral catalysts for asymmetric alkynylation reactions[J].Coord Chem Rev,2005,249(17):1736-1744.
[7]Yus M, Ramón D J. Enantioselective addition of organozinc reagents to carbonyl compounds[J].Pure Appl Chem,2005,77(12),2111-2120.
[8]Wingstrand E, Lundgren S, Penhoat M,etal. Dual Lewis acid-Lewis base activation in enantioselective additions to aldehydes[J].Pure Appl Chem,2006,78(2):409-414.
[9]Denmark S E, Fu J. Catalytic enantioselective addition of allylic organometallic reagents to aldehydes and ketones[J].Chem Rev,2003,103(8):2763-2794.
[10]Sato I, Saito T, Soai K. Solvent-free catalytic enantioselective addition of diethylzinc to aldehydes[J].Chem Commun,2000,24:2471-2472.
[11]Sato I, Kodaka R, Soai K. Asymmetric synthesis ofN-diphenylphosphinoylamines by solvent-free enantioselective addition of dialkylzincs toN-diphenylphosphinoylimines[J].J Chem Soc:Perkin Trans 1,2001,22:2912-2914.
[12]García C, LaRochelle L K, Walsh P J. A practical catalytic asymmetric addition of alkyl groups to ketones[J].J Am Chem Soc,2002,124(37):10970-10971.
[13]Betancort J M, García C, Walsh P J. Development of the first practical catalyst for the asymmetric addition of alkyl-and arylzinc reagents to ketones[J].Synlet,2004,5:749-760.
[14]Li H, Walsh P J. Catalytic asymmetric vinylation of ketones[J].J Am Chem Soc,2004,126(21):6538-6539.
[15]Li H, García C, Walsh P J. Catalytic asymmetric addition of diphenylzinc to cyclicα,β-unsaturated ketones[J].Proc Nat Acad Sci USA,2004,101(15):5425-5427.
[16]Li H, Walsh P J. Catalytic asymmetric vinylation and dienylation of ketones[J].J Am Chem Soc,2005,127(23):8355-8361.
[17]Jeon S J, Li H, García C,etal. Catalytic asymmetric addition of alkylzinc and functionalized alkylzinc reagents to ketones[J].J Org Chem,2005,70(2):448-455.
[18]García C, Walsh P J. Highly enantioselective catalytic phenylation of ketones with a constrained geometry titanium catalyst[J].Org Lett,2003,5(20):3641-3644.
[19]Ramón D J, Yus M. Chiral tertiary alcohols made by catalytic enantioselective addition of unreactive zinc reagents to poorly electrophilic ketones[J].Angew Chem Int Ed,2004,43(3):284-287.
[20]Ramón D J, Yus M. First enantioselective addition of dialkylzinc to ketones promoted by titanium(IV) derivatives[J].Tetrahedron Lett,1998,39(10):1239-1242.
[21]Prieto O, Ramón D J, Yus M. Highly enantioselective arylation of ketones[J].Tetrahedron Asymmetry,2003,14(14):1955-1957.
[22]Lu G, Li X, Jia X,etal. Enantioselective alkynylation of aromatic ketones catalyzed by chiral camphorsulfonamide ligands[J].Angew Chem Int Ed,2003,42(41):5057-5058.
[23]Jeon S J, Walsh P J. Asymmetric addition of alkylzinc reagents to cyclicα,β-unsaturated ketones and a tandem enantioselective addition/diastereoselective epoxidation with dioxygen[J].J Am Chem Soc,2003,125(32):9544-9545.
[24]Jeon S J, Li H, Walsh P. A green chemistry approach to a more efficient asymmetric catalyst:Solvent-free and highly concentrated alkyl additions to ketones[J].J Am Chem Soc,2005,127(47):16416-16425.
[25]Berrisford D J, Bolm C, Sharpless K B. Ligand-accelerated catalysis[J].Angew Chem Int Ed,1995,34(10):1059-1070.
[26]Kitamura M, Okada S, Suga S,etal. Enantioselective addition of dialkylzincs to aldehydes promoted by chiral amino alcohols:Mechanism and nonlinear effect[J].J Am Chem Soc,1989,111(11):4028-4036.
[27]Knochel P, Rozema M J, Tucker C E,etal. The chemistry of polyfunctional organozinc and copper reagents[J].Pure Appl Chem,1992,64(3):361-370.
[28]Ishihara K, Hatan, M, Mizuno T. Commercially available neat organozincs as highly reactive reagents for catalytic enantioselective addition to ketones and aldehydes under solvent free conditions[J].Tetrahedron,2011,67(24):4417-4424.
[29]Bolm C, Hermanns N, Hildebrand J P,etal. Asymmetric,catalytic phenyl transfer to aldehydes:Enantioselective synthesis of diarylmethanols[J].Angew Chem Int Ed,2000,39(19):3465-3467.
[30]Schmidt F, Stemmler R T, Rudolph J,etal. Catalytic asymmetric approaches towards enantiomerically enriched diarylmethanols and diarylmethylamines[J].Chem Soc Rev,2006,35(5):454-470.
Application of Solvent-Free Method in Asymmetic Addition Reaction of Organozinc with Aldehyde or Ketone
YANG Cui-feng1,2,LIU Wen3*,LIN Shuang-zheng1,2,XU Ze-gang1,2,CHEN Tao1,2,WEI Tian-qi1,2,LI Bing-bo1,2
(1. State Key Laboratory of Fluorine & Nitrogen Chemicals, Xi’an 710065, China;2. Xi’an Modern Chemistry Research Institute, Xi’an 710065, China;3. College of Science, Xi’an University of Architecture and Technology, Xi’an 710065, China)
Abstract:Application of solvent-free method in asymmetric addition reaction of organozinc with aldehyde or ketone was reviewed with 30 references. Application in preparation of secondary or tertiary alcohol was introduced. Suggestions on future development of this method were proposed.
Keywords:solvent-free method; organozinc; aldehyde(ketone)asymmetric addition; application; review
收稿日期:2016-01-13
作者简介:杨翠凤(1983-),女,汉族,山东菏泽人,博士,主要从事手性药物合成的研究。E-mail: ycf@mail.ustc.edu.cn通信联系人: 刘文,讲师, E-mail: wliu019@mail.ustc.edu.cn
中图分类号:O621.3
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.05.16021
