新型查尔酮哌嗪衍生物的合成
2016-06-12王秀丽王子杰毛泽伟
王秀丽, 王子杰, 毛泽伟
(云南中医学院 中药学院,云南 昆明 650500)
·研究简报·
新型查尔酮哌嗪衍生物的合成
王秀丽, 王子杰, 毛泽伟*
(云南中医学院 中药学院,云南 昆明650500)
摘要:以4-二甲氨基苯甲醛和2-溴-4′-氟苯乙酮为原料,经缩合和取代反应制得4-二甲氨基-4′-(1-哌嗪基)查尔酮(2); 2与卤代烃反应合成了6个新型的查尔酮哌嗪衍生物,收率71%~88%,其结构经1H NMR,13C NMR和HR-MS表征。
关键词:4-二甲氨基苯甲醛; 2-溴-4′-氟苯乙酮; 查尔酮; 哌嗪; 合成
查尔酮类化合物及其衍生物是一类含有α,β-不饱和羰基的化合物,具有抗菌、抗炎和抗肿瘤等多种生物活性[1-4]。天然查尔酮化合物主要存在于甘草、红花等药用植物中,毒副作用较小,反应活性较高,在医药合成领域具有重要研究价值[5-8]。
哌嗪具有良好的生物活性,是重要的医药中间体,常用于药物分子的设计与合成。在本课题组前期研究[9-10]中发现,含哌嗪的苯乙酮和苯并呋喃衍生物均具有潜在的生理活性。在此基础上,如果将哌嗪片段引入查尔酮分子中,有望得到药理活性更佳的新化合物。
本文以4-二甲氨基苯甲醛和2-溴-4′-氟苯乙酮为原料,经缩合和取代反应制得中间体——4-二甲氨基-4′-(1-哌嗪基)查尔酮(2); 2与卤代烃(3a~3f)反应合成了6个新型的查尔酮哌嗪衍生物(4a~4f, Scheme 1),收率71%~88%,其结构经1H NMR,13C NMR和HR-MS表征。
1实验部分
1.1仪器与试剂
Yanaco型熔点仪(温度未校正);Bruker AM 300和Bruker AM 400型核磁共振仪(CDCl3为溶剂,TMS为内标);AutoSpec Premier P776型双聚焦三扇型磁质谱仪。
所用试剂均为分析纯;其中DMF和DCM使用前经干燥处理。
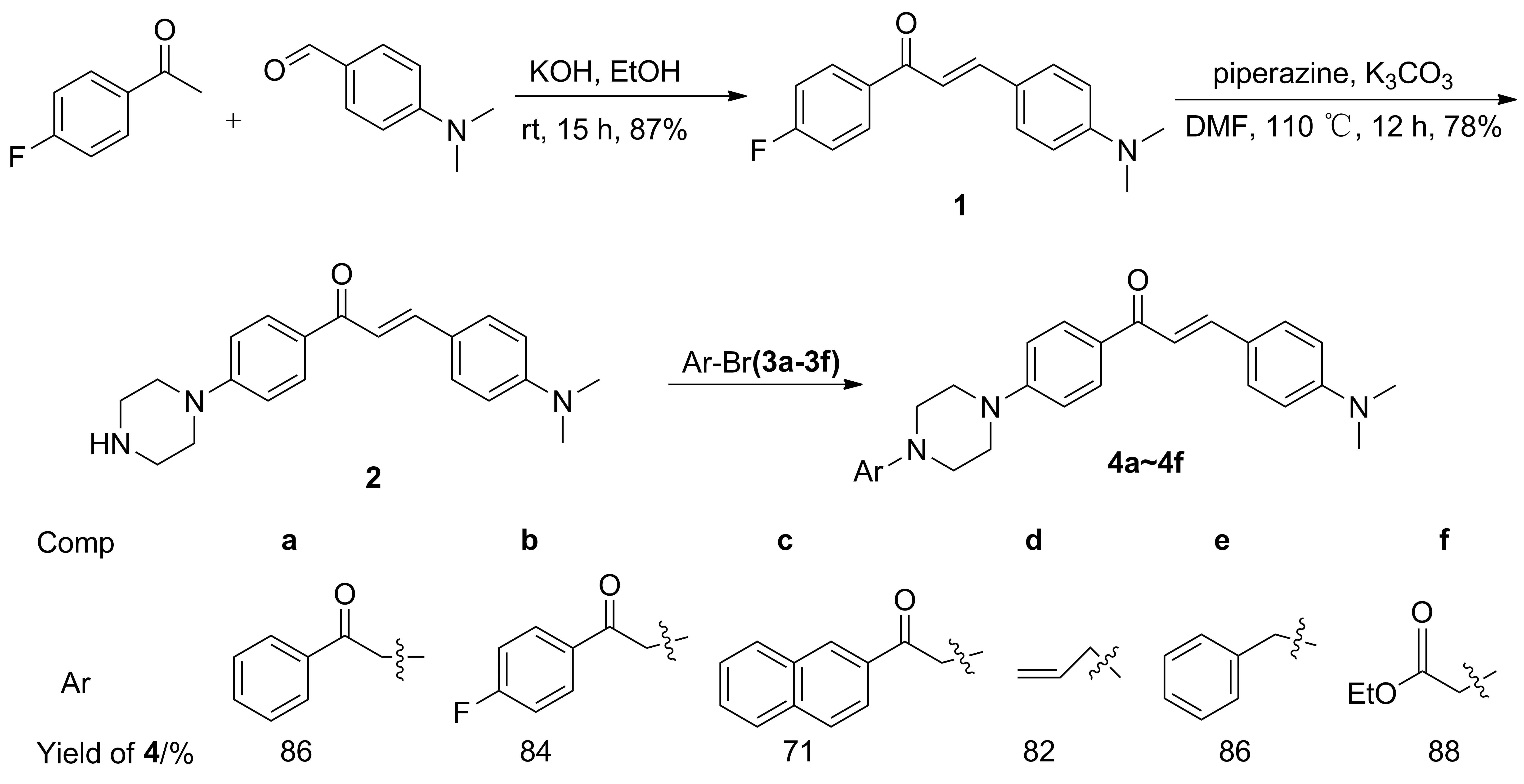
Scheme 1
1.2合成
(1) 4-二甲氨基-4′-氟查尔酮(1)的合成
在圆底烧瓶中加入4-氟苯乙酮1.38 g(10 mmol), 4-二甲氨基苯甲醛1.49 g(10 mmol)和乙醇15 mL,搅拌下于室温滴加20%氢氧化钾溶液15 mL,滴毕,反应15 h(TLC检测)。反应液倒入水(50 mL)中,抽滤,滤饼用水(3×20 mL)洗涤,干燥得橙黄色固体1 2.34 g,收率87%, m.p.139~141 ℃;1H NMRδ: 8.01~8.05(m, 2H), 7.81(d,J=15.3 Hz, 1H), 7.55(d,J=8.7 Hz, 2H), 7.32(d,J=15.2 Hz, 1H), 7.12~7.17(m, 2H), 3.03(s, 6H);13C NMRδ: 188.9, 166.9, 163.6, 152.1, 146.0, 135.4, 130.9, 130.7, 130.5, 122.5, 116.3, 115.6, 115.3, 111.8, 40.1。
(2) 2的合成
在圆底烧瓶中加入1 2.69 g(10 mmol),碳酸钾2.74 g,六水合哌嗪3.98 g(20 mmol)和DMF 30 mL,搅拌下于110 ℃反应12 h(TLC检测)。反应液倒入冷水(50 mL)中,用DCM(2×30 mL)萃取,合并有机相,用无水硫酸钠干燥,浓缩后经硅胶柱层析[洗脱剂:V(MeOH) ∶V(DCM)=1 ∶50]纯化得黄褐色固体2,收率78%;1H NMRδ: 8.01(d,J=9.0 Hz, 2H), 7.80(d,J=15.3 Hz, 1H), 7.56(d,J=9.0 Hz, 2H), 7.41(d,J=15.6 Hz, 1H), 6.92(d,J=9.0 Hz, 2H), 6.70(d,J=9.0 Hz, 2H), 3.33(t,J=4.8 Hz, 4H), 3.01~3.04(m, 10H), 2.12(s, 1H);13C NMRδ: 188.3, 154.2, 151.8, 144.1, 130.3, 130.1, 129.1, 123.0, 116.8, 113.6, 111.8, 48.5, 45.9, 40.2; HR-MSm/z: Calcd for C21H26N3O{[M+H]+}336.207 0, found 336.207 2。
(3) 4a~4f的合成(以4a为例)
在圆底烧瓶中加入2 100 mg(0.3 mmol)和DCM 10 mL,搅拌使其溶解;依次加入碳酸钾83 mg和2-溴苯乙酮(3a)g(0.45 mmol),搅拌下于室温反应2 h(TLC检测)。反应液倒入水(30 mL)中,搅拌1 h,用DCM(3×10 mL)萃取,合并有机相,用无水硫酸钠干燥,浓缩后经硅胶柱层析(洗脱剂:DCM)纯化得黄色固体4a。
用类似的方法合成黄色固体4b, 4c, 4e和4f,褐色固体4d。
4a: m.p.250~252 ℃;1H NMRδ: 7.99(d,J=8.1 Hz, 4H), 7.79(d,J=15.3 Hz, 1H), 7.54~7.50(m, 3H), 7.46(d,J=7.5 Hz, 2H), 7.39(d,J=15.6 Hz, 1H), 6.89(d,J=8.7 Hz, 2H), 6.66(d,J=8.7 Hz, 2H), 3.84(s, 2H), 3.41(t,J=4.2 Hz, 4H), 2.97(s, 6H), 2.74(t,J=4.5 Hz, 4H);13C NMRδ: 196.1, 188.2, 153.7, 151.7, 144.1, 135.9, 133.4, 130.3, 130.1, 129.1, 128.6, 128.1, 123.0, 116.7, 113.6, 111.8, 64.2, 53.1, 47.3, 40.1; HR-MSm/z: Calcd for C29H32N3O2{[M+H]+}454.248 9, found 454.248 8。
4b: m.p.252~254 ℃;1H NMRδ: 8.07~8.02(dd,J=5.7 Hz, 5.4 Hz, 2H), 7.99(d,J=8.7 Hz, 2H), 7.79(d,J=15.6 Hz, 1H), 7.54(d,J=8.7 Hz, 2H), 7.38(d,J=15.3 Hz, 1H), 7.14(t,J=8.4 Hz, 2H), 6.90(d,J=8.7 Hz, 2H), 6.68(d,J=8.7 Hz, 2H), 3.81(s, 2H), 3.42(t,J=4.2 Hz, 4H), 3.00(s, 6H), 2.74(t,J=4.8 Hz, 4H);13C NMRδ: 194.76, 188.38, 164.25, 153.77, 151.9, 144.2, 132.4, 131.1, 131.0, 130.4, 130.2, 129.3, 123.1, 116.9, 116.0, 115.7, 113.8, 111.9, 64.5, 53.2, 47.4, 40.2; HR-MSm/z: Calcd for C29H31N3O2F{[M+H]+}472.239 5, found 472.239 3。
4c: m.p.241~243 ℃;1H NMRδ: 8.55(s, 1H), 8.04~7.95(m, 4H), 7.90(t,J=12.0 Hz, 3H), 7.82(d,J=15.4 Hz, 1H), 7.52~7.60(m, 4H), 7.43(d,J=15.3 Hz, 1H), 6.91(d,J=9.0 Hz, 2H), 6.67(d,J=8.7 Hz, 2H), 4.01(s, 2H), 3.43(s, 4H), 3.00(s, 6H), 2.80(s, 2H);13C NMRδ: 196.1, 188.3, 153.8, 151.8, 144.2, 130.4, 130.2, 129.8, 129.6, 128.7, 128.5, 127.8, 126.9, 123.8, 116.9, 113.7, 113.5, 111.9, 64.4, 53.2, 47.4, 47.3, 40.1。
4d: m.p.180~182 ℃;1H NMRδ: 7.99(d,J=8.6 Hz, 2H), 7.80(d,J=15.4 Hz, 1H), 7.53(d,J=8.5 Hz, 2H), 7.39(d,J=15.4 Hz, 1H), 6.89(d,J=8.7 Hz, 2H), 6.66(d,J=8.5 Hz, 2H), 5.92~5.82(m, 1H), 5.23~5.16(dd,J=17.2 Hz, 10.1 Hz, 2H), 3.35(t,J=3.6 Hz, 4H), 3.03(d,J=6.4 Hz, 2H), 2.98(s, 6H), 2.57(d,J=5.0 Hz, 4H);13C NMRδ: 188.1, 153.7, 151.7, 144.0, 134.6, 130.3, 130.1, 129.0, 123.0, 118.2, 116.7, 113.5, 113.3, 111.8, 61.6, 52.6, 47.3, 40.1。
4e: m.p.196~198 ℃;1H NMRδ: 7.85(d,J=6.4 Hz, 2H), 7.66(d,J=11.5 Hz, 1H), 7.39(d,J=8.5 Hz, 2H), 7.25~7.12(m, 6H), 6.74(d,J=6.5 Hz, 2H), 6.53(d,J=8.5 Hz, 2H), 3.40(s, 2H), 3.20(t,J=3.5 Hz, 4H), 2.84(s, 6H), 2.43(t,J=3.7 Hz, 2H);13C NMRδ: 188.3, 153.9, 151.8, 144.1, 137.8, 130.4, 130.1, 129.2, 129.0, 128.4, 127.2, 123.1, 116.9, 113.6, 113.3, 111.9, 63.0, 52.8, 47.4, 40.2。
4f: m.p.180~182 ℃;1H NMRδ: 7.99(d,J=8.4 Hz, 2H), 7.78(d,J=15.2 Hz, 1H), 7.54(d,J=8.2 Hz, 2H), 7.38(d,J=15.2 Hz, 1H), 6.91(d,J=8.4 Hz, 2H), 6.68(d,J=8.3 Hz, 2H), 4.22(q,J=7.0 Hz, 2H), 3.41(t,J=4.3 Hz, 4H), 3.26 (s, 2H), 3.01(s, 6H), 2.74(t,J=3.3 Hz, 4H), 1.29(t,J=7.1 Hz, 3H);13C NMRδ: 188.4, 170.2, 153.8, 151.8, 144.2, 130.4, 130.2, 129.3, 123.2, 116.9, 113.8, 113.5, 111.9, 60.8, 59.4, 52.7, 47.4, 40.2, 14.3。
2结果与讨论
2.14a反应条件优化
为优化.4的合成条件,以4a为例,考察了碱和物料比r[n(3a) ∶n(2)]对4a收率的影响,结果分别见表1和表2。
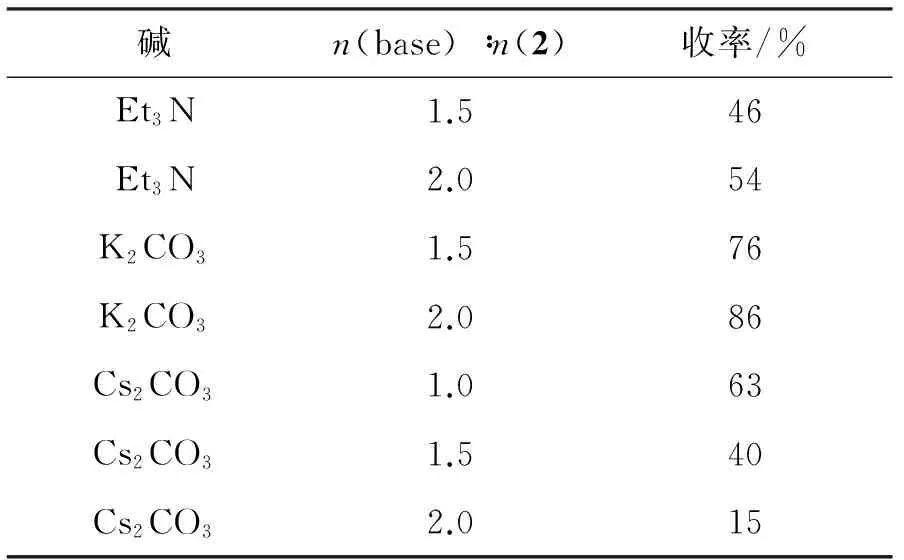
表1 碱对4a收率的影响*
*2 100 mg,r=1.5, 其余反应条件同1.2(3)。
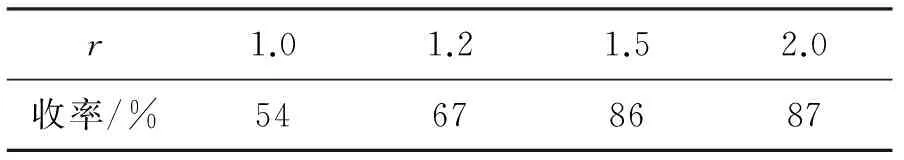
表2 r对反应的影响*
*2 100 mg, K2CO383 mg,其余反应条件同1.2(3)。
由表1可见,碱对4a收率影响较大。其原因在于:胺的亲核反应活性与氮原子的电子云密度密切相关。在碱性条件下,N—H解离,碱性增强,反应活性提高。三乙胺碱性较弱,不利于N—H解离,收率较低。碳酸铯碱性太强,导致副反应增多,收率也降低。因此,选择碳酸钾为碱,用量为n(K2CO3) ∶n(2)=2.0。
由表2可见,当r>1.2时,4a收率较高(>86%),继续增加3a用量,收率变化不大。因此,适宜的r为1.5。
2.2底物扩展
在最佳反应条件下对底物进行扩展,结果见Scheme 1。从Scheme 1可见,该方法适应性较强,收率较高,是一种较好的合成查尔酮哌嗪衍生物的方法。
参考文献
[1]Mukherjee S, Kumar V, Prasad A K,etal. Synthetic and biological activity evaluation studies on novel 1,3-diarylpropenones[J].Bioorg Med Chem,2001,9(2):337-345.
[2]Wu J, Li J, Cai Y,etal. Evaluation and discovery of novel synthetic chalcone derivatives as anti-inflammatory agents[J].J Med Chem,2011,54(23):8110-8123.
[3]Wu J H, Wang X H, Yi Y H,etal. Anti-AIDS agents 54:A potent anti-HIV chalcone and flavonoids from genus desmos[J].Bioorg Med Chem Lett,2003,13(10):1813-1815.
[4]Gloria H T, Bin T, Carlos F B. Organocatalysis as a safe practical method for the stereospecific dibromination of unsaturated compounds[J].Org Lett,2012,14(7):1858-1861.
[5]De Carvalho T L, Johann S, De Almeida A T,etal. Quinolinyl and quinolinylN-oxide chalcones:Synthesis,antifungal and cytotoxic activities[J].Eur J Med Chem,2011,46(9):4448-4456.
[6]姜集苗,胡国辉,左明明,等. 查尔酮类似物的合成及抗肿瘤活性研究[J].化学研究与应用,2010,22(11):1405-1408.
[7]赵乐晶,石玉,刘巍,等. 新型查尔酮类化合物的合成及其抗肿瘤活性[J].中国药物化学杂志,2010,20(3):161-165.
[8]Mishra N, Arora P, Kumar B,etal. Synthesis of novel substituted 1,3-diaryl propenone derivatives and their antimalarial activityinvitro[J].Eur J Med Chem,2008,43(7):1530-1535.
[9]毛泽伟,万春平,姜圆,等.N-杂环取代苯并呋喃衍生物的合成及抗肿瘤活性[J].中国药科大学学报,2015,46(1):58-61.
[10]毛泽伟,万春平,郑喜,等. 新型哌嗪类苯乙酮衍生物的合成及生物活性[J].中国药科大学学报,2014,45(5):517-521.
Synthesis of Novel Chalcone-piperazine Derivatives
WANG Xiu-li,WANG Zi-jie,MAO Ze-wei*
(School of Traditional Chinese Medicine, Yunnan University of Traditional Chinese Medicine, Kunming 650500, China)
Abstract:4-Dimethylamino-4′-(1-piperazinyl)chalcone(2) was preapared by aldol condensation and substitution, using 4-dimethylaminobenzaldehyde and 4′-fluoroacetophenone as materials. Six novel chalcone-piperazine derivatives, in yields of 71%~88%, were synthesized by reaction of 2 with haloalkanes. The structures were characterized by1H NMR,13C NMR and HR-MS.
Keywords:4-dimethylaminobenzaldehyde; 2-bromine-4′-fluoroacetophenone; chalcone; piperazine; synthesis
收稿日期:2015-12-18
作者简介:王秀丽(1993-),女,汉族,山东临沂人,本科生,主要从事药物合成的研究。 E-mail: 1210329276@qq.com通信联系人: 毛泽伟,博士,讲师, E-mail: ydmason@163.com
中图分类号:O625.6
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.05.15416
