药物联合手术去势对前列腺癌患者临床症状及肿瘤干细胞指标的影响
2016-06-07张益萍曹廷虎胡锦新
朱 军 张益萍 曹廷虎 胡锦新
上海市宝山区中西医结合医院泌尿外科(上海 201900)
药物联合手术去势对前列腺癌患者临床症状及肿瘤干细胞指标的影响
朱 军 张益萍 曹廷虎 胡锦新
上海市宝山区中西医结合医院泌尿外科(上海 201900)
目的 探究手术去势治疗联合雄激素阻断治疗(androgen deprivation therapy, ADT)对前列腺癌患者症状及肿瘤干细胞的影响。方法 选取我院2013年1月至2015年1月收治的前列腺癌患者82例,根据随机数表法分为观察组和对照组各41例,对照组实施手术去势治疗,观察组在其基础上联合ADT。9个月后所有患者接受根治性前列腺切除。比较两组患者相关临床症状和肿瘤干细胞的情况。结果 治疗后观察组下尿路症状明显改善,差异有统计学意义(P<0.05)。对照组治疗前后干细胞抗原(stem cell antigen, SCA)mRNA阳性率及表达含量差异均无统计学意义(P>0.05),观察组治疗后SCAmRNA阳性率及表达含量均显著下降(31.71%vs78.05%,22.59±8.03μg/L vs 74.05±9.35μg/L),差异均有统计学意义(P<0.05),且减少程度与治疗前肿瘤的Gleason评分有关,Gleason评分越高,阳性肿瘤细胞减少的百分比越高。对照组治疗前后CD44和整合素α2β1双标阳性干细胞比例无明显变化,而观察组治疗后显著下降[(9.33±1.63)% VS(3.48±1.16)%, t=18.723,P<0.05]。结论 ADT联合手术去势治疗可有效改善症状,降低SCA mRNA阳性表达率和肿瘤干细胞比例,值得临床进一步分析应用。
雄激素阻断治疗; 睾丸切除术; 前列腺肿瘤; 肿瘤干细胞
前列腺癌是发生在男性前列腺上皮细胞的恶性肿瘤,在发达国家发病率高,在我国则表现有以下特点:(1)70岁以上的老年人群发病率最高;(2)城市男性发病率高于农村;(3)整体发病率随时间明显增长[1]。目前我国前列腺癌患者一经发现往往就被诊断为进展期或转移期,此时ADT是治疗这类患者最为重要的方法[2]。本文对ADT进行研究,以求进一步临床分析应用。
资料与方法
一、一般资料
经我市医学伦理委员会同意,选取2012年1月至2015年1月来我院就诊的82例前列腺癌患者,根据随机数表法分为对照组和观察组各41例。前列腺癌的诊断由经尿道前列腺穿刺活检确诊,所有患者都为中晚期。对照组年龄60~77岁,平均年龄(70.10±6.13)岁,腺泡腺癌31例,导管腺癌3例,鳞状细胞癌3例,尿路上皮癌4例。观察组年龄62~78岁,平均年龄(72.03±5.61)岁,腺泡腺癌34例,导管腺癌3例,鳞状细胞癌2例,尿路上皮癌2例。两组患者基线资料相比差异无统计学意义,具有可比性。
二、方法
(一)治疗方案
1. 对照组患者接受去势治疗,即行单纯双侧睾丸切除术。
2. 观察组在去势治疗的基础上给予雄激素阻断治疗,方案为戈舍瑞林(AstraZeneca UK Limited生产,国药准字X19990231)联合氟他胺(天士力生产,国药准字H19990144)[3]。具体方法为:氟他胺口服0.25g/次(每天3次),15d后进行戈舍瑞林皮下注射(每月1次);当患者病情缓解、血清前列腺特异抗原PSA<0.2μg /L时,则在 3个月后停止注射戈舍瑞林,维持氟他胺用药;当PSA>0.4μg /L时,再重新开始注射戈舍瑞林。
(二)标本处理
在实验前活检获取一期标本,在根治性前列腺切除术中获取二期标本。选出最具代表性的标本,分为两组(每组均含所有患者的一、二期标本)。
1. 第一组标本:(1)进行完全固定[4]:即用4%多聚甲醛处理后,立刻用石蜡封埋,石蜡凝固后机器切片,最后固定在有聚乙烯涂层的玻璃载片上;(2)进行原位杂交分析:将制好的标本脱蜡脱水后放入37.5℃的胃蛋白酶溶液中消化20min后,于常温PBS溶液中漂洗处理后待用。48℃的条件于盖玻片下使用洋地黄类标记探针与切片组织杂交,维持24h后洗涤干净,加入抗洋地黄类抗体,37.5℃孵育40min后加入链霉亲和素过氧化酶,继续孵育20分钟。最后再用常温PBS溶液漂洗,加入DAB溶液、苏木素,进行显色和复染。
2. 第二组标本:(1)制片方法:与第一组标本相同;(2)进行免疫组织化学分析[5]:标本脱蜡脱水后加入1.5%双氧水溶液中,10min后用常温PBS溶液漂洗干净,再加入动物血清孵育1h。最后加入分别由PE和FITC标记的抗-CD44和抗-整合素α2β1抗体,37.5℃孵育1h后漂洗封片。
三、观察指标
(一)Gleason评分
由两位病理学专家对腺泡腺癌患者的一期标本进行Gleason评分,所得结果取均值。
(二)显微镜观察
使用Olympus系列光学显微镜观察第一组标本,放大并随机记录15个视野中染至棕色的细胞所占的比例;采用40倍的高倍视野观察第二组标本,记录CD44和整合素α2β1双标阳性细胞所占比例(以此双标阳性细胞比例代表干细胞比例)。
(三)下尿路症状
记录两组患者治疗前后下尿路症状的改善情况。
四、统计学处理
结 果
一、治疗前后两组患者下尿路症状情况
对照组治疗前有28人出现下尿路症状(尿痛10人,尿潴留13人,尿失禁5人),治疗后为25人(尿痛11人,尿潴留8人,尿失禁6人),治疗前后比较差异无统计学意义(x2=0.48,P>0.05)。
观察组治疗前有30人出现下尿路症状(尿痛12人,尿潴留10人,尿失禁8人),治疗后为4人(尿痛3人,尿潴留1人),治疗前后比较差异有统计学意义(x2=33.97,P<0.05)。
二、SCA mRNA阳性表达情况
原位杂交结果显示,对照组治疗前后癌组织SCAmRNA表达程度无明显变化;观察组治疗前癌组织高表达SCAmRNA,治疗后表达程度明显下降(图1)。治疗前后对照组癌组织SCAmRNA的表达阳性率和含量差异均无统计学意义(73.17% vs 68.29%,73.42±9.12μg/L vs 68.03±8.18μg/L,x2=0.236, P>0.05,t=2.817,P>0.05);治疗后观察组癌组织SCAmRNA的表达阳性率和含量均低于治疗前(31.71%vs78.05%,22.59±8.03μg/L vs 74.05±9.35μg/L),差异均有统计学意义(x2=17.779,P<0.05,t=26.735,P<0.05)。治疗后观察组癌组织SCAmRNA的表达阳性率和含量均低于对照组(31.71%vs68.29%,22.59±8.03μg/L vs 68.03±8.18μg/L),差异均有统计学意义(x2=10.976,P<0.05,t=25.383,P<0.05)。
三、SCAmRNA减少程度与治疗前肿瘤Gleason评分关系
观察组治疗前Gleason评分2-6分、7分和8-10分分别有9例,11例和14例,其SCAmRNA减少程度与治疗前肿瘤的Gleason评分有关,评分越高阳性肿瘤细胞减少的百分比越高(表1)。
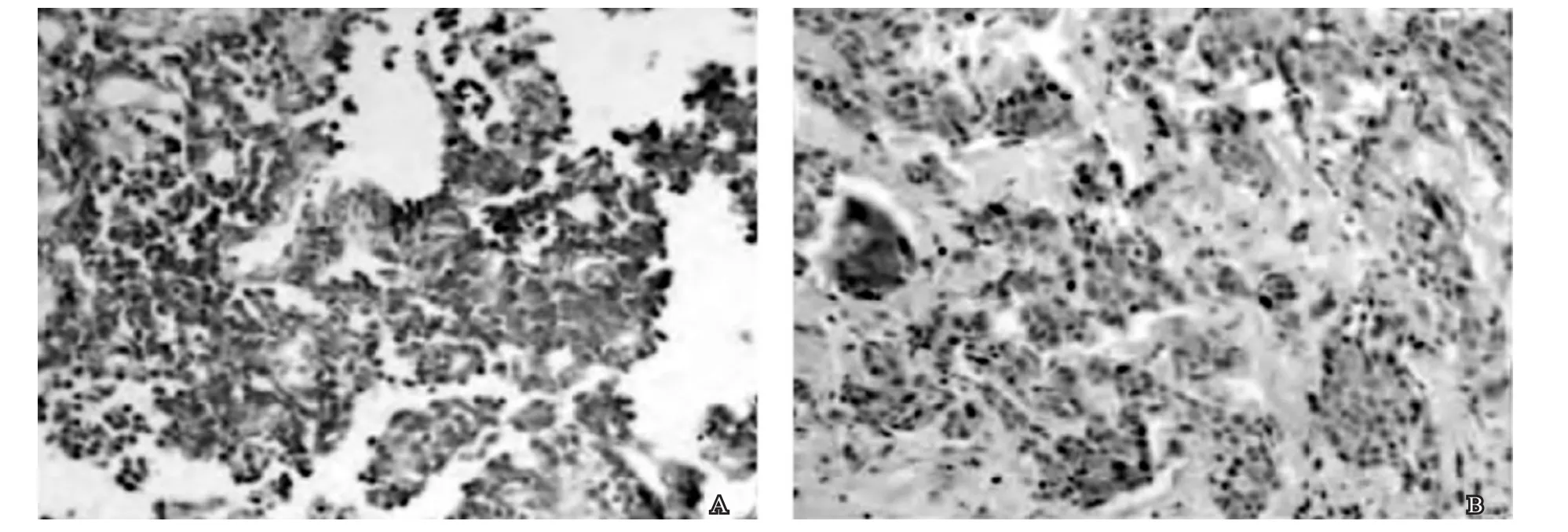
图1 观察组治疗前后SCA mRNA表达情况 (DAB×200)

表1 观察组SCA mRNA表达减少与治疗前肿瘤的Gleason评分的关系
四、治疗前后CD44和整合素α2β1双标阳性干细胞比例的变化
对照组患者一期标本CD44和整合素α2β1双标阳性细胞比例为(9.45±1.69)%,二期标本为(9.37±1.57)%,两者无统计学差异(n=41,t=0.222,P>0.05)。而观察组患者从一期标本的(9.33±1.63)%下降至二期标本的(3.48±1.16)%,差异有统计学意义(n=41,t=18.723,P<0.05)。经过一段时间ADT后,肿瘤组织和癌旁组织中的CD44和整合素α2β1双标阳性细胞大幅下降(图2),治疗前后双标阳性细胞比例的变化可见图3。
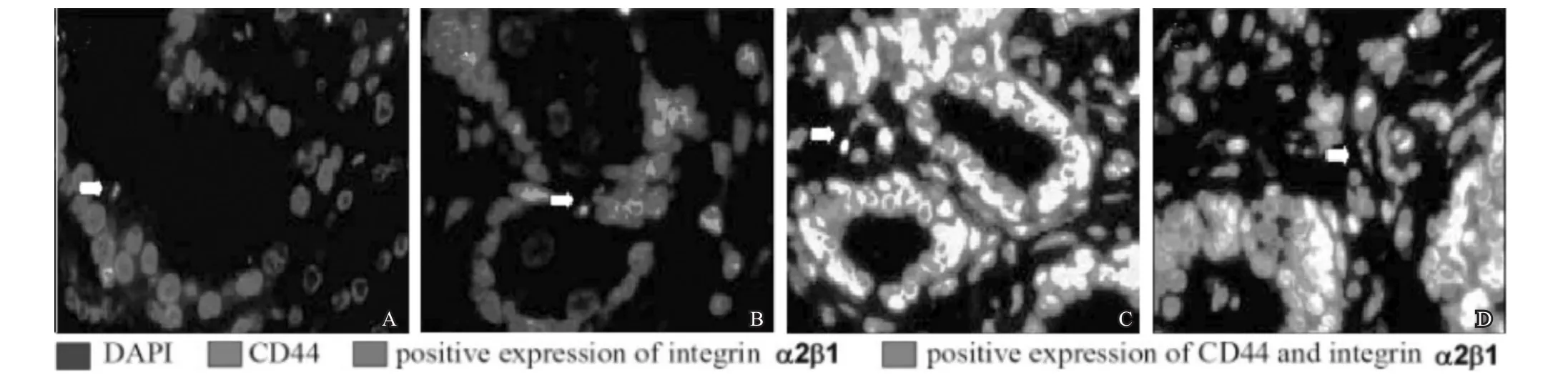
图2 ADT对前列腺癌组织及癌旁组织干细胞比例的影响(免疫组织化学法×20)
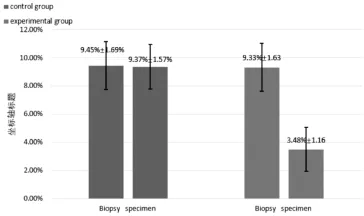
图3 治疗后前列腺癌组织中CD44和整合素α2β1双标阳性细胞比例的变化
讨 论
前列腺癌的发病率有显著的地区差异,在欧美地区较高,在亚洲地区较低。从全世界范围来看,前列腺癌的危害性已跃居泌尿系统恶性肿瘤的第三位,仅次于膀胱癌和肾癌[6,7]。而2010年在美国本土,前列腺癌发病已超过肺癌,排在男性癌性死亡原因的第二位[8]。前列腺癌的治疗方案取决于疾病的临床分期,临床分期主要由肿瘤的进展状态而定:一般而言,前列腺癌最开始局限在前列腺组织之内,然后向周围扩展,侵犯并突破前列腺包膜到达精囊腺附近,进而通过淋巴路径转移到盆腔各路淋巴结,最终达到骨骼和远隔脏器组织。临床上大部分患者主要以排泄困难为主要症状就诊,此时肿瘤已达到棘手的中晚期。
针对中晚期前列腺癌的治疗主要采用内分泌治疗[2]:目前所悉的机制主要是通过使用黄体生成素释放激素类似物、非甾体类抗雄激素制剂、5α-还原酶抑制剂等药物(ADT),或者手术切除睾丸等方法来阻断体内雄激素对前列腺肿瘤及正常组织的作用,达到抑制癌肿生长,延长患者生命的目的;治疗的时机可选在诊断确定后或者疾病出现进展后,分别称为早期治疗和延迟治疗。两种治疗时机的选取各有优缺点:早期治疗易引起患者出现骨质疏松、认知障碍、性功能下降等副反应,但是可以早期控制癌肿的进展;延迟治疗早期出现副反应较少,但往往难以有效控制疾病进程,最终降低了治疗效果,因此,两种治疗时机的选择在临床上的争议极大,本研究中未对此进行分析,尚待临床同行研究指教。此外,有学者[9]发现经过ADT治疗的大部分患者,最终结果是死于非雄激素依赖前列腺癌的进展后,在前列腺癌发展的自然病程、AR基因的表达和扩增、AR的突变、AR共调解因子活性的改变、配体非依赖型AR的活化、癌肿转移中的上皮-间质细胞转化、癌干细胞和激素非依赖前列腺癌的潜在联系等多个方面进行了研究,最后提出了个体化药物治疗的可能[11,12]。本研究中基于对前人经验[3,9]的总结,采用间断ADT治疗,有效避免了副反应的出现,改善了患者的临床症状,取得了满意的结果。
另一方面,我们通过原位杂交检测得到了患者治疗前后SCA mRNA的结果,发现接受ADT的观察组患者SCA mRNA有了明显的下降,与赵志刚等[4]的研究有相似的结果:SCA mRNA是有用的前列腺癌肿瘤标志物,并且可能预测患者的临床预后,它的下降提示了ADT治疗的成功,并提示在患者远期生活质量等方面可能会有所改善。与SCA mRNA一样,我们还选取了CD44和整合素α2β1双标这两项经典前列腺癌干细胞标志物[10],用来监测治疗前后患者肿瘤干细胞比例的变化,结果发现对照组治疗前后变化不明显,而观察组治疗后肿瘤干细胞比例明显下降,与陈伟等[5]的结果相符,提示前列腺肿瘤干细胞具有雄激素依赖性,可通过雄激素阻断达到杀灭干细胞的作用,从而间接抑制前列腺肿瘤干细胞的分化和增殖。
综上所述,雄激素阻断治疗可降低SCA mRNA阳性表达率,降低肿瘤干细胞比例,改善下尿路症状,值得临床进一步分析应用。
1 韩苏军, 张思维, 陈万青, 等. 中国前列腺癌发病现状和流行趋势分析. 临床肿瘤学杂志 2013; 18(4): 330-334
2 黄珊, 张晓智. 前列腺癌内分泌治疗的临床应用. 现代泌尿外科杂志 2012; 17(5): 527-530
3 黄宝星, 宿恒川, 曹万里, 等. 前列腺癌内分泌治疗方法研究及预后分析. 中华男科学杂志 2013; 19(9): 815-819
4 赵志刚, 何军, 张镜伟, 等. 全雄激素阻断治疗抑制人前列腺癌前列腺干细胞抗原mRNA的表达. 现代泌尿生殖肿瘤杂志 2014; 6(1): 42-45
5 陈伟, 王国民. 雄激素阻断治疗后前列腺癌组织中肿瘤干细胞比例变化. 肿瘤防治研究 2014; 41(2): 128-130
6 Schroder FH. Stratifying risk-the U. S. Preventive services task force and prostate-cancer screening. N Engl J Med 2011; 365(21): 1953- 1955
7 阚秀芳, 赵丽晶, 李倩, 等. 前列腺癌诊断模式与发病率的研究进展. 中国老年学杂志 2013; 33 (23) : 6069-6071
8 Siegel R, Naishadham D, Jemal A. Cancer statistics,2012. CA Cancer J Clin 2012; 62(1): 10-29
9 HSIEH Jer-Tsong, 吴开杰, 杨林, 等. 雄激素非依赖性前列腺癌发生的机制. 现代泌尿外科杂志 2010; 15(6): 401-407
10 郝玉美, 刘谦, 宋娜玲. 前列腺癌干细胞相关肿瘤标志物的研究进展. 中国肿瘤临床 2013; 40(19): 1199-1202
11 刘欣, 刘丽丽, 曹靖晨, 等. 前列腺癌干细胞的研究进展.中国男科学杂志 2014; 28(11): 56-60
12 曹尹, 刘凌云, 王洪亮. 间歇性雄激素抑制疗法治疗前列腺癌的Meta分析. 中国男科学杂志 2016; 30(2): 29-36
(2016-08-05收稿)
Effects of androgen deprivation combined with surgical castration therapy on prostate cancer patients’ symptoms and cancer stem cells
Zhu Jun, Zhang Yiping, Cao Tinghu, Hu Jinxin
Department of Urology, Shanghai Baoshan District Combining Traditional Chinese and Western Wedicine Hosprital, Shanghai 201900, China
Objective To investigate the effects of androgen deprivation combined with surgical castration therapy on prostate cancer patients' symptoms and cancer stem cells. Methods Total of 82 patients were enrolled in the study, and they were divided into the control group and the experimental group. Patients in the control group were treated with surgical castration therapy, and the patients in the experimental group with androgen deprivation combined with surgical castration therapy. Nine months later, all patients
prostate cut. The tumor stem cells and clinical symptoms of patients between these two groups were compared. Results Lower urinary tract symptoms of patients in the experiment group were improved obviously (x2=33.97, P<0.05). No changes in positive expression rate of stem cell antigen (SCA) mRNA was found in control group, and decrease in the experiment group[31.71%vs78.05%, 22.59±8.03μg/L vs 74.05±9.35μg/L, P<0.05], and the reduce degree was related to Gleason scores, the higher the Gleason score was, the higher the percentage of positive tumor cell was. Proportion of stem cell remained unchangeable in the control group, but decrease in the other one [ (9.33±1.63) % VS (3.48±1.16)%, t =18.723, P<0.05]. Conclusion Androgen deprivation combined with surgical castration therapy not only reduce the positive expression rate of SCA mRNA, but also decrease the proportion of cancer stem cells and clinical symptoms. This treatment method is worthy of clinical application.
androgen deprivation therapy; orchiectomy; prostatic neoplasms; neoplasic stem cells
10.3969/j.issn.1008-0848.2016.12.004
R 737.25; R 699.8
