miR-222通过调控BCL2L13基因促进HBx-HepG2细胞生长*
2016-06-01余桂芳陈树娣陈雪竹侯开连
余桂芳, 陈树娣, 陈雪竹, 侯开连, 梁 敏
(广州医科大学附属第五医院肿瘤科,广东 广州 510700)
miR-222通过调控BCL2L13基因促进HBx-HepG2细胞生长*
余桂芳△, 陈树娣, 陈雪竹, 侯开连, 梁 敏
(广州医科大学附属第五医院肿瘤科,广东 广州 510700)
目的: 探讨HBx-HepG2 细胞中微小RNA-222(miR-222)对BCL2L13基因表达的调控作用以及对细胞生长和凋亡的影响,并研究其潜在的分子作用机制。方法: 利用实时荧光定量PCR检测miR-222的表达水平;MTT和集落形成实验检测细胞的生长;流式细胞术检测细胞周期和凋亡;构建BCL2L13 3’UTR双萤光素酶报告载体,通过采用双萤光素酶报告实验验证miR-222的靶基因。结果: 与正常的肝细胞 L02相比, miR-222在HBx-HepG2细胞过量表达(P<0.05)。miR-222过表达可促进HBx-HepG2细胞的生长,改变细胞周期,降低细胞的凋亡率;miR-222表达下调可抑制HBx-HepG2细胞的生长,改变细胞周期,增加细胞的凋亡率,和对照组相比差异有统计学显著性(P<0.05)。与正常肝细胞 L02相比,BCL2L13在HBx-HepG2细胞表达下调(P<0.05);miR-222表达下调可促进BCL2L13的表达(P<0.05)。双萤光素酶报告实验和pcDNA3.1-BCL2L13转染实验结果提示miR-222可以通过作用于BCL2L13的3’UTR区,负向调控其表达,从而促进细胞的生长。结论: miR-222可以通过靶向调控BCL2L13基因进而促进HBx-HepG2细胞的生长。
微小RNA-222; HBx-HepG2细胞; 细胞生长; 细胞周期; 细胞凋亡;BCL2L13基因
微小RNA(microRNA,miRNA)是一种内源性的小分子单链RNA,长度介于22~25个碱基。miRNA能够在转录后水平上对基因表达进行调控,其表达与多种人类肿瘤的发展有着密切的关系,miRNA既可作为癌基因促进肿瘤生长,又可作为抑癌基因抑制相关下游靶基因的表达[1-4]。研究发现miRNA-222(miR-222)在多种肿瘤上有着过表达;在肝癌组织中,miR-222 过量表达并且在肿瘤形成过程中具有促进肝癌细胞的生长、侵袭和转移的能力[5-8]。目前miR-222在肝癌细胞中,特别是表达乙肝病毒X蛋白(hepatitis B virus X protein, HBx)的肝癌细胞HBx-HepG2中的作用机制尚不清楚,本研究通过生物信息学方法预测miR-222的靶基因,利用双萤光素酶报告系统进行检测,通过分子生物学技术证实了miR-222通过作用于BCL2L13基因对HBx-HepG2细胞生长产生影响,从而进一步解释了miR-222影响HBx-HepG2生长的分子作用机制。
材 料 和 方 法
1 主要材料
HBx-HepG2细胞株是之前实验构建的稳定表达HBx的HepG2细胞株[9]; L02 和 HEK293T细胞株购自上海中科院细胞库;RPMI-1640培养液和胎牛血清购自HyClone; miR-222模拟物(miR-222 mimics)、miR-222抑制物(miR-222 inhibitor)、无关序列模拟物对照(miR-control,miR-Ctrl)、抑制物对照(miR inhibitor-Ctrl)以及miR-222的引物均购于广州瑞博生物科技有限公司;High Pure miRNA Isolation Kit 购于Roche;miRNA-222 cDNA Synthesis Kit和Lipofectamine 2000购于Invitrogen;miR-222荧光定量PCR试剂盒购于TaKaRa;pmirGLO质粒和pcDNA3.1-BCL2L13质粒购于上海捷瑞生物工程有限公司;双萤光素酶报告基因试剂盒购于Promega;MTT购于Sigma; Annexin V-FITC/PI凋亡试剂盒购于东仁化学科技有限公司。
2 主要方法
2.1 细胞培养 HBx-HepG2细胞,L02细胞用含有10%胎牛血清的RPMI-1640培养液,置于37 ℃、5% CO2的细胞培养箱内常规培养,消化传代。当6孔板里每孔细胞数量达2×105细胞时,用不含双抗的培养液培养24 h, 细胞融合率达80%时采用Lipofectamine 2000试剂进行转染,在转染miR-222的实验中,实验分为miR-222 mimics组和miR-222 inhibitor组,以及各自的对照组miR-Ctrl和 miR inhibitor-Ctrl;在转染pcDNA3.1-BCL2L13实验中,实验分为pcDNA3.1空质粒组和pcDNA3.1-BCL2L13组。转染后24 h收集细胞进行各项检测。
2.2 实时荧光定量PCR(RT-qPCR)检测细胞miR-222以及BCL2L13的表达 使用High Pure miRNA Isolation Kit以及TRIzol分别提取miRNA和mRNA, 然后将miRNA或者mRNA逆转录成cDNA; 采用荧光定量PCR 仪扩增检测miR-222和BCL2L13目的片段。miR-222以U6为内参照,BCL2L13以GAPDH为内参照,采用2-ΔΔCt方法分析结果,每组设3个复孔,实验重复3次。
2.3 MTT法检测细胞活力 取对数生长期的HBx-HepG2细胞每孔1×104个细胞接种在96孔板中预培养24 h, 然后按照2.1分组转染细胞,转染24 h的HBx-HepG2细胞每孔加入MTT 20 μL 继续培养4 h 后小心吸弃孔内培养上清液,每孔加入DMSO 150 μL,用酶联免疫标记分析仪在570 nm 波长处测定各孔的吸光度A值,按下列公式计算细胞生长率(%)=实验组A值/对照组A值×100%。为了检测BCL2L13对细胞活力的影响,取对数生长期的HBx-HepG2细胞以每孔1×104接种在96孔板中预培养24 h, 然后按照2.1分组(pcDNA3.1组与pcDNA3.1-BCL2L13组)转染细胞,对转染24 h的HBx-HepG2细胞进行MTT检测。
2.4 细胞平板克隆形成实验 将转染24 h 的HBx-HepG2细胞接种于6 孔培养板,每孔2 mL,充分混匀,常规培养10 d,每组3个复孔。每隔3 d更换新鲜培养液继续培养。倒尽培养基,生理盐水洗涤2遍,空气干燥后75%乙醇固定15 min,0.5%结晶紫染色2 h,清水洗净干燥。显微镜下观察拍照,形成的克隆(≥50个细胞为1个克隆)计数。
2.5 流式细胞术检测细胞凋亡 将转染48 h的HBx-HepG2细胞用PBS洗涤,加入70% 冷乙醇固定后重新收集细胞,PBS洗去固定液,加入RNA 酶反应过夜,与碘化丙啶(propidium iodide,PI)染液混匀后,用流式细胞仪作流式细胞分析,激发波长为488 nm,并用ModFit LT 2.0 软件分析细胞周期分布及凋亡情况。计算各期细胞所占比例。Annexin V-FITC/PI双染后检测细胞凋亡率。
2.6 双萤光素酶报告基因系统验证miR-222对BCL2L13 基因的调控作用 根据TargetScan靶基因预测数据库预测miR-222的靶基因,我们发现BCL2L13为miR-222的潜在靶基因并寻找出与miR-222 互补配对的BCL2L13 3’UTR区。提取正常基因组,PCR扩增包含有miR-222结合位点的BCL2L13 3’UTR区,回收纯化后插入到pmirGLO载体多克隆位点中,载体命名为pmirGLO-BCL2L13-wide type(BCL2L13-3’UTR-WT); 设计针对BCL2L13 3’UTR“种子区”的突变引物,插入到pmirGLO载体多克隆位点中,载体命名为pmirGLO-BCL2L13-mutant(BCL2L13-3’UTR-Mut)。萤光素酶报告载体BCL2L13-3’UTR-WT和BCL2L13-3’UTR-Mut分别与miR-222 mimics和miR-222 inhibitor,以及各自的对照(miR-Ctrl和miR inhibitor Ctrl)两两组合共转染到HEK293T 细胞中。每组设3个复孔。转染48 h后收集细胞按照萤光素酶报告基因检测试剂盒说明书测定各组细胞萤火虫萤光素信号及海肾萤光素信号。
3 统计学处理
采用SPSS 16.0软件进行数据分析。所有数据以均数±标准差(mean±SD)表示,两组间均数的比较采用Student’st检验,多组间均数的比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 HBx-HepG2细胞中miR-222的表达
RT-qPCR结果发现HBx-HepG2细胞中的miR-222表达显著高于对照细胞株L02中miR-222的表达 (P<0.05),见图1A。 miR-222 mimics转染组HBx-HepG2细胞中的miR-222表达水平与miR-Ctrl相比显著升高(P<0.05); 而miR-222 inhibitor转染组HBx-HepG2细胞中的miR-222表达水平与miR inhibitor-Ctrl相比显著降低(P<0.05),见图1B。
2 miR-222对HBx-HepG2细胞生长、细胞周期以及凋亡的影响
MTT法检测结果显示,miR-222 mimics 转染组HBx-HepG2细胞的生存率显著高于miR-Ctrl组(P<0.05);而miR-222 inhibitor转染组HBx-HepG2细胞的生存率显著低于miR inhibitor-Ctrl组(P<0.05),见图1C。细胞平板克隆形成实验的结果可见,miR-222 mimics转染组的HBx-HepG2集落形成数目显著高于miR-Ctrl组(P<0.05);而miR-222 inhibitor转染组的HBx-HepG2集落形成数目显著低于miR inhibitor-Ctrl组(P<0.05),见图1D。流式细胞术实验结果发现,miR-222 mimics转染组HBx-HepG2的G0/G1细胞比例下降和S期细胞比例上升(P<0.05)并且细胞凋亡率与miR-Ctrl组相比显著降低(P<0.05);而miR-222 inhibitor转染组HBx-HepG2的G0/G1细胞比例上升和S期细胞比例下降(P<0.05);细胞凋亡率与miR inhibitor-Ctrl组相比显著升高(P<0.05),见图2。
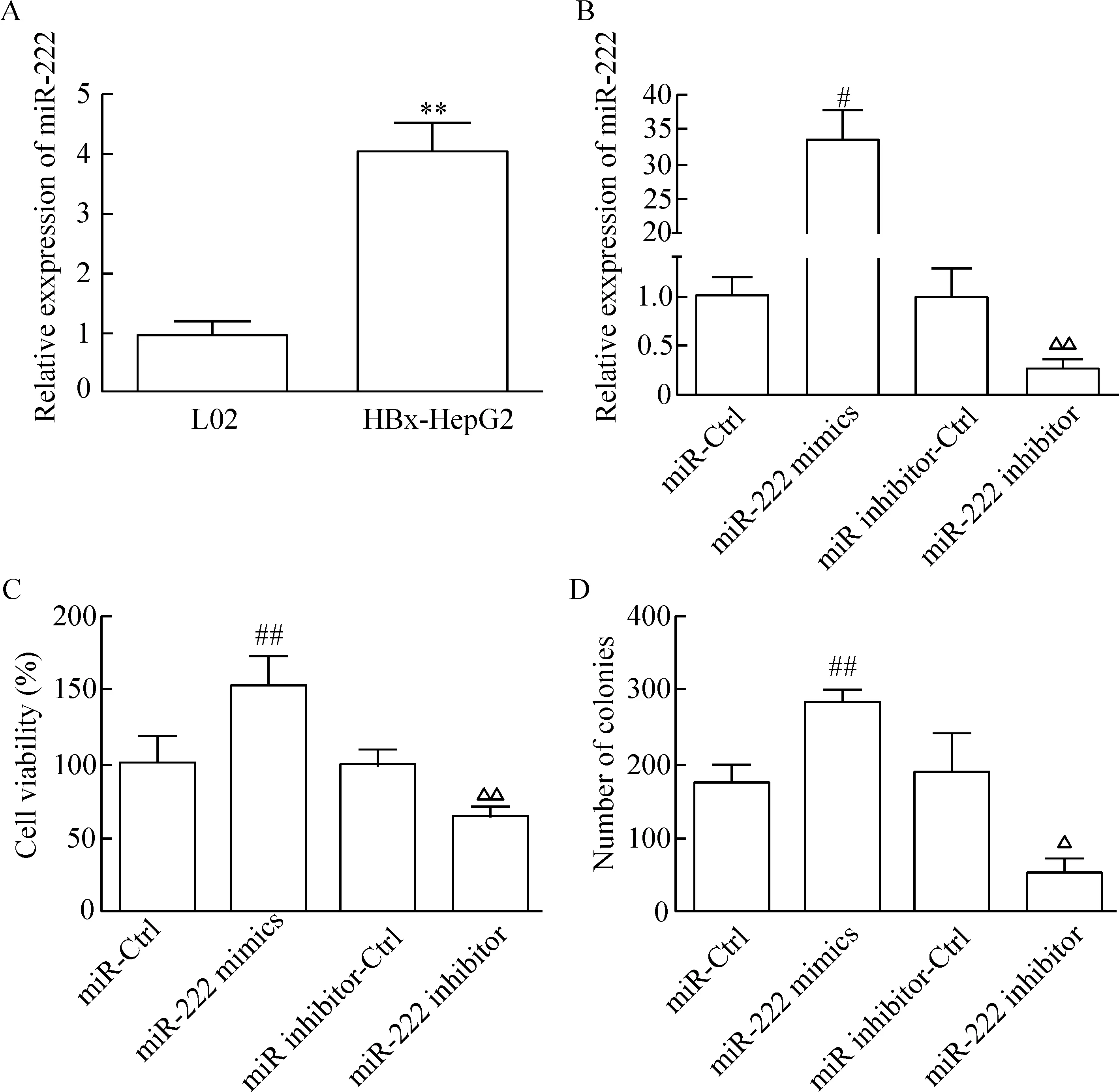
Figure 1.The effect of miR-222 on the growth of HBx-HepG2 cells. A: the expression of miR-222 in L02 and HBx-HepG2 cells; B: the effect of miR-222 mimics or miR-222 inhibitor transfection on miR-222 expression; C: the effect of miR-222 on the viability of HBx-HepG2 cells; D: the effect of miR-222 on colony formation of HBx-HepG2 cells. Mean±SD.n=3.**P<0.01vsL02;#P<0.05,##P<0.01vsmiR-Ctrl;△P<0.05,△△P<0.01vsmiR inhibitor-Ctrl group.
图1 miR-222 对HBx-HepG2细胞生长的影响
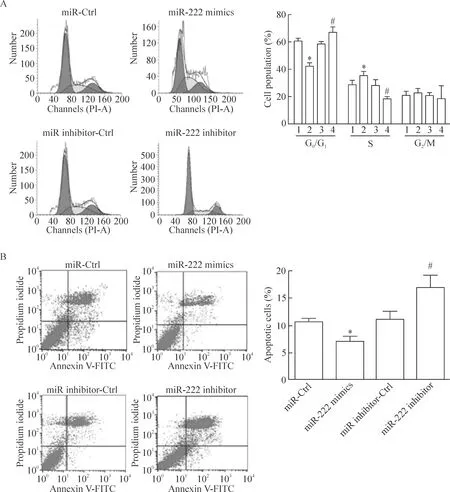
Figure 2.The effect of miR-222 on the cell cycle and apoptotic rate in the HBx-HepG2 cells. A: the effect of miR-222 mimics or miR-222 inhibitor transfection on the cell cycle; B: the effect of miR-222 mimics or miR-222 inhibitor transfection on the apoptotic rate. 1: miR-Ctrl; 2: miR-222 mimics; 3: miR inhibitor-Ctrl; 4: miR-222 inhibitor. Mean±SD.n=3.*P<0.05vsmiR-Ctrl;#P<0.05vsmiR inhibitor-Ctrl group. 图2 miR-222对HBx-HepG2细胞周期以及凋亡率的影响
3 miR-222对BCL2L13 3’UTR表达的影响
采用双萤光素酶报告基因检测各组萤光信号的变化。实验结果发现,miR-222 mimics和BCL2L13-3’ UTR-WT共转染HEKT293细胞后,细胞的萤光素酶与对照组相比明显受到抑制;miR-222 inhibitor和BCL2L13-3’ UTR-WT共转染细胞后,细胞的萤光素酶与对照组相比明显升高(P<0.05)。而miR-222 mimics或者miR-222 inhibitor和BCL2L13-3’ UTR-Mut共转染细胞后, 萤光素酶的表达水平与对照组相比差异无统计学显著性(P>0.05),见图3。
4BCL12L13在HBx-HepG2中的表达及其对细胞生长的影响
RT-qPCR实验结果发现,BCL12L13在HBx-HepG2细胞中的表达水平显著低于正常肝细胞L02的表达水平(P<0.05),见图4A。同时,在HBx-HepG2转染miR-222 inhibitor后,BCL2L13的表达水平明显高于只转染miR inhibitor-Ctrl的细胞(P<0.05),见图4B。转染pcDNA3.1-BCL2L13载体能够显著提高HBx-HepG2细胞中BCL2L13的表达水平(P<0.05),见图4C。同时转染pcDNA3.1-BCL2L13载体的HBx-HepG2细胞生存率明显低于转染了空载体的HBx-HepG2细胞(P<0.05),见图4D。
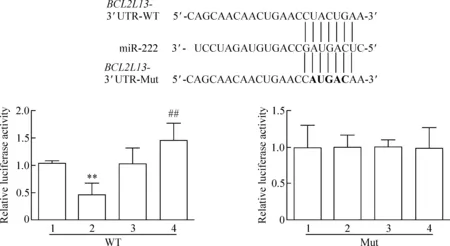
Figure 3. The targeted inhibition ofBCL2L13 expression in the HEKT293 cells by miR-222 detected by dual-luciferase reporter assay. 1: miR-Ctrl; 2: miR-222 mimics; 3: miR inhibitor-Ctrl; 4: miR-222 inhibitor. Mean±SD.n=3.**P<0.01vsmiR-Ctrl;##P<0.01vsmiR inhibitor-Ctrl.
图3 双萤光素酶报告系统检测提示miR-222靶向抑制HEKT293细胞中BCL2L13基因表达
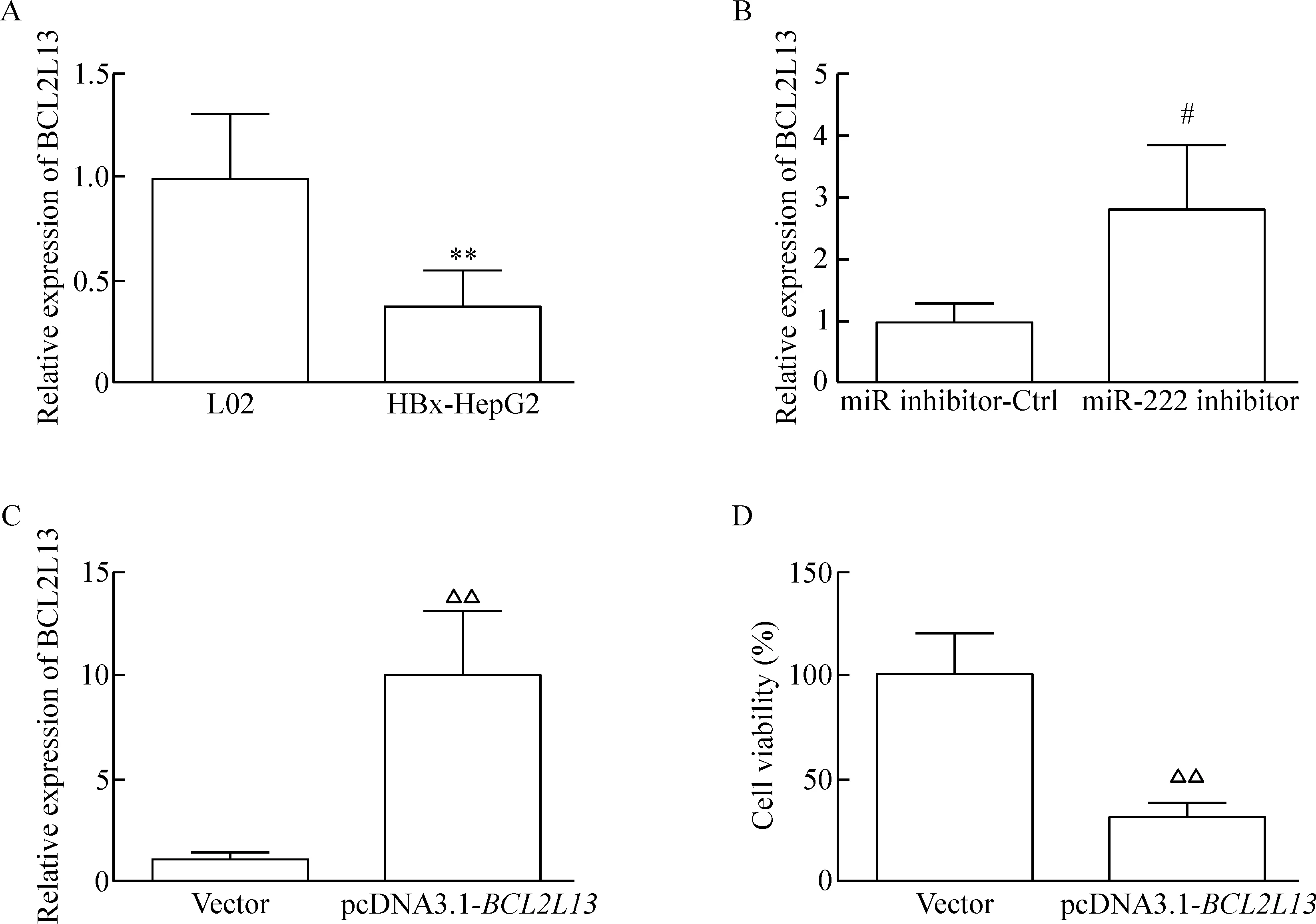
Figure 4.BCL2L13 was down-regulated in the HBx-HepG2 cells and inhibited cell growth. A: the expression ofBCL2L13 in the L02 and HBx-HepG2 cells; B: the effect of miR-222 inhibitor transfection on the expression level ofBCL2L13; C: the effect of pcDNA3.1-BCL2L13 transfection on the expression ofBCL2L13; D: the effect of pcDNA3.1-BCL2L13 transfection on the viability of HBx-HepG2 cells. Mean±SD.n=3.**P<0.01vsL02;#P<0.05vsmiR inhibitor-Ctrl;△△P<0.01vsvector.
图4BCL2L13在HBx-HepG2细胞中下调并且可以抑制细胞生长
讨 论
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶行肿瘤之一,死亡率位于世界第4,慢性乙肝病毒感染是其发病的主要原因之一[10-11]。HBx是HBV 4个开放读码框中的X-ORF编码的病毒蛋白,为含有154个氨基酸的多肽,分子量为17.5 kD,研究发现HBx促进了与其相关的HCC的发展[12-13]。HBx蛋白通过与不同宿主因素相互作用来调节细胞信号转导,转录调控,细胞周期进程,DNA修复,细胞凋亡和遗传稳定性[14]。前期的实验中我们成功建立了稳定表达HBx的HCC细胞模型,并且发现稳定表达的HBx促进HepG2细胞的增殖,本实验在前面基础上进一步研究其分子机制,为寻找新的早期诊断标志和治疗靶点提供依据。
miRNA既可作为癌基因促进肿瘤生长,又可作为抑癌基因抑制相关下游靶基因的表达[2]。研究发现miR-222在多种肿瘤上有着过表达;在肝癌组织中,miR-222 过量表达并且在肿瘤形成过程中具有促进肝癌细胞的生长、侵袭和转移的能力[5-8]。进一步的研究发现miR-222的过表达与肝癌细胞的转移有关,而且miR-222是通过AKT信号通路来影响肝癌细胞转移的[15]。同时研究发现miR-222能够通过抑制GNAI3的表达来促进肝癌细胞的转移和入侵[16]。miR-222的过量表达能够下调p27的表达从而来促进肝癌细胞的增长[5]。本研究第一次在HBx-HepG2细胞上证明miR-222的过表达可以促进细胞的增长,而miR-222影响HBx-HepG2细胞的增长可能是通过调控细胞周期,降低细胞的凋亡率而实现的。
我们通过生物信息学分析发现BCL2L13基因是miR-222的一个潜在靶点,双萤光素酶报告实验和pcDNA3.1-BCL2L13转染实验结果提示miR-222可以通过作用于BCL2L13的3’UTR区,负向调控其表达,从而促进细胞的生长。BCL2L13属于Bcl-2家族中的一员,BCL2L13的过表达可以促进细胞的凋亡[17]。尽管BCL2L13基因与细胞的凋亡有关,但是其具体的分子机制还是有很多争议。研究发现BCL2L13基因的过表达与小孩急性白血病的生存率呈负相关[18]。在多型性神经胶母细胞中,BCL2L13能够抑制化疗药物引起的细胞凋亡[19]。而本实验发现BLC2L13 的过表达可以抑制HBx-HepG2的生长。这些具有争议的结果可能因为不同的细胞系或是不同的癌症种类。BCL2L13基因在 HBx-HepG2细胞中的分子机制可能还需要进一步的研究。
综上所述,miR-222可以通过靶向调控BCL2L13基因进而促进HBx-HepG2细胞的生长。为了进一步阐述miR-222在HBx-HepG2中的机制,我们将来的实验有必要观察miR-222在临床样本中的表达情况,从而进一步确认miR-222 在慢性乙肝病毒感染肝癌中的临床意义。
[1] Cheng G. Circulating miRNAs: roles in cancer diagnosis, prognosis and therapy[J]. Adv Drug Deliv Rev, 2015, 81:75-93.
[2] Croce CM, Calin GA. miRNAs, cancer, and stem cell division[J]. Cell, 2005, 122(1):6-7.
[3] Thorgeirsson SS, Lee JS, Grisham JW. Functional geno-mics of hepatocellular carcinoma[J]. Hepatology, 2006, 43 (2 Suppl 1): S145-S150.
[4] 嵇晓辉,范秉琳,张红鸽,等. MicroRNA-100对肝癌细胞增殖活力和细胞周期的影响[J]. 中国病理生理杂志, 2013, 29(1):108-111.
[5] Yang YF, Wang F, Xiao JJ, et al. miR-222 overexpression promotes proliferation of human hepatocellular carcinoma HepG2 cells by downregulating p27[J]. Int J Clin Exp Med, 2014, 7(4):893-902.
[6] Zhong C, Ding S, Xu Y, et al. MicroRNA-222 promotes human non-small cell lung cancer H460 growth by targeting p27[J]. Int J Clin Exp Med, 2015, 8(4): 5534-5540.
[7] Liu S, Sun X, Wang M, et al. A microRNA 221- and 222-mediated feedback loop maintains constitutive activation of NFκB and STAT3 in colorectal cancer cells[J]. Gastroenterology, 2014, 147(4):847-859.e11.
[8] Liu W, Song N, Yao H, et al. miR-221 and miR-222 simultaneously target RECK and regulate growth and invasion of gastric cancer cells[J]. Med Sci Monit, 2015, 21:2718-2725.
[9] 余桂芳, 严跃红, 王瑞鑫,等. 慢病毒介导HBV X基因稳定表达HepG2细胞系的建立[J]. 世界华人消化杂志, 2012, 20(8):638-643.
[10]Motavaf M, Safari S, Saffari Jourshari M, et al. Hepatitis B virus-induced hepatocellular carcinoma: the role of the virus x protein[J]. Acta Virol, 2013, 57(4):389-396.
[11]Guerrieri F, Belloni L, Pediconi N, et al. Molecular mechanisms of HBV-associated hepatocarcinogenesis[J]. Semin Liver Dis, 2013, 33(2):147-156.
[12]Bouchard MJ, Schneider RJ. The enigmatic X gene of hepatitis B virus[J]. J Virol, 2004, 78(23):12725-12734.
[13] 崔利园,张钊瑞,费洪荣,等. 乙肝病毒X蛋白相互作用蛋白促进HepG2细胞迁移并调节β-catenin表达[J]. 中国病理生理杂志, 2012, 28(6): 1128-1131.
[14]Riviere L, Ducroux A, Buendia MA. The oncogenic role of hepatitis B virus[J]. Recent Results Cancer Res, 2014, 193:59-74.
[15]Wong QW, Ching AK, Chan AW, et al. miR-222 overexpression confers cell migratory advantages in hepatocellular carcinoma through enhancing AKT signaling[J]. Clin Cancer Res, 2010, 16(3):867-875.
[16]Zhang Y, Yao J, Huan L, et al. GNAI3 inhibits tumor cell migration and invasion and is post-transcriptionally regulated by miR-222 in hepatocellular carcinoma[J]. Cancer Lett, 2015, 356(2 Pt B):978-984.
[17]Kataoka T, Holler N, Micheau O, et al. Bcl-rambo, a novel Bcl-2 homologue that induces apoptosis via its unique C-terminal extension[J]. J Biol Chem, 2001, 276(22):19548-19554.
[18]Yang YL, Lin SR, Chen JS, et al. Expression and prognostic significance of the apoptotic genesBCL2L13,Livin, andCASP8AP2 in childhood acute lymphoblastic leukemia[J]. Leuk Res, 2010, 34(1):18-23.
[19]Jensen SA, Calvert AE, Volpert G, et al.BCL2L13 is a ceramide synthase inhibitor in glioblastoma[J]. Proc Natl Acad Sci U S A, 2014, 111(15): 5682-5687.
(责任编辑: 林白霜, 罗 森)
miR-222 enhances HBx-HepG2 cell growth via regulation ofBCL2L13 gene
YU Gui-fang, CHEN Shu-di, CHEN Xue-zhu, HOU Kai-lian, LIANG Min
(DepartmentofOncology,TheFifthAffiliatedHospitalofGuangzhouMedicalUniversity,Guangzhou510700,China.E-mail:guifangyu1023@sina.com)
AIM: To investigate the regulation of miR-222 onBCL2L13 gene and its effect on the growth and apoptosis of HBx-HepG2 cells, and to explore the underlying molecular mechanisms. METHODS: The expression level of miR-222 was detected by RT-qPCR. The HBx-HepG2 cell growth was examined by MTT and colony formation assays. The cell cycle and apoptosis were analyzed by flow cytometry. The recombination vector pmirGLO-BCL2L13 was constructed, and dual-luciferase reporter experiment was performed to validate the target of miR-222. RESULTS: The expression level of miR-222 in the HBx-HepG2 cells was significantly higher than that in the L02 cells (P<0.05). Over-expression of miR-222 enhanced HBx-HepG2 cell growth, changed cell cycle, and inhibited apoptosis (P<0.05). Knockdown of miR-222 reduced HBx-HepG2 cell growth, changed cell cycle, and increased cell apoptotic rate (P<0.05).BCL2L13 was down-regulated in the HBx-HepG2 cells as compared with L02 cells (P<0.05), and knockdown of miR-222 in the HBx-HepG2 cells increased the expression level ofBCL2L13 (P<0.05). The results of dual-luciferase reporter assay and restore experiment showed that miR-222 negatively regulated the expression ofBCL2L13 via targeting 3’UTR ofBCL2L13, resulting in the promotion of HBx-HepG2 cell growth. CONCLUSION: miR-222 enhances HBx-HepG2 cell growth via down-regulation ofBCL2L13.
MicroRNA-222; HBx-HepG2 cells; Cell growth; Cell cycle; Apoptosis;BCL2L13 gene
1000- 4718(2016)08- 1389- 06
2015- 11- 25
2016- 07- 06
广东省科技计划项目(No. 20130319c)
R363
A
10.3969/j.issn.1000- 4718.2016.08.008
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-32208059; E-mail: guifangyu1023@sina.com
