氙气减轻庆大霉素诱导的大鼠急性肾损伤
2016-06-01丁小强
贾 平, 丁小强
复旦大学附属中山医院肾内科,上海 200032
·论著·
氙气减轻庆大霉素诱导的大鼠急性肾损伤
贾平, 丁小强*
复旦大学附属中山医院肾内科,上海200032
[摘要]目的: 观察氙气对庆大霉素肾毒性的预防作用。方法: 选择雄性Wistar大鼠48只,随机分成4组。模型组:腹腔注射硫酸庆大霉素100 mg/(kg·d),连续7 d;对照组:腹腔注射等体积的0.9%氯化钠液;氙气处理组:先予70%氙气+30%氧气暴露2 h,24 h后予庆大霉素100 mg/(kg·d)腹腔注射,连续7 d,此间分别于第2、4、6天给药前再次给予70%氙气+30%氧气暴露30 min;氮气处理组:作为氙气处理的对照,将氙气改为70%氮气,方法同氙气处理组。分别于给药结束后第2、4天检测各组大鼠肾功能、肾脏形态学及氧化应激指标。结果: 与对照组相比,模型组与氮气处理组大鼠在给药结束后第2、4天,肾功能明显减退,表现为血肌酐与尿素氮水平明显升高;肾小管损伤指数明显增大;氧化应激指标丙二醛浓度也高于对照组,超氧化物歧化酶活性下降(P<0.01)。而氙气处理组与模型组、氮气处理组相比,肾损伤程度明显减轻,表现为血肌酐、尿素氮浓度降低,肾小管损伤指数减小,肾组织丙二醛浓度也降低,超氧化物歧化酶活性升高(P<0.01)。结论: 间断氙气干预可以减轻庆大霉素诱导的大鼠急性肾损伤。
[关键词]氙气; 庆大霉素; 急性肾损伤; 氧化应激
抗生素引起急性肾损伤(acute kidney injury,AKI)在临床上较为常见,尤其常见于氨基糖苷类药物。药物肾毒性一方面限制了该药的临床应用,另一方面,肾损伤的发生使患者病情更复杂,预后更差。氙气是一种吸入性麻醉剂,但研究[1-3]发现其具有独立于麻醉作用之外的器官(如心、脑、肾)保护作用。本研究采用庆大霉素(gentamicin, GM)诱导大鼠急性肾损伤模型,研究氙气对肾毒性的干预作用。
1材料与方法
1.1实验动物及分组清洁级雄性Wistar大鼠48只,体质量200~250 g,购自复旦大学上海医学院实验动物中心。将大鼠随机分为4组, 每组12只。模型组(Gent)大鼠给予腹腔注射100 mg/(kg·d)硫酸庆大霉素,连续7 d;对照组(Control)大鼠腹腔注射等剂量0.9%氯化钠液,连续7 d;氙气处理组(Xe+gent):先予70%氙气+30%氧气暴露2 h,24 h后予庆大霉素100 mg/(kg·d)腹腔注射,连续7 d,此间分别于第2、4、6天给药前再次给予70%氙气+30%氧气暴露30 min;氮气处理组(N2+gent):将氙气改为70%氮气,方法同氙气处理组。
1.2血肌酐和尿素氮的测定于给药结束后第2、4天,分别处死6只大鼠,留取血标本,采用酶法测定血肌酐浓度,用尿素酶-谷氨酸脱氢酶(GLDH)法测定尿素氮浓度。
1.3组织病理学检查肾组织以10%多聚甲醛溶液固定,常规石蜡包埋,苏木精-伊红(hematoxylin- eosin, H-E)染色切片,在光镜下观察肾组织形态学变化,作肾小管损伤评分。肾小管损伤评分根据盲法原则由病理医师完成,采用Jablonski评分法:正常为0分,肾小管间质受损≤25%为1分,25%~50%为2分(包括50%),50%~75%为3分(包括75%),>75%为4分;作半定量分析。
1.4肾组织氧化应激指标检测硫代巴比妥酸反应物(TBARS)显色法检测肾组织匀浆中丙二醛(malondialdehyde, MDA)浓度。采用TBARS试剂盒(TBARS Assay Kit, 美国Cayman Chemical公司)检测,具体操作按照其说明书进行。黄嘌呤氧化酶法检测超氧化物歧化酶(superoxide dismutase, SOD) 活性,试剂盒购自南京建成生物工程研究所。
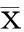
2结果
2.1氙气改善庆大霉素引起的大鼠肾功能异常结果(表1)表明:模型组和氮气处理组大鼠在给药结束后第2天和第4天,肾功能明显减退,表现为血肌酐与尿素氮值显著升高,而氙气处理组大鼠肾功能损伤的程度较模型组和氮气处理组明显减轻(P<0.01)。见表1。
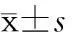
表1 各实验组大鼠肾功能指标的变化 n=6,
**P<0.01与模型组比较,△△P<0.01与氮气处理组比较
2.2氙气可改善大鼠肾脏组织学变化组织形态学上(图1),模型组和氮气处理组大鼠在给药结束后第2、4天,肾脏近端小管上皮细胞出现广泛的坏死、脱落,基底膜断裂,伴有间质水肿和炎细胞浸润,可见蛋白管型。而氙气处理组大鼠肾脏病理损伤较模型组和氮气处理组明显减轻,肾小管损伤指数也明显低于后两组(P<0.01)。

图1 各组大鼠组织学表现
A:各组大鼠在给药后第2、4天时肾脏组织学改变,H-E染色(×100);B:各组大鼠肾小管损伤指数评分.**P<0.01与模型组(Gent)比较;△△P<0.01与氮气处理组(N2+gent)比较
2.3氙气减轻庆大霉素引起的大鼠肾脏组织氧化应激水平MDA和SOD是脂质过氧化的产物,是反映氧化应激损伤的常用指标。结果(图2)表明:在给药结束后第4天,模型组和氮气处理组大鼠肾组织中MDA含量明显升高,而氙气处理组大鼠肾组织MDA含量则明显低于模型组与氮气处理组(P<0.01)。模型组和氮气处理组肾组织SOD含量明显下降,而氙气处理组SOD含量显著高于模型组和氮气处理组(P<0.01)。
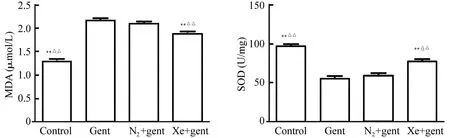
图2 各组大鼠在给药后第4天肾组织MDA和SOD含量**P<0.01与模型组(gent)比较;△△P<0.01与氮气处理组(N2+gent)比较.n=6,
3讨论
肾毒性是氨基糖苷类抗生素最常见的不良反应。10%~20%患者在应用常规剂量的氨基糖苷类药物时出现肾损伤[4]。GM引起肾损伤的机制包括多方面,其中肾小管上皮细胞毒性是最重要的环节,其损伤程度与GM的使用剂量、时间以及药物在肾小管上皮细胞中的蓄积程度等有关。本研究发现,庆大霉素组(模型组)及氮气处理组大鼠在用药后第2天,肾皮质及近髓外带近曲小管出现广泛而严重的上皮细胞坏死、脱落,基底膜裸露、断裂,大鼠肾脏功能明显减退;而氙气处理组大鼠肾小管损伤较模型组明显减轻,血肌酐、尿素氮浓度也较模型组明显减低,提示氙气处理可以减轻庆大霉素引起的肾小管损伤,改善肾功能。
氧化应激是GM诱导急性肾损伤的重要机制[4]。研究[5]发现,GM可以促使肾皮质中活性氧簇(reactive oxygen species, ROS)增加,如超氧化物阴离子、羟自由基和反应性氮族,并最终导致肾脏结构和功能的异常。GM还可以显著增加肾皮质中脂质过氧化水平和蛋白质氧化[6]。ROS一方面会破坏细胞内的蛋白、脂质和核酸,从而影响细胞功能,导致细胞死亡;一方面会引起肾小球和血管的收缩,影响肾小球滤过率[7]。我们在实验中发现,大鼠在注射GM后肾组织中氧化应激指标MDA浓度明显升高,而抗氧化指标SOD活性显著降低;氙气干预后,肾组织中 MDA浓度明显降低,同时,抗氧化指标SOD活性显著升高,说明氙气可以减轻GM引起的肾脏氧化应激损伤。
氙气是常压下唯一具有麻醉作用的气体,麻醉起效快、作用消失迅速。氙气除具有吸入麻醉剂的理想属性外,还具有器官保护作用。研究[1-3]证明,氙气对神经系统、心脏、肾脏等重要器官有保护作用, 并且可产生预适应效应,而这种器官保护作用独立于其麻醉作用之外。Rizvi等[8]应用氦、氖、氩、氪、氙5种惰性气体分别预处理人类肾小管上皮细胞3 h,然后除去培养基中的糖和氧,造成细胞损伤,发现只有氙气能够提高肾小管上皮细胞的成活力,具有细胞保护作用,并且氙气能增加蛋白激酶B的磷酸化水平和低氧诱导因子-1α的表达。本研究发现,氙气明显减轻GM诱导的肾脏损伤可能与其抑制氧化应激有关,而具体机制有待于进一步研究明确。
参考文献
[1]Harris K, Armstrong SP, Campos-Pires R, et al. Neuroprotection against traumatic brain injury by xenon, but not argon, is mediated by inhibition at the N-methyl-D-aspartate receptor glycine site[J]. Anesthesiology, 2013,119(5):1137-1148.
[2]Jia P, Teng J, Zou J, et al. Xenon protects against septic acute kidney injury via miR-21 target signaling pathway[J]. Crit Care Med, 2015, 43(7): e250-e259.
[3]Li Q, Lian C, Zhou R, et al. Pretreatment with xenon protected immature rabbit heart from ischaemia/reperfusion injury by opening of the mitoKATP channel[J]. Heart Lung Circ, 2013,22(4):276-283.
[4]Lopez-Novoa JM, Quiros Y, Vicente L, et al. New insights into the mechanism of aminoglycoside nephrotoxicity: an integrative point of view [J]. Kidney Int, 2011, 79(1): 33-45.
[5]Maldonado PD, Barrera D, Rivero I, et al. Antioxidant S-allylcysteine prevents gentamicin-induced oxidantive stress and renal damage [J]. Free Rad Biol Med, 2003, 35(3): 317-324.
[6]Cuzzocrea S, Mazzon E, Dugo L, et al.A role for superoxide in gentamicin-mediated nephropathy in rats[J]. Eur J Pharmacol, 2002, 450(1): 67-76.
[7]Förstermann U. Nitric oxide and oxidative stress in vascular disease[J]. Pflugers Arch, 2010, 459(6): 923-939.
[8]Rizvi M, Jawad N, Li Y, et al. Effect of noble gases on oxygen and glucose deprived injury in human tubular kidney cells[J]. Exp Biol Med(Maywood), 2010, 235(7):886-891.
[本文编辑]姬静芳
Xenon reduces gentamicin-induced acute kidney injury in rats
JIA Ping, DING Xiao-qiang*
Department of Nephrology, Zhongshan Hospital, Fudan University, Shanghai 200032, China
[Abstract]Objective: To observe the effect of xenon exposure on gentamicin-induced acute kidney injury.Methods: 48 male Wistar rats were randomly divided into four groups as follows: the model group, where rats were given intraperitoneal (i.p.) injection of gentamicin sulfate solution 100 mg/(kg·d) for 7 days; the control group, where rats were intraperitoneally administrated physiological saline (0.9%) for 7 days; the N2+gentamicin group (N2+gent) and the Xenon+gentamicin group (Xe+gent), where rats were pretreated with 70% nitrogen or 70% xenon balanced with 30% oxygen for 2 h, followed by 7 days of gentamicin treatment initiated 24 h later, and repeatedly treated with 70% nitrogen or 70% xenon for 30 min on day 2, 4, and 6 during the 7-day administration of gentamicin. Renal function, renal morphology and, oxidative stress indexes were collected respectively on day 2, 4 after the last gentamicin injection for assay (n=6 at each time point per group). serum creatinine (Scr) and blood urea nitrogen (BUN) were examined. The kidney tissue was stained by H-E. Renal malondialdehyde (MDA) and renal superoxide dismutase (SOD) activity were measured.Results: Compared with the control group, Scr and BUN levels were significantly increased on day 2, 4 after last gentamicin injection in the model group and N2+gent group, renal tubular damage index increased significantly, MDA concentration, the oxidative stress index, were also higher than that of the control group, and the activity of SOD decreased, all showing obvious decline in renal function(P<0.01). Compared with the model group and the N2+gent group, the degree of renal injury was significantly reduced in the Xe+gent group: Scr and BUN concentration decreased, renal tubular damage index decreased, the MDA concentration in renal tissue decreased, and SOD activity increased significantly(P<0.01).Conclusions: Xenon treatment can significantly reduce gentamicin-induced acute kidney injury in rats.
[Key Words]xenon; gentamicin; acute kidney injury; oxidative stress
[中图分类号]R 692
[文献标志码]A
[作者简介]贾平,博士,主治医师. E-mail:JPWXL999@126.com*通信作者(Corresponding author). Tel: 021-64041990-2288, E-mail:ding.xiaoqiang@zs-hospital.sh.cn
[收稿日期]2016-01-27[接受日期]2016-03-25
