纯磨玻璃结节定量CT鉴别肺浸润性腺癌与浸润前病变和微浸润腺癌
2016-05-28秦福兵陆友金
秦福兵陆友金
作者单位:1 安徽医科大学第二附属医院呼吸内科 2 舒城县人民医院呼吸科
纯磨玻璃结节定量CT鉴别肺浸润性腺癌与浸润前病变和微浸润腺癌
秦福兵1.2陆友金1
作者单位:1 安徽医科大学第二附属医院呼吸内科2 舒城县人民医院呼吸科
【摘要】目的:研究肺纯磨玻璃结节(pGGN)CT定量参数能否鉴别浸润性腺癌和浸润前病变/微浸润腺癌。方法:回顾性分析58例(其中9名男性,年龄27~79岁)58个经手术病理诊断的pGGN的大小和CT值指标,用方差分析及t检验比较各组间的差异,用受试者工作特性曲线(ROC曲线)确立鉴别诊断的最佳临界点。结果:病变分成浸润前/微浸润病灶(n=38, 包括7个非典型腺瘤样增生,17个原位腺癌,14个微浸润腺癌)和浸润性腺癌(n=20)。浸润性腺癌瘤体大小(20.3±8.5)mm和CT值(-412.6±55.0)HU均明显大于浸润前/微浸润病灶[大小为(9.5±3.2)mm,CT值为(-554.7±84.4)HU;P<0.001]。上述两个指标分别取临界值≥12.5 mm 和 CT值 ≥-482.5 HU作为诊断浸润性肺腺癌的标准,诊断的准确度为87.9%,敏感度100%,特异度81.6%,阳性预测值74.1%,阴性预测值100%。结论:pGGN大小和CT值有助于鉴别浸润性腺癌和浸润前/微浸润病变。
【关键词】肺腺癌;浸润性;磨玻璃结节;CT
中国医学计算机成像杂志,2016,22:22-26
Chin Comput Med Imag,2016,22:22-26
1.Department of Respiratory, Second Affiliated Hospital of Anhui Medical University
2. Department of Respiratory, Shucheng People's Hospital
Address: 678 Furong Rd., Hefei 230601, P.R.C.
Address Correspondence to LU You-jin (E-mail: luyougolden@hotmail.com)
Foundation item:The Study was Supported by the National Natural Science Foundation of China(81301218)
肺磨玻璃结节(ground-glass opacity nodule,GGN)是指在CT肺窗图像上表现为云雾状密度增高结节灶,病灶内血管和支气管影仍清晰可辨,而在纵隔窗图像上不能显示或仅能显示病灶的实性成分[1]。随着人们对健康的重视,CT已被广泛运用到健康体检中,尤其低剂量螺旋CT已被应用于肺癌筛查中,肺GGN的检出大大增加。肺GGN是一种非特异性的影像学表现,它可代表着多种的病理异常,如炎症、出血、局灶性纤维化和肿瘤等。当GGN持续存在(一般认为存在至少1个月而无变化)时,通常提示癌前病变、微浸润性或浸润性肿瘤的可能,这些病变包括非典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)和各种亚型的肺腺癌。甚至在胸外恶性肿瘤患者中出现持续肺GGN时,其原发性肺肿瘤的可能性仍大于胸外恶性肿瘤肺转移[2]。2011年国际肺癌研究协会(the International Association for the Study of Lung Cancer, IASLC)、美国胸科学会(American Thoracic Cancer Society, ATS)及欧洲呼吸学会(European Respiratory Society, ERS)联合推出了新版的肺腺癌分类标准,新的肺腺癌分型中,提出了一个微浸润的概念:为了区分浸润程度>5mm的浸润性肺腺癌,将浸润程度≤5mm的以伏壁样生长为主的腺癌定义为微浸润腺癌(minimally invasive adenocarcinoma, MIA),这类患者与原位腺癌(adenocarcinoma in situ, AIS)一样,若接受完全手术切除,其疾病相关生存率为100%或接近100%[3]。Yoshizawa等报道分析了514名临床I期的肺腺癌中,AIS和MIA完全手术切除的5年疾病相关生存率为100%[4]。肺腺癌新分类给外科肺实质切除范围带来了个体化外科策略。因此,在临床上,准确的术前区分浸润性肺腺癌与AIS/MIA是有临床意义的。
CT在鉴别肺GGN的良恶性及表现为GGN的肺腺癌的浸润程度方面已有一些报道表明存在价值,如pGGN大多数对应于肿瘤的伏壁样生长,这种生长模式有较好的预后;对于一些混合密度的结节,其中的实性成分对应于肿瘤的浸润性生长[5-6]。这些研究多数侧重于CT形态学征象的分析,这些征象的认识存在主观性,正确认识需要临床经验的积累,而对于临床内、外科医生存在一定的困难。如果能建立一个简单易行的CT定量参数诊断标准指导临床实践,将具有重要的意义。因此,本研究着重分析研究pGGN大小和密度这两项定量指标辨别浸润前病变(包括AAH和AIS)、微浸润肺腺癌和浸润性肺腺癌能力,期望给临床内、外科医师在制定肺pGGN临床处理策略时提供简单、有效的参考指标。
方 法
1.患者资料
收集本院从2012年1月至2015年5月67名患者共67个接受手术的肺GGN患者的资料,经病理证实56个GGN为腺癌,7个为AAH,机化性肺炎/纤维化3个,肺淋巴结反应性增生1个。在56个表现为GGN的肺腺癌中,5个结节表现为混杂密度,因此,本研究将表现为pGGN的51个肺腺癌和7个AAH纳入研究。
2.CT检查方法
所有患者均应用Siemens SOMATOM Definition AS+128 CT进行检查。取仰卧位,先行常规CT平扫,范围自肺尖至肺底,主要扫描参数:准直0.625mm×128,120kV,250mA,SFOV400mm,标准算法和肺算法重建图像,重建层厚5mm,重建间隔5mm,图像矩阵512×512;发现病灶后再行病灶高分辨靶扫描,扫描参数:准直0.625mm×128,120kV,300mA,扫描时间1~3s,SFOV 180mm,重建层厚l mm,重建间隔0.4~0.5 mm,滤过函数F,CFOV l80mm,图像矩阵512×512,采用标准算法。
3.CT图像评价
所有CT图像传输至图像后处理工作站肺窗显示(窗位:-550 HU,窗宽:1500 HU)评价。评价指标包括:①最大径 标准横断位、矢状位和冠状位肺窗图像上显示的最大直径(mm);②CT密度值 选取标准横断位病灶中心层面肺窗图像、避开血管及支气管、在不同三处放置尽可能大兴趣区(ROI),记录各区域值,取三者平均值代表病灶CT密度值。
4.病理检查
手术标本经4%中性甲醛固定液固定24h后,石蜡包埋,常规HE染色制片。肺腺癌按照2011年IASLC/ATS/ERS肺腺癌新分类标准将所有病灶分为:①浸润前病变:包括AAH和AIS;②微浸润腺癌(MIA):病变≤3 cm,肿瘤细胞完全沿肺泡壁生长且伴有浸润灶最大径≤0.5 cm的小腺癌;③浸润腺癌。
5.统计学方法
所有计量资料数据均以平均数±标准差表示。不同病理组别的CT参数指标的比较用方差分析方法检验差异的统计学意义。用受试者曲线(ROC)分析方法确立合理的CT参数阈值。P<0.05认为差异有统计学意义。所有统计学处理均由SPSS软件完成。
结 果
最终纳入本研究的58名患者中,男性患者9名,女性49名,年龄范围27~79岁,平均年龄(58.7±11.4)岁。其中AAH患者 7名,AIS患者 17名,MIA患者14名,浸润性腺癌患者20名,包括贴壁为主型3例,腺泡为主型5名、乳头为主型12名。表1总结了各组病例的各指标特征。经方差分析可以看出:AAH、AIS、MIA和浸润腺癌各组pGGN在大小和CT密度值方面的差异均有统计学意义(P<0.05)。
根据2011年IASLC/ATS/ERS肺腺癌新分型标准,将本组资料分为浸润前/微浸润病变(包括AAH、AIS和MIA,n=38)和浸润性肺腺癌(n=20)。浸润前/微浸润病变最大径(9.5±3.2)mm、CT值(-554.7±84.4)HU均小于浸润性肺腺癌,分别为(20.3±8.5)mm和(-412.6±55.0)HU(表2,图1、图2);经t检验两组病灶大小和CT值的差异均有统计学意义(P<0.001)(图3、图4)。
经ROC曲线分析,以pGGN病灶大小≥12.5mm作为诊断浸润性肺腺癌的切割点,诊断敏感度
80.0%,特异度为89.5%,曲线下面积为0.872(图5);以pGGN病灶CT密度值≥-482.5 HU作为诊断浸润性肺腺癌的切割点,诊断敏感度90.0%,特异度为89.5%,曲线下面积0.966(图6)。综合运用上述指标(GGN大小≥12.5mm或CT密度值≥-482.5 HU)作为诊断浸润性肺腺癌的标准,诊断的准确度为87.9%,敏感度100%,特异度81.6%,阳性预测值74.1%,阴性预测值100%。

图1 52岁,女性。微浸润肺腺癌。CT肺窗显示左肺下叶基底段GGN,长径为9mm,CT值为-562HU。图2 61岁,女性,浸润性肺腺癌。CT肺窗图像显示右肺上叶GGN,长径为18mm,CT值为-459HU。图3 浸润前病变/微浸润肺癌和浸润性肺腺癌病灶大小的比较。图4 浸润前病变/微浸润肺癌和浸润性肺腺癌CT密度值比较。图5 以CT病灶大小指标鉴别诊断表现为GGN的肺腺癌的ROC曲线分析。图6 以CT病灶密度值指标鉴别诊断表现为GGN的肺腺癌的ROC曲线分析。
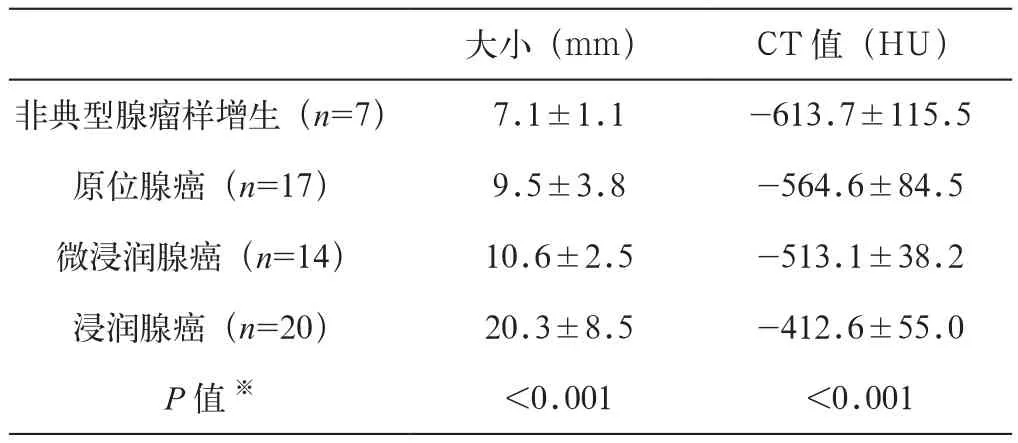
表1 不同性质肺GGN的大小和CT值

表2 浸润前病变/微浸润肺癌和浸润性肺腺癌大小与CT密度值比较
讨 论
由于肺癌的异质性,同一治疗手段对不同类型肺癌的治疗效果往往是大不相同,肺癌的分类和分期是其临床研究和临床处理的重要环节,以尽量减少其异质性造成的差异,从而达到治疗的归一性。2011年IASLC/ATS/ERS新分类提出了微浸润腺癌(MIA)概念,并将原位腺癌和AAH同被列入浸润前病变[7]。新分类增加了影像学在肺腺癌分类中的作用,如AIS 和MIA的病变直径应≤3 cm,需要精确测量胸部薄层CT所示的病变大小及密度。GGN是CT上一个非特异性的征象,可由多种病因引起,如炎症、纤维化和肿瘤性病变。本研究显示大多数持续存在的GGN是腺癌(56/67, 83.6%),这个结果显示持续存在的GGN是早期肺腺癌的一个有意义的征象。随着2011年IASLC/ATS/ERS肺腺癌新分型的临床应用[3]和临床对AIS/MIA采用局限性切除策略,在术前准确区分AIS/MIA和浸润性肺腺癌已显得很有必要。
目前,已有一些关于GGN的CT密度值和病理特征关系的研究报道[8-11]。Ikeda等运用三维CT 75%密度百分位数值可有效鉴别诊断AAH、BAC和肺腺癌,结果提示鉴别AAH和BAC的CT阈值为-584 HU,鉴别BAC和肺腺癌的阈值为-472 HU[9]。Nomori等[10]运用CT像素直方图法,利用CT像素峰值和平均数定量评价AAH和非黏液腺癌,发现AAH的平均CT值为-697±56HU,BAC 为-541±73HU,研究发现在直方图上,CT值峰值是常用的描述肿瘤的指标,可以忽略肿瘤内血管和支气管密度值的影响。虽然一维CT密度值可能受肿瘤内血管或支气管密度的影响,Kitami等[11]报道了利用一维CT密度值鉴别诊断AAH和浸润性肺腺癌,并提出以-600HU作为鉴别诊断的阈值。本研究结果表明,表现为pGGN的肺腺癌及浸润前病变中,结节大小及CT值能有效预测病变的浸润性,相对于浸润前或微浸润GGN,浸润性肺腺癌GGN病灶更大、CT密度更高。
最近,有几项研究放射和临床病理特征评价GGN病理浸润性[12-14]。Matsuguma等[12]评价了GGO病灶内实性成分比例与肺癌侵袭性的相关性,发现病灶中GGO成分与病灶侵袭性负相关。Son等[14]研究了定量CT指标能否鉴别诊断浸润性与非浸润性肺腺癌,发现CT值75%百分数和熵可以作为评价浸润性肺腺癌的独立预测因子,预测效能(受试者曲线下面积)为0.780。本研究受试者操作特性曲线分析显示肿瘤大小和CT值诊断浸润性肺腺癌的效能分别为0.872和0.966,表明这两个CT成像定量参数预测GGN为浸润性肺腺癌具有较大的临床应用价值。我们还进一步研究了联合这两个定量参数预测浸润性的价值,诊断的准确度为87.9%,敏感度100%,特异度81.6%,提示在临床上联合使用效能高于单独运用。浸润性肺腺癌较癌前病变/原位腺癌/微浸润癌具有更大直径和CT密度值是有病理生理基础的:在CT上表现为磨玻璃密度阴影,代表肿瘤的伏壁式生长。浸润性肺腺癌由于病灶内肿瘤组织成分相对多且肺泡间隔增厚,致使病灶内气腔减少[15]。
总之,腺癌的新分类向影像学提出了新要求。肺腺癌新分类对影像学的最大影响是要求影像学的诊断尽量向组织学分型靠拢。目前,要求通过影像学手段对肺腺癌进行全面组织学分型还是一件非常困难的事。影像学征象与病理的组织学改变还有一定的差距,完全相对应并不现实。相信随着研究的不断深入,影像学与组织病理学、肿瘤分子生物学和临床会有更紧密的联系。
参 考 文 献
[1]Suzuki K, Koike T, Asakawa T, et al. A prospective radiological study of thin-section computed tomography to predict pathological noninvasiveness in peripheral clinical IA lung cancer (Japan Clinical Oncology Group 0201). J Thorac Oncol, 2011, 6:751-756
[2]Park CM, Goo MJ, Kim TJ, et al. Pulmonary nodular ground glass opacities in patients with extrapulmonary cancers: what is their clinical significance and how can we determine whether they are malignant or benign lesions? Chest, 2008, 133:1402-1409
[3]Travis WD, Brambilla E, Noguchi M, et al. International association for the study of lung cancer/American thoracic society/European respiratory society international multidisciplinary classification of lung adenocarcinoma. J Thorac Oncol, 2011, 6: 244-285
[4]Yoshizawa A, Motoi N, Riely GJ, et al. Impact of proposed IASLC/ ATS/ERS classification of lung adenocarcinoma: prognostic subgroups and implications for further revision of staging based on analysis of 514 stage I cases. Mod Pathol, 2011, 24: 653–664
[5]陈群慧,叶晓丹,朱 莉,等.肺小腺癌中肺泡细胞癌含量与不同阈值CT测量的磨玻璃密度含量的相关性. 中国医学计算机成像杂志,2013,19:136-139
[6]陈群慧,张 杰,叶晓丹,等.磨玻璃密度肺小腺癌病理亚型的Ultra-HRCT分析. 中国医学计算机成像杂志,2011,17:307-312
[7]周晓军, 刘 标. 解读2011年IASLC/ATS/ERS肺腺癌国际多学科分类.临床与实验病理学杂志, 2011, 27:n801-805, 810
[8]Yanagawa M, Kuriyama K, Kunitomi Y, et al. One-dimensional quantitative evaluation of peripheral lung adenocarcinoma with or without ground-glass opacity on thin-section CT images using profile curve. Br J Radiol, 2009, 82:532–540
[9]Ikeda K, Awai K, Mori T, et al. Differential diagnosis of groundglass opacity nodules. CT number analysis by three dimensional computerized quantification. Chest, 2007, 132:984–990
[10]Nomori H, Ohtsuka T, Naruke T, et al. Differentiation between atypical adenomatous hyperplasia and bronchioloalveolar carcinoma using the computed tomography number histogram. Ann Thorac Surg, 2003, 76:867–871
[11]Kitami A, Kamio Y, Hayashi S, et al. One-dimensional mean computed tomography value evaluation of ground-glass opacity on high-resolution images. Gen Thorac Cardiovasc Surg 2012, 60:425–430
[12]Matsuguma H, Oki I, Nakahara R, et al. Comparison of three measurements on computed tomography for the prediction of less invasiveness in patients with clinical stage I non-small cell lung cancer. Ann Thorac Surg, 2013, 95:1878–1884
[13]Zhang Y, Qiang JW, Ye JD, et al. High resolution CT in differentiating minimally invasive component in early lung adenocarcinoma. Lung Cancer, 2014, 84:236–241
[14]Son JY, Lee HY, Lee KS, et al. Quantitative CT analysis of pulmonary ground-glass opacity nodules for the distinction of invasive adenocarcinoma from pre-invasive or minimally invasive adenocarcinoma. PLoS One, 2014, 9:e104066
[15]Noguchi M. Stepwise progression of pulmonary adenocarcinoma –clinical and molecular implications. Cancer Metastasis Rev, 2010, 29:15–21
Quantitative CT of Pulmonary Pure Ground-glass Nodules in the Differential Diagnosis of Invasive Adenocarcinoma with Preinvasive Lesion and Microinvasive Adenocarcinoma
QIN Fu-bing1.2,LU You-jin1
【Abstract】Purpose: To investigate whether quantitative CT parameters of pure ground-glass opacity nodules (pGGNs)could enable distinction of invasive adenocarcinoma from pre-invasive lesion or minimally invasive adenocarcinoma. Methods: We retrospectively evaluated 58 pulmonary pGGNs in 58 patients (age ranged from 27 to 79 years, 9 men). The pathological results of them were atypical adenomatous hyperplasia (AIS; n = 7), adenocarcinoma in situ (AIS; n = 17), minimally invasive adenocarcinoma (MIA; n = 14), and invasive adenocarcinoma (n = 20). Tumor size and computed tomography (CT) attenuation value of these different pathologic subtypes GGNs were compared by using one-way ANOVA and t-test. Receiver operating characteristic (ROC) curve analysis was used to decide the optimal cutoff points for CT parameters based on their highest diagnostic accuracy. Results: All lesions were categorized as pre-/ minimally invasive lesions (n =38) (including 7 AAHs, 17 AISs and 14 MIAs), and invasive adenocarcinoma (n=20). Invasive adenocarcinomas had larger size (20.3±8.5mm) and higher CT attenuation value (-412.6±55.0 HU) than that of pre- or minimally invasive lesions (9.5±3.2 mm in size; -554.7±84.4 HU in CT value) (all P<0.001). A combined cutoff values (i.e., tumor size ≥ 12.5 mm or mean CT attenuation ≥ –482.5 HU or both indicated invasive adenocarcinoma),book=28,ebook=28yielded a accuracy of 87.9%, sensitivity of 100%, specificity of 81.6%, positive predict value (PV) of 74.1%, and negative PV of 100%. Conclusion: Tumor size and CT attenuation of pGGNs could be successfully used to identify invasive adenocarcinoma from pre-/minimally invasive lesions.
【Key words】Lung adenocarcinoma; invasiveness; Ground-glass opacity nodule; CT
收稿时间:(2015.10.03;修回时间:2015.12.05)
基金项目:国家自然科学基金(81301218)
通信作者:陆友金(电子邮箱:luyougolden@hotmail.com.)
通信地址:安徽省合肥市芙蓉路678号 ,合肥230601
中图分类号:R445.3
文献标志码:A
文章编号:1006-5741(2016)-01-0022-05
