连续性肾脏替代治疗1型心肾综合征患者的预后及影响因素
2016-05-25严文艳邬步云孔祥清俞香宝朱亚梅邢昌赢毛慧娟
严文艳 邬步云 李 杏 孔祥清 俞香宝 朱亚梅 邢昌赢 毛慧娟
连续性肾脏替代治疗1型心肾综合征患者的预后及影响因素
严文艳1*邬步云1*李 杏2孔祥清2俞香宝1朱亚梅1邢昌赢1毛慧娟1
目的:对常规治疗无效的心肾综合征(CRS)可用连续性肾脏替代治疗(CRRT),通过回顾性观察性研究,描述接受CRRT治疗的1型CRS患者的起始特征、终止特征及预后。 方法:本研究纳入2009年5月至2015年4月在南京医科大学第一附属医院住院并行CRRT治疗的1型CRS患者。按患者90d是否死亡或是否摆脱透析分为摆脱透析组、透析依赖组和死亡组。记录3组患者一般情况、心肾功能、合并症、CRRT前用药、CRRT起始特征(血清肌酐、血清尿素氮、尿量、出入量平衡)、终止特征和预后,并使用单因素和多因素COX回归分析患者死亡的危险因素。 结果:研究纳入52例患者,男性27例、女性25例,平均年龄70.7±16.1岁。平均APACHE Ⅱ评分为14.4±4.2,平均SOFA评分为8.7±4.7。52例患者死亡率为65.4%。摆脱透析患者开始CRRT前中位尿量及出入量平衡(入量-出量)与透析依赖组、死亡组有明显差异。摆脱透析患者终止CRRT时中位尿量、出入量平衡显著大于透析依赖组(P<0.05)。多因素COX回归分析显示低左室射血分数、低血清白蛋白、高APACHE Ⅱ评分和出入量正平衡是死亡的独立危险因素。 结论:需行CRRT的1型CRS患者预后差,死亡的独立危险因素包括营养状况、心功能、疾病严重程度和容量平衡,死亡组相比存活组在治疗前液体正平衡更明显。尿量至少达到1 000 ml/24h、容量达负平衡时可考虑终止CRRT。
心肾综合征 连续性肾脏替代治疗 预后
心肾综合征(CRS)是指心脏和肾脏中,一个器官的急性或慢性受损导致另一个器官急性或慢性的功能不全[1]。CRS死亡率高,尤其是需行连续性肾脏替代治疗(CRRT)的CRS患者,文献报道,其死亡率为11.12%~62%[2-4],并延长住院时间、增加医疗费用[5-6]。
CRS分为5型,其中1型CRS[7]是指急性心功能衰竭导致急性肾损伤(AKI)。1型CRS的常规治疗[8-9]包括利尿剂、血管活性药物、肾素-血管紧张素-醛固酮系统(RAAS)阻滞剂等,当常规治疗措施失效时,CRRT是最后的挽救手段[10]。CRRT治疗CRS目前尚无可遵循的规范,如起始时机、终止时机、治疗剂量、超滤速度等,而这些技术规范很可能影响CRRT治疗患者的预后[11]。本研究拟通过回顾性观察性研究,描述接受CRRT治疗的1型CRS患者的起始特征、终止特征及预后。
对象和方法
研究人群 选取2009年5月至2015年4月在南京医科大学第一附属医院(江苏省人民医院)内科住院并行CRRT的1型CRS患者。入选标准:(1)年龄≥18岁;(2)诊断符合1型CRS[7];(3)接受CRRT治疗。排除标准包括:(1)孕妇;(2)对体外循环通路及材料过敏者。
CRRT 采用右侧颈内静脉或股静脉置管建立血管通路,血流量150~200 ml/min,采用滤过或透析滤过模式,治疗剂量为2~4 L/h,每次治疗时间为6~24h,抗凝剂剂量、超滤速度由心内科医生和肾内科医生联合决定。
相关定义 摆脱透析:住院期间或出院后停止透析≥90d。透析依赖:住院期间或出院后持续性的透析≥90d。利尿剂抵抗[12-13]:本研究定义为24h内呋塞米或等效药物累计超过80 mg仍有全身充血症状。高钾血症:血清钾浓度≥6.5 mmol/L;氮质血症:血清尿素氮(BUN)≥28 mmol/L;少尿:24h尿量≤400 ml;严重代谢性酸中毒:动脉血pH<7.25或碳酸氢根浓度<15 mmol/L;基础肾功能:本研究定义当患者入院未发生1型CRS,以入院血清肌酐(SCr)为基础肾功能;当入院已发生1型CRS时,按照年龄和性别估计基础eGFR,按CKD-EPI肌酐公式倒推患者基础SCr[14]。
数据收集 记录患者基础心脏疾病、基础肾功能、并发症、疾病严重程度评分(APACHE Ⅱ评分、SOFA评分)、心脏超声、患者首次CRRT时的SCr、BUN、电解质、血压、心率、前24h内的尿量、出入量平衡(入量-出量)、用药情况,患者CRRT相关数据及患者预后。若患者透析依赖,则收集患者出院前末次透析前的临床指标。
统计分析 采用SAS 9.2软件进行统计分析。计量资料采用均数±标准差表示,组间比较采用studentt检验或Kruskal-Wallis检验。分类资料以率表示,组间比较采用卡方检验。采用单因素和多因素COX回归分析死亡的危险因素。所有检验均为双侧检验,P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
一般情况 本研究纳入52例患者,其中男性27例、女性25例,平均年龄70.7±16.1岁。根据患者的90d存活情况及是否摆脱透析分为死亡组(34例,65.4%)、存活组(18例,34.6%)包括透析依赖组(9例)和摆脱透析组(9例)。与存活组患者相比,死亡组有慢性肾脏病史的比例较低。心脏基础病包括冠心病(50%)、瓣膜病(11.5%)、高血压性心脏病(13.5%)、肺心病(3.9%)、心肌病(15.4%)和心肌炎(5.8%)等,三组患者心脏原发病构成无显著差异。患者平均APACHE Ⅱ评分为14.4±4.2,平均SOFA评分为8.7±4.7。30d、90d死亡率分别为59.6%,65.4%。
实验室检查 与死亡组相比,存活组的谷草转氨酶、总胆红素、SOFA评分、血红蛋白显著低于死亡组,而血清白蛋白、基础SCr显著高于死亡组(表1),且CRRT前24h内较少使用升压药(P=0.014),而在心力衰竭NYHA分级、白细胞计数、中性粒细胞计数、血小板计数、谷丙转氨酶、氨基末端-B型脑钠肽前体(NT-proBNP)、扩血管药物、强心药物及利尿剂使用方面无统计学差异。三组患者在在合并肺部感染、心房颤动、糖尿病、肝功能衰竭方面均无统计学差异。
心脏超声 摆脱透析、透析依赖、死亡三组患者左房前后径有统计学差异(分别为31.6±15.1、49.0±4.5、44.4±8.5mm,P=0.009),左心室射血分数(分别为52.4±10.9、51.0±15.8、47.9±17.3%,P=0.824)及其他心脏超声指标无显著差异。

表1 所有患者临床及实验室检查结果
APACHE Ⅱ:急性生理与慢性健康评分;SOFA评分:序贯器官估计评分;NT-proBNP:氨基末端-B型脑钠肽前体
CRRT 三组患者在CRRT总超滤量、CRRT持续时间、治疗时间、治疗剂量及超滤速度方面无显著统计学差异(表2)。
起始CRRT的特征 CRRT治疗指征上,三组患者在严重高钾血症、代谢性酸中毒、氮质血症、利尿剂抵抗、少尿均无显著差异。起始CRRT时,三组患者在血压、心率、SCr、BUN、BUN/SCr、eGFR无统计学差异(表3)。三组患者从明确1型CRS发生与起始CRRT间隔时长有显著差异。同时摆脱透析组起始CRRT前24h的中位尿量、出入量平衡分别为800 ml、167 ml,与死亡组(345 ml,1 270 ml)有显著统计学差异。
CRRT终止特征 摆脱透析患者终止CRRT后2d内中位尿量和出入量平衡分别为1 350 ml、-460 ml(表4)。与透析依赖组住院期间末次CRRT治疗前指标相比,两组之间血压、心率、SCr、BUN无统计学差异,仅有尿量和出入量平衡有显著统计学差异。
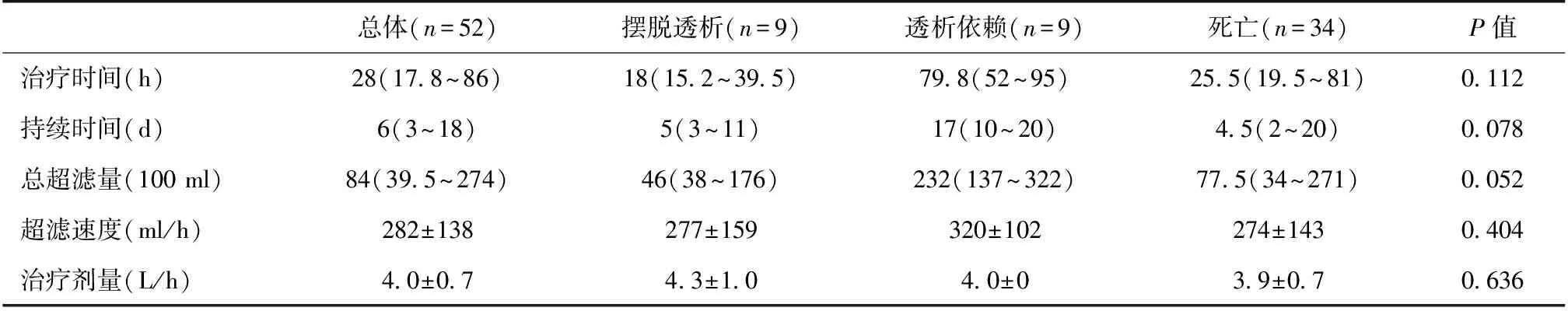
表2 连续性肾脏替代治疗相关参数
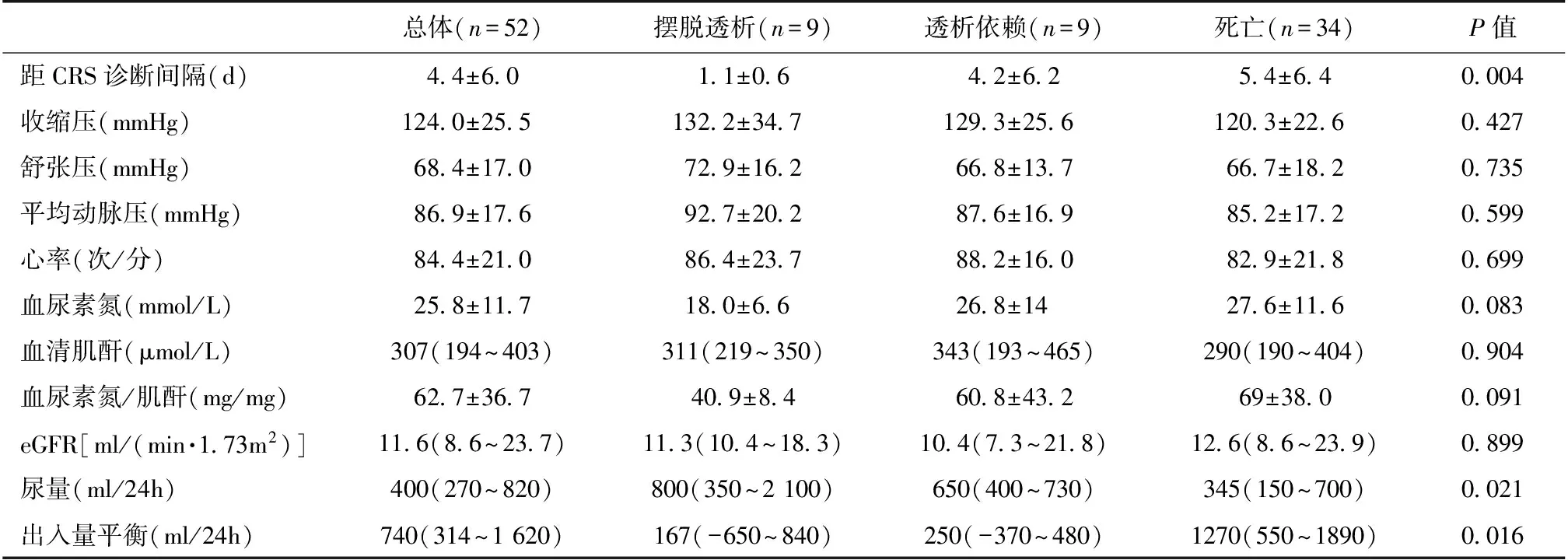
表3 患者起始CRRT时的临床情况
CRRT:连续性肾脏替代治疗;CRS:心肾综合征;eGFR:估计的肾小球滤过率,使用CKD-EPI肌酐公式计算;出入量平衡(ml/24h)=入量-出量
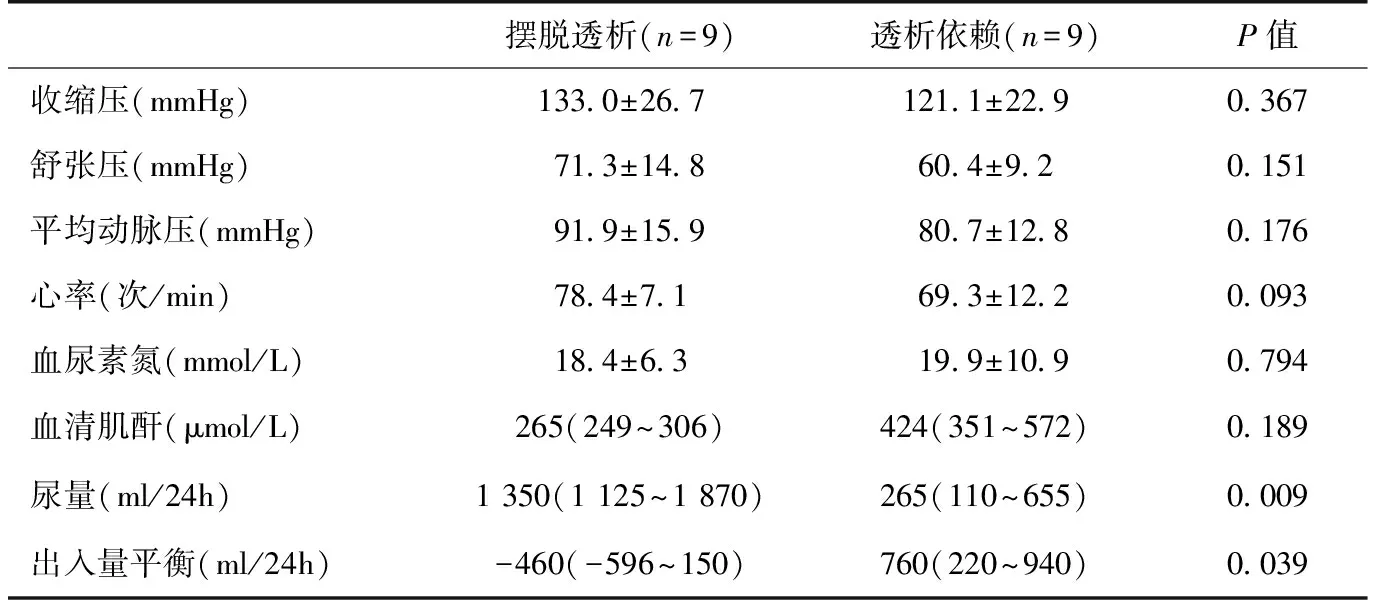
表4 摆脱透析患者终止CRRT时的情况与透析依赖患者住院末次透析的情况比较
CRRT:连续性肾脏替代治疗
预后的危险因素分析 单因素COX回归分析提示APACHE II评分(HR=1.091,P=0.049)、SOFA评分(HR=1.113,P=0.004)、使用升压药(HR=2.949,P=0.002)及抗心律失常药(HR=2.785,P=0.008)、血红蛋白(HR=1.018,P=0.006)、总胆红素(HR=1.015,P=0.005)、出入量平衡(HR=1.043,P=0.008)可能为其死亡的危险因素,血清白蛋白(HR=0.926,P=0.020)、尿量(HR=0.895,P=0.023)、既往肾脏病病史(HR=0.308,P=0.003)、基础SCr(HR=0.995,P=0.023)可能为其保护性因素。左室射血分数高(HR=0.974,P=0.086)可能为保护因素,但未达到统计学意义。逐步向后多因素COX回归分析显示高APACHE II评分、低血清白蛋白、低左室射血分数和容量正平衡是死亡的独立危险因素。在校正性别、年龄、基础SCr后,模型仍然成立(表5)。

表5 90d预后的多因素COX回归分析
模型1:逐步向后多因素COX回归,纳入APACHE II评分、SOFA评分、合并肺部感染、总胆红素、血红蛋白、血小板、血清白蛋白、左室射血分数、治疗前尿量、起始RRT前的出入量平衡、升压药物使用、抗心律失常药物使用、慢性肾脏病史、基础血肌酐14个变量,入选标准和剔除标准均为0.10;模型2:校正性别、年龄;模型3:校正性别、年龄、基础血清肌酐
讨 论
需行CRRT治疗的1型CRS患者的预后差。本研究显示1型CRS患者90d死亡率为65.4%,透析依赖率为17.3%。与Patarroyo等[15]研究(住院死亡率43.2%,透析依赖率24.3%)和Prins等[3]研究(住院死亡率62%)基本相当。2012年CARESS-HF研究[4]在排除SCr>310 μmol/L、低血压、静脉使用升压药或强心药的患者后,行超滤治疗的CRS的患者死亡率为17%,但显然入组患者在心肾功能和血流动力学方面明显优于本研究人群。本研究提示营养状况、心功能、疾病严重程度和液体平衡与死亡密切相关。
对于1型CRS患者,早期开展CRRT优势在于较好控制溶质和电解质,还可改善液体管理、预防容量负荷过重、清除尿毒症毒素,为CRS病因治疗争取时间[16]。但是部分AKI患者在纠正病因后可以自愈,早期开展CRRT使部分AKI患者接受不必要的CRRT治疗,增加了CRRT并发症及医疗资源的浪费[17]。目前对于CRRT治疗CRS时机仍无定论[18]。本研究发现,摆脱透析、透析依赖与死亡组起始CRRT时BUN及SCr无统计学差异,但三组初次CRRT治疗前24h的尿量依次减少,而出入量平衡逐渐偏向正平衡,再次验证容量负荷与患者死亡相关[19]。同时研究发现存活组在诊断CRS至行CRRT间隔时间短,而死亡组间隔时间长,提示在发生1型CRS并出现液体正平衡时,尽早采取CRRT干预可能改善预后。CRRT干预不能仅依据血清学肾功能指标,根据尿量和容量平衡来决定CRRT时机更为重要。
同样,1型CRS患者何时终止CRRT治疗也是困扰临床医生的一项重大难题,与之相关的研究甚少。Gibney等[20]指出何时终止CRRT需考虑众多因素,包括患者的血流动力学稳定性、尿量和容量负荷等及治疗费用、透析管路是否发生凝血等外界因素,因此对 CRRT 的终止时机需要进行全面的评估。2008年一项研究在分析成功摆脱组(摆脱透析>30d)和摆脱失败组(摆脱透析<30d)停止CRRT后第二天的各项指标发现[21],成功摆脱透析患者停止CRRT后第二天的平均尿量为1 435 ml,与本研究基本相当。BEST研究的事后分析[22]也表明对于AKI患者来说,尿量是评估是否终止CRRT的最准确指标,在未使用利尿剂的情况下,若患者的尿量> 400 ml/24h则成功脱离CRRT的可能性为 78.6%。本研究也显示,摆脱透析组及透析依赖组尿量存在显著性差异,但是出入量平衡可能是更好的预测CRS患者摆脱透析的指标。本研究提示,在使用利尿剂情况下,当患者尿量至少达到1 000 ml/24h、出入量平衡为负平衡时可考虑终止CRRT。
本研究的意义在于:(1)发现需要CRRT治疗的1型CRS患者预后极差,死亡的危险因素包括心功能(左室射血分数)、营养状况(血清白蛋白)、疾病严重程度评分和出入量平衡。(2)本研究描述了单中心接受CRRT治疗的1型CRS患者的起始特征,提示在容量正平衡早期开始CRRT可能改善预后,为以后1型CRS接受CRRT治疗时机的研究提供参考。(3)本研究提示CRS患者尿量至少达到1 000 ml/24h,出入量平衡为负平衡时可考虑终止CRRT。本研究的不足在于其为小样本的单中心、回顾性观察研究,不能代表所有CRS患者的普遍特点,仍然需要大样本、前瞻性研究来证实。
小结:本研究显示需要CRRT治疗的1型CRS患者预后差,死亡的危险因素是低左心室收缩功能、差的营养状况、疾病严重程度评分高和液体正平衡。死亡组相比存活组在治疗前液体正平衡更大,而尿量至少达到1 000 ml/24h、容量达负平衡可考虑终止CRRT。
1 Bongartz LG,Cramer MJ,Doevendans PA,et al.The severe cardiorenal syndrome:‘Guyton revisited’.Eur Heart J,2005,26(1):11-17.
2 Jia F,Rong P,Li D,et al.The effect of continuous blood purification on the prognosis of cardiorenal syndrome patients.Cell Biochem Biophys,2015,71(2):957-961.
3 Prins KW,Wille KM,Tallaj JA,et al.Assessing continuous renal replacement therapy as a rescue strategy in cardiorenal syndrome 1.Clin Kidney J,2015,8(1):87-92.
4 Bart BA,Goldsmith SR,Lee KL,et al.Ultrafiltration in decompensated heart failure with cardiorenal syndrome.N Engl J Med,2012,367(24):2296-2304.
5 Damman K,Valente MA,Voors AA,et al.Renal impairment,worsening renal function,and outcome in patients with heart failure:an updated meta-analysis.Eur Heart J,2014,35(7):455-469.
6 Ronco C,House AA,Haapio M.Cardiorenal syndrome:refining the definition of a complex symbiosis gone wrong.Intensive Care Med,2008,34(5):957-962.
7 Ronco C,McCullough P,Anker SD, et al.Cardiorenal syndromes:report from the consensus conference of the acute dialysis quality initiative.Eur Heart J,2010,31(6):703-711.
9 王庆文.心肾综合征的临床表现及其治疗.肾脏病与透析肾移植杂志,2011,20(1):45-46.
10 Jentzer JC,Chawla LS.A clinical approach to the acute cardiorenal syndrome.Crit Care Clin,2015,31(4):685-703.
11 Ronco C,Ricci Z,De Backer D,et al.Renal replacement therapy in acute kidney injury:controversy and consensus.Crit Care,2015,19:146.
12 Ronco C,Ricci Z,De Backer D,et al.Diuretic response in acute heart failure:clinical characteristics and prognostic significance.Eur Heart J,2014,35(19):1284-1293.
13 Leto L,Aspromonte N,Feola M.Efficacy and safety of loop diuretic therapy in acute decompensated heart failure:a clinical review.Heart Fail Rev,2014,19(2):237-246.
14 Bernardi MH,Schmidlin D,Ristl R,et al.Serum Creatinine Back-Estimation in Cardiac Surgery Patients:Misclassification of AKI Using Existing Formulae and a Data-Driven Model.Clin J Am Soc Nephrol ,2016,11(3):395-404.
15 Patarroyo M,Wehbe E,Hanna M,et al.Cardiorenal outcomes after slow continuous ultrafiltration therapy in refractory patients with advanced decompensated heart failure.J Am Coll Cardiol,2012,60(19):1906-1912.
16 程庆砾.心肾综合征患者的血液净化治疗.中国血液净化,2016,15(2):110-113.
17 Wald R,Adhikari NK,Smith OM,et al.Comparison of standard and accelerated initiation of renal replacement therapy in acute kidney injury.Kidney Int,2015,88(4):897-904.
18 刘文虎.危重患者连续性肾脏替代治疗开始及停止治疗的时机.中华肾病研究电子杂志,2013,2(2):25-29.
19 Chen H,Wu B,Gong D,et al.Fluid overload at start of continuous renal replacement therapy is associated with poorer clinical condition and outcome:a prospective observational study on the combined use of bioimpedance vector analysis and serum N-terminal pro-B-type natriuretic peptide measurement.Crit Care,2015,19:135.
20 Gibney N,Hoste E,Burdmann EA,et al.Timing of initiation and discontinuation of renal replacement therapy in AKI:unanswered key questions.Clin J Am Soc Nephrol,2008,3(3):876-880.
21 Wu VC,Ko WJ,Chang HW,et al.Risk factors of early redialysis after weaning from postoperative acute renal replacement therapy.Intensive Care Med,2008,34(1):101-108.
22 Uchino S,Bellomo R,Morimatsu H,et al.Discontinuation of continuous renal replacement therapy:a post hoc analysis of a prospective multicenter observational study.Crit Care Med,2009,37(9):2576-2582.
(本文编辑 律 舟 莫 非)
Prognosis and influence factors of patients with type 1 cardiorenal syndrome requring continuous renal replacement
YANWenyan1*,WUBuyun1*,LIXin2,KONGXiangqing2,YUXiangbao1,ZHUYamei1,XINGChangying1,MAOHuijuan1
1DepartmentofNephrology,JiangsuProvinceHospital,TheFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,China2DepartmentofCardiology,JiangsuProvinceHospital,TheFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,China*YANWenyanandWUBuyunareconsideredtobefirstauthors
MAOHuijuan(E-mail:huijuanmao@126.com)
Objective:To explore initiating and ending clinical feature, as well as the prognosis of continuous renal replacement therapy (CRRT) in patients with type 1 cardio-renal syndrome (CRS). Methodology:Fifty-two patients who were admitted for type 1 CRS from May 2009 to April 2015 and carried out CRRT in the Jiangsu Province Hospital were enrolled into this retrospective study. They were divided into three groups according to the prognosis- renal replacement therapy (RRT) independence, RRT dependence and death. The three groups were compared in the baseline index, diagnosis, complication, drugs before CRRT, CRRT initiating indications and the prognosis. Results:They were 27 males and 25 females with the mean ages of 70.7±16.1 years old. The mean APACHE II scores and SOFA scores were 14.4±4.2 and 8.7±4.7, respectively. Mortality rate was 65.4%. The mean urine output of RRT independence group was 800 ml/24h, much greater than that of RRT dependence group (650 ml) and death group (345 ml) before the initiation of CRRT. Additionally, the fluid balance were obviously different among the three group (167 ml、250 ml、1 270 ml, respectively). At the ending of CRRT, the mean urine output and fluid balance were remarkably different between RRT independence and RRT dependence group (1 350 mlvs265ml, -460 mlvs760 ml). A multivariate Cox regression approach showed that the risk factors for death were low left ventricular ejection fraction, low serum albumin, high APACHE II scores and positive fluid balance. Conclusion:Refractory type 1 CRS using CRRT for rescue therapy was associated with high mortality. The risk factors for death were low left ventricular ejection fraction, low serum albumin, high APACHE II scores and positive fluid balance. The mean fluid balance of survivors (RRT dependence and RRT independence)were remarkably less than the death group at the initiating time of CRRT. Meanwhile, when the urine output of patients reached to 1 000 ml/24h and the volume balance was negative, terminating CRRT could be considered.
cardiorenal syndrome continous renal replacement therapy prognosis
10.3969/cndt.j.issn.1006-298X.2016.03.003
“十二五”国家科技支撑计划课题(2011BAI10B08);江苏省青年自然科学基金(BK20151022)
1南京医科大学硕士研究生(严文艳) 南京医科大学第一附属医院(江苏省人民医院)肾内科(南京,210029),2心内科;*严文艳和邬步云为共同第一作者
毛慧娟(E-mail:huijuanmao@126.com)
2016-04-28
ⓒ 2016年版权归《肾脏病与透析肾移植杂志》编辑部所有
