溴隐亭对垂体泌乳素腺瘤血管形成的影响及其分子作用机制研究
2016-05-09陈宏谋郑捷敏闫宪磊肖振勇陈家康
陈宏谋,郑捷敏,闫宪磊,刘 全,黎 耀,肖振勇,陈家康
545005广西柳州市,广西医科大学第四附属医院神经外科
·论著·
溴隐亭对垂体泌乳素腺瘤血管形成的影响及其分子作用机制研究
陈宏谋,郑捷敏,闫宪磊,刘 全,黎 耀,肖振勇,陈家康
545005广西柳州市,广西医科大学第四附属医院神经外科
【摘要】目的探讨溴隐亭对垂体泌乳素腺瘤血管形成的影响及其分子作用机制。方法2014年1月—2015年6月,体外培养MMQ细胞株并进行MTT比色实验,共设置6个实验组、1个对照组和1个空白组,实验组在培养基和细胞悬液中添加不同浓度(0.125、0.250、0.500、1.000、2.000、4.000 μg/ml)溴隐亭,分别记为0.125 μg/ml组、0.250 μg/ml组、0.500 μg/ml组、1.000 μg/ml组、2.000 μg/ml组、4.000 μg/ml组,对照组加入等体积的培养基及细胞悬液,空白组仅加入等体积的培养基;根据半数抑制浓度(IC50)筛选最适浓度溴隐亭进行后续试验。再采用最适浓度的溴隐亭处理MMQ细胞48 h,制备条件培养液(CM),各实验组在培养基和细胞悬液基础上分别加入最适溶度的溴隐亭和CM,对照组加入等体积的培养基和细胞悬液,采用酶联免疫吸附试验(ELISA)检测泌乳素(PRL)浓度及其变化率。用携带GFP基因的慢病毒(LV-GFP)感染人脐静脉血管内皮细胞(HUVEC)制备HUVEC/LV-GFP,用CM孵育HUVEC/LV-GFP细胞,各实验组在培养基和细胞悬液基础上分别加入最适浓度的溴隐亭和CM,CM组在培养基和细胞悬液基础上仅加入CM,1.000 μg/ml组在培养基和细胞悬液基础上仅加入1.000 μg/ml溴隐亭,对照组加入等体积培养基和细胞悬液;24 h后在荧光显微镜下观察血管样结构形成情况并计数。采用Western blotting法检测对照组与最适浓度溴隐亭组垂体瘤转化基因(PTTG)和血管内皮生长因子(VEGF)表达情况。结果6个实验组MMQ细胞增殖抑制率时间与组间存在交互作用(P<0.05);培养48 h、72 h 0.125 μg/ml组、0.250 μg/ml组、0.500 μg/ml组、1.000 μg/ml组、2.000 μg/ml组、4.000 μg/ml组MMQ细胞增殖抑制率高于培养24 h,培养72 h 0.125 μg/ml组、0.250 μg/ml组、0.500 μg/ml组、1.000 μg/ml组、2.000 μg/ml组MMQ细胞增殖抑制率高于培养48 h(P<0.05);而培养48 h与培养72 h 4.000 μg/ml组MMQ细胞增殖抑制率比较,差异无统计学意义(P>0.05)。通过软件计算抑制MMQ细胞增殖的IC50接近0.500 μg/ml,遂选用0.250、0.500、1.000 μg/ml溴隐亭进行后续实验。1.000 μg/ml+CM组PRL浓度及变化率均低于0.500 μg/ml+CM组、0.250 μg/ml+CM组和对照组;0.500 μg/ml+CM组PRL浓度及变化率均低于0.250 μg/ml+CM组和对照组;0.250 μg/ml+CM组PRL浓度及变化率均低于对照组(P<0.05)。CM组MMQ细胞外血管样结构计数多于0.250 μg/ml+CM组、0.500 μg/ml+CM组、1.000 μg/ml+CM组、1.000 μg/ml组、对照组;0.250 μg/ml+CM组MMQ细胞外血管样结构计数多于0.500 μg/ml+CM组、1.000 μg/ml+CM组、1.000 μg/ml组、对照组;0.500 μg/ml+CM组MMQ细胞外血管样结构计数多于1.000 μg/ml+CM组、1.000 μg/ml组、对照组;1.000 μg/ml+CM组MMQ细胞外血管样结构计数多于1.000 μg/ml组、对照组;1.000 μg/ml组与对照组MMQ细胞外血管样结构计数比较,差异无统计学意义(P>0.05)。对照组PTTG、VEGF表达水平高于0.250 μg/ml组、0.500 μg/ml组、1.000 μg/ml组,0.250 μg/ml组PTTG、VEGF表达水平高于0.500 μg/ml组、1.000 μg/ml组,0.500 μg/ml组PTTG、VEGF表达水平高于1.000 μg/ml组(P<0.05)。结论溴隐亭可通过抑制垂体泌乳素腺瘤的血管形成而抑制其生长与侵袭,而这种抑制作用与下调PTTG/VEGF信号通路有关。
【关键词】催乳素瘤;溴隐亭;血管内皮生长因子类
陈宏谋,郑捷敏,闫宪磊,等.溴隐亭对垂体泌乳素腺瘤血管形成的影响及其分子作用机制研究[J].实用心脑肺血管病杂志,2016,24(3):43-48.[www.syxnf.net]
Chen HM,Zheng JM,Yan XL,et al.Impact of bromocriptine on vascularization of prolactinoma and the molecular mechanism[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2016,24(3):43-48.
垂体瘤是颅内常见疾病之一,占颅内肿瘤的10%~15%,其中垂体泌乳素腺瘤(prolactinoma)占30%左右[1]。外科手术是治疗垂体泌乳素腺瘤的首选方案,而溴隐亭是不能耐受手术或拒绝手术治疗患者的最佳选择。溴隐亭单独使用或结合外科手术治疗垂体泌乳素腺瘤已取得较好的临床疗效[2]。垂体泌乳素腺瘤的生长和转移依赖新生血管的形成,而肿瘤血管的形成极为复杂,包括正常静脉血管系统激活、新生血管出芽以及肿瘤细胞、内皮细胞、外周细胞间相互作用等多种因素共同作用。血管内皮生长因子(VEGF)是迄今公认的最重要的血管形成因子,其可在多种生理、病理状态下促进周围血管的形成。垂体瘤转化基因(PTTG)在正常垂体中不表达,而在垂体瘤中高表达。PTTG、VEGF对肿瘤血管的形成起重要作用。有研究表明,上调PTTG和VEGF表达可促进垂体瘤周围血管的形成,其表达情况可作为判断垂体瘤侵袭性的一项生物学指标,对判断患者预后也有一定的临床意义[3]。
本研究旨在分析溴隐亭对大鼠垂体泌乳素腺瘤MMQ细胞泌乳素(prolactin,PRL)分泌、血管形成及PTTG、VEGF表达的影响,初步探讨溴隐亭对垂体泌乳素腺瘤的治疗作用是否与通过调节PTTG/VEGF通路而抑制血管形成有关,为临床上应用溴隐亭治疗垂体泌乳素腺瘤提供参考。
1材料与方法
1.1实验材料
1.1.1细胞株与病毒大鼠垂体泌乳素腺瘤细胞株MMQ及人脐静脉血管内皮细胞(HUVEC)均购自American Type Culture Collection(ATCC)公司,携带GFP基因的慢病毒(LV-GFP)由Gene Chem公司制备。
1.1.2主要试剂及试剂盒溴隐亭(Gedeon Richter Plc.),噻唑蓝(MTT,Sigma),F12培养基(Hyclone),胎牛血清(Hyclone),马血清(Gibco),0.25%胰蛋白酶消化液(Hyclone),二甲基亚砜(DMSO,Amresco),Polybrene(Sigma);Matrigel(Sigma),鼠源性抗VEGF、PTTG单克隆抗体(Santa Cruz),鼠源性抗GAPDH单克隆抗体(Santa Cruz),化学发光试剂ECL(Pierce),辣根过氧化物酶标记的二抗羊抗鼠IgG(Santa Cruz);酶联免疫吸附试验(ELISA)试剂盒(BOSTER),BCA蛋白定量试剂盒(Pierce)。
1.2实验方法
1.2.1MTT比色法2014年1月—2015年6月,将MMQ细胞复苏后在含10%胎牛血清和5%马血清的F12培养基中培养,置于37 ℃、5% CO2培养箱中常规传代培养,观察细胞状态,待生长良好即进行下一步实验。取处于对数生长期的MMQ细胞,制成1×105个/ml细胞悬液,加入96孔板中,100 μl/孔(边缘孔用无菌的PBS填充),37 ℃、5% CO2培养箱孵育过夜。共设置6个实验组、1个对照组和1个空白组,实验组加入培养基、细胞悬液和不同浓度(0.125、0.250、0.500、1.000、2.000、4.000 μg/ml)溴隐亭,分别记为0.125 μg/ml组、0.250 μg/ml组、0.500 μg/ml组、1.000 μg/ml组、2.000 μg/ml组、4.000 μg/ml组,对照组加入等体积的培养基及细胞悬液,空白组仅加入等体积的培养基,每组设6个复孔。置于培养箱中培养24、48、72 h后,每孔加入5 mg/ml MTT溶液20 μl,继续培养4 h后,每孔加入150 μl DMSO;振荡10 min后,用酶标仪在570 nm波长处测量吸光度(OD),并计算MMQ细胞增殖抑制率。实验独立重复3次。MMQ细胞增殖抑制率=〔1-(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)〕×100%。并根据各组MMQ细胞增殖的半数抑制浓度(IC50)选取最适浓度的溴隐亭进行后续试验。
1.2.2制备条件培养液(CM)和提取总蛋白取对数生长期的MMQ细胞,制成2×105个/ml的细胞悬液,加入6孔板中,1 ml/孔,置于培养箱中过夜。在孔板中加入最适浓度的溴隐亭培养48 h后,离心取上清液即为CM(4 ℃保存);6孔板中加入细胞裂解液,提取总蛋白(70 ℃保存)。
1.3ELISA检测CM中PRL浓度各实验组在培养基和细胞悬液基础上分别加入最适溶度的溴隐亭和CM,对照组加入等体积的培养基和细胞悬液:(1)将100 μl的上述CM和标准品(标准品按试剂盒说明稀释)加入相应的反应孔中,37 ℃孵育2 h,洗板5次;(2)每孔加100 μl一抗,37 ℃孵育2 h,洗板5次;(3)每孔加100 μl酶标二抗,37 ℃孵育30 min,洗板5次;(4)每孔加100 μl底物工作液37 ℃避光孵育15 min,洗板5次;(5)每孔加100 μl终止液混匀;(6)用酶标仪在450 nm波长处测量OD值;(7)根据标准曲线计算样本OD值对应的PRL浓度,并计算变化率,变化率(%)=(实验组PRL浓度/对照组PRL浓度)×100%。实验独立重复3次取平均值。
1.4体外血管形成
1.4.1慢病毒感染制备HUVEC/LV-GFP细胞将HUVEC细胞接种于24孔板中培养,24 h后用LV-GFP感染,根据细胞的增殖特性调整细胞密度,使感染时细胞汇合度为30%~40%。将60 μl LV-GFP(滴度为1×108 TU/ml)与435 μl培养液及5 μg/ml Polybrene 5 μl混匀制成感染混合体系,吸去细胞培养液,加入感染混合体系,37 ℃下孵育24 h,然后更换为常规培养液,72 h后用1 μg/ml嘌呤霉素筛选稳定表达GFP的细胞,即HUVEC/LV-GFP细胞。
1.4.2体外血管形成实验在96孔板加入Matrigel,50 μl/孔,37 ℃孵育1 h;将HUVEC/LV-GFP细胞悬液加入Matrigel上层,5×103个/孔;用CM孵育HUVEC/LV-GFP细胞。各实验组在培养基和细胞悬液基础上分别加入最适浓度的溴隐亭和CM,CM组在培养基和细胞悬液基础上仅加入CM,1.000 μg/ml组在培养基和细胞悬液基础上仅加入1.000 μg/ml溴隐亭,对照组加入等体积的培养基和细胞悬液。24 h后,在荧光显微镜下观察血管样结构的形成情况,任意取5个视野,计数血管样结构。实验独立重复3次取平均值。
1.5Western blotting法(1)用BCA蛋白定量试剂盒进行蛋白定量,取一定体积总蛋白进行聚丙烯酰胺凝胶(SDS-PAGE)电泳。(2)100 V恒压电泳至溴酚蓝迁移到分离胶底部0.5 cm处,300 mA恒流转膜(PVDF膜)90 min。(3)用含5%脱脂奶粉的封闭液封闭PVDF膜;加入适当稀释的一抗,封于塑料膜中4 ℃过夜;用TBST洗涤,加入适当稀释的二抗,室温孵育1 h;用TBST洗涤。(4)用增敏化学发光底物试剂(ECL)处理后在显影仪中曝光成像,并用Image J软件进行灰度分析,以GAPDH作为内参照。实验独立重复3次取平均值。

2结果
2.1各组MMQ细胞增殖抑制率比较6个实验组MMQ细胞增殖抑制率时间与组间存在交互作用(P<0.05);培养24h、48h、72h6组MMQ细胞增殖抑制率比较,差异有统计学意义(P<0.05)。其中培养48h、72h0.125μg/ml组、0.250μg/ml组、0.500μg/ml组、1.000μg/ml组、2.000μg/ml组、4.000μg/ml组MMQ细胞增殖抑制率高于培养24h,培养72h0.125μg/ml组、0.250μg/ml组、0.500μg/ml组、1.000μg/ml组、2.000μg/ml组MMQ细胞增殖抑制率高于培养48h,差异有统计学意义(P<0.05);而培养48h与培养72h4.000μg/ml组MMQ细胞增殖抑制率比较,差异无统计学意义(P>0.05,见表1)。通过软件计算抑制MMQ细胞增殖的IC50接近0.500μg/ml,遂选用0.250、0.500、1.000μg/ml溴隐亭进行后续实验。

Table1ComparisonofinhibitionratioofMMQcellproliferationamongthesixgroupswithdifferentconcentrationofbromocriptine

组别培养24h培养48h培养72h0.125μg/ml组27.12±2.2432.89±3.45a43.57±3.89ab0.250μg/ml组36.33±2.2641.44±3.22a55.59±3.12ab0.500μg/ml组50.48±1.5558.88±1.67a75.68±1.22ab1.000μg/ml组63.22±3.4574.24±3.89a86.22±2.24ab2.000μg/ml组75.65±3.2278.56±3.12a92.01±2.26ab4.000μg/ml组90.34±1.6796.44±1.22a96.67±1.55aF值F组间=103.32,F时间=44.58,F交互=115.07P值P组间=0.00,P时间=0.00,P交互=0.00
注:与培养24 h比较,aP<0.05;与培养48 h比较,bP<0.05
2.2对照组与最适浓度溴隐亭组PRL浓度及变化率比较4组PRL浓度及变化率比较,差异有统计学意义(P<0.05);其中1.000 μg/ml+CM组PRL浓度及变化率均低于0.500 μg/ml+CM组、0.250 μg/ml+CM组和对照组,差异有统计学意义(P<0.05);0.500 μg/ml+CM组PRL浓度及变化率均低于0.250 μg/ml+CM组和对照组,差异有统计学意义(P<0.05);0.250 μg/ml+CM组PRL浓度及变化率均低于对照组,差异有统计学意义(P<0.05,见表2)。
表2对照组与最适浓度溴隐亭组PRL浓度及变化率比较
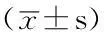
Table2ComparisonofPRLconcentrationandthechangerateamongcontrolgroupandtestgroupswithbestconcentrationofbromocriptineandCM
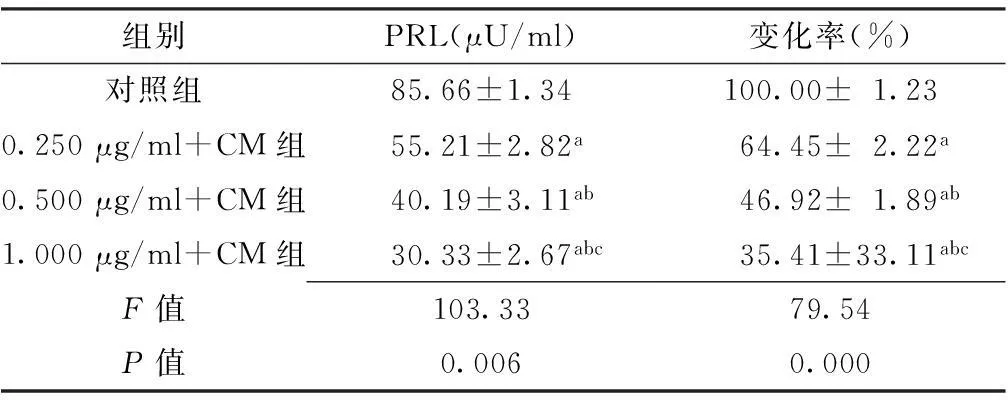
组别PRL(μU/ml)变化率(%)对照组85.66±1.34100.00±1.230.250μg/ml+CM组55.21±2.82a64.45±2.22a0.500μg/ml+CM组40.19±3.11ab46.92±1.89ab1.000μg/ml+CM组30.33±2.67abc35.41±33.11abcF值103.3379.54P值0.0060.000
注:PRL=泌乳素;与对照组比较,aP<0.05;与0.250 μg/ml+CM组比较,bP<0.05;与0.500 μg/ml+CM组比较,cP<0.05
2.3对照组、1.000 μg/ml组、CM组与最适浓度溴隐亭组MMQ细胞外血管样结构计数比较6组MMQ细胞外血管样结构计数比较,差异有统计学意义(P<0.05);其中CM组MMQ细胞外血管样结构计数多于0.250 μg/ml+CM组、0.500 μg/ml+CM组、1.000 μg/ml+CM组、1.000 μg/ml组、对照组,差异有统计学意义(P<0.05);0.250 μg/ml+CM组MMQ细胞外血管样结构计数多于0.500 μg/ml+CM组、1.000 μg/ml+CM组、1.000 μg/ml组、对照组,差异有统计学意义(P<0.05);0.500 μg/ml+CM组MMQ细胞外血管样结构计数多于1.000 μg/ml+CM组、1.000 μg/ml组、对照组,差异有统计学意义(P<0.05);1.000 μg/ml+CM组MMQ细胞外血管样结构计数多于1.000 μg/ml组、对照组,差异有统计学意义(P<0.05);1.000 μg/ml组与对照组MMQ细胞外血管样结构计数比较,差异无统计学意义(P>0.05,见表3)。
2.4对照组与最适浓度溴隐亭组PTTG、VEGF表达水平比较4组PTTG、VEGF表达水平比较,差异有统计学意义(P<0.05);其中对照组PTTG、VEGF表达水平高于0.250 μg/ml组、0.500 μg/ml组、1.000 μg/ml组,差异有统计学意义(P<0.05);0.250 μg/ml组PTTG、VEGF表达水平高于0.500 μg/ml组、1.000 μg/ml组,差异有统计学意义(P<0.05);0.500 μg/ml组PTTG、VEGF表达水平高于1.000 μg/ml组,差异有统计学意义(P<0.05,见表4)。不同溴隐亭浓度组PTTG、VEGF表达水平电泳图见图1。

Table 3Comparison of capillary structure count of MMQ cells among control group and test groups with best concentration of bromocriptine,with/without CM

组别血管样结构计数对照组10.33±0.10abcd1.000μg/ml组9.3±0.05abcd1.000μg/ml+CM组20.5±0.90abc0.500μg/ml+CM组40.33±1.10ab0.250μg/ml+CM组55.23±1.90aCM组90.22±1.40F值119.43P值0.000
注:与CM组比较,aP<0.05;与0.250 μg/ml+CM组比较,bP<0.05;与0.500 μg/ml+CM组比较,cP<0.05;与1.000 μg/ml+CM组比较,dP<0.05
表4对照组和最适浓度溴隐亭组PTTG、VEGF表达水平比较

Table4ComparisonofexpressionsofPTTGandVEGFamongcontrolgroupandtestgroupswithbestconcentrationofbromocriptine

组别PTTGVEGF对照组1.00±0.011.00±0.010.250μg/ml组0.59±0.02a0.69±0.02a0.500μg/ml组0.29±0.01ab0.58±0.01ab1.000μg/ml组0.15±0.02abc0.36±0.02abcF值109.32105.02P值0.0070.009
注:PTTG=垂体瘤转化基因,VEGF=血管内皮生长因子;与对照组比较,aP<0.05;与0.250 μg/ml组比较,bP<0.05;与0.500 μg/ml组比较,cP<0.05

注:PTTG=垂体瘤转化基因,VEGF=血管内皮生长因子
图1对照组与最适浓度溴隐亭组PTTG、VEGF表达水平的电泳图
Figure 1Electrophoretogram for expressions of PTTG and VEG of control group and test groups with best concentration of bromocriptine
3讨论
溴隐亭作为临床最常用的一种D2受体激动剂,在侵袭性垂体泌乳素腺瘤的临床治疗中已被证明安全有效。溴隐亭可使80%~90%患者的血清PRL水平恢复至参考范围,使60%~75%垂体泌乳素大腺瘤患者肿瘤缩小,使80%~90%垂体泌乳素微腺瘤和60%~75%大腺瘤患者恢复性腺功能[4-6]。19世纪70年代,Folkman[7]提出肿瘤的生长和转移依赖于血管形成的假说。垂体泌乳素腺瘤的生长和侵袭亦依赖于肿瘤血管的形成,而肿瘤血管的形成过程极为复杂,与肿瘤细胞分泌的许多生长因子有关,目前已有文献指出参与调控肿瘤血管形成的生长因子有30多种,而在众多调控因子中VEGF是最重要的促进血管生成因子之一[8-9]。VEGF是目前公认的作用最强、特异性最高的肿瘤血管形成的关键调控因子,其由多种正常细胞和肿瘤细胞分泌,在多种肿瘤组织的血管形成中起关键作用[10]。在肿瘤的生长和侵袭过程中,当肿瘤细胞与内皮细胞通过缝隙连结相互作用后,VEGF分泌增加,基质金属蛋白酶1(MMP-1)明显升高,基质金属蛋白酶原2(Pro-MMP-2)活化,胞膜型基质金属蛋白酶1(MT1-MMP)、尿激酶型纤溶酶原激活剂(uPA)、纤溶酶原激活物抑制剂(PAI-1)表达增高,从而促进肿瘤侵袭和肿瘤血管的形成。多种因子可通过调节VEGF水平或血管内皮生长因子受体(VEGFR)活性而参与血管形成和调节,如在缺血缺氧环境下,肿瘤血管形成可通过诱导缺氧诱导因子-1α(HIF-1α)增多而实现。VEGF是肿瘤血管形成过程中最重要的刺激因子,同时又是缺氧诱导因子1(HIF-1)重要的靶基因,机体缺氧时HIF-1能调节VEGFR表达上调,促进血管内皮细胞增生并形成新的血管,以满足自身营养供应[11]。PTTG是1997年从鼠垂体肿瘤细胞分离并确定的垂体洐生转化基因,与肿瘤血管形成关系密切[12]。PTTG可通过正反馈机制促进碱性成纤维细胞生长因子(bFGF)的表达,参与肿瘤血管的形成;且PTTG与基质金属蛋白酶2(MMP-2)成正相关,可抑制肿瘤血管生成[13];PTTG也可能通过p53抑制血小板反应蛋白(TSP-1)的表达,从而促进肿瘤血管生成。总之,PTTG可通过多条途径诱导肿瘤血管生成。而PTTG与VEGF之间是否存在相关性,目前尚不明确。有学者认为,PTTG可上调VEGF和血管内皮生长因子受体(KDR)的表达,因此提出了PTTG/VEGF/KDR自分泌信号通路[14-15]。也有学者认为,尽管PTTG确实存在诱导血管形成的作用,但未必是通过调节VEGF表达而实现,两种基因表达不存在关联性[16]。因此,在肿瘤血管形成方面,PTTG与VEGF的关系尚需进一步探究。
本研究中MTT实验和ELISA结果显示,培养24 h、48 h、72 h,0.125 μg/ml组、0.250 μg/ml组、0.500 μg/ml组、1.000 μg/ml组、2.000 μg/ml组、4.000 μg/ml组MMQ细胞增殖抑制率间有差异;其中培养48 h、72 h 0.125 μg/ml组、0.250 μg/ml组、0.500 μg/ml组、1.000 μg/ml组、2.000 μg/ml组、4.000 μg/ml组MMQ细胞增殖抑制率高于培养24 h,培养72 h 0.125 μg/ml组、0.250 μg/ml组、0.500 μg/ml组、1.000 μg/ml组、2.000 μg/ml组MMQ细胞增殖抑制率高于培养48 h。1.000 μg/ml+CM组PRL浓度及变化率均低于0.500 μg/ml+CM组、0.250 μg/ml+CM组和对照组;0.500 μg/ml+CM组PRL浓度及变化率均低于0.250 μg/ml+CM组和对照组;0.250 μg/ml+CM组PRL浓度及变化率均低于对照组;表明溴隐亭可抑制MMQ细胞增殖和PRL的分泌。继而构建能稳定表达GFP的HUVEC/LV-GFP,在添加CM的培养基中培养,通过荧光显微镜下观察血管样结构形成情况发现,1.000 μg/ml组与对照组MMQ细胞外血管样结构计数间无差异,CM组MMQ细胞外血管样结构计数多于0.250 μg/ml+CM组、0.500 μg/ml+CM组、1.000 μg/ml+CM组、1.000 μg/ml组、对照组,0.250 μg/ml+CM组MMQ细胞外血管样结构计数多于0.500 μg/ml+CM组、1.000 μg/ml+CM组、1.000 μg/ml组、对照组,0.500 μg/ml+CM组MMQ细胞外血管样结构计数多于1.000 μg/ml+CM组、1.000 μg/ml组、对照组,1.000 μg/ml+CM组MMQ细胞外血管样结构计数多于1.000 μg/ml组、对照组;表明MMQ细胞培养48 h后分泌了能促进HUVEC/LV-GFP细胞形成血管的因子,而这种因子在HUVEC/LV-GFP细胞自身合成中含量较低,溴隐亭处理MMQ细胞48 h后明显抑制了血管的形成,且随着溴隐亭浓度的增加,其血管形成抑制能力逐渐加强。为探索其相关机制,采用Western blotting实验分析MMQ细胞总蛋白中PTTG和VEGF表达情况,结果显示,对照组PTTG、VEGF表达水平高于0.250 μg/ml组、0.500 μg/ml组、1.000 μg/ml组,0.250 μg/ml组PTTG、VEGF表达水平高于0.500 μg/ml组、1.000 μg/ml组,0.500 μg/ml组PTTG、VEGF表达水平高于1.000 μg/ml组;表明PTTG和VEGF表达受溴隐亭浓度的影响。分析原因为MMQ细胞合成并分泌了PTTG和VEGF,即PTTG/VEGF信号通路,以促进HUVEC/LV-GFP细胞形成血管样结构,而溴隐亭可抑制PTTG/VEGF信号通路。
综上所述,溴隐亭可通过抑制垂体泌乳素腺瘤血管形成而抑制其生长与侵袭,而这种抑制作用可能与下调PTTG/VEGF信号通路有关。
作者贡献:陈宏谋进行资料收集整理、撰写论文、成文并对文章负责;郑捷敏进行实验设计并组织实施;闫宪磊、刘全、黎耀、肖振勇进行实验实施、评估、资料收集;陈家康进行质量控制及审校。
本文无利益冲突。
参考文献
[1]Glezer A,Bronstein MD.Prolactinoma[J].Arq Bras Endocrinol Metabol,2014,58(2):118-123.
[2]底爱英,高文生.溴隐亭治疗垂体泌乳素腺瘤的研究进展[J].脑与神经疾病杂志,2013,21(1):78-81.
[3]王永胜,孙灵梅,夏家林,等.PTTG和VEGF在垂体腺瘤中的表达及其与微血管形成的关系[J].中国临床神经外科杂志,2008,13(5):279-281.
[4]Buvat J.Hyperprolactinemia and sexual function in men:a short review[J].Int J Impot Res,2003,15(5):373-377.
[5]Yang MS,Hong JW,Lee SK,et al.Clinical management and outcome of 36 invasive prolactinomas treated with dopamine agonist[J].J Neurooncol,2011,104(1):195-204.
[6]Cho KR,Jo KI,Shin HJ.Bromocriptine therapy for the treatment of invasiveProlactinoma:the single institute experience[J].Brain Tumor Res Treat,2013,1(2):71-77.
[7]Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285(21):1182-1186.
[8]李涛,孙才兴.肿瘤血管形成的分子调控机制[J].中国肿瘤,2014,23(1):44-48.
[9]Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
[10]Dvorak HF,Weaver VM,Tlsty TD,et al.Tumor microenvironment and progression[J].J Surg Oncol,2011,103(6):468-474.
[11]Burroughs SK,Kaluz S,Wang D,et al.Hypoxia inducible factor pathway inhibitors as anticancer therapeutics[J].Future Med Chem,2013,5(5):553-572.
[12]马艳会,吴静.垂体瘤转化基因PTTG与肿瘤血管生成相关研究进展[J].医学综述,2011,17(21):3260-3262.
[13]Malik MT,Kakar SS.Regulation of angiogenesis and invasion by human Pituitary tumor transforming gene(PTTG) through increased expression and secretion of matrix met alloproteinase-2(MMP-2)[J].Mol Cancer,2006(5):61.
[14]McCabe CJ,Boelaert K,Tannahill LA,et al.Vascular endothelial growth factor,its receptor KDR/Flk-1,and pituitary tumor transforming gene in pituitary tumors[J].J Clin Endocrinol Metab,2002,87(9):4238-4244.
[15]Kim DS,Franklyn JA,Stratford AL,et al.Pituitary tumor-transforming gene regulates multiple downstream angiogenic genes in thyroid cancer[J].J Clin Endocrinol Metab,2006,91(3):1119-1128.
[16]Hunter JA,Skelly RH,Aylwin SJ,et al.The relationship between pituitary tumour transforming gene(PTTG) expression and in vitro hormone and vascular endothelial growth factor(VEGF) secretion from human pituitary adenomas[J].Eur J Endocrinol,2003,148(2):203-211.
(本文编辑:毛亚敏)
Impact of Bromocriptine on Vascularization of Prolactinoma and the Molecular Mechanism
CHENHong-mou,ZHENGJie-min,YANXian-lei,etal.DepartmentofNeurosurgery,theFourthAffiliatedHospitalofGuangxiMedicalUniversity,Liuzhou545005,China
【Abstract】ObjectiveTo investigate the impact of bromocriptine on vascularization of prolactinoma and the molecular mechanism.MethodsFrom January 2014 to June 2015,MMQ cell strains were cultured in vitro,MTT colorimetric assay was used to find the best concentration of bromocriptine.A group added 0.125 μg/ml of bromocriptine,B group added 0.250 μg/ml of bromocriptine,C group added 0.500 μg/ml of bromocriptine,D group added 1.000 μg/ml of bromocriptine,E group added 2.000 μg/ml of bromocriptine,F group added 4.000 μg/ml of bromocriptine,control group added isovolumetric culture medium and cell suspension,blank control group added isovolumetric culture medium.IC50 was calculated to find the best concentration of bromocriptine.After that,MMQ cell strains were cultured by the best concentration of bromocriptine for 48 hours,and conditioned medium(CM)was prepared at the same time,then B group added with CM served as B1 group,C group added with CM served as C1 group,D group added with CM served as D1 group,control group added isovolumetric culture medium and cell suspension as before,and ELISA method was used to detect the PRL concentration and the change rate.Lentivirus with GFP gene was used to infect the HUVEC and prepared for HUVEC/LV-GFP cells,then B group hatched by CM served as B2 group,C group hatched by CM served as C2 group,D group hatched by CM served as D2 group,control group add with CM served as control-CM group;after 24 hours of culture,fluorescence microscope was used to observe the formation and counts of capillary structure.Western blotting method was used to detect the expressions of PTTG and VEGF of control group,of B group,of C group,of D group.ResultsThere was interaction of inhibition ratio of cell multiplication between time and group among A group,B group,C group,D group,E group and F group(P<0.05);after 48 hours,72 hours of culture,inhibition ratio of cell multiplication of A group,of B group,of C group,of D group,of E group,of F group was statistically significantly higher than that after 24 hours of culture,respectively;after 72 hours of culture,inhibition ratio of cell multiplication of A group,of B group,of C group,of D group,of E group was statistically significantly higher than that after 48 hours of culture,respectively(P<0.05),while no statistically significant differences of inhibition ratio of cell multiplication of F group was found compared to that after 48 hours of culture(P>0.05).The calculation showed that,IC50 of inhibition of cell multiplication was close to 0.500 μg/ml.The PRL concentration and the change rate of D1 group were statistically significantly lower those of C1 group,of B1 group,of control group,PRL concentration and the change rate of C1 group were statistically significantly lower than those of B1 group,of control group,PRL concentration and the change rate of B1 group were statistically significantly lower than those of control group(P<0.05).Capillary structure count of control-CM group was statistically significant more than that of B2 group,of C2 group,of D2 group,of D group,of control group,respectively;capillary structure count of B2 group was statistically significant more than that of C2 group,of D2 group,of D group,of control group,respectively;capillary structure count of C2 group was statistically significant more than that of D2 group,of D group,of control group,respectively;capillary structure count of D2 group was statistically significant more than that of D group,of control group,respectively(P<0.05);while no statistically significant differences of capillary structure count was found between D group and control group(P>0.05).Expressions of PTTG and VEGF of control group were statistically significantly higher than those of B group,of C group,of D group;expressions of PTTG and VEGF of B group were statistically significantly higher than those of C group,of D group;expressions of PTTG and VEGF of C group were statistically significantly higher than those of D group(P<0.05).ConclusionBromocriptine can inhibit development and invasion of prolactinoma by inhibiting the vascularization,the molecular mechanism is possibly correlated with the down-regulation PTTG/VEGF signaling pathway.
【Key words】Prolactinoma;Bromocriptine;Vascular endothelial growth factors
(收稿日期:2015-11-19;修回日期:2016-02-23)
【中图分类号】R 736
【文献标识码】A
doi:10.3969/j.issn.1008-5971.2016.03.012
通信作者:陈家康,545005广西柳州市,广西医科大学第四附属医院神经外科;E-mail:lgsjwk45@163.com
基金项目:广西壮族自治区卫生厅自筹经费科研课题(z2013624);广西壮族自治区临床重点专科建设项目
